Дисперсные системы. Коллоиды Степень раздробленности растворенного вещества: >0,2-0,1


Дисперсные системы. Коллоиды

Степень раздробленности растворенного вещества: >0,2-0,1 мм, разрешающая способность глаза; От 0,1мм до 400-300нм, разрешающая способность микроскопа при освещении белым светом; От 400-300нм до 1 нм, не видимые в оптический микроскоп (коллоидные) Молекулярное (ионное) состояние

Дисперсные системы (ДС)– гетерогенные, состоят из сплошной непрерывной фазы (дисперсионная среда )и находящихся в ней раздробленных частиц (дисперсионная фаза) ДС классифицируются по дисперсности, агрегатному состоянию фазы и среды, интенсивности взаимодействия между ними. 1) Количественная характеристика дисперсности – степень дисперсности, величина обратная поперечнику дисперсных частиц. 2)Образующие фазы ДС могут находиться в любых агрегатных состояниях. При записи первым указывают состояние среды, затем фазы.

Аэрозоли – дисперсионные системы с газообразной средой . Туман – аэрозоль с жидкой фазой (Г-Ж), пыль и дым – с твердой фазой (Г-Т); пыль образуется при диспегировании веществ, дым – при конденсации летучих веществ. Пена –дисперсия газа в жидкости (Ж-Г) Эмульсия –дисперсия жидкости в нерастворяющей ее жидкости (Ж-Ж) Суспензия или взвесь – низкодисперсные твердые частицы в жидкости (Ж-Т) Коллоидные растворы (золи)- высокодисперсные твердые частицы в жидкости (Ж-Т)

В твердой дисперсионной среде могут быть диспергированы газы, жидкости или твердые вещества. Системы Т-Г (твердые пены)- пенопласты, пенобетон, пемза, шлак, хлебобулочные изделия. Т-Ж натуральный жемчуг (СаСО3,в нем коллоидно- диспергирована вода) Т-Т сплавы, цветные стекла, эмали, драгоценные и полудрагоценные камни

Коллоидные растворы или золи

Коллоидные растворы или золи – это гетерогенные мелкодисперсные системы(частицы дисперсной фазы не видны в микроскоп, но превышают размерами молекулы и ионы в истинных растворах). Золи занимают промежуточное место между истинными растворами и суспензиями (раствор глины и т.д.), частицы которых хорошо различимы в микроскоп. Коллоидно-химические процессы играют большую роль в биологии, пищевой промышленности, производстве искусственных материалов и т.д.

СВОЙСТВА КОЛЛОИДНЫХ СИСТЕМ В 1861-64 гг. английский ученый Грем, изучая диффузию растворов, заметил, что некоторые вещества (гидроксиды металлов, белки, танин и др.) диффундируют очень медленно. Эти вещества, напоминающие клей, Грем назвал коллоидами («колла» - клей).

Установлено, что коллоиды -это особое состояние вещества. Многие вещества могут находиться как в коллоидной, так и в кристаллической формах. Eсли приготовить суспензию (взвесь) мела или глины в воде, то cо временем частицы суспензии осядут. Это явление называется седиментацией. Частицы золя малы (<1 мкм), что из-за хаотического теплового движения они никогда не оседают(молоко). Это свойство золей называется седиментационной устойчивостью.
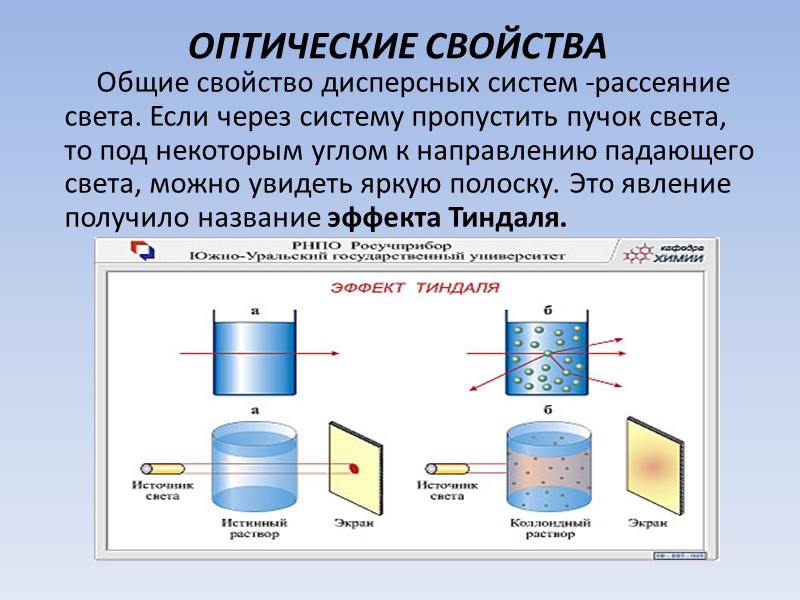
ОПТИЧЕСКИЕ СВОЙСТВА Общие свойство дисперсных систем -рассеяние света. Если через систему пропустить пучок света, то под некоторым углом к направлению падающего света, можно увидеть яркую полоску. Это явление получило название эффекта Тиндаля.

Суть эффекта -частицы дисперсной фазы рассеивают световые лучи. В суспензиях свет рассеивается из-за многократных отражений и преломлений лучей на границе раздела частиц со средой. Лучи с разной длиной волны рассеиваются при этом одинаково, если падающий свет белый, то и отраженный – белый. В коллоидах размер частиц меньше длины волны света, лучи света не отражаются. Рассеивание света в коллоидах обусловлено дифракцией, т. е. отклонением луча от прямой линии

Интенсивность рассеянного света описывается законом Релея: I=I0Kn2/4 (1) где I– интенсивность рассеянного света; I0 - интенсивность падающего света; K- константа, характерная для данного коллоида; n- концентрация частиц коллоида; - их объем; - длина волны падающего света. Рассеивание зависит от длины волны. Сильнее всего рассеивается коротковолновый голубой свет, красный - меньше всего (противотуманная сигнализация). Изменение окраски коллоида, связанное со светорассеянием, называется опалесценцией.

Коллоидные частицы в золях часто оказываются заряженными относительно жидкости. Поэтому при пропускании электрического тока в системе происходит разделение фаз: коллоидные частицы движутся к одному электроду (электрофорез), жидкость начинает перемещаться к другому электроду (электроосмос). Эти электрокинетические явления оказываются очень сильными, что протекают даже через непроницаемые в обычных условиях перегородки. Электрофорез широко используется в промышленности – для обезвоживания нефти, в производстве изделий из латекса, в медицине.

ПОЛУЧЕНИЕ КОЛЛОИДНЫХ СИСТЕМ Получают коллоиды двумя способами: - диспергационный (несамопроизвольный) - дробление крупных частиц до размера 1-0,1 мкм в специальных коллоидных мельницах; - конденсационный (самопроизвольный) - создание условий, когда атомы и молекулы истинных растворов под воздействием вандерваальсовых сил объединяются в коллоидные агрегаты.

Для получения устойчивых золей необходим стабилизатор (создает защитный слой вокруг коллоидных частиц и препятствует их разрушению или слипанию). Стабилизаторы -ионы или молекулы некоторых неорганических веществ и ВМС (мыла). Стабилизатор – электролит, например, если при образовании гидрозоля иодида серебра KI + AgNO3 = AgI + KNO3 в раствор AgNO3 постепенно при перемешивании вливать раствор KI, то осадок AgI формируется в присутствии ионов на Ag+, NO3- и K+(I- сразу связывается в AgI и в системе отсутствует).

На поверхности кристаллов (AgI)k в момент их зарождения будут адсорбироваться ионы Ag+. В результате образуются ядра коллоидных частиц, несущие в среднем по m положительных электрических зарядов, поступивших с ионами Ag+ (потенциалопределяющие ионы); [(AgI)k mAg+]m+ Под действием сил электростатического взаимодействия из раствора к ядрам притягиваются в среднем по (m-x) присутствующих в системе противоионов NO3- (ионы, заряд которых противоположен заряду ядер). В итоге образуются положительно заряженные коллоидные частицы: {[(AgI)k mAg+]m+(m-x) NO3- }x+

Средний электрический заряд x коллоидной частицы равен сумме зарядов потенциалопределяющих ионов и противоионов, входящих в состав этих частиц x = m - (m-x). В дисперсионной системе действуют и силы диффузии. Часть NO3- остается в растворе и обладает свободой движения. Совместно с этими NO3- коллоидные частицы составляют так называемые мицеллы, средний состав имеет формулу: {[(AgI)k mAg+]m+(m-x) NO3- }x+ х NO3- , в которой (AgI)k – зародыш, [(AgI)k mAg+]m+-ядро, [(AgI)k mAg+]m+(m-x) NO3- }x+ - частица.

При изменении условий формирования осадка (к раствору KI добавлять AgNO3) поменяется знак заряда коллоидных частиц и средний состав мицелл: {[(AgI)k nI-]n-(n-y) K+ }y- yK+. В любом случае мицеллы электронейтральны и являются структурной единицей коллоидной системы. Наличие у частиц одноименных электрических зарядов приводит к их взаимному отталкиванию. Это препятствует возможному слипанию частиц и обеспечивает системе коллоидную устойчивость. Чем больше средний электрический заряд коллоидных частиц, тем больше силы их взаимного отталкивания.

Электролит, в состав которого входят ионы, адсорбирующиеся на поверхности дисперсных частиц, называется электролитом - стабилизатором. Большое количество электролита приводит к увеличению количества противоионов в коллоидных частицах и уменьшению их среднего заряда. В итоге отталкивание частиц ослабеет и увеличится вероятность столкновений, что приведет к их слипанию (коагуляция) и может последовать оседание укрупнившихся частиц – седиментация.

Различают две стадии коагуляции – скрытую и явную. Первая стадия заканчивается очень быстро. При этом частицы укрупняются, но осадок не образуется(меняется окраска, появляется муть). Вторая стадия завершается разделением системы на две фазы и выпадением части или всего коллоида в виде осадка вследствие седиментации. Такой осадок называется коагель или коагулянт. Коагуляцию вызвают механические воздействия, изменение температуры, состава среды, свет, электрический ток, примеси электролитов. Коагулирующее действие оказывают ионы, которые имеют заряд, противоположный заряду коллоидных частиц. Эти ионы называют ионами-коагуляторами, а электролит, в состав которого они входят – электролитом-коагулятором.

Минимальная концентрация электролита-коагулятора, вызывающая в системе коагуляцию, называется порогом коагуляции или критической концентрацией Скр. Скр = VэC/(V+Vэ)=n/(V+Vэ) (2) где V – объем образца коллоидной системы, м3; Vэ- объем раствора электролита-коагулятора, введение которого вызвало во взятом образце коллоидной системы быструю коагуляцию, м3; C и n – концентрация (моль/ м3) и количество (моль) ионов – коагуляторов.

Порог коагуляции Скр связан с валентностью z ионов-коагуляторов: Скр = kT5/z6 (3) где Т – температура системы, К; k – коэффициент, зависящий от физических свойств фаз системы. Обратный процесс перевода осадка в коллоид путем добавления в систему раствора электролита называется пептизацией.
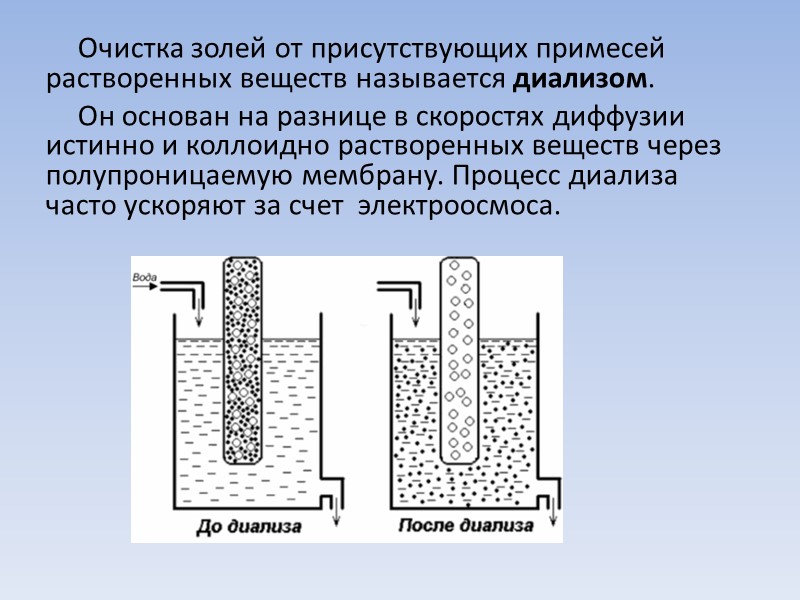
Очистка золей от присутствующих примесей растворенных веществ называется диализом. Он основан на разнице в скоростях диффузии истинно и коллоидно растворенных веществ через полупроницаемую мембрану. Процесс диализа часто ускоряют за счет электроосмоса.

При постепенном добавлении электролита в золь порог коагуляции может оказаться существенно выше, чем при одновременном добавлении всей порции электролита. Это явление получило название привыкание золей. Стабилизирующие примеси значительно повышают порог коагуляции.

Процесс коагуляции и стабилизации коллоидов имеют большое прикладное значение. Коагуляция используется для очистки питьевой воды солями алюминия и железа, из которых в водной среде образуются хорошо оседающие коагели, захватывающие и удаляемые примеси. Получение бетона – тоже разновидность коагуляции, так же как и прокисание молока. В качестве стабилизатора иногда используют питьевую соду для нейтрализации молочной кислоты. Особый случай коагуляции – переход в гель.

Гель - твердая не текучая структурированная система, образовавшаяся за счет действия межмолекулярных сил между коллоидными частицами. Ячейки пространственных сеток геля обычно заполнены растворителем. Возможны жесткие гели – структурированные двухфазные системы и эластичные гели (студни) – структурированные однофазные системы. Объем жестких гелей мало зависит от количества растворителя в нем, поэтому их называют ненабухающими. К ним относятся, в частности, коагели. К эластичным гелям относятся растворы полимеров.

Растворение полимеров проходит через предварительное набухание, затем образуется жидкотекучий раствор. Если молекулы полимера имеют пространственно- развитое строение или «сшиты» между собой, то процесс растворения полимера «затормаживается» на стадии набухания – происходит ограниченное набухание, которое характеризуется степенью набухания, : = (V-V0)/V0 или =(m-m0)/ m0, где V0 и m0 , V и m – объем и масса исходного и набухшего образца полимера соответственно

Эластичные гели, поглощая или теряя растворитель, легко и обратимо меняют свой объем. При неограниченном поглощении растворителя они переходят в золь. Пример – желатин в воде и каучук в бензине. Для эластичных гелей переход из золя в гель обычно является обратимым. Так, нагрев весьма твердого студня 10%-ного желатина переводит его в легко текучую жидкость, то есть в золь, а при охлаждении вновь образуется гель.

Гели можно перевести в золь с помощью механического воздействия при перемешивании, а при хранении в покое они снова переходят в гель. Такой процесс называется тиксотропия. Переход же золя в жесткий гель обычно необратим. К обратимым коллоидам относят природные и синтетические ВМС с молекулярной массой от 10000 до n *106. Важнейшие свойства полимеров- лиофильность («любовь» к растворителю) и лиофобность («боязнь» растворителя).

Полимеры не растворяются в веществах, к которым они лиофобны: гидрофобные полимеры нерастворимы в воде и других полярных растворителях, олеофобные – нерастворимы в углеводородах нефти. Растворение полимеров возможно лишь в тех растворителях, к которым они лиофильны: гидрофильные полимеры могут быть растворены в воде и других полярных растворителях, а олеофильные – растворимы в нефтепродуктах.

Растворы полимеров во многом подобны дисперсным системам, хотя и являются молекулярными растворами. Они обладают структурной вязкостью, характерной особенностью которой является ее зависимость не только от концентрации раствора, но и от интенсивности движения жидкости. В связи с этим растворы полимеров характеризуются: - относительной вязкостью: отн = /0 - удельной вязкостью: уд = (-0)/0 - приведенной вязкостью: пр = уд/ С
![- характеристической вязкостью: – [] = где и 0 - - характеристической вязкостью: – [] = где и 0 -](https://present5.com/presentacii-2/20170601\12-kolloidy_dor.ppt\12-kolloidy_dor_32.jpg)
- характеристической вязкостью: – [] = где и 0 - вязкости раствора полимера и чистого растворителя, определенные при одинаковых условиях, С- концентрация раствора, выраженная в моль/м3, в расчете на мономерное звено Характеристическая вязкость [] растворов полимеров не зависит от их концентрации и определяется природой полимера и растворителя. Поэтому ее используют при вискозиметрическом определении молярной массы М полимера.
12-kolloidy_dor.ppt
- Количество слайдов: 32

