дисперсные системы.ppt
- Количество слайдов: 43
 ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ. 1. Дисперсные системы и их классификация. 2. Методы получения и очистки коллоидных растворов. 3. Строение коллоидных частиц. 4. Устойчивость и коагуляция коллоидных систем.
ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ. 1. Дисперсные системы и их классификация. 2. Методы получения и очистки коллоидных растворов. 3. Строение коллоидных частиц. 4. Устойчивость и коагуляция коллоидных систем.
 Коллоидная химия – наука, изучающая физико-химические свойства гетерогенных, высоко-дисперсных систем и ВМС (высоко-молекулярных соединений). Томас Грэм (1862)
Коллоидная химия – наука, изучающая физико-химические свойства гетерогенных, высоко-дисперсных систем и ВМС (высоко-молекулярных соединений). Томас Грэм (1862)
 ДИСПЕРСНАЯ СИСТЕМА – Дисперсная фаза ( Д. Ф. ) - Дисперсионная среда ( Д. С. ) -
ДИСПЕРСНАЯ СИСТЕМА – Дисперсная фаза ( Д. Ф. ) - Дисперсионная среда ( Д. С. ) -
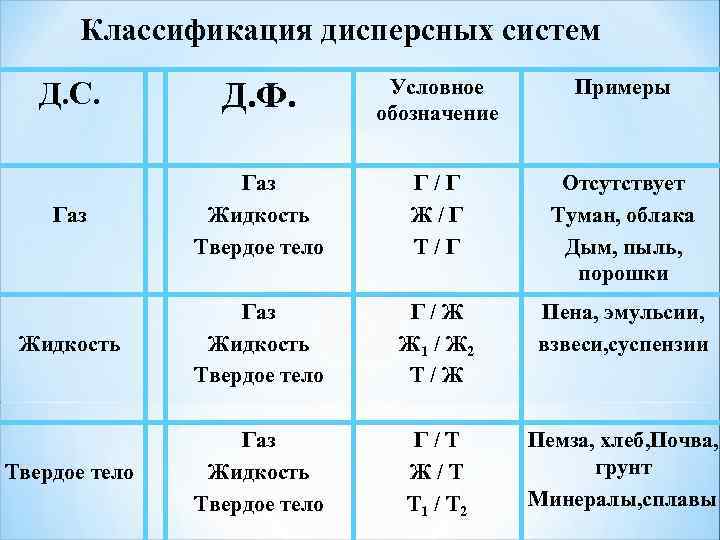 Классификация дисперсных систем Д. С. Д. Ф. Условное обозначение Примеры Газ Жидкость Твердое тело Г / Г Ж / Г Т / Г Отсутствует Туман, облака Дым, пыль, порошки Жидкость Газ Жидкость Твердое тело Г / Ж Ж 1 / Ж 2 Т / Ж Пена, эмульсии, взвеси, суспензии Твердое тело Газ Жидкость Твердое тело Г / Т Ж / Т Т 1 / Т 2 Пемза, хлеб, Почва, грунт Минералы, сплавы
Классификация дисперсных систем Д. С. Д. Ф. Условное обозначение Примеры Газ Жидкость Твердое тело Г / Г Ж / Г Т / Г Отсутствует Туман, облака Дым, пыль, порошки Жидкость Газ Жидкость Твердое тело Г / Ж Ж 1 / Ж 2 Т / Ж Пена, эмульсии, взвеси, суспензии Твердое тело Газ Жидкость Твердое тело Г / Т Ж / Т Т 1 / Т 2 Пемза, хлеб, Почва, грунт Минералы, сплавы
 II. По степени дисперсности дисперсной фазы 1. Грубодисперсные системы (микрогетерогенные) >10 -7 м или >100 нм 2. Коллоидно-дисперсные системы (ультрамикрогетерогенные) ≈ 10 -7 - 10 -9 м, 1 - 100 нм 3. Молекулярно-ионные (истинные) растворы: < 10 -9 м, < 1 нм
II. По степени дисперсности дисперсной фазы 1. Грубодисперсные системы (микрогетерогенные) >10 -7 м или >100 нм 2. Коллоидно-дисперсные системы (ультрамикрогетерогенные) ≈ 10 -7 - 10 -9 м, 1 - 100 нм 3. Молекулярно-ионные (истинные) растворы: < 10 -9 м, < 1 нм
 Вид дисперсной частицы Коллоидные металлы (золото, платина, серебро) Взвеси в воде Молекула гемоглобина Молекула крахмала Вирусы (вирус гриппа) Бактерии Эритроциты Размеры частиц, м 3 · 10– 9 ÷ 5 · 10– 8 ÷ 10– 5 3, 5 · 10– 9 10– 8 ÷ 3 · 10– 6 (~ 1 · 10– 7) 4 · 10– 7 ÷ 1, 5 · 10– 5 7 · 10– 6 ÷ 7, 5 · 10– 6
Вид дисперсной частицы Коллоидные металлы (золото, платина, серебро) Взвеси в воде Молекула гемоглобина Молекула крахмала Вирусы (вирус гриппа) Бактерии Эритроциты Размеры частиц, м 3 · 10– 9 ÷ 5 · 10– 8 ÷ 10– 5 3, 5 · 10– 9 10– 8 ÷ 3 · 10– 6 (~ 1 · 10– 7) 4 · 10– 7 ÷ 1, 5 · 10– 5 7 · 10– 6 ÷ 7, 5 · 10– 6
 Свойства систем различной степени дисперсности Грубодисперсные системы Коллоиднодисперсные системы Истинные растворы Гетерогенные Гомогенные Термодинамически неустойчивы Термодинамически неустойчивы Устойчивые Стареют со временем Частицы не проходят Проходят через бумажный фильтр Не стареют Проходят
Свойства систем различной степени дисперсности Грубодисперсные системы Коллоиднодисперсные системы Истинные растворы Гетерогенные Гомогенные Термодинамически неустойчивы Термодинамически неустойчивы Устойчивые Стареют со временем Частицы не проходят Проходят через бумажный фильтр Не стареют Проходят
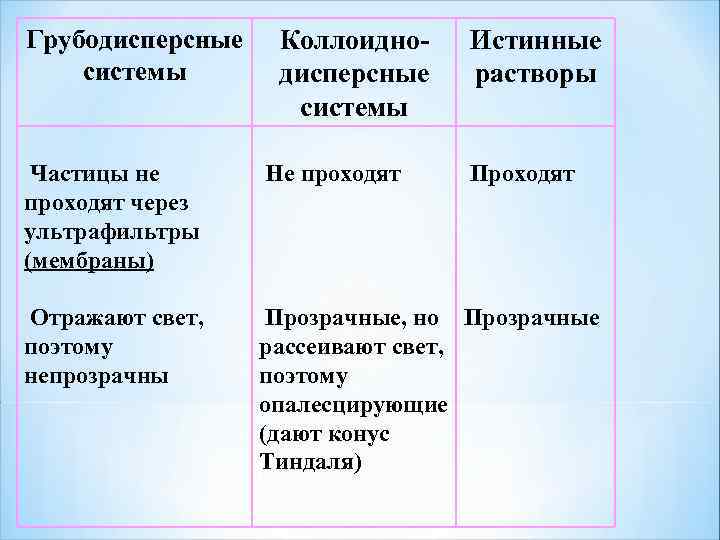 Грубодисперсные системы Коллоиднодисперсные системы Истинные растворы Частицы не проходят через ультрафильтры (мембраны) Не проходят Проходят Отражают свет, поэтому непрозрачны Прозрачные, но Прозрачные рассеивают свет, поэтому опалесцирующие (дают конус Тиндаля)
Грубодисперсные системы Коллоиднодисперсные системы Истинные растворы Частицы не проходят через ультрафильтры (мембраны) Не проходят Проходят Отражают свет, поэтому непрозрачны Прозрачные, но Прозрачные рассеивают свет, поэтому опалесцирующие (дают конус Тиндаля)
 Условия получения золя: 1. плохая растворимость Д. Ф. в Д. С. , т. е. наличие границы раздела фаз; 2. размер частиц 10 -7 -10 -9 м (1 -100 нм) ; 3. наличие иона стабилизатора, который сорбируясь на ядре прeпятствует слипанию частиц (ион-стабилизатор определяется правилом Панетта. Фаянса)
Условия получения золя: 1. плохая растворимость Д. Ф. в Д. С. , т. е. наличие границы раздела фаз; 2. размер частиц 10 -7 -10 -9 м (1 -100 нм) ; 3. наличие иона стабилизатора, который сорбируясь на ядре прeпятствует слипанию частиц (ион-стабилизатор определяется правилом Панетта. Фаянса)
 МЕТОДЫ ПОЛУЧЕНИЯ КОЛЛОИДНЫХ РАСТВОРОВ: I. Методы диспергирования: 1. - механическое дробление; 2. - дробление ультразвуком ; 3. - электрический метод ; 4. - метод пептизации.
МЕТОДЫ ПОЛУЧЕНИЯ КОЛЛОИДНЫХ РАСТВОРОВ: I. Методы диспергирования: 1. - механическое дробление; 2. - дробление ультразвуком ; 3. - электрический метод ; 4. - метод пептизации.
 II. Методы конденсации физические методы: а - метод замены растворителя б - метод конденсации паров химические методы: - реакции восстановления (Ag 2 O+H 2 → 2 Ag↓ +H 2 O) - реакции окисления (2 H 2 S + SO 2 → 3 S↓ + 2 Н 2 О) - реакции обмена (Сu. Сl 2+ Na 2 S → Cu. S↓ + 2 Na. Cl) - реакции гидролиза (Fе. Сl 3 +ЗН 2 O → Fe(OH)3↓ +3 HCI)
II. Методы конденсации физические методы: а - метод замены растворителя б - метод конденсации паров химические методы: - реакции восстановления (Ag 2 O+H 2 → 2 Ag↓ +H 2 O) - реакции окисления (2 H 2 S + SO 2 → 3 S↓ + 2 Н 2 О) - реакции обмена (Сu. Сl 2+ Na 2 S → Cu. S↓ + 2 Na. Cl) - реакции гидролиза (Fе. Сl 3 +ЗН 2 O → Fe(OH)3↓ +3 HCI)
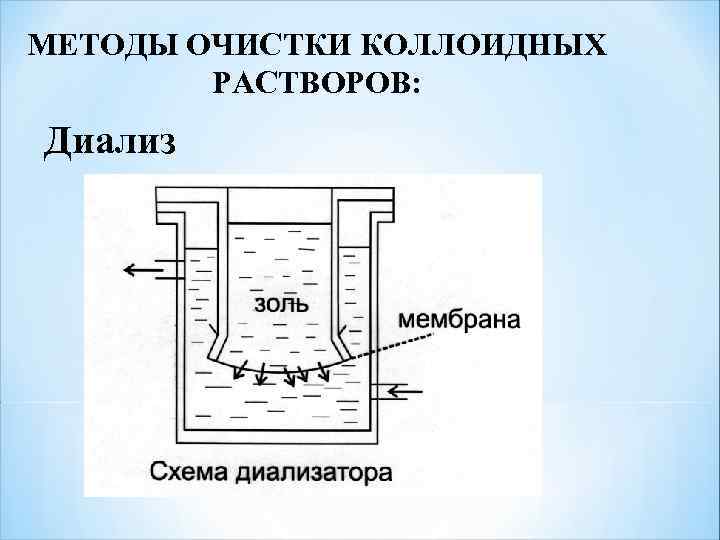 МЕТОДЫ ОЧИСТКИ КОЛЛОИДНЫХ РАСТВОРОВ: Диализ
МЕТОДЫ ОЧИСТКИ КОЛЛОИДНЫХ РАСТВОРОВ: Диализ
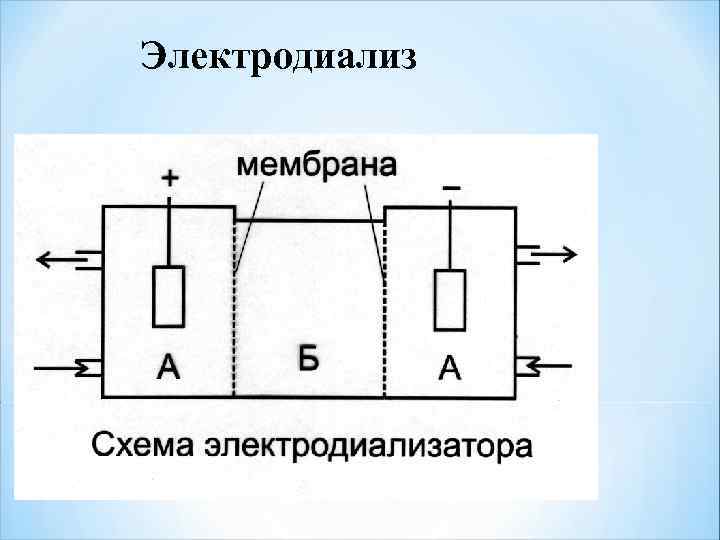 Электродиализ
Электродиализ
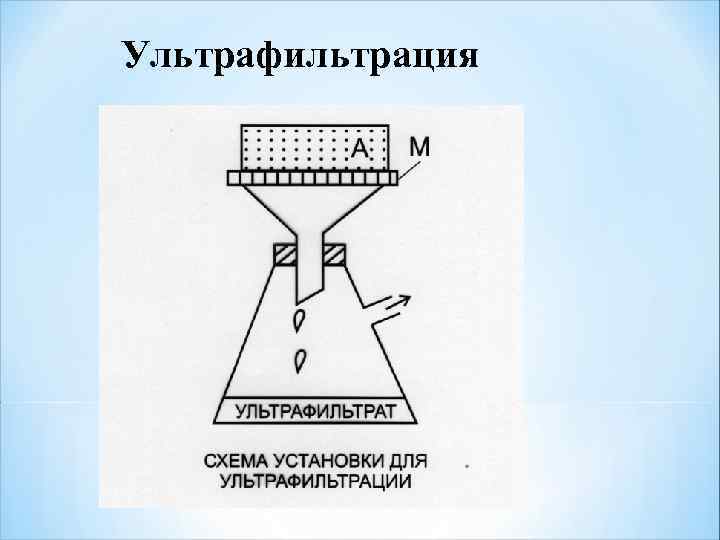 Ультрафильтрация
Ультрафильтрация
 Компенсационный диализ (вивидиализ) - АИП
Компенсационный диализ (вивидиализ) - АИП
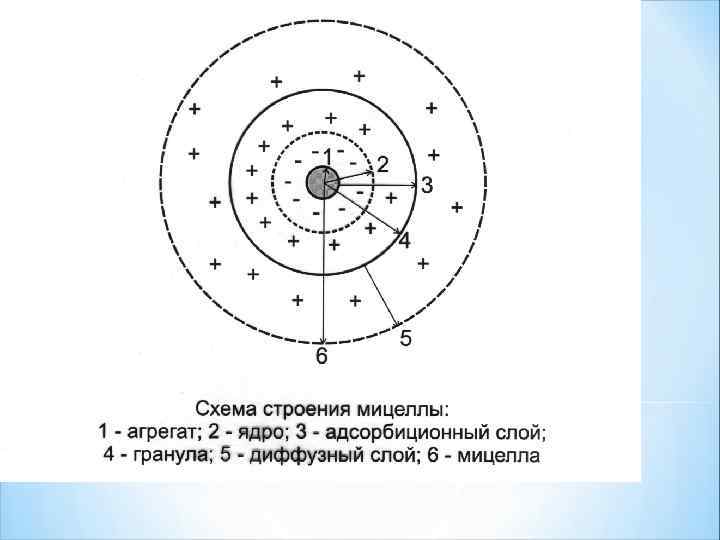
 Мицеллярная теория строения коллоидных частиц МИЦЕЛЛА (Лат. Mica -крошка) - это отдельная частица дисперсной фазы коллоидного раствора с жидкой дисперсионной средой.
Мицеллярная теория строения коллоидных частиц МИЦЕЛЛА (Лат. Mica -крошка) - это отдельная частица дисперсной фазы коллоидного раствора с жидкой дисперсионной средой.
 Мицелла состоит из: 1. ядра; 2. адсорбционного слоя; 3. диффузного слоя. Ядро состоит из агрегата (микрокристаллы малорастворимого вещества) и потенциалопределяющих ионов (ПОИ).
Мицелла состоит из: 1. ядра; 2. адсорбционного слоя; 3. диффузного слоя. Ядро состоит из агрегата (микрокристаллы малорастворимого вещества) и потенциалопределяющих ионов (ПОИ).
 Правило ПАНЕТТА-ФАЯНСА: кристаллическую решетку ядра достраивает тот ион, который находится в растворе в избытке и содержится в агрегате или родственен ему.
Правило ПАНЕТТА-ФАЯНСА: кристаллическую решетку ядра достраивает тот ион, который находится в растворе в избытке и содержится в агрегате или родственен ему.
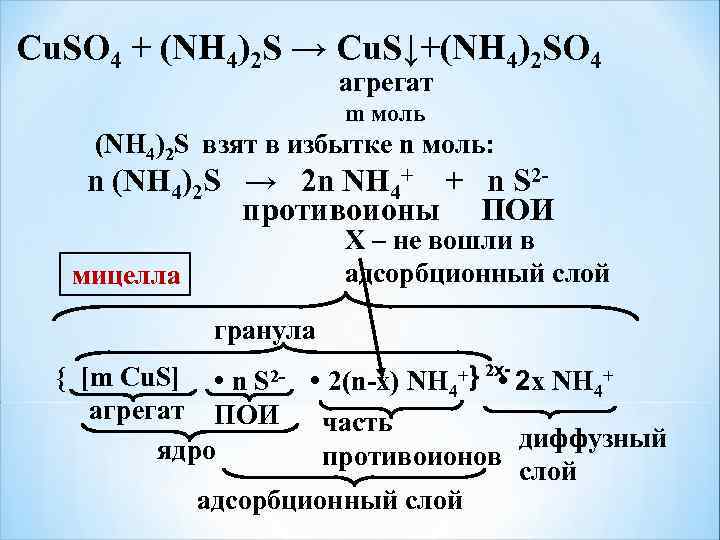 Сu. SO 4 + (NH 4)2 S → Cu. S↓+(NH 4)2 SO 4 агрегат m моль (NH 4)2 S взят в избытке n моль: n (NH 4)2 S → 2 n NH 4+ + n S 2 - противоионы ПОИ Х – не вошли в адсорбционный слой мицелла гранула { [m Cu. S] • n S 2 - • 2(n-x) NH 4+ } 2 х- 2 x NH 4+ • агрегат ПОИ часть диффузный ядро противоионов слой адсорбционный слой
Сu. SO 4 + (NH 4)2 S → Cu. S↓+(NH 4)2 SO 4 агрегат m моль (NH 4)2 S взят в избытке n моль: n (NH 4)2 S → 2 n NH 4+ + n S 2 - противоионы ПОИ Х – не вошли в адсорбционный слой мицелла гранула { [m Cu. S] • n S 2 - • 2(n-x) NH 4+ } 2 х- 2 x NH 4+ • агрегат ПОИ часть диффузный ядро противоионов слой адсорбционный слой
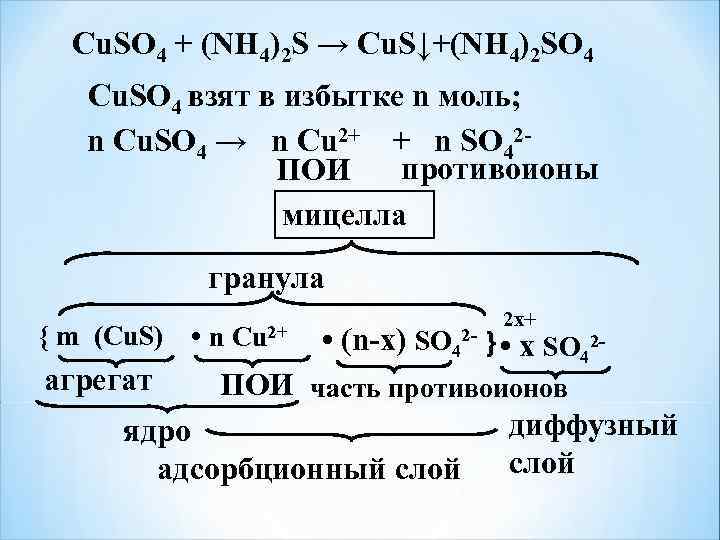 Сu. SO 4 + (NH 4)2 S → Cu. S↓+(NH 4)2 SO 4 Сu. SO 4 взят в избытке n моль; n Сu. SO 4 → n Сu 2+ + n SO 42 - ПОИ противоионы мицелла гранула { m (Cu. S) • агрегат n Сu 2+ 2 x+ • (n-x) SO 42 - } • x SO 42 - ПОИ часть противоионов диффузный ядро адсорбционный слой
Сu. SO 4 + (NH 4)2 S → Cu. S↓+(NH 4)2 SO 4 Сu. SO 4 взят в избытке n моль; n Сu. SO 4 → n Сu 2+ + n SO 42 - ПОИ противоионы мицелла гранула { m (Cu. S) • агрегат n Сu 2+ 2 x+ • (n-x) SO 42 - } • x SO 42 - ПОИ часть противоионов диффузный ядро адсорбционный слой
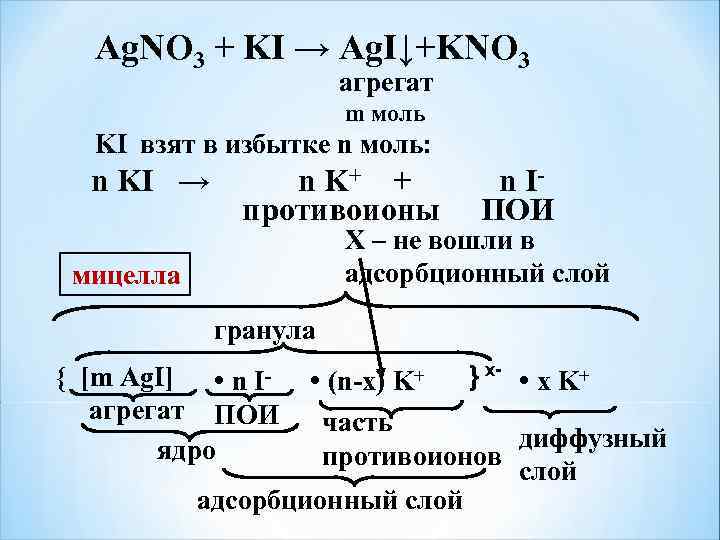 Ag. NO 3 + KI → Ag. I↓+KNO 3 агрегат m моль KI взят в избытке n моль: n KI → n K+ + n I- противоионы ПОИ Х – не вошли в адсорбционный слой мицелла гранула • (n-x) K+ } х- • x K+ часть диффузный противоионов слой адсорбционный слой { [m Ag. I] • n Iагрегат ПОИ ядро
Ag. NO 3 + KI → Ag. I↓+KNO 3 агрегат m моль KI взят в избытке n моль: n KI → n K+ + n I- противоионы ПОИ Х – не вошли в адсорбционный слой мицелла гранула • (n-x) K+ } х- • x K+ часть диффузный противоионов слой адсорбционный слой { [m Ag. I] • n Iагрегат ПОИ ядро
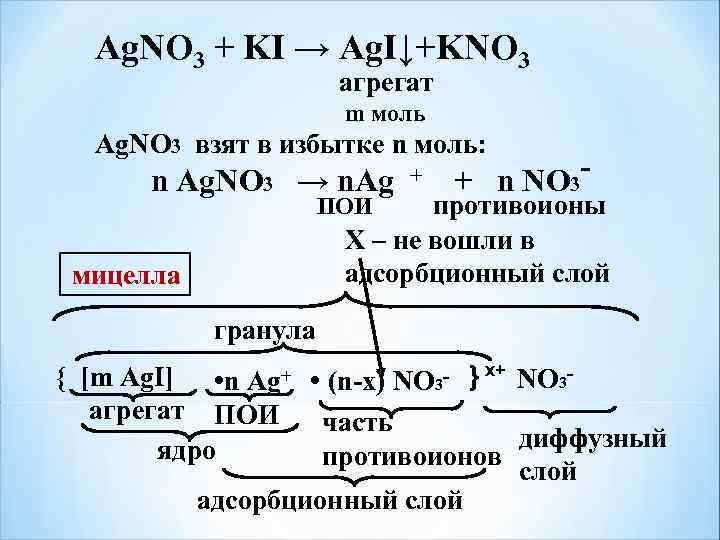 Ag. NO 3 + KI → Ag. I↓+KNO 3 агрегат m моль Ag. NO 3 взят в избытке n моль: n Ag. NO 3 → n. Ag + + n NO 3 - ПОИ противоионы Х – не вошли в адсорбционный слой мицелла гранула { [m Ag. I] • n Ag+ • (n-x) NO 3 - } х+ NO 3 - агрегат ПОИ часть диффузный ядро противоионов слой адсорбционный слой
Ag. NO 3 + KI → Ag. I↓+KNO 3 агрегат m моль Ag. NO 3 взят в избытке n моль: n Ag. NO 3 → n. Ag + + n NO 3 - ПОИ противоионы Х – не вошли в адсорбционный слой мицелла гранула { [m Ag. I] • n Ag+ • (n-x) NO 3 - } х+ NO 3 - агрегат ПОИ часть диффузный ядро противоионов слой адсорбционный слой
 *Строение мицеллы золя гидроксида железа
*Строение мицеллы золя гидроксида железа
 В мицелле существует 2 скачка потенциала: 1) φ - электротермодинамический – φ ~ 1 В. 2) ζ (дзетта) - электрокинетический – ζ = 0, 1 В {[m Cu. S] • n Сu 2+ • (n-x) SO 4 2 -}2 x+ • x SO 42φ ζ Состояние гранулы, когда все ионы диффузного слоя переходят в адсорбционный и ζ = 0 - называется изоэлектрическим.
В мицелле существует 2 скачка потенциала: 1) φ - электротермодинамический – φ ~ 1 В. 2) ζ (дзетта) - электрокинетический – ζ = 0, 1 В {[m Cu. S] • n Сu 2+ • (n-x) SO 4 2 -}2 x+ • x SO 42φ ζ Состояние гранулы, когда все ионы диффузного слоя переходят в адсорбционный и ζ = 0 - называется изоэлектрическим.
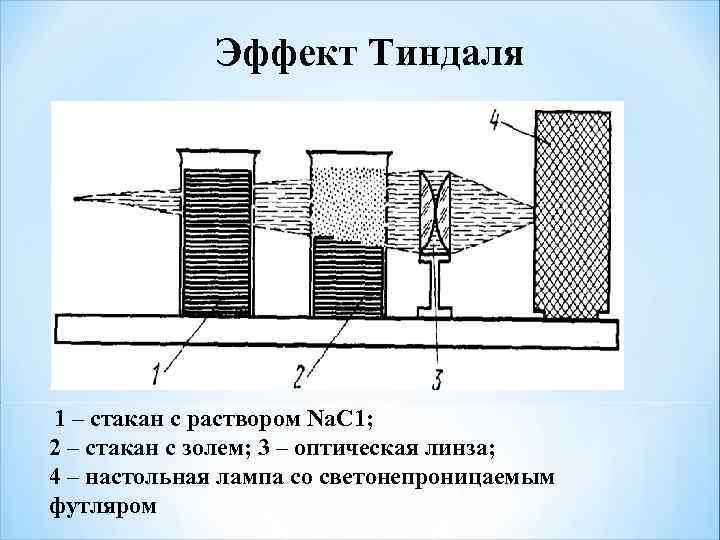 Эффект Тиндаля 1 – стакан с раствором Nа. С 1; 2 – стакан с золем; 3 – оптическая линза; 4 – настольная лампа со светонепроницаемым футляром
Эффект Тиндаля 1 – стакан с раствором Nа. С 1; 2 – стакан с золем; 3 – оптическая линза; 4 – настольная лампа со светонепроницаемым футляром
 Уравнение Релея *
Уравнение Релея *
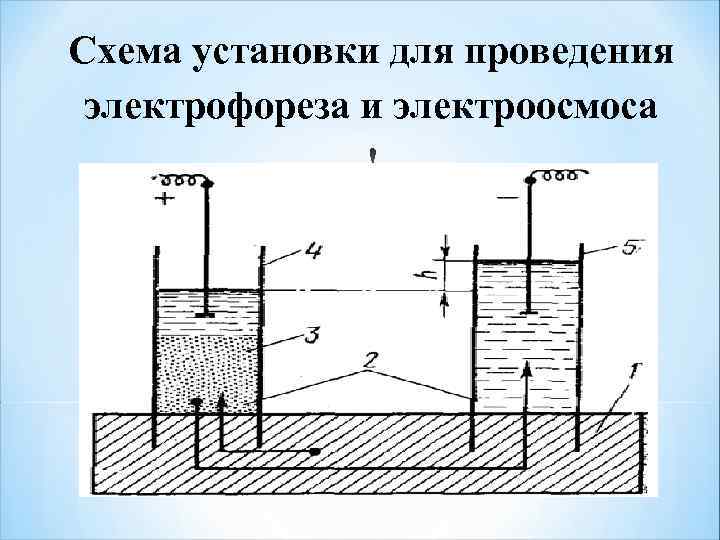 Схема установки для проведения электрофореза и электроосмоса
Схема установки для проведения электрофореза и электроосмоса
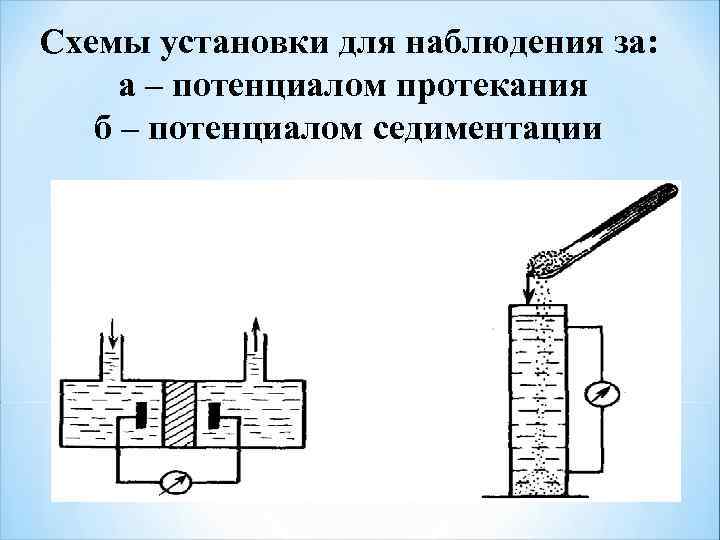 Схемы установки для наблюдения за: а – потенциалом протекания б – потенциалом седиментации
Схемы установки для наблюдения за: а – потенциалом протекания б – потенциалом седиментации
 Устойчивость коллоидных растворов: I. Седиментационная (кинетическая) устойчивость - Критерии: 1. броуновское движение; 2. степень дисперсности; 3. вязкость дисперсионной среды (чем ↑, тем ↑ уст-сть); 4. температура (чем ↑, тем ↑ уст-сть).
Устойчивость коллоидных растворов: I. Седиментационная (кинетическая) устойчивость - Критерии: 1. броуновское движение; 2. степень дисперсности; 3. вязкость дисперсионной среды (чем ↑, тем ↑ уст-сть); 4. температура (чем ↑, тем ↑ уст-сть).
 II. Агрегативная устойчивость – способность системы противостоять слипанию частиц дисперсной фазы. Критерии: 1. ионная оболочка, т. е. наличие двойного электрического слоя; ДЭС = адсорбционный + диффузный слой 2. сольватная (гидратная) оболочка растворителя (чем ↑, тем ↑ уст-сть); 3. величина ζ– потенциала гранулы ( чем > ζ , тем < вероятность слипания и тем > уст-сть) 4. температура.
II. Агрегативная устойчивость – способность системы противостоять слипанию частиц дисперсной фазы. Критерии: 1. ионная оболочка, т. е. наличие двойного электрического слоя; ДЭС = адсорбционный + диффузный слой 2. сольватная (гидратная) оболочка растворителя (чем ↑, тем ↑ уст-сть); 3. величина ζ– потенциала гранулы ( чем > ζ , тем < вероятность слипания и тем > уст-сть) 4. температура.
 Основные факторы устойчивости коллоидных растворов 1. Величина ζ-потенциала 2. Величина электродинамического потенциала (φ) 3. Толщина диффузного слоя 4. Величина заряда гранулы
Основные факторы устойчивости коллоидных растворов 1. Величина ζ-потенциала 2. Величина электродинамического потенциала (φ) 3. Толщина диффузного слоя 4. Величина заряда гранулы
 КОАГУЛЯЦИЯ - процесс укрупнения частиц дисперсной фазы золя с последующим выпадением в осадок. Факторы, вызывающие коагуляцию: 1. увеличение концентрации золя; 2. действие света; 3. изменение температуры; 4. облучение; 5. добавление электролитов.
КОАГУЛЯЦИЯ - процесс укрупнения частиц дисперсной фазы золя с последующим выпадением в осадок. Факторы, вызывающие коагуляцию: 1. увеличение концентрации золя; 2. действие света; 3. изменение температуры; 4. облучение; 5. добавление электролитов.
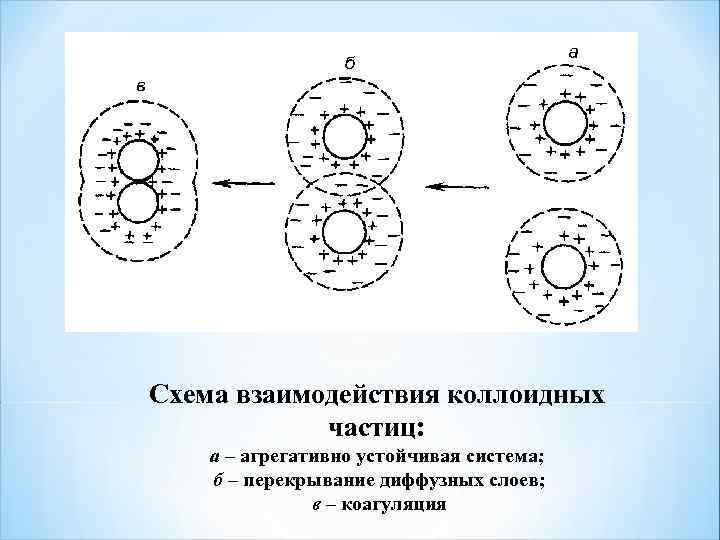 Схема взаимодействия коллоидных частиц: а – агрегативно устойчивая система; б – перекрывание диффузных слоев; в – коагуляция
Схема взаимодействия коллоидных частиц: а – агрегативно устойчивая система; б – перекрывание диффузных слоев; в – коагуляция
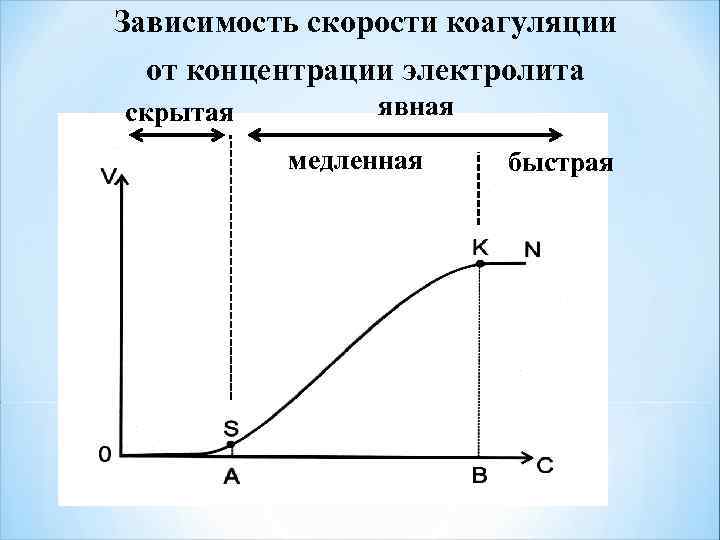 Зависимость скорости коагуляции от концентрации электролита скрытая явная медленная быстрая
Зависимость скорости коагуляции от концентрации электролита скрытая явная медленная быстрая
 Порог коагуляции наименьшее количество электролита, которое вызывает явную коагуляцию 1 л золя - γ = C· V / Vо γ - порог коагуляции, моль/л; С - концентрация электролита, моль/л; V - объем раствора электролита, л; Vo - объем золя, л. Р = 1/ γ - коагулирующая способность электролита
Порог коагуляции наименьшее количество электролита, которое вызывает явную коагуляцию 1 л золя - γ = C· V / Vо γ - порог коагуляции, моль/л; С - концентрация электролита, моль/л; V - объем раствора электролита, л; Vo - объем золя, л. Р = 1/ γ - коагулирующая способность электролита
 Правило Шульце-Гарди: Для разновалентных ионов их коагулирующее действие прямо пропорционально зарядам ионов в шестой степени
Правило Шульце-Гарди: Для разновалентных ионов их коагулирующее действие прямо пропорционально зарядам ионов в шестой степени
 лиотропные ряды Гофмейстера:
лиотропные ряды Гофмейстера:
 Гранула ( - ) Р(Al+3) : Р(Ca+2) : Р(K+1) ≈ 36 : 26 : 16 ≈ 729 : 64 : 1 γ(Al+3): γ(Ca+2): γ(K+1) ≈ 1/36: 1/26: 1/16 Гранула ( + ) Р(PO 4 3 -) : Р(SO 42 -) : Р(Cl-) ≈ 36 : 26 : 16 γ(PO 4 3 -): γ(SO 42 -): γ(Cl-) ≈ 1/36: 1/26: 1/16
Гранула ( - ) Р(Al+3) : Р(Ca+2) : Р(K+1) ≈ 36 : 26 : 16 ≈ 729 : 64 : 1 γ(Al+3): γ(Ca+2): γ(K+1) ≈ 1/36: 1/26: 1/16 Гранула ( + ) Р(PO 4 3 -) : Р(SO 42 -) : Р(Cl-) ≈ 36 : 26 : 16 γ(PO 4 3 -): γ(SO 42 -): γ(Cl-) ≈ 1/36: 1/26: 1/16
 При коагуляции смесями электролитов возможны 3 случая: 1) аддитивность – 2) антагонизм – 3) синергизм –
При коагуляции смесями электролитов возможны 3 случая: 1) аддитивность – 2) антагонизм – 3) синергизм –
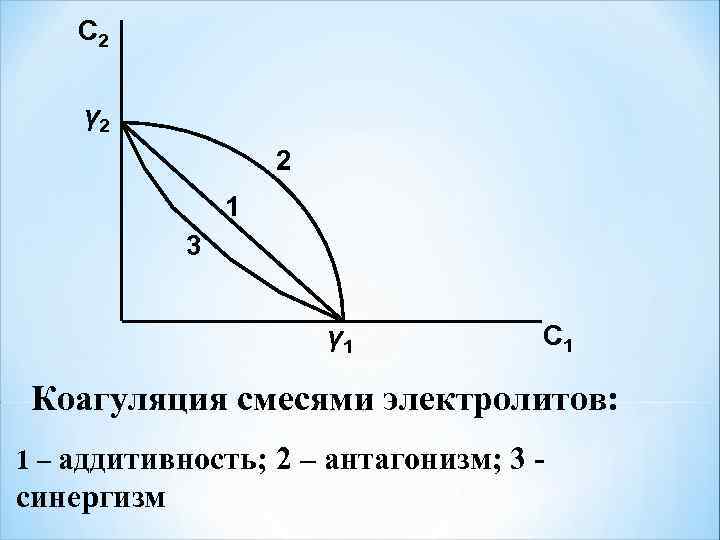 C 2 γ 2 2 1 3 γ 1 C 1 Коагуляция смесями электролитов: 1 – аддитивность; 2 – антагонизм; 3 - синергизм
C 2 γ 2 2 1 3 γ 1 C 1 Коагуляция смесями электролитов: 1 – аддитивность; 2 – антагонизм; 3 - синергизм
 Механизм коагуляции золей электролитами 1. Сжатие диффузного слоя 2. Избирательная адсорбция ионов с зарядом, противоположным заряду гранулы 3. Ионообменная адсорбция
Механизм коагуляции золей электролитами 1. Сжатие диффузного слоя 2. Избирательная адсорбция ионов с зарядом, противоположным заряду гранулы 3. Ионообменная адсорбция
 Защита коллоидов от коагуляции Устойчивость коллоидов к действию электролитов повышается при добавлении к ним ВМС (белков, полисахаридов: желатин, крахмал, казеин натрия. Механизм защитного действия ВМС: 1. Макромолекулы ВМС адсорбируются на коллоидных частицах золя. Т. к. молекулы ВМС гидрофильны, то гидрофобные части золя, окруженные молекулами ВМС, становятся более гидрофильными и устойчивость их в водном растворе увеличивается. 2. Увеличиваются сольватные оболочки вокруг гидрофобных частиц, что препятствует сближению и слипанию частиц золя.
Защита коллоидов от коагуляции Устойчивость коллоидов к действию электролитов повышается при добавлении к ним ВМС (белков, полисахаридов: желатин, крахмал, казеин натрия. Механизм защитного действия ВМС: 1. Макромолекулы ВМС адсорбируются на коллоидных частицах золя. Т. к. молекулы ВМС гидрофильны, то гидрофобные части золя, окруженные молекулами ВМС, становятся более гидрофильными и устойчивость их в водном растворе увеличивается. 2. Увеличиваются сольватные оболочки вокруг гидрофобных частиц, что препятствует сближению и слипанию частиц золя.


