Л 6 Дисперсн системы.ppt
- Количество слайдов: 41
 Дисперсные системы 1
Дисперсные системы 1
 План лекции n n n n Понятие дисперсной системы. Классификация дисперсных систем. Коллоидные системы. Методы получения коллоидных систем. Молекулярно-кинетические и оптические свойства коллоидных систем свойства Строение двойного электрического слоя. Строение коллоидных частиц. Коагуляция коллоидных растворов и факторы, вызывающие коагуляцию. Структурообразование в дисперсных системах Микрогетерогенные системы: суспензии, эмульсии, пены, порошки. 2
План лекции n n n n Понятие дисперсной системы. Классификация дисперсных систем. Коллоидные системы. Методы получения коллоидных систем. Молекулярно-кинетические и оптические свойства коллоидных систем свойства Строение двойного электрического слоя. Строение коллоидных частиц. Коагуляция коллоидных растворов и факторы, вызывающие коагуляцию. Структурообразование в дисперсных системах Микрогетерогенные системы: суспензии, эмульсии, пены, порошки. 2
 Дисперсные системы n Дисперсные системы – системы, состоящие из вещества, раздробленного до определенной величины, размера и распределенного в другом веществе. Размельченное, раздробленное вещество называется дисперсной фазой. Вещество, в котором распределена дисперсная фаза, называется дисперсионной средой. n Количественной характеристикой дисперсных систем является степень дисперсности, раздробленности, которая обратно пропорциональна размеру частиц. , см 1 , где D – размер частиц, α – степень дисперсности 3
Дисперсные системы n Дисперсные системы – системы, состоящие из вещества, раздробленного до определенной величины, размера и распределенного в другом веществе. Размельченное, раздробленное вещество называется дисперсной фазой. Вещество, в котором распределена дисперсная фаза, называется дисперсионной средой. n Количественной характеристикой дисперсных систем является степень дисперсности, раздробленности, которая обратно пропорциональна размеру частиц. , см 1 , где D – размер частиц, α – степень дисперсности 3
 Дисперсные системы n Другой количественной характеристикой дисперсной системы является удельная поверхность, которая равна отношению общей поверхности частиц дисперсной фазы, т. е. поверхности раздела к общему объему частиц дисперсной фазы 4
Дисперсные системы n Другой количественной характеристикой дисперсной системы является удельная поверхность, которая равна отношению общей поверхности частиц дисперсной фазы, т. е. поверхности раздела к общему объему частиц дисперсной фазы 4
 Классификация дисперсных систем По размеру частиц дисперсной фазы – ДФдисперсные системы делятся на: а) грубодисперсные системы: размер ДФ 10 -3 -10 -5 см. б) коллоидные системы (золи): размер ДФ 10 -5 -10 -7 см. в) молекулярно – ионные дисперсные системы: размер ДФ 10 -7 -10 -9 см. 5
Классификация дисперсных систем По размеру частиц дисперсной фазы – ДФдисперсные системы делятся на: а) грубодисперсные системы: размер ДФ 10 -3 -10 -5 см. б) коллоидные системы (золи): размер ДФ 10 -5 -10 -7 см. в) молекулярно – ионные дисперсные системы: размер ДФ 10 -7 -10 -9 см. 5
 Классификация дисперсных систем Дисперсные системы классифицируются также в зависимости от природы дисперсионной среды - ДС: а) ДС жидкая – лиозоли, б) ДС вода – гидрозоли, в) ДС органическая жидкость – органозоли, г) спирт – алкализоли. 6
Классификация дисперсных систем Дисперсные системы классифицируются также в зависимости от природы дисперсионной среды - ДС: а) ДС жидкая – лиозоли, б) ДС вода – гидрозоли, в) ДС органическая жидкость – органозоли, г) спирт – алкализоли. 6
 Коллоидные системы n Коллоидные системы изучает коллоидная химия – наука о свойствах гетерогенных высокодисперсных систем и о протекающих в ней процессах. 7
Коллоидные системы n Коллоидные системы изучает коллоидная химия – наука о свойствах гетерогенных высокодисперсных систем и о протекающих в ней процессах. 7
 Получение коллоидных систем Основные условия получения коллоидных систем: n нерастворимость вещества дисперсной фазы в дисперсной среде n достижение коллоидной дисперсности (105 -10 -7 см) n наличие стабилизатора – третьего компонента, который сообщает системе агрегативную устойчивость (ПАВ, электролиты). 8
Получение коллоидных систем Основные условия получения коллоидных систем: n нерастворимость вещества дисперсной фазы в дисперсной среде n достижение коллоидной дисперсности (105 -10 -7 см) n наличие стабилизатора – третьего компонента, который сообщает системе агрегативную устойчивость (ПАВ, электролиты). 8
 Методы получения коллоидных систем n n Диспергирование (от большего размера частиц ДФ – к меньшей) – дробление механическим путем (мельницы, ультразвуковые дробилки) или воздействием сильного электрического разряда. Конденсация (от меньшего размера частиц ДФ – к большей) - получение золей путем: n n n 1) конденсацией паров, 2) заменой растворителя 3) с помощью различных химических реакций. 9
Методы получения коллоидных систем n n Диспергирование (от большего размера частиц ДФ – к меньшей) – дробление механическим путем (мельницы, ультразвуковые дробилки) или воздействием сильного электрического разряда. Конденсация (от меньшего размера частиц ДФ – к большей) - получение золей путем: n n n 1) конденсацией паров, 2) заменой растворителя 3) с помощью различных химических реакций. 9
 Получения золя с помощью химической реакции Пример получения золя химической реакцией: Na. Cl + Ag. NO 3 = Ag. Cl + Na. NO 3 При этом одно вещество должно быть взято в избытке, и служить стабилизатором получаемого золя. 10
Получения золя с помощью химической реакции Пример получения золя химической реакцией: Na. Cl + Ag. NO 3 = Ag. Cl + Na. NO 3 При этом одно вещество должно быть взято в избытке, и служить стабилизатором получаемого золя. 10
 Молекулярно-кинетические свойства коллоидных систем n На коллоидные частицы, распределенные в дисперсионной среде, действуют в противоположных направлениях две силы. n n n Под действием силы тяжести частицы стремятся осесть на дно – седиментировать. Силы диффузии, наоборот, стремятся распределить частицы равномерно по всему объему системы. В результате в системе установится определенное равновесное распределение частиц по высоте – седиментационное равновесие. Равновесное распределение устанавливается очень медленно, его легко нарушают сотрясения, толчки, конвекционные потоки. Способность дисперсных систем сохранять определенное распределение частиц по объему называется седиментационной или кинетической устойчивостью. 11
Молекулярно-кинетические свойства коллоидных систем n На коллоидные частицы, распределенные в дисперсионной среде, действуют в противоположных направлениях две силы. n n n Под действием силы тяжести частицы стремятся осесть на дно – седиментировать. Силы диффузии, наоборот, стремятся распределить частицы равномерно по всему объему системы. В результате в системе установится определенное равновесное распределение частиц по высоте – седиментационное равновесие. Равновесное распределение устанавливается очень медленно, его легко нарушают сотрясения, толчки, конвекционные потоки. Способность дисперсных систем сохранять определенное распределение частиц по объему называется седиментационной или кинетической устойчивостью. 11
 Оптические свойства коллоидных систем При прохождении света через дисперсную систему он может: n поглощаться n отражаться n рассеиваться частицами. Для типичных коллоидных систем наиболее характерным оптическим свойством является рассеяние света во всех направлениях. Частицы коллоидной системы меньше полуволны света и поэтому рассеяние света обусловлено не отражением от поверхности частиц, а его дифракцией. Рассеяние света было исследовано Тиндалем, который обнаружил, что при освещении коллоидного раствора ярким световым пучком путь его виден при наблюдении сбоку виде светящейся полосы (конус Тиндаля) опалесценция. 12
Оптические свойства коллоидных систем При прохождении света через дисперсную систему он может: n поглощаться n отражаться n рассеиваться частицами. Для типичных коллоидных систем наиболее характерным оптическим свойством является рассеяние света во всех направлениях. Частицы коллоидной системы меньше полуволны света и поэтому рассеяние света обусловлено не отражением от поверхности частиц, а его дифракцией. Рассеяние света было исследовано Тиндалем, который обнаружил, что при освещении коллоидного раствора ярким световым пучком путь его виден при наблюдении сбоку виде светящейся полосы (конус Тиндаля) опалесценция. 12
 Оптические свойства коллоидных систем Прохождение света через истинный раствор и коллоид. Пучок света проходит через истинный раствор не рассеиваясь; Коллоидные частицы рассеивают проходящий через раствор пучок света, в результате он становится видимым. Диффузный пучок света не дает на экране четкого изображения 13
Оптические свойства коллоидных систем Прохождение света через истинный раствор и коллоид. Пучок света проходит через истинный раствор не рассеиваясь; Коллоидные частицы рассеивают проходящий через раствор пучок света, в результате он становится видимым. Диффузный пучок света не дает на экране четкого изображения 13
 Электрокинетические явления коллоидных систем В электрическом поле коллоидные частицы перемещаются с постоянной скоростью к одному из электродов. n Электрофорез - явление переноса частиц дисперсной фазы в электрическом поле n Электроосмос – явление движения в электрическом поле дисперсионной среды. 14
Электрокинетические явления коллоидных систем В электрическом поле коллоидные частицы перемещаются с постоянной скоростью к одному из электродов. n Электрофорез - явление переноса частиц дисперсной фазы в электрическом поле n Электроосмос – явление движения в электрическом поле дисперсионной среды. 14
 Строение двойного электрического слоя n Двойной электрический слой может возникать на поверхности твердого тела или в результате избирательной адсорбции одного из ионов электролита, находящегося в растворе. n Двойной электрический слой состоит из ионов, достаточно прочно связанных с твердой фазой – потенциалопределяющих ионов – и эквивалентного количества противоположно заряженных ионов, которые находятся в жидкой фазе – противоионов. n Между твердой фазой и жидкостью возникает разность потенциалов – термодинамический потенциал (φ-дзетапотенциал), определяемый плотностью зарядов 15
Строение двойного электрического слоя n Двойной электрический слой может возникать на поверхности твердого тела или в результате избирательной адсорбции одного из ионов электролита, находящегося в растворе. n Двойной электрический слой состоит из ионов, достаточно прочно связанных с твердой фазой – потенциалопределяющих ионов – и эквивалентного количества противоположно заряженных ионов, которые находятся в жидкой фазе – противоионов. n Между твердой фазой и жидкостью возникает разность потенциалов – термодинамический потенциал (φ-дзетапотенциал), определяемый плотностью зарядов 15
 Строение двойного электрического слоя 1 - потенциалопределяющие ионы 2 - адсорбционный сой противоионов 3 - диффузный слой противоионов ав – плоскость скольжения 16
Строение двойного электрического слоя 1 - потенциалопределяющие ионы 2 - адсорбционный сой противоионов 3 - диффузный слой противоионов ав – плоскость скольжения 16
 Строение коллоидных частиц Рассмотрим на примере золя хлорида серебра, полученного в избытке Na. Cl: Na. Cl + Ag. NO 3 = Ag. Cl + Na. NO 3 m[Ag. Cl]. n. Cl-. (n-x)Na+ x- . x. Na+ ядро адсорбционный слой гранула мицелла m, n, x – непостоянные числа в зависимости от условий приготовления золей, они могут меняться в широких пределах. 17
Строение коллоидных частиц Рассмотрим на примере золя хлорида серебра, полученного в избытке Na. Cl: Na. Cl + Ag. NO 3 = Ag. Cl + Na. NO 3 m[Ag. Cl]. n. Cl-. (n-x)Na+ x- . x. Na+ ядро адсорбционный слой гранула мицелла m, n, x – непостоянные числа в зависимости от условий приготовления золей, они могут меняться в широких пределах. 17
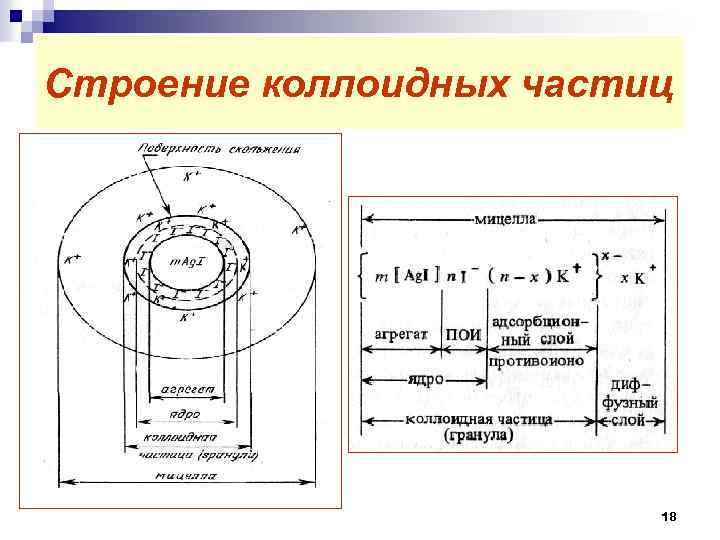 Строение коллоидных частиц 18
Строение коллоидных частиц 18
 Коагуляция коллоидных растворов n n n Коллоидные частицы, имеют сильно развитую поверхность и соответственно обладают избытком свободной поверхностной энергии и следовательно стремятся к понижению запаса свободной энергии до некоторого минимума. Уменьшение удельной поверхности и свободной энергии достигается в результате укрупнения частиц за счет их слипания. Процесс укрупнения называется коагуляцией коллоидных частиц. 19
Коагуляция коллоидных растворов n n n Коллоидные частицы, имеют сильно развитую поверхность и соответственно обладают избытком свободной поверхностной энергии и следовательно стремятся к понижению запаса свободной энергии до некоторого минимума. Уменьшение удельной поверхности и свободной энергии достигается в результате укрупнения частиц за счет их слипания. Процесс укрупнения называется коагуляцией коллоидных частиц. 19
 Коагуляция коллоидных растворов Коагуляция протекает в три стадии: n Скрытая коагуляция - начальная стадия, протекающая незаметно для невооруженного глаза. n Явная коагуляция – процесс агрегации частиц может быть обнаружен визуально. n Седиментация - выпадение частиц в осадок. 20
Коагуляция коллоидных растворов Коагуляция протекает в три стадии: n Скрытая коагуляция - начальная стадия, протекающая незаметно для невооруженного глаза. n Явная коагуляция – процесс агрегации частиц может быть обнаружен визуально. n Седиментация - выпадение частиц в осадок. 20
 Седиментация в дисперсных системах Седиментацией (от лат. sedimentum — осадок) называют процесс оседания частиц дисперсной фазы в жидкой или газообразной среде под действием силы тяжести. Всплывание частиц (например, капель в эмульсиях) носит название обратной седиментации. 21
Седиментация в дисперсных системах Седиментацией (от лат. sedimentum — осадок) называют процесс оседания частиц дисперсной фазы в жидкой или газообразной среде под действием силы тяжести. Всплывание частиц (например, капель в эмульсиях) носит название обратной седиментации. 21
 Факторы, вызывающие коагуляцию n Коагуляцию можно вызвать различными по природе действиями: ¨ длительный диализ (отток растворителя), ¨ прибавление электролитов и неэлектролитов ¨ действие температуры ¨ лучистая энергия ¨ электрический ток ¨ механическое воздействие (перешивание, встряхивание). 22
Факторы, вызывающие коагуляцию n Коагуляцию можно вызвать различными по природе действиями: ¨ длительный диализ (отток растворителя), ¨ прибавление электролитов и неэлектролитов ¨ действие температуры ¨ лучистая энергия ¨ электрический ток ¨ механическое воздействие (перешивание, встряхивание). 22
 Коагуляция электролитами n n n Чаще всего для коагуляции коллоидных растворов используют электролиты. Явная заметная коагуляция наступает, когда концентрация электролита начинает превышать некоторую минимальную величину. Наименьшая концентрация электролита, вызывающая коагуляцию за определенный промежуток времени называется порогом коагуляции золя данным электролитом (ммоль/л). 23
Коагуляция электролитами n n n Чаще всего для коагуляции коллоидных растворов используют электролиты. Явная заметная коагуляция наступает, когда концентрация электролита начинает превышать некоторую минимальную величину. Наименьшая концентрация электролита, вызывающая коагуляцию за определенный промежуток времени называется порогом коагуляции золя данным электролитом (ммоль/л). 23
 Коагуляция электролитами Коагуляцию вызывает не весь электролит, а один из ионов. Коагулирующий ион определяется по правилу Шульце-Гарди: 1) коагулирующим ионом является ион, противоположный по знаку – заряду потенциалопределяющих ионов. 2) Чем выше заряд коагулирующего иона, тем сильнее выражена его коагулирующая способность и тем меньше порог коагуляции прибавленного электролита. Коагулирующая способность обратно пропорциональна порогу коагуляции Кс = 1/γ Например, коагулирующая способность по отношению к золю Al. I 3 ионов K+ , Co 2+ , Al 3+ будет следующая: K+ : Co 2+ : Al 3+ = 1 : 64 : 729 24
Коагуляция электролитами Коагуляцию вызывает не весь электролит, а один из ионов. Коагулирующий ион определяется по правилу Шульце-Гарди: 1) коагулирующим ионом является ион, противоположный по знаку – заряду потенциалопределяющих ионов. 2) Чем выше заряд коагулирующего иона, тем сильнее выражена его коагулирующая способность и тем меньше порог коагуляции прибавленного электролита. Коагулирующая способность обратно пропорциональна порогу коагуляции Кс = 1/γ Например, коагулирующая способность по отношению к золю Al. I 3 ионов K+ , Co 2+ , Al 3+ будет следующая: K+ : Co 2+ : Al 3+ = 1 : 64 : 729 24
 Структурообразование в дисперсных системах n n Cвободнодисперсные системы - коллоидные системы, в которых частицы находятся на достаточно больших расстояниях друг от друга и практически не взаимодействуют друг с другом, называются. Вязкость таких систем практически не отличается от вязкости дисперсионной среды. Связнодисперсные системы - дисперсные системы, в которых частицы связаны друг с другом межмолекулярными силами и вследствие этого не способны к перемещению, называются. Частицы дисперсной фазы в таких системах образуют пространственную сетку или структуру. 25
Структурообразование в дисперсных системах n n Cвободнодисперсные системы - коллоидные системы, в которых частицы находятся на достаточно больших расстояниях друг от друга и практически не взаимодействуют друг с другом, называются. Вязкость таких систем практически не отличается от вязкости дисперсионной среды. Связнодисперсные системы - дисперсные системы, в которых частицы связаны друг с другом межмолекулярными силами и вследствие этого не способны к перемещению, называются. Частицы дисперсной фазы в таких системах образуют пространственную сетку или структуру. 25
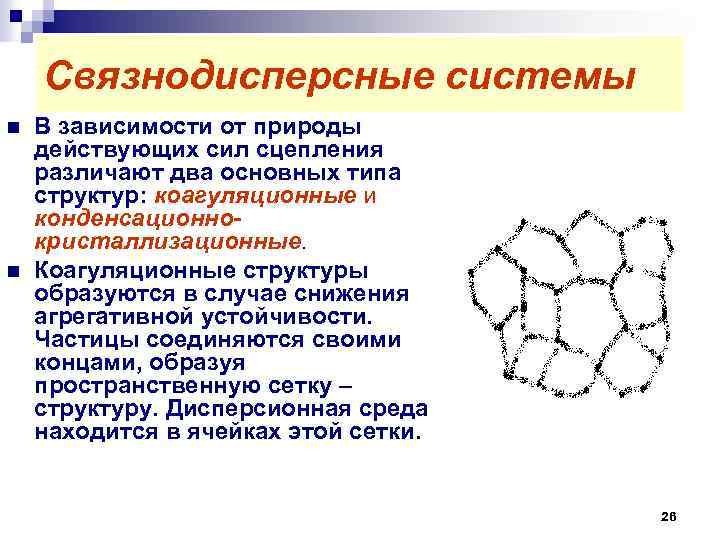 Связнодисперсные системы n n В зависимости от природы действующих сил сцепления различают два основных типа структур: коагуляционные и конденсационнокристаллизационные. Коагуляционные структуры образуются в случае снижения агрегативной устойчивости. Частицы соединяются своими концами, образуя пространственную сетку – структуру. Дисперсионная среда находится в ячейках этой сетки. 26
Связнодисперсные системы n n В зависимости от природы действующих сил сцепления различают два основных типа структур: коагуляционные и конденсационнокристаллизационные. Коагуляционные структуры образуются в случае снижения агрегативной устойчивости. Частицы соединяются своими концами, образуя пространственную сетку – структуру. Дисперсионная среда находится в ячейках этой сетки. 26
 Коагуляционное структурообразование n Переход коллоидного раствора из свободнодисперсного состояния в связнодисперсное, называется гелеобразованием, а образующиеся при этом структурированные коллоидные системы называются гелями 27
Коагуляционное структурообразование n Переход коллоидного раствора из свободнодисперсного состояния в связнодисперсное, называется гелеобразованием, а образующиеся при этом структурированные коллоидные системы называются гелями 27
 Коагуляционное структурообразование n n Если коллоидные частицы полностью потеряют свою агрегативную устойчивость, то они будут соединяться в крупные агрегаты, образуя коагулят - осадок, а не рыхлую структуру – гель. Многие коагуляционные структуры обладают свойством восстанавливаться после их разрушения в результате какого-нибудь механического воздействия (перемешивания, встряхивания, нагревания и т. д. ). Это свойство структурированных систем называется тиксотропией. 28
Коагуляционное структурообразование n n Если коллоидные частицы полностью потеряют свою агрегативную устойчивость, то они будут соединяться в крупные агрегаты, образуя коагулят - осадок, а не рыхлую структуру – гель. Многие коагуляционные структуры обладают свойством восстанавливаться после их разрушения в результате какого-нибудь механического воздействия (перемешивания, встряхивания, нагревания и т. д. ). Это свойство структурированных систем называется тиксотропией. 28
 Тиксотропные свойства гелей n n При механическом воздействии связи между частицами в коагуляционной сетке могут быть нарушены и гель превратится в текучий золь. Если оставить этот золь в покое через некоторое время связи снова самопроизвольно восстановится и образуется нетекучий гель Гель может быть переведен в золь прибавлением к нему электролита – стабилизатора; этот процесс называется пептизацией: Гелеобразование ГЕЛЬ ЗОЛЬ Пептизация Гели с течением времени начинают сжиматься, уменьшаются в объеме, выделяя при этом дисперсионную среду. Это явление называется синерезисом. 29
Тиксотропные свойства гелей n n При механическом воздействии связи между частицами в коагуляционной сетке могут быть нарушены и гель превратится в текучий золь. Если оставить этот золь в покое через некоторое время связи снова самопроизвольно восстановится и образуется нетекучий гель Гель может быть переведен в золь прибавлением к нему электролита – стабилизатора; этот процесс называется пептизацией: Гелеобразование ГЕЛЬ ЗОЛЬ Пептизация Гели с течением времени начинают сжиматься, уменьшаются в объеме, выделяя при этом дисперсионную среду. Это явление называется синерезисом. 29
 Конденсационнокристализационные структуры n Конденсационно-кристализационные структуры образуются в результате возникновения или между частицами прочных химических связей или при сращивании кристаллов. Они не обладают тиксотропными свойствами и разрушаются необратимо. 30
Конденсационнокристализационные структуры n Конденсационно-кристализационные структуры образуются в результате возникновения или между частицами прочных химических связей или при сращивании кристаллов. Они не обладают тиксотропными свойствами и разрушаются необратимо. 30
 Микрогетерогенные системы Суспензии n Суспензии - дисперсные системы с жидкой дисперсионной средой и твердой дисперсионной фазой. Суспензии седиментационно неустойчивы, их частицы оседают или вплывают в зависимости от плотности среды. В суспензиях нет броуновского движения, а, следовательно, они не проявляют таких молекулярно- кинетических свойств, как диффузия и осмотическое давление. n Не обладая седиментационной устойчивойстью частицы могут обладать агрегативной устойчивостью, т. к. несут на себе двойной электрический слой, преимущественно адсорбционный или сольватную оболочку. 31
Микрогетерогенные системы Суспензии n Суспензии - дисперсные системы с жидкой дисперсионной средой и твердой дисперсионной фазой. Суспензии седиментационно неустойчивы, их частицы оседают или вплывают в зависимости от плотности среды. В суспензиях нет броуновского движения, а, следовательно, они не проявляют таких молекулярно- кинетических свойств, как диффузия и осмотическое давление. n Не обладая седиментационной устойчивойстью частицы могут обладать агрегативной устойчивостью, т. к. несут на себе двойной электрический слой, преимущественно адсорбционный или сольватную оболочку. 31
 Суспензии n n n Суспензии могут быть агрегативно устойчивы и без образования двойного слоя. В этом случае частицы суспензии или сами хорошо смачиваются жидкой дисперсионной средой, или им надо искусственно придать свойство смачиваться. И в том и в другом случае на поверхности частиц суспензии образуется сольватная оболочка, обладающая упругими свой ствами и препятствующая соединению частиц в крупные агрегаты. При введении ПАВ, растворимое в дисперсной среде, то молекулы ПАВ, адсорбируясь на частицах сажи своими неполярными группами, сообщают им свойство смачиваться, т. е. гидрофилизируют ее. Это ведет к образованию гидратной оболочки и как следствие к агрегативной устойчивости. 32
Суспензии n n n Суспензии могут быть агрегативно устойчивы и без образования двойного слоя. В этом случае частицы суспензии или сами хорошо смачиваются жидкой дисперсионной средой, или им надо искусственно придать свойство смачиваться. И в том и в другом случае на поверхности частиц суспензии образуется сольватная оболочка, обладающая упругими свой ствами и препятствующая соединению частиц в крупные агрегаты. При введении ПАВ, растворимое в дисперсной среде, то молекулы ПАВ, адсорбируясь на частицах сажи своими неполярными группами, сообщают им свойство смачиваться, т. е. гидрофилизируют ее. Это ведет к образованию гидратной оболочки и как следствие к агрегативной устойчивости. 32
 Суспензии n Примеры суспензий: n n n Цементные, известковые растворы Масляные краски, Крахмальное молоко Шоколадная масса при температуре выше 35 0 С и порошок какао, размешанный в воде. Чтобы придать устойчивость суспензии, порошок обрабатывают щелоками: при этой операции происходит омыление жиров на поверхности частиц какао с образованием небольшого количества солей жирных кислот, растворимых в воде - ПАВ. Высококонцентрированные суспензии называются пастами. Пасты имеют свойства структурированных систем (помадные пасты в кондитерском производстве, где твердой фазой являются кристаллики сахара, а дисперсионной средой – растворы сахарозы, глюкозы, мальтозы. 33
Суспензии n Примеры суспензий: n n n Цементные, известковые растворы Масляные краски, Крахмальное молоко Шоколадная масса при температуре выше 35 0 С и порошок какао, размешанный в воде. Чтобы придать устойчивость суспензии, порошок обрабатывают щелоками: при этой операции происходит омыление жиров на поверхности частиц какао с образованием небольшого количества солей жирных кислот, растворимых в воде - ПАВ. Высококонцентрированные суспензии называются пастами. Пасты имеют свойства структурированных систем (помадные пасты в кондитерском производстве, где твердой фазой являются кристаллики сахара, а дисперсионной средой – растворы сахарозы, глюкозы, мальтозы. 33
 Эмульсии n n n Эмульсии - дисперсные системы, состоящие из жидкой дисперсной фазы (ДФ) и жидкой дисперсионной среды (ДС). Размер частиц ДФ колеблется от 10 -5 до 10 -3 см. Обязательным условием образования эмульсий является нерастворимость вещества дисперсной фазы в среде. Получают методом механического диспергирования. Жидкости, из которых получают эмульсии (ДФ и ДС) сильно отличаются по свойствам. Практически одной из них всегда является вода, а другой какая-нибудь неполярная нерастворимая в воде жидкость, называемая маслом. Это может быть и масло, и бензол, и хлороформ, керосин и т. д. 34
Эмульсии n n n Эмульсии - дисперсные системы, состоящие из жидкой дисперсной фазы (ДФ) и жидкой дисперсионной среды (ДС). Размер частиц ДФ колеблется от 10 -5 до 10 -3 см. Обязательным условием образования эмульсий является нерастворимость вещества дисперсной фазы в среде. Получают методом механического диспергирования. Жидкости, из которых получают эмульсии (ДФ и ДС) сильно отличаются по свойствам. Практически одной из них всегда является вода, а другой какая-нибудь неполярная нерастворимая в воде жидкость, называемая маслом. Это может быть и масло, и бензол, и хлороформ, керосин и т. д. 34
 Классификация эмульсий По характеру ДФ и ДС все эмульсии можно разбить на два вида: n Эмульсия первого рода (прямая) эмульсия масла в воде (м/в) или Пример «жир в молоке» . При добавлении воды эмульсии первого рода не разрушаются – не происходит расслаивания. n Эмульсия второго рода (обратная) эмульсия воды в масле (в/м) или Пример: вода в масле – сметана. При приливании воды эмульсия разрушается – расслоение. 35
Классификация эмульсий По характеру ДФ и ДС все эмульсии можно разбить на два вида: n Эмульсия первого рода (прямая) эмульсия масла в воде (м/в) или Пример «жир в молоке» . При добавлении воды эмульсии первого рода не разрушаются – не происходит расслаивания. n Эмульсия второго рода (обратная) эмульсия воды в масле (в/м) или Пример: вода в масле – сметана. При приливании воды эмульсия разрушается – расслоение. 35
 Эмульсии n n В зависимости от степени концентрирования различают разбавленные -<0. 1%, концентрированные – до 74% и высококонцентрированные - > 74% эмульсии. В высококонцентрированных эмульсиях капельки дисперсной фазы настолько сближены друг с другом, что деформируются, приобретая форму многогранников, разделенных тонкими пленками дисперсионной среды. Эмульсии являются седиментационно неустойчивыми системами. Если дисперсионная среда и фаза сильно отличаются по плотности, то возможно оседание или всплывание капелек дисперсной фазы, т. е. нарушение однородности. Агрегативная неустойчивость проявляется в слиянии капелек дисперсной фазы – коалесценции. Этот процесс может привести к разрушению эмульсии и разделению ее на два слоя. 36
Эмульсии n n В зависимости от степени концентрирования различают разбавленные -<0. 1%, концентрированные – до 74% и высококонцентрированные - > 74% эмульсии. В высококонцентрированных эмульсиях капельки дисперсной фазы настолько сближены друг с другом, что деформируются, приобретая форму многогранников, разделенных тонкими пленками дисперсионной среды. Эмульсии являются седиментационно неустойчивыми системами. Если дисперсионная среда и фаза сильно отличаются по плотности, то возможно оседание или всплывание капелек дисперсной фазы, т. е. нарушение однородности. Агрегативная неустойчивость проявляется в слиянии капелек дисперсной фазы – коалесценции. Этот процесс может привести к разрушению эмульсии и разделению ее на два слоя. 36
 Роль эмульгатора n Концентрированные эмульсии могут быть устойчивыми при наличии в системе стабилизатора или эмульгатора. Роль эмульгатора – двоякая: эмульгатор должен адсорбироваться на границе раздела фаз и снижать межфазное натяжение, т. е. быть ПАВ ¨ эмульгатор должен образовывать защитную пленку. ¨ 37
Роль эмульгатора n Концентрированные эмульсии могут быть устойчивыми при наличии в системе стабилизатора или эмульгатора. Роль эмульгатора – двоякая: эмульгатор должен адсорбироваться на границе раздела фаз и снижать межфазное натяжение, т. е. быть ПАВ ¨ эмульгатор должен образовывать защитную пленку. ¨ 37
 Примеры эмульсий n К эмульсиям относится ряд важнейших жиросодержащих продуктов питания: молоко, сливки, сливочное масло, сметана, майонез. n В качестве эмульгаторов в маргариновом производстве применяют или натуральные продукты – яичный желток, лецитин или специальные пищевые эмульгаторы – моноглицериды жирных кислот, сахароглицериды. Для повышения пищевой ценности хлебо-булочных изделий и улучшения их вкуса в тесто водят жиры. Внесение жира в виде тонкодисперсной эмульсии м/в заметно улучшает качество хлеба. n В фармацевтической и парфюмерной промышленности многие мази и кремы представляют собой эмульсию. 38
Примеры эмульсий n К эмульсиям относится ряд важнейших жиросодержащих продуктов питания: молоко, сливки, сливочное масло, сметана, майонез. n В качестве эмульгаторов в маргариновом производстве применяют или натуральные продукты – яичный желток, лецитин или специальные пищевые эмульгаторы – моноглицериды жирных кислот, сахароглицериды. Для повышения пищевой ценности хлебо-булочных изделий и улучшения их вкуса в тесто водят жиры. Внесение жира в виде тонкодисперсной эмульсии м/в заметно улучшает качество хлеба. n В фармацевтической и парфюмерной промышленности многие мази и кремы представляют собой эмульсию. 38
 Пены n Пены - грубодисперсные высококонцентрированные системы, в которых дисперсионная среда – жидкость, а дисперсная фаза – газ. Пузырьки газа в пенах имеют большие размеры, форму многогранников и оделены друг от друга очень тонкими слоями жидкой дисперсионной среды. n Устойчивую пену можно получить только в присутствии стабилизатора ПАВ – пенообразователя. Чистые жидкости не обладают способностью образовывать устойчивую пену. 39
Пены n Пены - грубодисперсные высококонцентрированные системы, в которых дисперсионная среда – жидкость, а дисперсная фаза – газ. Пузырьки газа в пенах имеют большие размеры, форму многогранников и оделены друг от друга очень тонкими слоями жидкой дисперсионной среды. n Устойчивую пену можно получить только в присутствии стабилизатора ПАВ – пенообразователя. Чистые жидкости не обладают способностью образовывать устойчивую пену. 39
 Свойства пены. Примеры пен n n n С повышением температуры устойчивость пены снижается, т. к. при этом снижается адсорбция пенообразователя на границе фаз и уменьшается вязкость жидкости. Пены и пенообразование имеют очень важное значение в нашей жизни. Всем известно положительное действие пен мыла и других моющих средств при удалении загрязнений с любой поверхности. Очень распространены пенообразующие системы в пищевой промышленности: хлеб и некоторые кондитерские изделия имеют структуру пены и это определяет не только их вкусовые качества, но и пищевую ценность. Для приготовления вспененных кондитерских изделий (пастила, зефир, суфле) в качестве пенообразователя применяют белок, иногда экстракт чая, метилцеллюлозу. Для повышения стойкости пищевых пен в них вводят стабилизаторы – вещества, повышающие вязкость дисперсионной среды агар, агароид, крахмал. 40
Свойства пены. Примеры пен n n n С повышением температуры устойчивость пены снижается, т. к. при этом снижается адсорбция пенообразователя на границе фаз и уменьшается вязкость жидкости. Пены и пенообразование имеют очень важное значение в нашей жизни. Всем известно положительное действие пен мыла и других моющих средств при удалении загрязнений с любой поверхности. Очень распространены пенообразующие системы в пищевой промышленности: хлеб и некоторые кондитерские изделия имеют структуру пены и это определяет не только их вкусовые качества, но и пищевую ценность. Для приготовления вспененных кондитерских изделий (пастила, зефир, суфле) в качестве пенообразователя применяют белок, иногда экстракт чая, метилцеллюлозу. Для повышения стойкости пищевых пен в них вводят стабилизаторы – вещества, повышающие вязкость дисперсионной среды агар, агароид, крахмал. 40
 Аэрозоли n n Аэрозоли дисперсные системы, ДС - газ (воздух), ДФ - твердые частицы или капельки жидкости. Обычно аэрозоли классифицируют по агрегатному состоянию дисперсной фазы: n n n Аэрозоли с жидкой дисперсной фазой называют туманами Аэрозоли с твердыми частицами – дымы. Аэрозоли с более крупными твердыми частицами дисперсной фазы называют обычно пылью. 41
Аэрозоли n n Аэрозоли дисперсные системы, ДС - газ (воздух), ДФ - твердые частицы или капельки жидкости. Обычно аэрозоли классифицируют по агрегатному состоянию дисперсной фазы: n n n Аэрозоли с жидкой дисперсной фазой называют туманами Аэрозоли с твердыми частицами – дымы. Аэрозоли с более крупными твердыми частицами дисперсной фазы называют обычно пылью. 41


