Лекция-РХ.ppt
- Количество слайдов: 18

 Дисциплина “Основы ядерной физики, радиохимии и дозиметрии” 4. Химические явления, сопровождающие ядерные превращения (химия горячих атомов). Лекция 4. Изотопные эффекты. Н. Д. Бетенеков зав. каф. радиохимии ГОУ ВПО УГТУ УПИ, г. Екатеринбург
Дисциплина “Основы ядерной физики, радиохимии и дозиметрии” 4. Химические явления, сопровождающие ядерные превращения (химия горячих атомов). Лекция 4. Изотопные эффекты. Н. Д. Бетенеков зав. каф. радиохимии ГОУ ВПО УГТУ УПИ, г. Екатеринбург
 Содержание лекции ИЗОТОПНЫЕ ЭФФЕКТЫ. ТЕРМОДИНАМИЧЕСКИЕ ИЗОТОПНЫЕ ЭФФЕКТЫ. КИНЕТИЧЕСКИЕ ИЗОТОПНЫЕ ЭФФЕКТЫ. ОТКРЫТИЕ ЧЕРДЫНЦЕВА И ЧАЛОВА “ЯВЛЕНИЯ ЕСТЕСТВЕННОГО РАЗДЕЛЕНИЯ 234 U И 238 U”.
Содержание лекции ИЗОТОПНЫЕ ЭФФЕКТЫ. ТЕРМОДИНАМИЧЕСКИЕ ИЗОТОПНЫЕ ЭФФЕКТЫ. КИНЕТИЧЕСКИЕ ИЗОТОПНЫЕ ЭФФЕКТЫ. ОТКРЫТИЕ ЧЕРДЫНЦЕВА И ЧАЛОВА “ЯВЛЕНИЯ ЕСТЕСТВЕННОГО РАЗДЕЛЕНИЯ 234 U И 238 U”.
 4. 11. ИЗОТОПНЫЕ ЭФФЕКТЫ При использовании радионуклидов для изучения химических процессов обычно предполагают, что поведение изотопно замещенных молекул (т. е. молекул, содержащих разные изотопы одного и того же элемента) практически идентично. • Как показывают теория и практика, в подавляющем большинстве случаев это предположение вполне оправдано. Однако следует учитывать, что различие масс изотопов может привести у изотопно замещенных молекул к более или менее значительным изменениям некоторых физических и физико химических характеристик (как термодинамических, так и кинетических). • Различия свойств изотопно замещенных молекул (и ионов) получили название изотопных эффектов. •
4. 11. ИЗОТОПНЫЕ ЭФФЕКТЫ При использовании радионуклидов для изучения химических процессов обычно предполагают, что поведение изотопно замещенных молекул (т. е. молекул, содержащих разные изотопы одного и того же элемента) практически идентично. • Как показывают теория и практика, в подавляющем большинстве случаев это предположение вполне оправдано. Однако следует учитывать, что различие масс изотопов может привести у изотопно замещенных молекул к более или менее значительным изменениям некоторых физических и физико химических характеристик (как термодинамических, так и кинетических). • Различия свойств изотопно замещенных молекул (и ионов) получили название изотопных эффектов. •
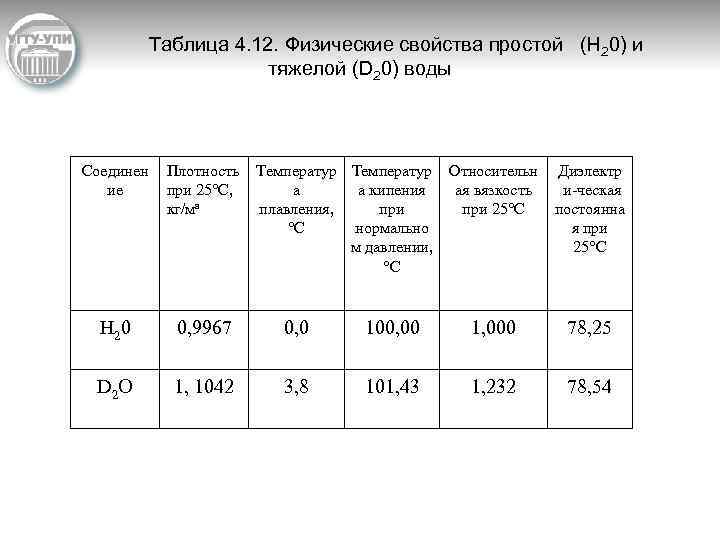 Таблица 4. 12. Физические свойства простой (Н 20) и тяжелой (D 20) воды Соединен ие Плотность при 25°С, кг/ма Температур а а кипения плавления, при °С нормально м давлении, °С Н 2 0 0, 9967 0, 0 D 2 O 1, 1042 3, 8 Относительн ая вязкость при 25°С Диэлектр и ческая постоянна я при 25°С 100, 00 1, 000 78, 25 101, 43 1, 232 78, 54
Таблица 4. 12. Физические свойства простой (Н 20) и тяжелой (D 20) воды Соединен ие Плотность при 25°С, кг/ма Температур а а кипения плавления, при °С нормально м давлении, °С Н 2 0 0, 9967 0, 0 D 2 O 1, 1042 3, 8 Относительн ая вязкость при 25°С Диэлектр и ческая постоянна я при 25°С 100, 00 1, 000 78, 25 101, 43 1, 232 78, 54
 Термодинамические изотопные эффекты • Изотопные эффекты, связанные с распределением изотопов в равновесных системах, получили название термодинамических. Их влияние на распределение изотопов приводит к тому, что константа равновесия K реакции изотопного обмена становится отличной от единицы. Так, например, для реакции изотопного обмена НТ+Н 20 = Н 2 + НТО опытным путем найдено, что K= [Н 2][НТО]/[НТ][ Н 20]=6, 23, т. е. равновесие сильно сдвинуто вправо. С увеличением массы элемента и уменьшением разности масс изотопных атомов термодинамический изотопный эффект быстро уменьшается. Например, для реакции изотопного обмена при 25°С 12 СО 2 (водн. р р) + 14 СО 14 СО 2 (водн. р р) +12 СО (газ) 3 2 (газ) = 3 2 К = 1, 024. В случае таких легких элементов, как Li, В, С, С 1, термодинамические изотопные эффекты приводят к изменению константы равновесия не более чем на 10%, а для более тяжелых элементов — нa 1 % и менее.
Термодинамические изотопные эффекты • Изотопные эффекты, связанные с распределением изотопов в равновесных системах, получили название термодинамических. Их влияние на распределение изотопов приводит к тому, что константа равновесия K реакции изотопного обмена становится отличной от единицы. Так, например, для реакции изотопного обмена НТ+Н 20 = Н 2 + НТО опытным путем найдено, что K= [Н 2][НТО]/[НТ][ Н 20]=6, 23, т. е. равновесие сильно сдвинуто вправо. С увеличением массы элемента и уменьшением разности масс изотопных атомов термодинамический изотопный эффект быстро уменьшается. Например, для реакции изотопного обмена при 25°С 12 СО 2 (водн. р р) + 14 СО 14 СО 2 (водн. р р) +12 СО (газ) 3 2 (газ) = 3 2 К = 1, 024. В случае таких легких элементов, как Li, В, С, С 1, термодинамические изотопные эффекты приводят к изменению константы равновесия не более чем на 10%, а для более тяжелых элементов — нa 1 % и менее.
 кинетические изотопные эффекты Различия свойств изотопно замещенных молекул и ионов может сказаться и на скоростях протекающих процессов (так называемые кинетические изотопные эффекты). Примером такого эффекта может служить уменьшение приблизительно в 2 раза скорости переноса электрона между ионами Fe 2+ и Fe 3+, которое наблюдается при замене Н 20 (растворитель) на D 2 O. Различия скоростей реакции изотопно замещенных молекул объ ясняют различиями в энергиях активации соответствующих процессов (а для изотопов водорода — и различиями в числе соударений реагирующих молекул). При замене легкого изотопа какого либо элемента на более тяжёлый любая реакция протекает медленнее. Значение кинетического изотопного эффекта быстро падает с увеличением массы элемента и с уменьшением разности масс изотопно замещенных молекул и изотопных атомов. Так, если для пары изотопов Н/Т кинетический изотопный эффект (отношение констант скоростей прямой и обратной реакций kп/kобр) при 25° С равен приблизительно 60 (наибольшее известное значение), то для пары 12 С/14 С он снижается до 1, 50, а для пары 127 I/131 I — до значения 1, 02, практически не отличающегося от единицы.
кинетические изотопные эффекты Различия свойств изотопно замещенных молекул и ионов может сказаться и на скоростях протекающих процессов (так называемые кинетические изотопные эффекты). Примером такого эффекта может служить уменьшение приблизительно в 2 раза скорости переноса электрона между ионами Fe 2+ и Fe 3+, которое наблюдается при замене Н 20 (растворитель) на D 2 O. Различия скоростей реакции изотопно замещенных молекул объ ясняют различиями в энергиях активации соответствующих процессов (а для изотопов водорода — и различиями в числе соударений реагирующих молекул). При замене легкого изотопа какого либо элемента на более тяжёлый любая реакция протекает медленнее. Значение кинетического изотопного эффекта быстро падает с увеличением массы элемента и с уменьшением разности масс изотопно замещенных молекул и изотопных атомов. Так, если для пары изотопов Н/Т кинетический изотопный эффект (отношение констант скоростей прямой и обратной реакций kп/kобр) при 25° С равен приблизительно 60 (наибольшее известное значение), то для пары 12 С/14 С он снижается до 1, 50, а для пары 127 I/131 I — до значения 1, 02, практически не отличающегося от единицы.
 Выводы • Резюмируя этот раздел, можно сделать вывод, что изотопные эффекты следует, безусловно, учитывать при работах с изотопами водорода и, в значительно меньшей степени, при работах с изотопами таких легких элементов, как Li, Be, В, С и N. • В случае использования изотопов более тяжелых элементов поправками, обусловленными, изотопными эффектами, можно пренебречь, так как их значение обычно составляет 1— 3% и менее.
Выводы • Резюмируя этот раздел, можно сделать вывод, что изотопные эффекты следует, безусловно, учитывать при работах с изотопами водорода и, в значительно меньшей степени, при работах с изотопами таких легких элементов, как Li, Be, В, С и N. • В случае использования изотопов более тяжелых элементов поправками, обусловленными, изотопными эффектами, можно пренебречь, так как их значение обычно составляет 1— 3% и менее.
 открытие Чердынцева и Чалова “Явления естественного разделения 234 U и 238 U”. • На фоне большой роли в ядерной физике и энергетике самых распространенных изотопов природного урана 238 U и 235 U, являющихся родоначальниками двух естественных радиоактивных рядов, 234 U длительное время после его открытия упоминался лишь как продукт распада 238 U. • Положение коренным образом изменилось после открытия Чердынцева и Чалова “Явления естественного разделения 234 U и 238 U”. • Сущность этого явления состоит в том, что при переходе изотопов урана из твердых природных урансодержащих образований в жидкости, не растворяющие эти образования, происходит обогащение изотопной смеси ураном 234.
открытие Чердынцева и Чалова “Явления естественного разделения 234 U и 238 U”. • На фоне большой роли в ядерной физике и энергетике самых распространенных изотопов природного урана 238 U и 235 U, являющихся родоначальниками двух естественных радиоактивных рядов, 234 U длительное время после его открытия упоминался лишь как продукт распада 238 U. • Положение коренным образом изменилось после открытия Чердынцева и Чалова “Явления естественного разделения 234 U и 238 U”. • Сущность этого явления состоит в том, что при переходе изотопов урана из твердых природных урансодержащих образований в жидкости, не растворяющие эти образования, происходит обогащение изотопной смеси ураном 234.
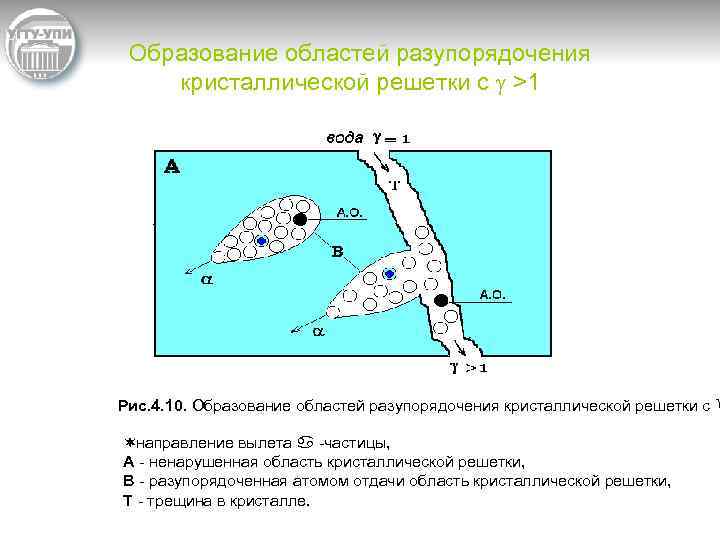 Образование областей разупорядочения кристаллической решетки с g >1 Рис. 4. 10. Образование областей разупорядочения кристаллической решетки с g ¬направление вылета a частицы, A ненарушенная область кристаллической решетки, B разупорядоченная атомом отдачи область кристаллической решетки, Т трещина в кристалле.
Образование областей разупорядочения кристаллической решетки с g >1 Рис. 4. 10. Образование областей разупорядочения кристаллической решетки с g ¬направление вылета a частицы, A ненарушенная область кристаллической решетки, B разупорядоченная атомом отдачи область кристаллической решетки, Т трещина в кристалле.
 отношение активностей 234 U/238 U • Наиболее просто избыток 234 U определяется путем измерений отношения активностей 234 U и 238 U , т. е. • . (4. 74) • Анализируя значение этой величины для ненарушенной (A) и нарушенной (B) областей кристалла, мы обнаружим существенные различия. • Если для области A, как правило, наблюдается радиоактивное равновесие, т. е. • (4. 75) • то для области B (т. е. пика смещения) есть вероятность p того, что атом отдачи останется в ней и (4. 76) • Таким образом, в области разупорядочения B отношение активностей 234 U/238 U по сравнению с областью A будет больше на величину: p/ 238 N 238, которая и соответствует величине избытка a активности 234 U.
отношение активностей 234 U/238 U • Наиболее просто избыток 234 U определяется путем измерений отношения активностей 234 U и 238 U , т. е. • . (4. 74) • Анализируя значение этой величины для ненарушенной (A) и нарушенной (B) областей кристалла, мы обнаружим существенные различия. • Если для области A, как правило, наблюдается радиоактивное равновесие, т. е. • (4. 75) • то для области B (т. е. пика смещения) есть вероятность p того, что атом отдачи останется в ней и (4. 76) • Таким образом, в области разупорядочения B отношение активностей 234 U/238 U по сравнению с областью A будет больше на величину: p/ 238 N 238, которая и соответствует величине избытка a активности 234 U.
 отношение активностей 234 U/238 U • Число атомов 238 U N 238 можно представить как произведение атомной концентрации 238 U (С) на общее число разупорядоченных атомов N в области B (пике смещения). Тогда (4. 76) перепишется в виде: • . (4. 77) • Здесь gp отношение активностей 234 U/238 U для пика смещения (область B), а g 0 та же величина для области A или кристалла в целом. • Соотношение (4. 77) определяет основные параметры, от которых может зависеть избыток 234 U в пиках смещения, и при наличии дополнительной информации может объяснить реально наблюдаемые вариации этой величины в различных условиях.
отношение активностей 234 U/238 U • Число атомов 238 U N 238 можно представить как произведение атомной концентрации 238 U (С) на общее число разупорядоченных атомов N в области B (пике смещения). Тогда (4. 76) перепишется в виде: • . (4. 77) • Здесь gp отношение активностей 234 U/238 U для пика смещения (область B), а g 0 та же величина для области A или кристалла в целом. • Соотношение (4. 77) определяет основные параметры, от которых может зависеть избыток 234 U в пиках смещения, и при наличии дополнительной информации может объяснить реально наблюдаемые вариации этой величины в различных условиях.
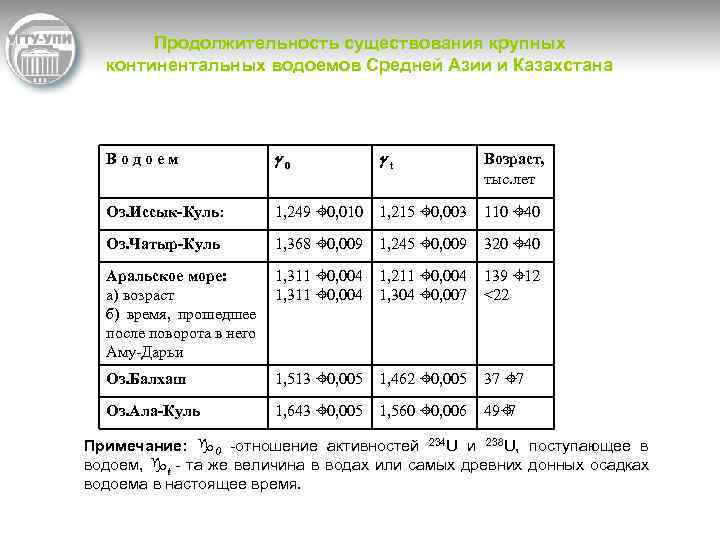 Продолжительность существования крупных континентальных водоемов Средней Азии и Казахстана Водоем g 0 gt Возраст, тыс. лет Оз. Иссык-Куль: 1, 249 ± 0, 010 1, 215 ± 0, 003 110 ± 40 Оз. Чатыр-Куль 1, 368 ± 0, 009 1, 245 ± 0, 009 320 ± 40 Аральское море: а) возраст б) время, прошедшее после поворота в него Аму Дарьи 1, 311 ± 0, 004 1, 211 ± 0, 004 1, 304 ± 0, 007 139 ± 12 <22 Оз. Балхаш 1, 513 ± 0, 005 1, 462 ± 0, 005 37 ± 7 Оз. Ала-Куль 1, 643 ± 0, 005 1, 560 ± 0, 006 49± 7 Примечание: g 0 отношение активностей 234 U и 238 U, поступающее в водоем, gt та же величина в водах или самых древних донных осадках водоема в настоящее время.
Продолжительность существования крупных континентальных водоемов Средней Азии и Казахстана Водоем g 0 gt Возраст, тыс. лет Оз. Иссык-Куль: 1, 249 ± 0, 010 1, 215 ± 0, 003 110 ± 40 Оз. Чатыр-Куль 1, 368 ± 0, 009 1, 245 ± 0, 009 320 ± 40 Аральское море: а) возраст б) время, прошедшее после поворота в него Аму Дарьи 1, 311 ± 0, 004 1, 211 ± 0, 004 1, 304 ± 0, 007 139 ± 12 <22 Оз. Балхаш 1, 513 ± 0, 005 1, 462 ± 0, 005 37 ± 7 Оз. Ала-Куль 1, 643 ± 0, 005 1, 560 ± 0, 006 49± 7 Примечание: g 0 отношение активностей 234 U и 238 U, поступающее в водоем, gt та же величина в водах или самых древних донных осадках водоема в настоящее время.
 открытие Чердынцева и Чалова “Явления естественного разделения 234 U и 238 U”. • Предлагается использование неравновесного урана для экологических целей, а именно для оценки доли техногенного урана, мигрирующего с подземными водами из хвостохранилищ заводов по переработке уранового сырья. • Чтобы сделать такую оценку необходимо количественно определить мигрирующий из хвостохранилищ техногенный уран. До сих пор способа решения такой задачи не предложено, так как уран элемент техногенного и естественного (природного) происхождения в водах не отличается. Однако такая возможность появилась после открытия эффекта естественного фракционирования урана 234 и урана 238. Она вытекает из механизма и закономерностей естественного разделения 234 U и 238 U, который рассмотрен выше.
открытие Чердынцева и Чалова “Явления естественного разделения 234 U и 238 U”. • Предлагается использование неравновесного урана для экологических целей, а именно для оценки доли техногенного урана, мигрирующего с подземными водами из хвостохранилищ заводов по переработке уранового сырья. • Чтобы сделать такую оценку необходимо количественно определить мигрирующий из хвостохранилищ техногенный уран. До сих пор способа решения такой задачи не предложено, так как уран элемент техногенного и естественного (природного) происхождения в водах не отличается. Однако такая возможность появилась после открытия эффекта естественного фракционирования урана 234 и урана 238. Она вытекает из механизма и закономерностей естественного разделения 234 U и 238 U, который рассмотрен выше.
 открытие Чердынцева и Чалова “Явления естественного разделения 234 U и 238 U”. • Природные воды практически всегда имеют избыток 234 U, что уже иллюстрировалось на рис. 4. 10. Но, если растворить кристалл полностью (см. рис. 4. 10), то мы получим в растворе равновесное отношение активностей 234 U/238 U. Именно такой процесс происходит при разложении урановых руд в ходе их переработки. В результате техногенный уран, в отличие от урана природных вод, должен иметь g =1. Следовательно, чтобы отличить уран природных вод от техногенного урана, мы имеем две разные изотопные метки: g>1 для первого и g=1 для второго. Выполнение указанных исходных предпосылок уран изотопного метода для исследуемого Кара Балтинского хвостохранилища и окружающих подземных вод иллюстрируется данными табл. 4. 14 и рис. 4. 12.
открытие Чердынцева и Чалова “Явления естественного разделения 234 U и 238 U”. • Природные воды практически всегда имеют избыток 234 U, что уже иллюстрировалось на рис. 4. 10. Но, если растворить кристалл полностью (см. рис. 4. 10), то мы получим в растворе равновесное отношение активностей 234 U/238 U. Именно такой процесс происходит при разложении урановых руд в ходе их переработки. В результате техногенный уран, в отличие от урана природных вод, должен иметь g =1. Следовательно, чтобы отличить уран природных вод от техногенного урана, мы имеем две разные изотопные метки: g>1 для первого и g=1 для второго. Выполнение указанных исходных предпосылок уран изотопного метода для исследуемого Кара Балтинского хвостохранилища и окружающих подземных вод иллюстрируется данными табл. 4. 14 и рис. 4. 12.
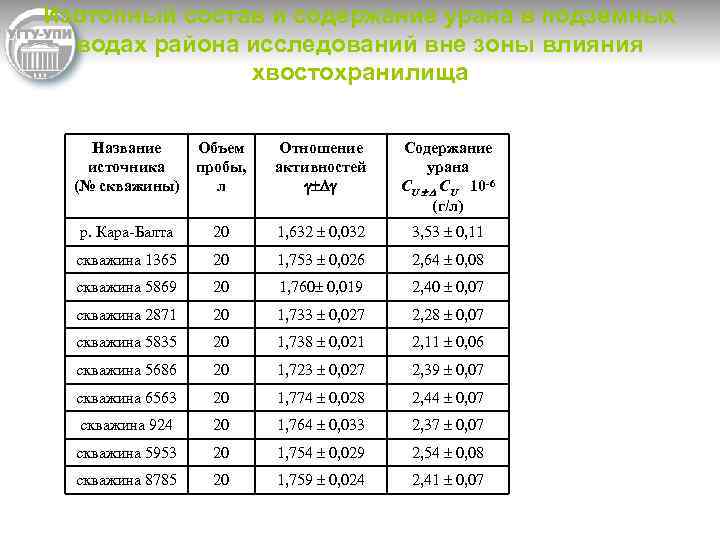 Изотопный состав и содержание урана в подземных водах района исследований вне зоны влияния хвостохранилища Название источника (№ скважины) Объем пробы, л Отношение активностей Содержание урана CU ± D CU 10 -6 (г/л) р. Кара Балта 20 1, 632 ± 0, 032 3, 53 ± 0, 11 скважина 1365 20 1, 753 ± 0, 026 2, 64 ± 0, 08 скважина 5869 20 1, 760± 0, 019 2, 40 ± 0, 07 скважина 2871 20 1, 733 ± 0, 027 2, 28 ± 0, 07 cкважина 5835 20 1, 738 ± 0, 021 2, 11 ± 0, 06 скважина 5686 20 1, 723 ± 0, 027 2, 39 ± 0, 07 скважина 6563 20 1, 774 ± 0, 028 2, 44 ± 0, 07 скважина 924 20 1, 764 ± 0, 033 2, 37 ± 0, 07 скважина 5953 20 1, 754 ± 0, 029 2, 54 ± 0, 08 скважина 8785 20 1, 759 ± 0, 024 2, 41 ± 0, 07
Изотопный состав и содержание урана в подземных водах района исследований вне зоны влияния хвостохранилища Название источника (№ скважины) Объем пробы, л Отношение активностей Содержание урана CU ± D CU 10 -6 (г/л) р. Кара Балта 20 1, 632 ± 0, 032 3, 53 ± 0, 11 скважина 1365 20 1, 753 ± 0, 026 2, 64 ± 0, 08 скважина 5869 20 1, 760± 0, 019 2, 40 ± 0, 07 скважина 2871 20 1, 733 ± 0, 027 2, 28 ± 0, 07 cкважина 5835 20 1, 738 ± 0, 021 2, 11 ± 0, 06 скважина 5686 20 1, 723 ± 0, 027 2, 39 ± 0, 07 скважина 6563 20 1, 774 ± 0, 028 2, 44 ± 0, 07 скважина 924 20 1, 764 ± 0, 033 2, 37 ± 0, 07 скважина 5953 20 1, 754 ± 0, 029 2, 54 ± 0, 08 скважина 8785 20 1, 759 ± 0, 024 2, 41 ± 0, 07
 открытие Чердынцева и Чалова “Явления естественного разделения 234 U и 238 U”. • Реально, имея дело со смесью этих двух разновидностей урана в водах, из уравнения изотопного разбавления (баланса) мы всегда можем рассчитать долю каждого из них. Это, в свою очередь, позволит оценить истинную радиационную опасность урана хвостохранилищ и отвалов, мигрирующего с природными водами. • Естественно, что этим путем мы можем также получить пространственную картину распределения техногенного урана в природных водах вокруг хвостохранилищ и отвалов. Для этого необходимо провести уран изотопную съемку.
открытие Чердынцева и Чалова “Явления естественного разделения 234 U и 238 U”. • Реально, имея дело со смесью этих двух разновидностей урана в водах, из уравнения изотопного разбавления (баланса) мы всегда можем рассчитать долю каждого из них. Это, в свою очередь, позволит оценить истинную радиационную опасность урана хвостохранилищ и отвалов, мигрирующего с природными водами. • Естественно, что этим путем мы можем также получить пространственную картину распределения техногенного урана в природных водах вокруг хвостохранилищ и отвалов. Для этого необходимо провести уран изотопную съемку.
 Рекомендуемая литература. • • • Радиоактивные индикаторы в химии. Основы метода: Учеб. пособие для ун тов/В. Б. Лукьянов, С. С. Бердоносов, И. О. Богатырев и др. ; Под ред. В. Б. Лукьянова. М. : Высш. шк. , 1985. Келлер К. Радиохимия. М. : Атомиздат, 1978. Несмеянов А. Н. Радиохимия. М. : Химия, 1979. 559 с. Чердынцев В. В. и Чалов П. И. Явление естественного разделения урана 234 и урана 238. Открытия в СССР. М. : ЦНИИПИ, 1977. C. 28. Чалов П. И. Изотопное фракционирование природного урана. Фрунзе: Илим, 1975. 236 с.
Рекомендуемая литература. • • • Радиоактивные индикаторы в химии. Основы метода: Учеб. пособие для ун тов/В. Б. Лукьянов, С. С. Бердоносов, И. О. Богатырев и др. ; Под ред. В. Б. Лукьянова. М. : Высш. шк. , 1985. Келлер К. Радиохимия. М. : Атомиздат, 1978. Несмеянов А. Н. Радиохимия. М. : Химия, 1979. 559 с. Чердынцев В. В. и Чалов П. И. Явление естественного разделения урана 234 и урана 238. Открытия в СССР. М. : ЦНИИПИ, 1977. C. 28. Чалов П. И. Изотопное фракционирование природного урана. Фрунзе: Илим, 1975. 236 с.


