 Диоксид-дихлорид хрома (Хлористый хромил) Cr. O 2 Cl 2 Кинев Владислав 1171
Диоксид-дихлорид хрома (Хлористый хромил) Cr. O 2 Cl 2 Кинев Владислав 1171
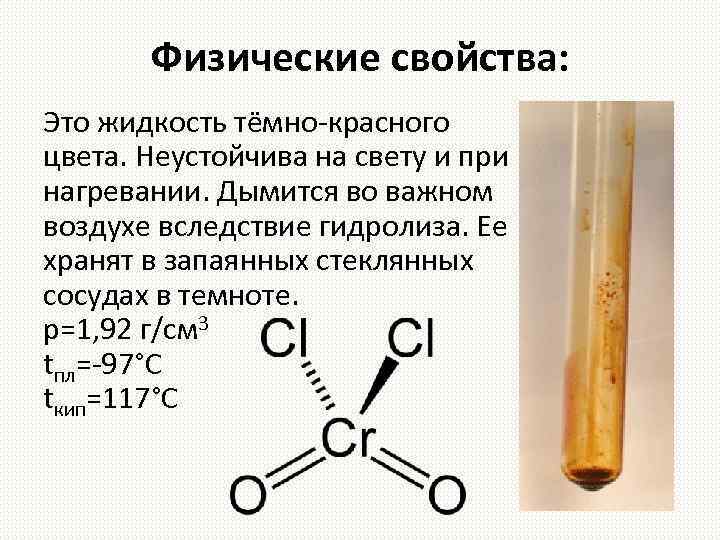 Физические свойства: Это жидкость тёмно-красного цвета. Неустойчива на свету и при нагревании. Дымится во важном воздухе вследствие гидролиза. Ее хранят в запаянных стеклянных сосудах в темноте. р=1, 92 г/см 3 tпл=-97°С tкип=117°С
Физические свойства: Это жидкость тёмно-красного цвета. Неустойчива на свету и при нагревании. Дымится во важном воздухе вследствие гидролиза. Ее хранят в запаянных стеклянных сосудах в темноте. р=1, 92 г/см 3 tпл=-97°С tкип=117°С
 Получение: 1)Cr. O 3 + 2 HCl (конц. ) = Cr. Cl 2 O 2(ж)↓ + H 2 O (0° C, в конц. H 2 SO 4) 2)4 Na. Cl + K 2 Cr 2 O 7 + 3 H 2 SO 4 = 2 Cr. Cl 2 O 2 + K 2 SO 4 + 2 Na 2 SO 4 + 3 H 2 O
Получение: 1)Cr. O 3 + 2 HCl (конц. ) = Cr. Cl 2 O 2(ж)↓ + H 2 O (0° C, в конц. H 2 SO 4) 2)4 Na. Cl + K 2 Cr 2 O 7 + 3 H 2 SO 4 = 2 Cr. Cl 2 O 2 + K 2 SO 4 + 2 Na 2 SO 4 + 3 H 2 O
 Химические свойства: Cr. O 2 Cl 2 является очень электрофильным веществом и агрессивным окислителем; самовозгорается при капании на аморфную серу. При гидролизе в продуктах реакции получаются хромовая и соляная кислоты: Cr. O 2 Cl 2 + 2 H 2 O = H 2 Cr. O 4 + 2 HCl Его высокая реакционная способность по отношению к воде указывает на тот факт, что Cr. O 2 Cl 2 способен дымиться во влажном воздухе. С горючими неорганическими и органическими веществами может реагировать со взрывом.
Химические свойства: Cr. O 2 Cl 2 является очень электрофильным веществом и агрессивным окислителем; самовозгорается при капании на аморфную серу. При гидролизе в продуктах реакции получаются хромовая и соляная кислоты: Cr. O 2 Cl 2 + 2 H 2 O = H 2 Cr. O 4 + 2 HCl Его высокая реакционная способность по отношению к воде указывает на тот факт, что Cr. O 2 Cl 2 способен дымиться во влажном воздухе. С горючими неорганическими и органическими веществами может реагировать со взрывом.
 Применение: Дихлорид-диоксида хрома является очень агрессивным реагентом. Активно реагирует с водой, спиртами и другими сильно электрофильными веществами, такими как VOCl 3, Ti. Cl 4 и SO 2 Cl 2. Хлористый хромил нашел некоторое применение при окислении олефинов.
Применение: Дихлорид-диоксида хрома является очень агрессивным реагентом. Активно реагирует с водой, спиртами и другими сильно электрофильными веществами, такими как VOCl 3, Ti. Cl 4 и SO 2 Cl 2. Хлористый хромил нашел некоторое применение при окислении олефинов.