11Транспорт ионов Bio.ppt
- Количество слайдов: 65

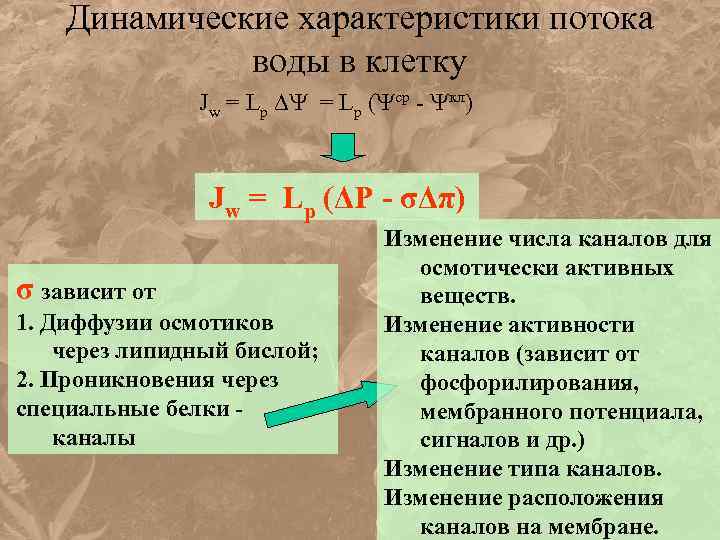 Динамические характеристики потока воды в клетку Jw = Lр ( ср - кл) Jw = Lр (ΔP - σΔπ) σ зависит от 1. Диффузии осмотиков через липидный бислой; 2. Проникновения через специальные белки - каналы Изменение числа каналов для осмотически активных веществ. Изменение активности каналов (зависит от фосфорилирования, мембранного потенциала, сигналов и др. ) Изменение типа каналов. Изменение расположения каналов на мембране.
Динамические характеристики потока воды в клетку Jw = Lр ( ср - кл) Jw = Lр (ΔP - σΔπ) σ зависит от 1. Диффузии осмотиков через липидный бислой; 2. Проникновения через специальные белки - каналы Изменение числа каналов для осмотически активных веществ. Изменение активности каналов (зависит от фосфорилирования, мембранного потенциала, сигналов и др. ) Изменение типа каналов. Изменение расположения каналов на мембране.
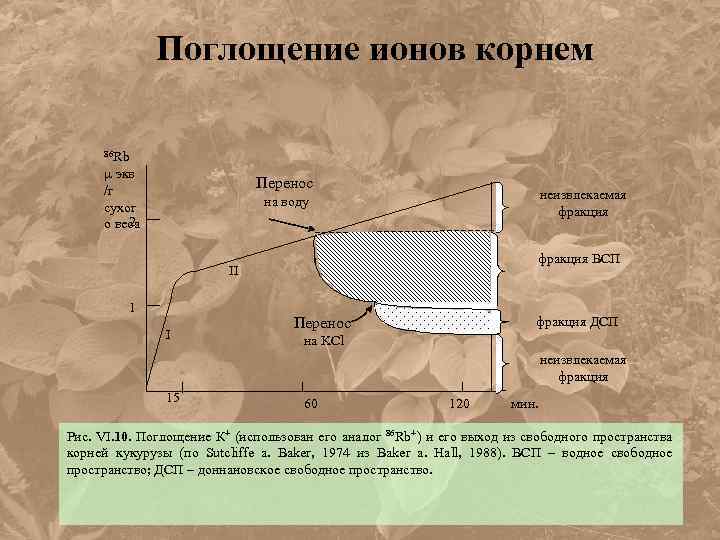 Поглощение ионов корнем 86 Rb экв /г сухог 2 о веса Перенос неизвлекаемая фракция на воду фракция ВСП II 1 I фракция ДСП Перенос на KCl неизвлекаемая фракция 15 60 120 мин. Рис. VI. 10. Поглощение К+ (использован его аналог 86 Rb+) и его выход из свободного пространства корней кукурузы (по Sutcliffe a. Baker, 1974 из Baker a. Hall, 1988). ВСП – водное свободное пространство; ДСП – доннановское свободное пространство.
Поглощение ионов корнем 86 Rb экв /г сухог 2 о веса Перенос неизвлекаемая фракция на воду фракция ВСП II 1 I фракция ДСП Перенос на KCl неизвлекаемая фракция 15 60 120 мин. Рис. VI. 10. Поглощение К+ (использован его аналог 86 Rb+) и его выход из свободного пространства корней кукурузы (по Sutcliffe a. Baker, 1974 из Baker a. Hall, 1988). ВСП – водное свободное пространство; ДСП – доннановское свободное пространство.
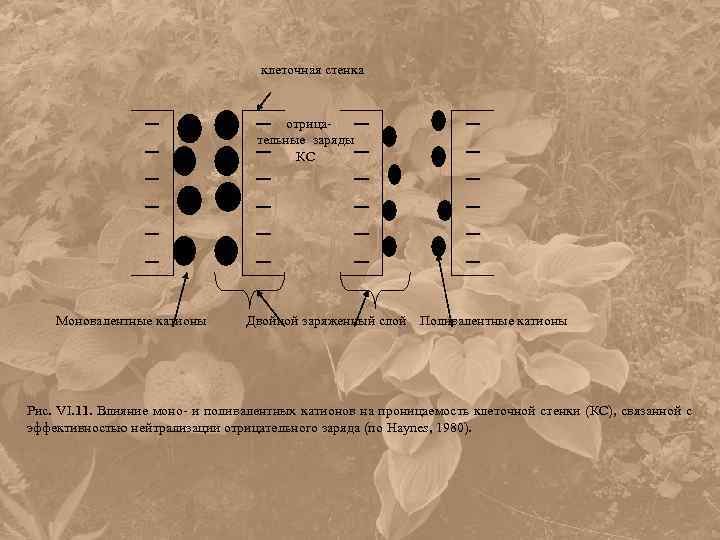 клеточная стенка отрица- тельные заряды КС Моновалентные катионы Двойной заряженный слой Поливалентные катионы Рис. VI. 11. Влияние моно- и поливалентных катионов на проницаемость клеточной стенки (КС), связанной с эффективностью нейтрализации отрицательного заряда (по Haynes, 1980).
клеточная стенка отрица- тельные заряды КС Моновалентные катионы Двойной заряженный слой Поливалентные катионы Рис. VI. 11. Влияние моно- и поливалентных катионов на проницаемость клеточной стенки (КС), связанной с эффективностью нейтрализации отрицательного заряда (по Haynes, 1980).
 Х- К 1+ + К 1 А 1 - К 2+ А 2 Неуравновешенный ион Рис. VI. 12. Возникновение Доннановского потенциала (ЕD) в системе клеточная стенка – раствор. Х- - фиксированный отрицательный заряд клеточной стенки; К 1+ и К 2+ - одновалентные катионы; А 1 - и А 2 - - одновалентные анионы диссоциированной соли, стрелки указывают на перемещение ионов; большая стрелка отражает возникновение градиента электрического потенциала. В формуле Доннана: R – газовая постоянная; T – абсолютная температура; F – число Фарадея; z – заряд иона; СKin(Ain) и CKout(Aout) – концентрации ионов в КС (in) и в растворе (out).
Х- К 1+ + К 1 А 1 - К 2+ А 2 Неуравновешенный ион Рис. VI. 12. Возникновение Доннановского потенциала (ЕD) в системе клеточная стенка – раствор. Х- - фиксированный отрицательный заряд клеточной стенки; К 1+ и К 2+ - одновалентные катионы; А 1 - и А 2 - - одновалентные анионы диссоциированной соли, стрелки указывают на перемещение ионов; большая стрелка отражает возникновение градиента электрического потенциала. В формуле Доннана: R – газовая постоянная; T – абсолютная температура; F – число Фарадея; z – заряд иона; СKin(Ain) и CKout(Aout) – концентрации ионов в КС (in) и в растворе (out).
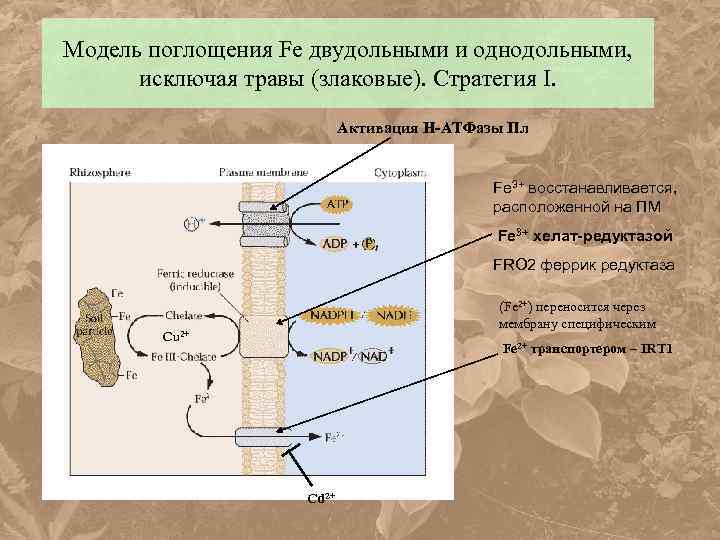 Модель поглощения Fe двудольными и однодольными, исключая травы (злаковые). Стратегия I. Активация Н-АТФазы Пл Fe 3+ восстанавливается, расположенной на ПМ Fe 3+ хелат-редуктазой FRO 2 феррик редуктаза (Fe 2+) переносится через мембрану специфическим Cu 2+ Fe 2+ транспортером – IRT 1 Cd 2+
Модель поглощения Fe двудольными и однодольными, исключая травы (злаковые). Стратегия I. Активация Н-АТФазы Пл Fe 3+ восстанавливается, расположенной на ПМ Fe 3+ хелат-редуктазой FRO 2 феррик редуктаза (Fe 2+) переносится через мембрану специфическим Cu 2+ Fe 2+ транспортером – IRT 1 Cd 2+
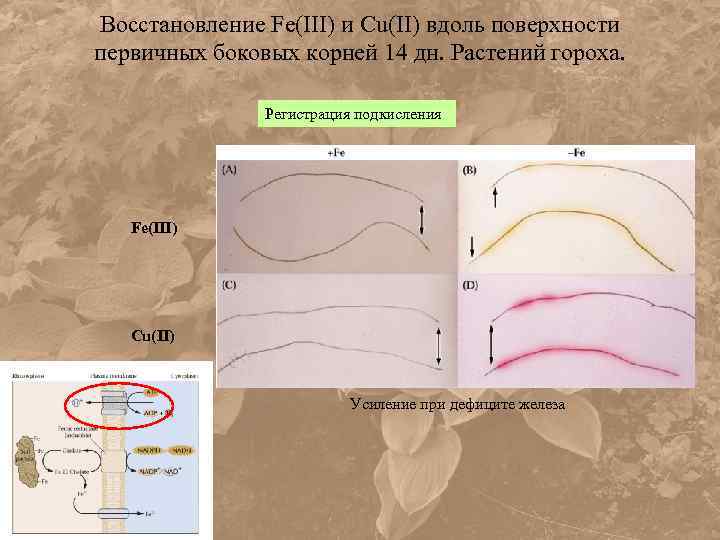 Восстановление Fe(III) и Cu(II) вдоль поверхности первичных боковых корней 14 дн. Растений гороха. Регистрация подкисления Fe(III) Cu(II) Усиление при дефиците железа
Восстановление Fe(III) и Cu(II) вдоль поверхности первичных боковых корней 14 дн. Растений гороха. Регистрация подкисления Fe(III) Cu(II) Усиление при дефиците железа
 Феррохелатаза
Феррохелатаза
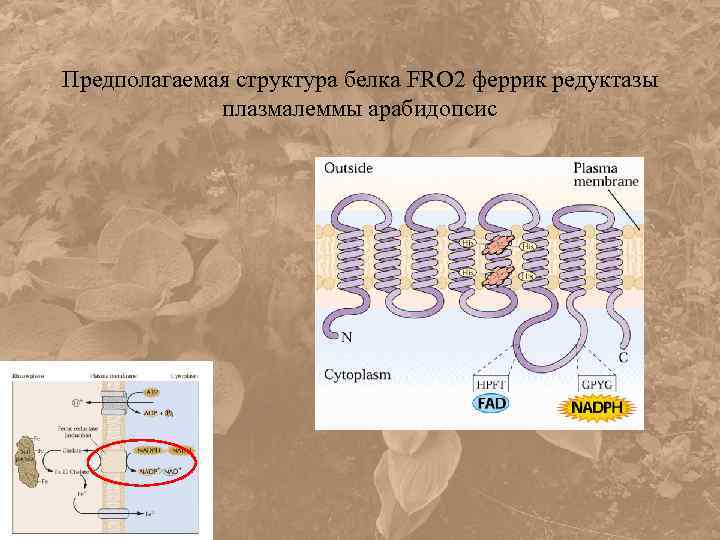 Предполагаемая структура белка FRO 2 феррик редуктазы плазмалеммы арабидопсис
Предполагаемая структура белка FRO 2 феррик редуктазы плазмалеммы арабидопсис
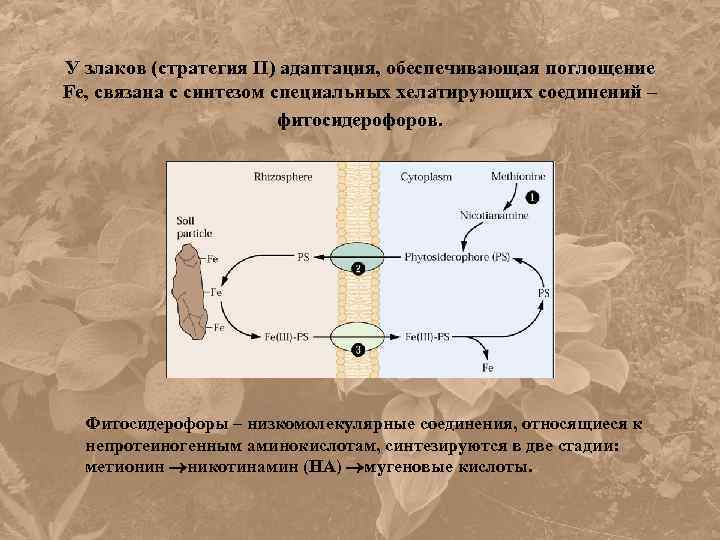 У злаков (стратегия II) адаптация, обеспечивающая поглощение Fe, связана с синтезом специальных хелатирующих соединений – фитосидерофоров. Фитосидерофоры – низкомолекулярные соединения, относящиеся к непротеиногенным аминокислотам, синтезируются в две стадии: метионин никотинамин (НА) мугеновые кислоты.
У злаков (стратегия II) адаптация, обеспечивающая поглощение Fe, связана с синтезом специальных хелатирующих соединений – фитосидерофоров. Фитосидерофоры – низкомолекулярные соединения, относящиеся к непротеиногенным аминокислотам, синтезируются в две стадии: метионин никотинамин (НА) мугеновые кислоты.
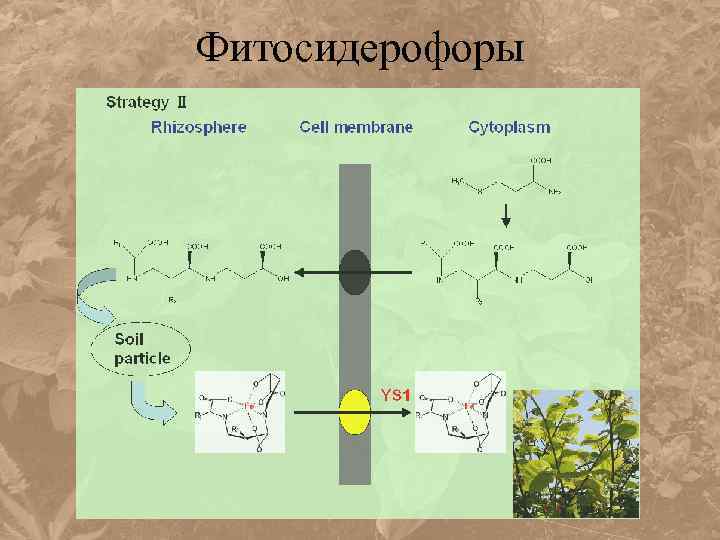 Фитосидерофоры
Фитосидерофоры
 Поступление в клетку. Перенос через плазмалемму. 1. Электрофизиологический подход 2. Кинетический подход 3. Молекулярно биологический подход
Поступление в клетку. Перенос через плазмалемму. 1. Электрофизиологический подход 2. Кинетический подход 3. Молекулярно биологический подход
 Электрофизиологический подход Потенциал Нернста может быть использован, чтобы установить тип транспорта: активный или пасивный? = 0 + RTlna + z. FE - электрохимический потенциал
Электрофизиологический подход Потенциал Нернста может быть использован, чтобы установить тип транспорта: активный или пасивный? = 0 + RTlna + z. FE - электрохимический потенциал
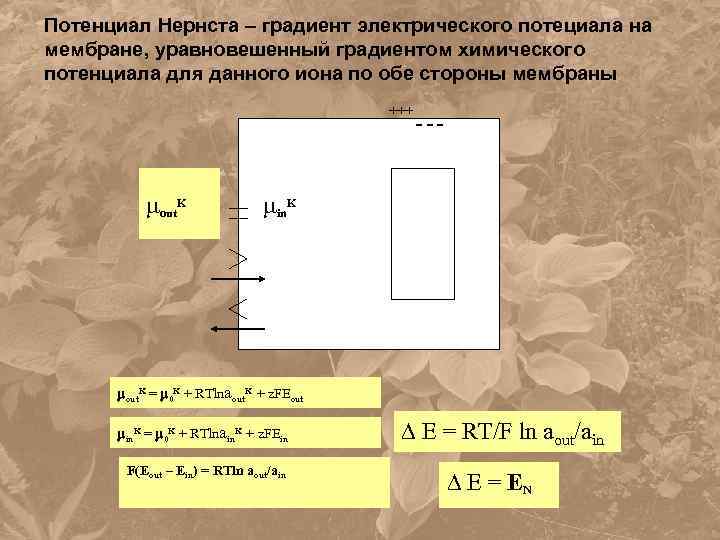 Потенциал Нернста – градиент электрического потециала на мембране, уравновешенный градиентом химического потенциала для данного иона по обе стороны мембраны +++ out. K - - - in. K out. K = 0 K + RTlnaout. K + z. FEout in. K = 0 K + RTlnain. K + z. FEin F(Eout – Ein) = RTln aout/ain E = RT/F ln aout/ain E = EN
Потенциал Нернста – градиент электрического потециала на мембране, уравновешенный градиентом химического потенциала для данного иона по обе стороны мембраны +++ out. K - - - in. K out. K = 0 K + RTlnaout. K + z. FEout in. K = 0 K + RTlnain. K + z. FEin F(Eout – Ein) = RTln aout/ain E = RT/F ln aout/ain E = EN
 Электрофизиологический подход позволяет предсказать тип транспорта • Пассивный транспорт – движение иона через мембрану в сторону его меньшего электрохимического потенциала. • Активный транспорт - перемещение иона через мембрану в сторону его более высокого электрохимического потенциала.
Электрофизиологический подход позволяет предсказать тип транспорта • Пассивный транспорт – движение иона через мембрану в сторону его меньшего электрохимического потенциала. • Активный транспорт - перемещение иона через мембрану в сторону его более высокого электрохимического потенциала.
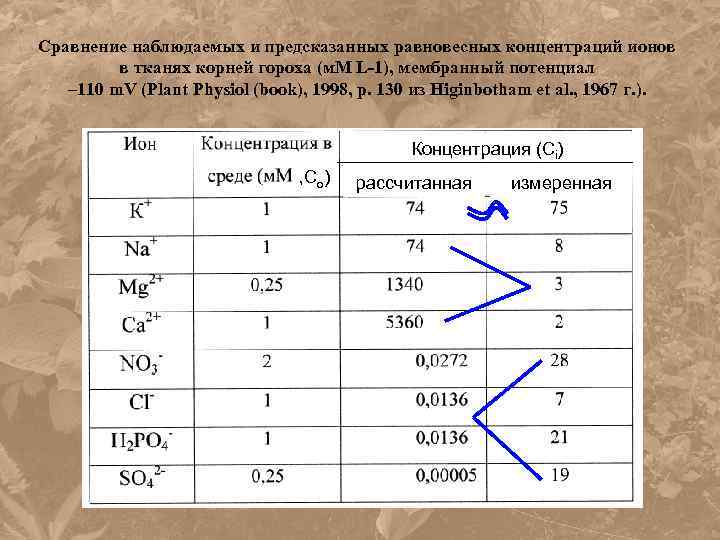 Сравнение наблюдаемых и предсказанных равновесных концентраций ионов в тканях корней гороха (м. М L-1), мембранный потенциал – 110 m. V (Plant Physiol (book), 1998, p. 130 из Higinbotham et al. , 1967 г. ). Концентрация (Сi) , Со) рассчитанная измеренная
Сравнение наблюдаемых и предсказанных равновесных концентраций ионов в тканях корней гороха (м. М L-1), мембранный потенциал – 110 m. V (Plant Physiol (book), 1998, p. 130 из Higinbotham et al. , 1967 г. ). Концентрация (Сi) , Со) рассчитанная измеренная
 По градиенту электрохимического потенциала, без затраты энергии Без специальных структур на мембране Против градиента электрохимического потенциала, с затратой энергии Первично активный Переносится одно вещество, используются макроэргические связи АТФ, пирофосфат и др. Вторично активный Два вещества переносятся в одном направлении, используется электрохимический потенциал одного из веществ Вторично Специальные белковые на мембране активный комплексы, обладающие Два вещества переносятся в разных разной специфичностью направлениях, используется электрохимический к переносимому веществу потенциал одного из веществ
По градиенту электрохимического потенциала, без затраты энергии Без специальных структур на мембране Против градиента электрохимического потенциала, с затратой энергии Первично активный Переносится одно вещество, используются макроэргические связи АТФ, пирофосфат и др. Вторично активный Два вещества переносятся в одном направлении, используется электрохимический потенциал одного из веществ Вторично Специальные белковые на мембране активный комплексы, обладающие Два вещества переносятся в разных разной специфичностью направлениях, используется электрохимический к переносимому веществу потенциал одного из веществ
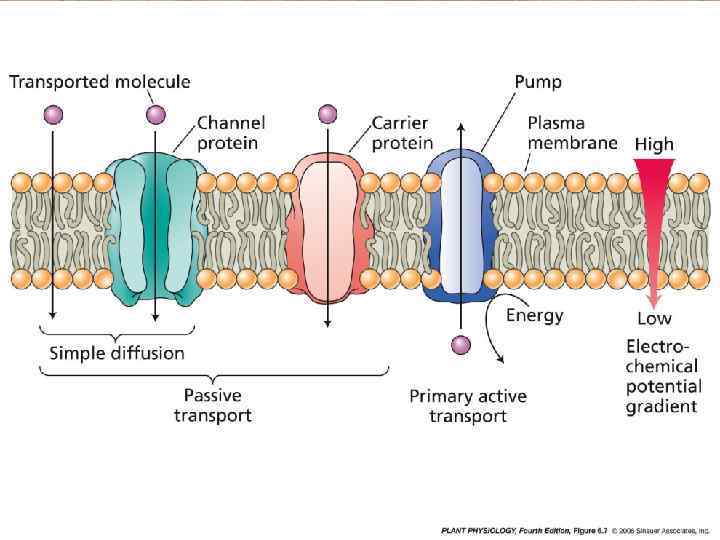
 Активное поглощение и пассивное поглощение. Активный транспорт Первичный Вторичный Помпы Портерные системы Н-АТФаза плазмалеммы Симпорт Н-АТФаза тонопласта Антипорт Пирофосфатаза Тн Унипорт Редокс цепи Пассивный транспорт Каналы: входящие (in) и выходящие (out) Способы (или механизмы) активного поглощения различаются по формам потребляемой энергии.
Активное поглощение и пассивное поглощение. Активный транспорт Первичный Вторичный Помпы Портерные системы Н-АТФаза плазмалеммы Симпорт Н-АТФаза тонопласта Антипорт Пирофосфатаза Тн Унипорт Редокс цепи Пассивный транспорт Каналы: входящие (in) и выходящие (out) Способы (или механизмы) активного поглощения различаются по формам потребляемой энергии.
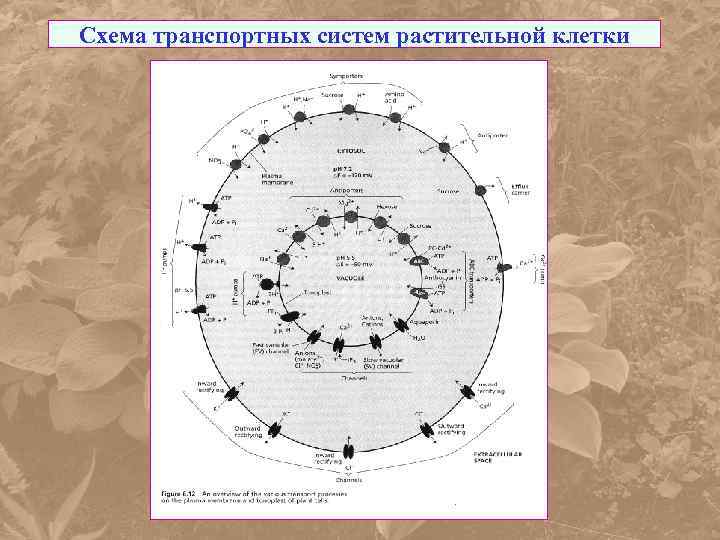 Схема транспортных систем растительной клетки
Схема транспортных систем растительной клетки
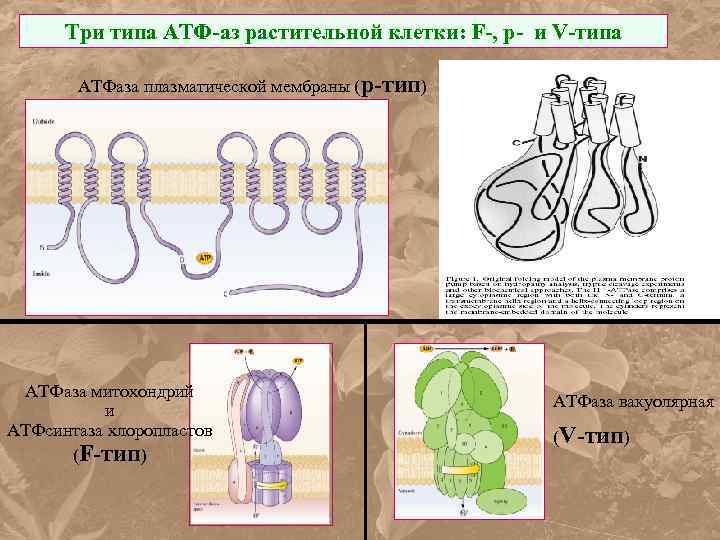 Три типа АТФ-аз растительной клетки: F-, p- и V-типа АТФаза плазматической мембраны (p-тип) АТФаза митохондрий и АТФсинтаза хлоропластов (F-тип) АТФаза вакуолярная (V-тип)
Три типа АТФ-аз растительной клетки: F-, p- и V-типа АТФаза плазматической мембраны (p-тип) АТФаза митохондрий и АТФсинтаза хлоропластов (F-тип) АТФаза вакуолярная (V-тип)
 Н-АТФаза плазмалеммы Р-типа • Один большой полипептид 100 - 106 к. Да • Регулируется по принципу «фосфорилирование/дефосфорилирование» по серину протенкиназами • Образует промежуточный фосфорилированный интермедиат (по аспартиловому концу фермента) • Ингибируется ванадатом (блокирует фосфорилирование по аспартиловому концу фермента) • Ингибируется DES, DCCD, сульфгидрильными реагентами • Сходна с АТФазами животных клеток: Na, K-АТФаза; H, KАТФаза; Ca-АТФаза) • Зависит от градиента Н+ • К+-зависимая
Н-АТФаза плазмалеммы Р-типа • Один большой полипептид 100 - 106 к. Да • Регулируется по принципу «фосфорилирование/дефосфорилирование» по серину протенкиназами • Образует промежуточный фосфорилированный интермедиат (по аспартиловому концу фермента) • Ингибируется ванадатом (блокирует фосфорилирование по аспартиловому концу фермента) • Ингибируется DES, DCCD, сульфгидрильными реагентами • Сходна с АТФазами животных клеток: Na, K-АТФаза; H, KАТФаза; Ca-АТФаза) • Зависит от градиента Н+ • К+-зависимая
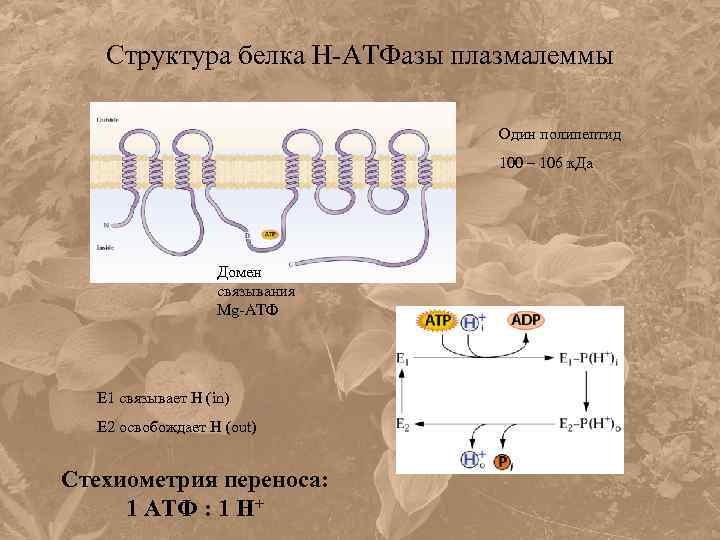 Структура белка Н-АТФазы плазмалеммы Один полипептид 100 – 106 к. Да Домен связывания Mg-АТФ Е 1 связывает Н (in) Е 2 освобождает Н (out) Стехиометрия переноса: 1 АТФ : 1 Н+
Структура белка Н-АТФазы плазмалеммы Один полипептид 100 – 106 к. Да Домен связывания Mg-АТФ Е 1 связывает Н (in) Е 2 освобождает Н (out) Стехиометрия переноса: 1 АТФ : 1 Н+
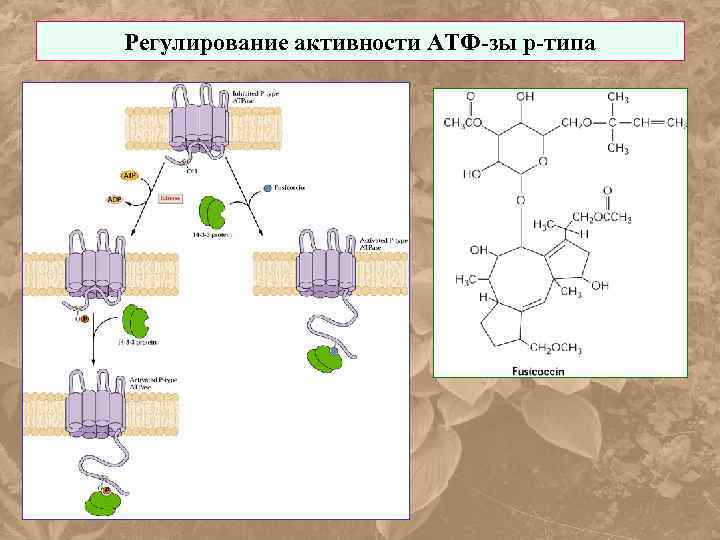 Регулирование активности АТФ-зы р-типа
Регулирование активности АТФ-зы р-типа
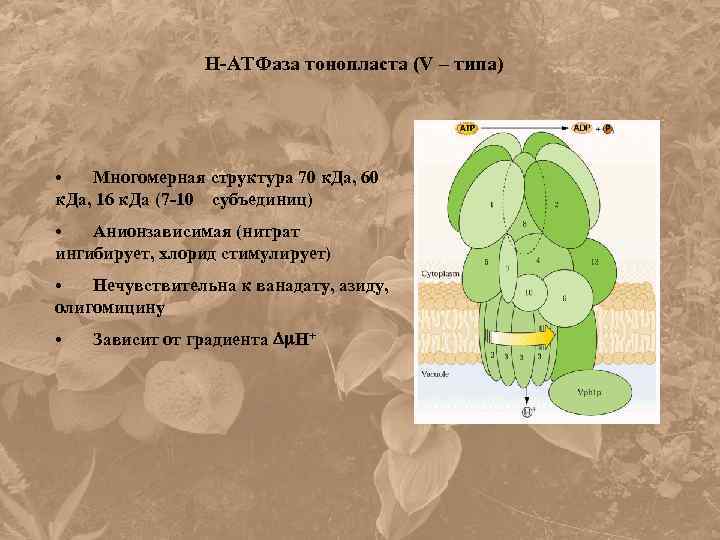 Н-АТФаза тонопласта (V – типа) • Многомерная структура 70 к. Да, 60 к. Да, 16 к. Да (7 -10 субъединиц) • Анионзависимая (нитрат ингибирует, хлорид стимулирует) • Нечувствительна к ванадату, азиду, олигомицину • Зависит от градиента Н+
Н-АТФаза тонопласта (V – типа) • Многомерная структура 70 к. Да, 60 к. Да, 16 к. Да (7 -10 субъединиц) • Анионзависимая (нитрат ингибирует, хлорид стимулирует) • Нечувствительна к ванадату, азиду, олигомицину • Зависит от градиента Н+
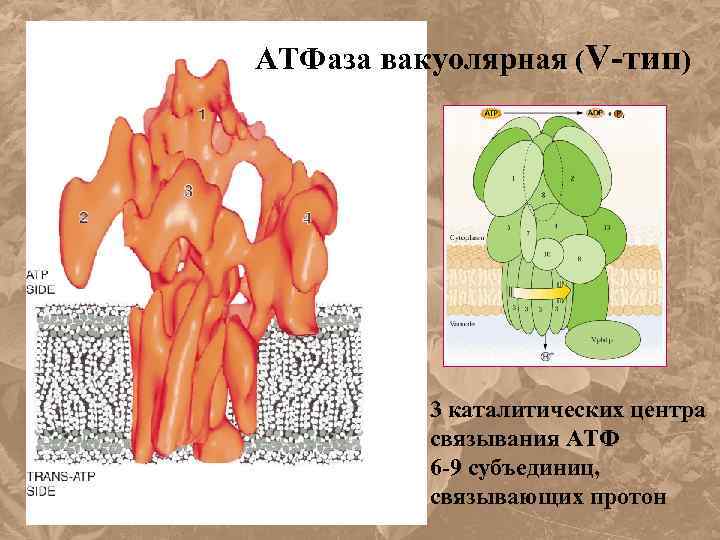 АТФаза вакуолярная (V-тип) 3 каталитических центра связывания АТФ 6 -9 субъединиц, связывающих протон
АТФаза вакуолярная (V-тип) 3 каталитических центра связывания АТФ 6 -9 субъединиц, связывающих протон
 • 64 – 67 к. Да • катионзависимая (стимулируется К+, ингибируется Na+, Са 2+) • высокоспецифична к пирофосфату • зависит от концентрации магния • зависит от градиента Н+ • ингибируется сульфгидрильными реагентами Входит в состав тонопласта. Стехиометрия переноса: 1 пирофосфат : 1 Н+
• 64 – 67 к. Да • катионзависимая (стимулируется К+, ингибируется Na+, Са 2+) • высокоспецифична к пирофосфату • зависит от концентрации магния • зависит от градиента Н+ • ингибируется сульфгидрильными реагентами Входит в состав тонопласта. Стехиометрия переноса: 1 пирофосфат : 1 Н+
 CS 1 Mg. ФФн (Са 2+) Н+ 1 N конец 2 ГП К+ Mg 2+ 5 6 7 14 С конец Входит в состав тонопласта. Стехиометрия переноса: 1 пирофосфат : 1 Н+
CS 1 Mg. ФФн (Са 2+) Н+ 1 N конец 2 ГП К+ Mg 2+ 5 6 7 14 С конец Входит в состав тонопласта. Стехиометрия переноса: 1 пирофосфат : 1 Н+
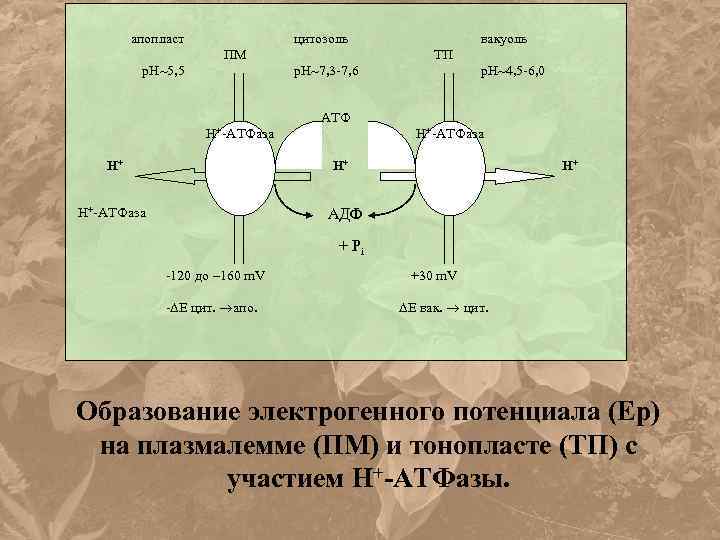 апопласт цитозоль ПМ р. Н 5, 5 вакуоль ТП р. Н 7, 3 -7, 6 р. Н 4, 5 -6, 0 АТФ Н+-АТФаза Н+ АДФ + Рi -120 до – 160 m. V - E цит. апо. +30 m. V E вак. цит. Образование электрогенного потенциала (Ер) на плазмалемме (ПМ) и тонопласте (ТП) с участием Н+-АТФазы.
апопласт цитозоль ПМ р. Н 5, 5 вакуоль ТП р. Н 7, 3 -7, 6 р. Н 4, 5 -6, 0 АТФ Н+-АТФаза Н+ АДФ + Рi -120 до – 160 m. V - E цит. апо. +30 m. V E вак. цит. Образование электрогенного потенциала (Ер) на плазмалемме (ПМ) и тонопласте (ТП) с участием Н+-АТФазы.
 Первичный активный транспорт Н+ Н+-АТФаза плазмалеммы (P-типа) Н+-АТФаза тонопласта (V-типа) Пирофосфатаза Тн Ca 2+ Са 2+АТФаза ПМ (P-типа) Са 2+АТФаза ЭР (P-типа) Na+ Ионы тяжелых Ме Аминокислоты Органические кислоты Пептиды липиды ксенобиотики Nа+АТФаза плазмалеммы АВС транспортеры
Первичный активный транспорт Н+ Н+-АТФаза плазмалеммы (P-типа) Н+-АТФаза тонопласта (V-типа) Пирофосфатаза Тн Ca 2+ Са 2+АТФаза ПМ (P-типа) Са 2+АТФаза ЭР (P-типа) Na+ Ионы тяжелых Ме Аминокислоты Органические кислоты Пептиды липиды ксенобиотики Nа+АТФаза плазмалеммы АВС транспортеры
 Са 2+ -АТФазы Са 2+АТФазы принадлежат к большому кругу АТФаз Ртипа Са 2+АТФазы ПМ Са 2+АТФазы ЭР У растений в отличие от животных Са 2+АТФазы ПМ типа локализованы не только на плазмалемме, но и на эндомембранах
Са 2+ -АТФазы Са 2+АТФазы принадлежат к большому кругу АТФаз Ртипа Са 2+АТФазы ПМ Са 2+АТФазы ЭР У растений в отличие от животных Са 2+АТФазы ПМ типа локализованы не только на плазмалемме, но и на эндомембранах
 ABC-транспортеры Транспортные белки, которые используют энергию гидролиза АТФ для транспорта через мембраны самых разных химических агентов Представлены у всех оганизмов Очень многочисленное семейство Арабидопсис : 131 различных белков 3 основных мультисемейства: pleiotropic drug resistance (PDR), multidrug resistance (MDR), multidrug resistance-associated protein (MRP)
ABC-транспортеры Транспортные белки, которые используют энергию гидролиза АТФ для транспорта через мембраны самых разных химических агентов Представлены у всех оганизмов Очень многочисленное семейство Арабидопсис : 131 различных белков 3 основных мультисемейства: pleiotropic drug resistance (PDR), multidrug resistance (MDR), multidrug resistance-associated protein (MRP)
 Пассивный ионный транспорт по каналу. Ионные каналы – интегральные мембранные белки, образующие «пору» в мембране Движущая сила транспорта – электрохимический градиент Кат = RTln Cout/Cin + z. F E (плазмалемма) Ан = RTln Cout/Cin - z. F E(плазмалемма) Транспорт иона по каналу зависит от потенциала на мембране концентрации иона по обе стороны мембраны свойств канального белка сигнала эндогенной природы
Пассивный ионный транспорт по каналу. Ионные каналы – интегральные мембранные белки, образующие «пору» в мембране Движущая сила транспорта – электрохимический градиент Кат = RTln Cout/Cin + z. F E (плазмалемма) Ан = RTln Cout/Cin - z. F E(плазмалемма) Транспорт иона по каналу зависит от потенциала на мембране концентрации иона по обе стороны мембраны свойств канального белка сигнала эндогенной природы
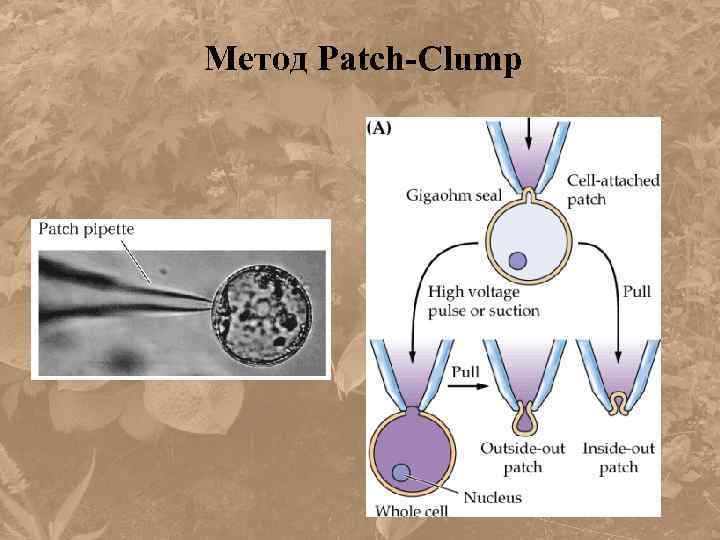 Метод Patch-Clump
Метод Patch-Clump
 1. Катионные и анионные 2. “Входящие” (in) и “выходящие” (out) 3. Селективность: специфические и неспецифические 4. Потенциал-зависимые и рецептороуправляемые 5. Быстрые и медленные
1. Катионные и анионные 2. “Входящие” (in) и “выходящие” (out) 3. Селективность: специфические и неспецифические 4. Потенциал-зависимые и рецептороуправляемые 5. Быстрые и медленные
 К+ участвует: поддержание катионно-анионного баланса – является противоионом для анионов органических кислот; Осморегуляции - в вакуоли калий выполняет роль осмотика Активирует некоторые ферменты; Участвует в создании мембранного потенциала
К+ участвует: поддержание катионно-анионного баланса – является противоионом для анионов органических кислот; Осморегуляции - в вакуоли калий выполняет роль осмотика Активирует некоторые ферменты; Участвует в создании мембранного потенциала
![[K+] [Cl-] A 100 м. М KCl Б 1 м. М KCl а) [K+] [Cl-] A 100 м. М KCl Б 1 м. М KCl а)](https://present5.com/presentation/112200768_352218689/image-37.jpg) [K+] [Cl-] A 100 м. М KCl Б 1 м. М KCl а) Исходная система электронейтральна + [K+] [Cl-] - - + + - E - + Ed - + б) Возникает - E, при равновесии потоков между А и Б электрический потенциал мембраны соответствует диффузионному потенциалу Еd Рис. VI. 13. Возникновение диффузионного потенциала (Еd) при разной проницаемости (Р) мембраны для катиона и аниона (РК+> РСl-); стрелки – градиенты химических и электрического потенциалов и их направления.
[K+] [Cl-] A 100 м. М KCl Б 1 м. М KCl а) Исходная система электронейтральна + [K+] [Cl-] - - + + - E - + Ed - + б) Возникает - E, при равновесии потоков между А и Б электрический потенциал мембраны соответствует диффузионному потенциалу Еd Рис. VI. 13. Возникновение диффузионного потенциала (Еd) при разной проницаемости (Р) мембраны для катиона и аниона (РК+> РСl-); стрелки – градиенты химических и электрического потенциалов и их направления.
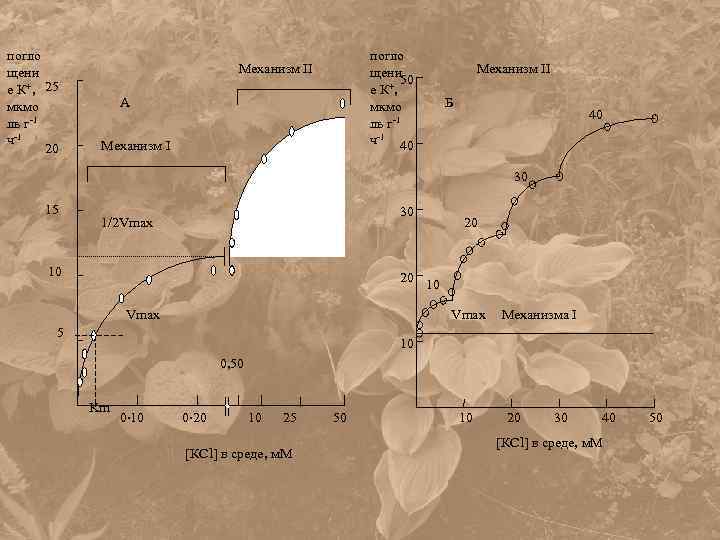 погло щени е К+, 25 мкмо ль г-1 ч-1 20 погло щени 50 е К+, мкмо ль г-1 ч-1 40 Механизм II А Механизм II Б 40 30 15 30 1/2 Vmax 10 20 20 10 Vmax 5 Механизма I 10 0, 50 Km 0 10 0 20 10 25 [КCl] в среде, м. М 50 10 20 30 40 [КCl] в среде, м. М 50
погло щени е К+, 25 мкмо ль г-1 ч-1 20 погло щени 50 е К+, мкмо ль г-1 ч-1 40 Механизм II А Механизм II Б 40 30 15 30 1/2 Vmax 10 20 20 10 Vmax 5 Механизма I 10 0, 50 Km 0 10 0 20 10 25 [КCl] в среде, м. М 50 10 20 30 40 [КCl] в среде, м. М 50
 Пассивный ионный транспорт по каналу. Ионные каналы – интегральные мембранные белки, образующие «пору» в мембране ФР под ред. И. П. Ермакова, с. 330 - 334 Транспорт иона по каналу зависит от • потенциала на мембране • концентрации иона по обе стороны мб • свойств канального белка • сигнала эндогенной природы
Пассивный ионный транспорт по каналу. Ионные каналы – интегральные мембранные белки, образующие «пору» в мембране ФР под ред. И. П. Ермакова, с. 330 - 334 Транспорт иона по каналу зависит от • потенциала на мембране • концентрации иона по обе стороны мб • свойств канального белка • сигнала эндогенной природы
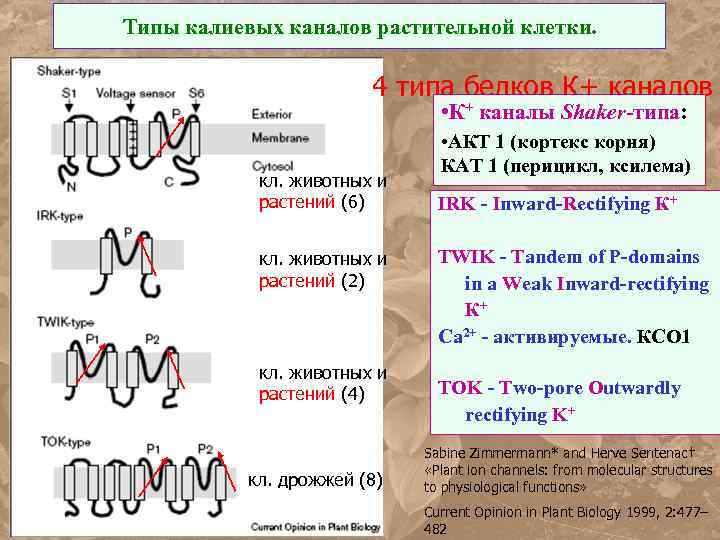 Типы калиевых каналов растительной клетки. 4 типа белков К+ каналов • К+ каналы Shaker-типа: кл. животных и растений (6) кл. животных и растений (2) кл. животных и растений (4) кл. дрожжей (8) • АКТ 1 (кортекс корня) КАТ 1 (перицикл, ксилема) IRK - Inward-Rectifying К+ TWIK - Tandem of P-domains in a Weak Inward-rectifying К+ Ca 2+ - активируемые. КСО 1 TOK - Two-pore Outwardly rectifying K+ Sabine Zimmermann* and Herve Sentenac† «Plant ion channels: from molecular structures to physiological functions» Current Opinion in Plant Biology 1999, 2: 477– 482
Типы калиевых каналов растительной клетки. 4 типа белков К+ каналов • К+ каналы Shaker-типа: кл. животных и растений (6) кл. животных и растений (2) кл. животных и растений (4) кл. дрожжей (8) • АКТ 1 (кортекс корня) КАТ 1 (перицикл, ксилема) IRK - Inward-Rectifying К+ TWIK - Tandem of P-domains in a Weak Inward-rectifying К+ Ca 2+ - активируемые. КСО 1 TOK - Two-pore Outwardly rectifying K+ Sabine Zimmermann* and Herve Sentenac† «Plant ion channels: from molecular structures to physiological functions» Current Opinion in Plant Biology 1999, 2: 477– 482
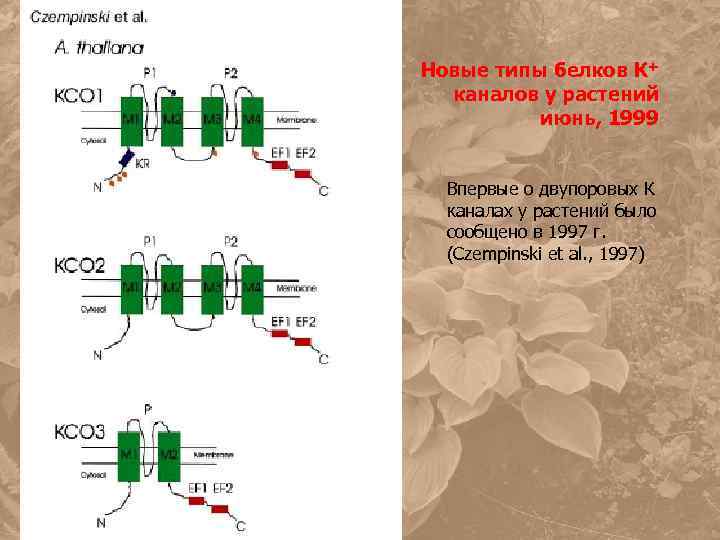 Новые типы белков К+ каналов у растений июнь, 1999 Впервые о двупоровых К каналах у растений было сообщено в 1997 г. (Czempinski et al. , 1997)
Новые типы белков К+ каналов у растений июнь, 1999 Впервые о двупоровых К каналах у растений было сообщено в 1997 г. (Czempinski et al. , 1997)
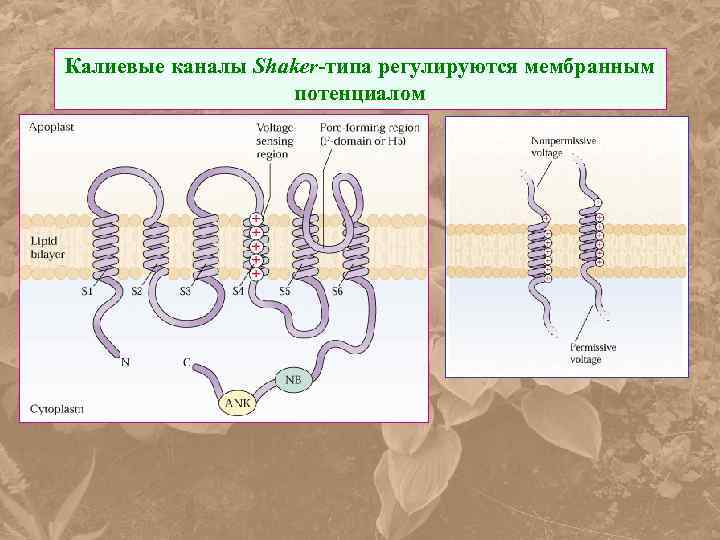 Калиевые каналы Shaker-типа регулируются мембранным потенциалом
Калиевые каналы Shaker-типа регулируются мембранным потенциалом
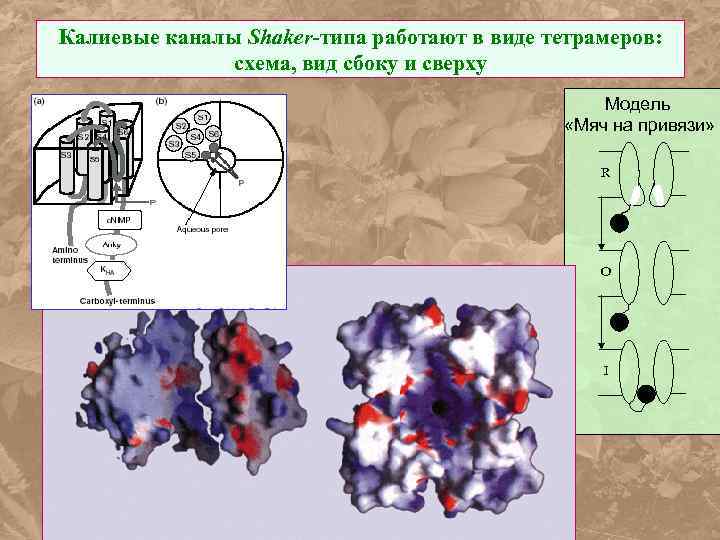 Калиевые каналы Shaker-типа работают в виде тетрамеров: схема, вид сбоку и сверху Модель «Мяч на привязи» R O I
Калиевые каналы Shaker-типа работают в виде тетрамеров: схема, вид сбоку и сверху Модель «Мяч на привязи» R O I
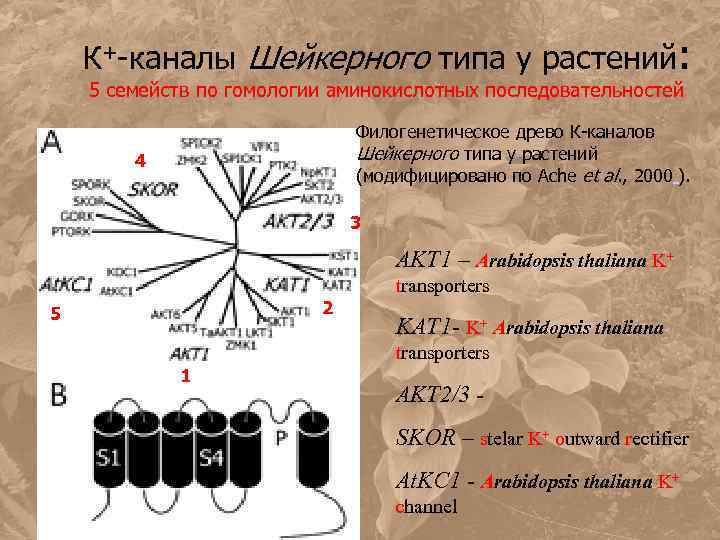 К+-каналы Шейкерного типа у растений: 5 семейств по гомологии аминокислотных последовательностей Филогенетическое древо К-каналов Шейкерного типа у растений (модифицировано по Ache et al. , 2000 ). 4 3 AKT 1 – Arabidopsis thaliana K+ 2 5 transporters KAT 1 - K+ Arabidopsis thaliana transporters 1 AKT 2/3 SKOR – stelar K+ outward rectifier At. KC 1 - Arabidopsis thaliana K+ channel
К+-каналы Шейкерного типа у растений: 5 семейств по гомологии аминокислотных последовательностей Филогенетическое древо К-каналов Шейкерного типа у растений (модифицировано по Ache et al. , 2000 ). 4 3 AKT 1 – Arabidopsis thaliana K+ 2 5 transporters KAT 1 - K+ Arabidopsis thaliana transporters 1 AKT 2/3 SKOR – stelar K+ outward rectifier At. KC 1 - Arabidopsis thaliana K+ channel
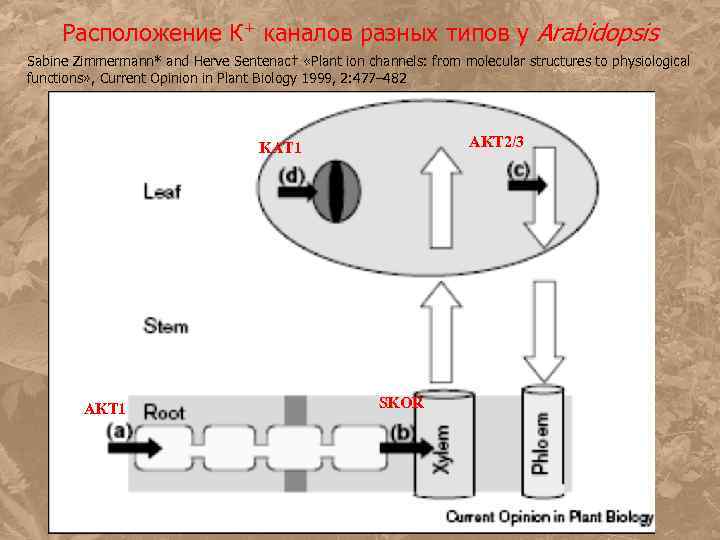 Расположение К+ каналов разных типов у Arabidopsis Sabine Zimmermann* and Herve Sentenac† «Plant ion channels: from molecular structures to physiological functions» , Current Opinion in Plant Biology 1999, 2: 477– 482 AKT 2/3 KAT 1 AKT 1 SKOR
Расположение К+ каналов разных типов у Arabidopsis Sabine Zimmermann* and Herve Sentenac† «Plant ion channels: from molecular structures to physiological functions» , Current Opinion in Plant Biology 1999, 2: 477– 482 AKT 2/3 KAT 1 AKT 1 SKOR
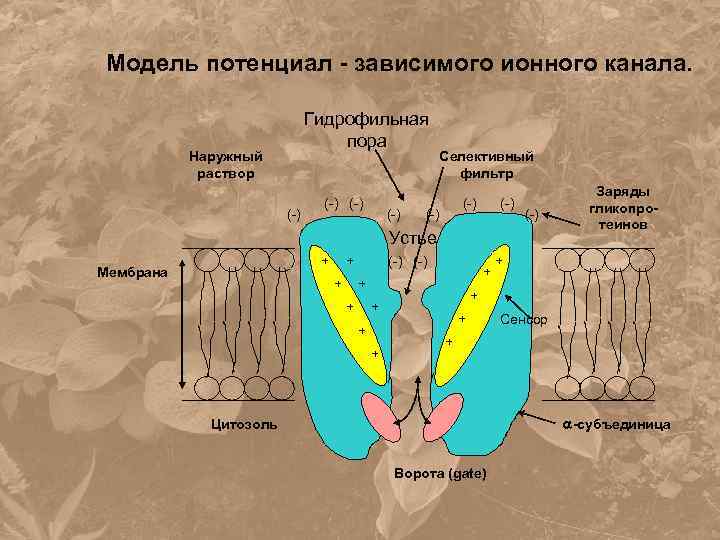 Модель потенциал - зависимого ионного канала. Гидрофильная пора Наружный раствор (-) (-) Селективный фильтр (-) (-) Устье + Мембрана + + (-) + + + + Заряды гликопротеинов + Сенсор + -субъединица Цитозоль Ворота (gate)
Модель потенциал - зависимого ионного канала. Гидрофильная пора Наружный раствор (-) (-) Селективный фильтр (-) (-) Устье + Мембрана + + (-) + + + + Заряды гликопротеинов + Сенсор + -субъединица Цитозоль Ворота (gate)
 Схема работы калиевого канала IRK-типа
Схема работы калиевого канала IRK-типа
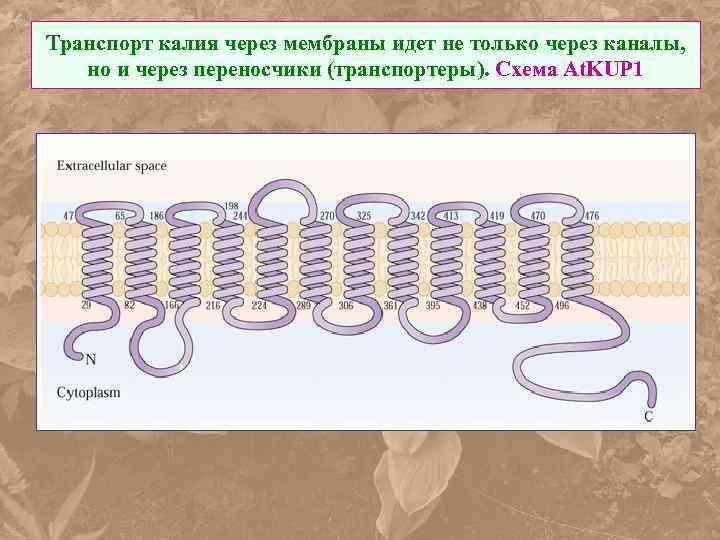 Транспорт калия через мембраны идет не только через каналы, но и через переносчики (транспортеры). Схема At. KUP 1
Транспорт калия через мембраны идет не только через каналы, но и через переносчики (транспортеры). Схема At. KUP 1
 Каливые и натриевые транспортные системы (каналы и транспортеры)
Каливые и натриевые транспортные системы (каналы и транспортеры)
 Лирическое отступление
Лирическое отступление
 Na+- стресс Растениягалофиты Salicornia Suaeda
Na+- стресс Растениягалофиты Salicornia Suaeda
 Адаптации Na+- стресс 1. Активация Na+/H+-антипортера на плазматической мембране (продукт гена SOS 1) 2. Активация Na+/H+-антипортера на мембране вакуоли (продукт гена At. NHX) 3. Активация экспорта хлорида из цитозоля как в апопласт, так и в вакуоль. 4. Синтез протекторных веществ, стабилизирующих заряд биополимеров (полиамины путресцин и спермидин) 5. Синтез шаперонов стабилизирующих конформацию 6. Синтез протеиназ и компонентов убиквитиновой системы (разрушает белки с неправильной конформацией) 8. Накопление в цитоплазме веществ, снижающих водный потенциал (пролин, маннитол и др. осмолиты, белки-осмотины) 7. Синтез стрессовых белков Lea-семейства, устраняющих токсические эффекты засоления 9. Выведение соли из организма, снижение транспирации
Адаптации Na+- стресс 1. Активация Na+/H+-антипортера на плазматической мембране (продукт гена SOS 1) 2. Активация Na+/H+-антипортера на мембране вакуоли (продукт гена At. NHX) 3. Активация экспорта хлорида из цитозоля как в апопласт, так и в вакуоль. 4. Синтез протекторных веществ, стабилизирующих заряд биополимеров (полиамины путресцин и спермидин) 5. Синтез шаперонов стабилизирующих конформацию 6. Синтез протеиназ и компонентов убиквитиновой системы (разрушает белки с неправильной конформацией) 8. Накопление в цитоплазме веществ, снижающих водный потенциал (пролин, маннитол и др. осмолиты, белки-осмотины) 7. Синтез стрессовых белков Lea-семейства, устраняющих токсические эффекты засоления 9. Выведение соли из организма, снижение транспирации
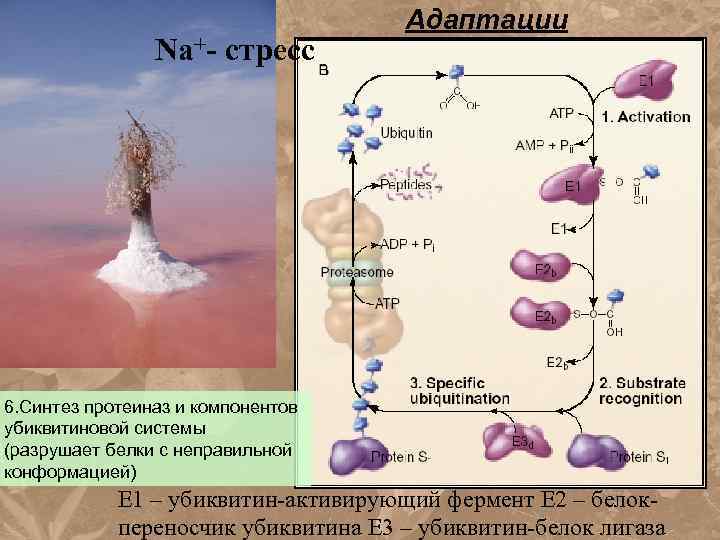 Na+- стресс Адаптации 6. Синтез протеиназ и компонентов убиквитиновой системы (разрушает белки с неправильной конформацией) Е 1 – убиквитин-активирующий фермент Е 2 – белокпереносчик убиквитина Е 3 – убиквитин-белок лигаза
Na+- стресс Адаптации 6. Синтез протеиназ и компонентов убиквитиновой системы (разрушает белки с неправильной конформацией) Е 1 – убиквитин-активирующий фермент Е 2 – белокпереносчик убиквитина Е 3 – убиквитин-белок лигаза
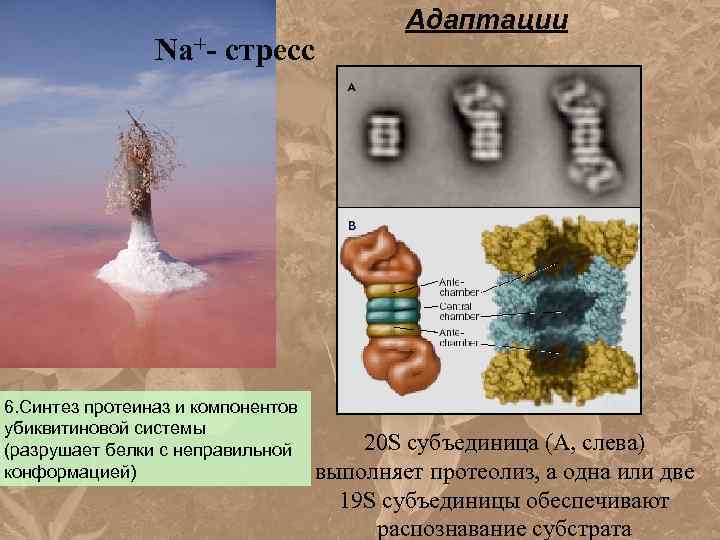 Na+- стресс 6. Синтез протеиназ и компонентов убиквитиновой системы (разрушает белки с неправильной конформацией) Адаптации 20 S субъединица (А, слева) выполняет протеолиз, а одна или две 19 S субъединицы обеспечивают распознавание субстрата
Na+- стресс 6. Синтез протеиназ и компонентов убиквитиновой системы (разрушает белки с неправильной конформацией) Адаптации 20 S субъединица (А, слева) выполняет протеолиз, а одна или две 19 S субъединицы обеспечивают распознавание субстрата
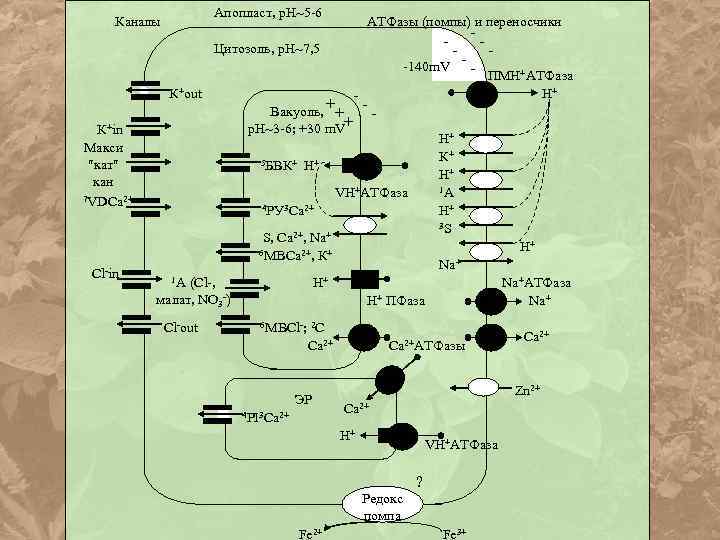 Апопласт, р. Н 5 -6 Каналы АТФазы (помпы) и переносчики -140 m. V ПМН+АТФаза Цитозоль, р. Н 7, 5 К+out К+in Макси кат кан 7 VDCа 2+ H+ + Вакуоль, + + р. Н 3 -6; +30 m. V 5 БВК+ H+ 1 A H+ 3 S H+ VH+АТФаза 4 PУ 3 Ca 2+ S, Cа 2+, Nа+ 6 MBCa 2+, К+ Cl-in 1 A (Cl-, H+ Nа+ H+ малат, NO 3 -) Cl-out Nа+АТФаза Nа+ H+ ПФаза 6 МВСl-; 2 C Cа 2+ ЭР 4 PI 3 Ca 2+ Cа 2+АТФазы Zn 2+ Cа 2+ H+ VH+АТФаза ? Редокс помпа Fe 2+ Cа 2+ Fe 3+
Апопласт, р. Н 5 -6 Каналы АТФазы (помпы) и переносчики -140 m. V ПМН+АТФаза Цитозоль, р. Н 7, 5 К+out К+in Макси кат кан 7 VDCа 2+ H+ + Вакуоль, + + р. Н 3 -6; +30 m. V 5 БВК+ H+ 1 A H+ 3 S H+ VH+АТФаза 4 PУ 3 Ca 2+ S, Cа 2+, Nа+ 6 MBCa 2+, К+ Cl-in 1 A (Cl-, H+ Nа+ H+ малат, NO 3 -) Cl-out Nа+АТФаза Nа+ H+ ПФаза 6 МВСl-; 2 C Cа 2+ ЭР 4 PI 3 Ca 2+ Cа 2+АТФазы Zn 2+ Cа 2+ H+ VH+АТФаза ? Редокс помпа Fe 2+ Cа 2+ Fe 3+
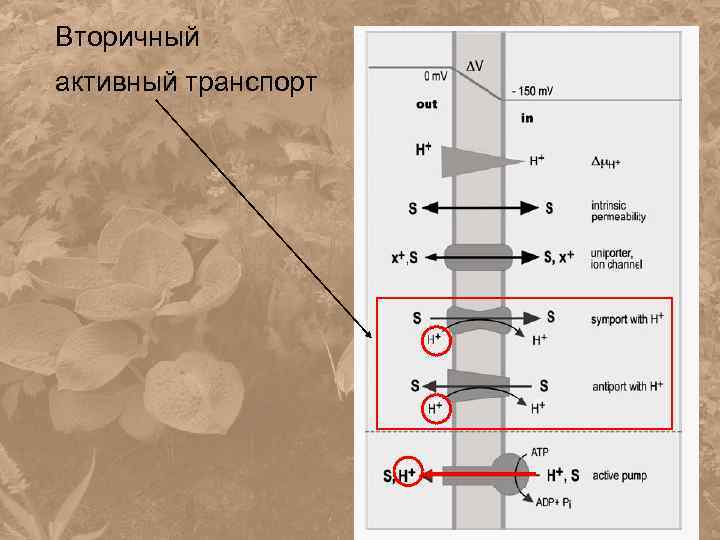 Вторичный активный транспорт
Вторичный активный транспорт
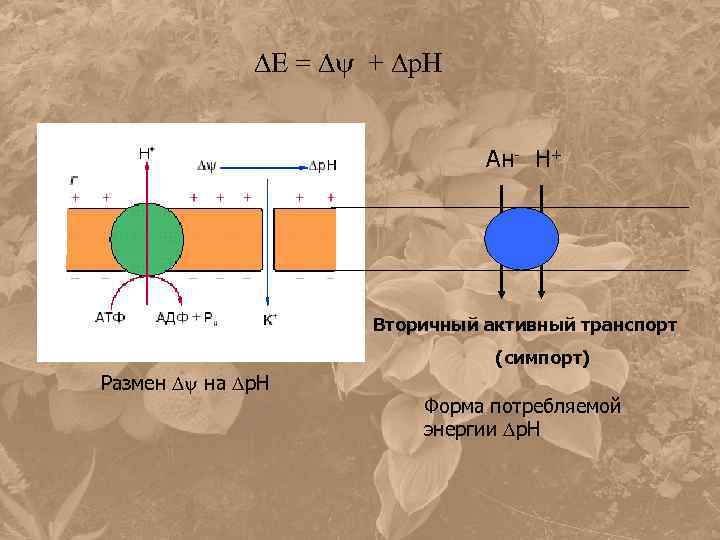 Е = + р. Н Ан- Н+ Вторичный активный транспорт (симпорт) Размен на р. Н Форма потребляемой энергии р. Н
Е = + р. Н Ан- Н+ Вторичный активный транспорт (симпорт) Размен на р. Н Форма потребляемой энергии р. Н
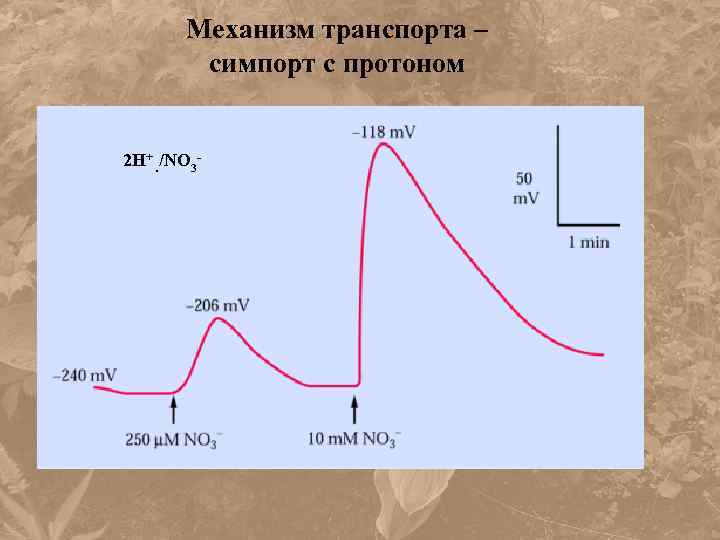 Механизм транспорта – симпорт с протоном 2 Н+. /NО 3 -
Механизм транспорта – симпорт с протоном 2 Н+. /NО 3 -
 Фосфатные транспортеры Высокого сродства (PT 2) (Км = 3 – 7 мкмолей) Низкого сродства (PТ 1) (Км = 50 – 330 мкмолей); Сульфатные транспортеры высокого сродства Sultr 1 или ST 1 (Km порядка 10 мкмолей) низкого сродства Sultr 2 или ST 2 (Km порядка 100 мкмолей) Нитратные транспортеры NRT 2 переносчики NO 3 - высокого сродства Km от 10 до 100 М. . NRT 1 переносчики с двойственными свойствами (с высокими и низкими Km) или переносчики низкого сродства.
Фосфатные транспортеры Высокого сродства (PT 2) (Км = 3 – 7 мкмолей) Низкого сродства (PТ 1) (Км = 50 – 330 мкмолей); Сульфатные транспортеры высокого сродства Sultr 1 или ST 1 (Km порядка 10 мкмолей) низкого сродства Sultr 2 или ST 2 (Km порядка 100 мкмолей) Нитратные транспортеры NRT 2 переносчики NO 3 - высокого сродства Km от 10 до 100 М. . NRT 1 переносчики с двойственными свойствами (с высокими и низкими Km) или переносчики низкого сродства.
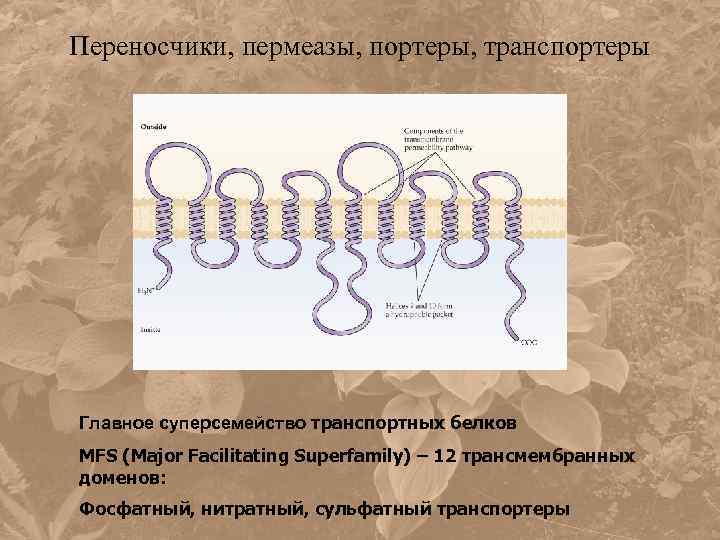 Переносчики, пермеазы, портеры, транспортеры Главное суперсемейство транспортных белков MFS (Major Facilitating Superfamily) – 12 трансмембранных доменов: Фосфатный, нитратный, сульфатный транспортеры
Переносчики, пермеазы, портеры, транспортеры Главное суперсемейство транспортных белков MFS (Major Facilitating Superfamily) – 12 трансмембранных доменов: Фосфатный, нитратный, сульфатный транспортеры
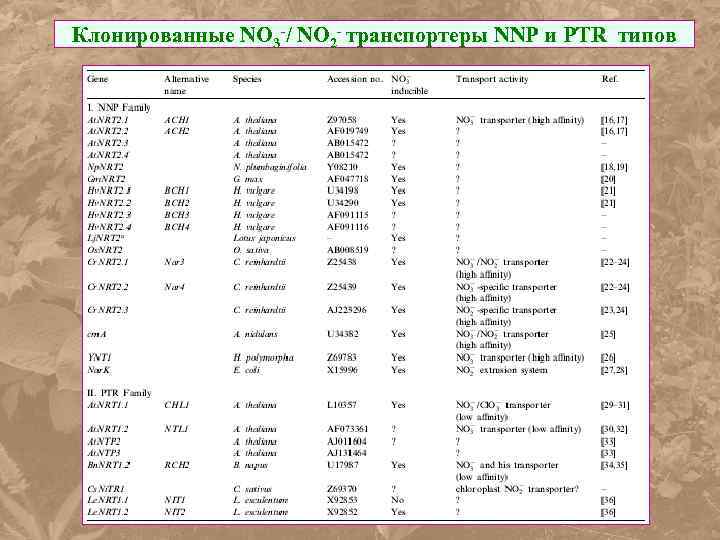 Клонированные NO 3 -/ NO 2 - транспортеры NNP и PTR типов
Клонированные NO 3 -/ NO 2 - транспортеры NNP и PTR типов
 Гены фосфатных транспортеров Arabidopsis Название гена Синонимы Экспрессия, органы, ткани, (органеллы) At; Pht 1; 1 PHT 1, APT 2, At. PT 1 Корни, семядоли, прорстки, бутоны, семена At; Pht 1; 2 At; Pht 1; 3 At; Pht 1; 4 At; Pht 1; 5 At; Pht 1; 6 At; Pht 1; 7 PHT 2, APT 1, PHT 3, At. PT 4 PHT 4, At. PT 2 PHT 5 PHT 6 Корни, семядоли, листья Корни, листья, культура клеток, цветки, Листья, бутоны, цветки Семядоли, пыльца Корни, цветки At; Pht 1; 8 Корни At; Pht 1; 9 Корни At; Pht 2; 1 At; Pht 3; 1 PHT 2, 1 Надземные органы (митохондрии) At; Pht 3; 2 (митохондрии) At; Pht 3; 3 (митохондрии) At; TPT At; PPT At; GPT 1 At; GPT 2 At; XPT TPT PPT GPT 1 GPT 2 XPT (пластиды) (пластиды, нефотосинтезирующие) Цветки, листья, побеги, корни (пластиды) TPT – Триозофосфат - Pi – Транспортер РРТ – Фосфоенолпируват - Pi – Транспортер GPT – Глюкозо-6 -фосфат - Pi – Транспортер XPT – Ксилулозо-5 -фосфат - Pi – Транспортер
Гены фосфатных транспортеров Arabidopsis Название гена Синонимы Экспрессия, органы, ткани, (органеллы) At; Pht 1; 1 PHT 1, APT 2, At. PT 1 Корни, семядоли, прорстки, бутоны, семена At; Pht 1; 2 At; Pht 1; 3 At; Pht 1; 4 At; Pht 1; 5 At; Pht 1; 6 At; Pht 1; 7 PHT 2, APT 1, PHT 3, At. PT 4 PHT 4, At. PT 2 PHT 5 PHT 6 Корни, семядоли, листья Корни, листья, культура клеток, цветки, Листья, бутоны, цветки Семядоли, пыльца Корни, цветки At; Pht 1; 8 Корни At; Pht 1; 9 Корни At; Pht 2; 1 At; Pht 3; 1 PHT 2, 1 Надземные органы (митохондрии) At; Pht 3; 2 (митохондрии) At; Pht 3; 3 (митохондрии) At; TPT At; PPT At; GPT 1 At; GPT 2 At; XPT TPT PPT GPT 1 GPT 2 XPT (пластиды) (пластиды, нефотосинтезирующие) Цветки, листья, побеги, корни (пластиды) TPT – Триозофосфат - Pi – Транспортер РРТ – Фосфоенолпируват - Pi – Транспортер GPT – Глюкозо-6 -фосфат - Pi – Транспортер XPT – Ксилулозо-5 -фосфат - Pi – Транспортер
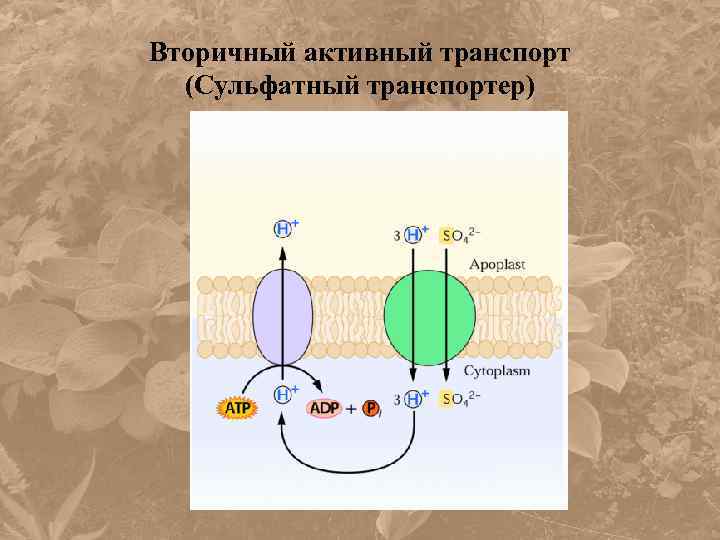 Вторичный активный транспорт (Сульфатный транспортер)
Вторичный активный транспорт (Сульфатный транспортер)
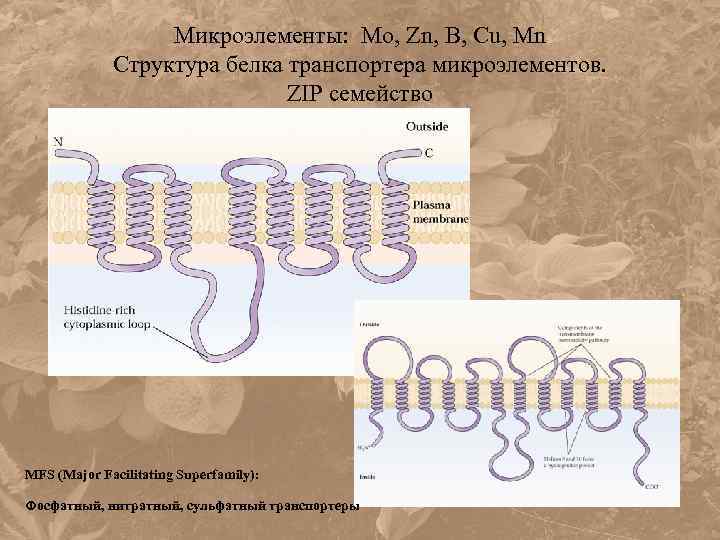 Микроэлементы: Mo, Zn, B, Cu, Mn Структура белка транспортера микроэлементов. ZIP семейство MFS (Major Facilitating Superfamily): Фосфатный, нитратный, сульфатный транспортеры
Микроэлементы: Mo, Zn, B, Cu, Mn Структура белка транспортера микроэлементов. ZIP семейство MFS (Major Facilitating Superfamily): Фосфатный, нитратный, сульфатный транспортеры