2. Дифференцировка и регуляции.pptx
- Количество слайдов: 121
 Дифференцировка СКК
Дифференцировка СКК
 Дифференцировка СКК • Alexander A. Maximow (1874 -1928) • "Der Lymphozyt als gemeinsame Stammzelle der verschiedenen Blutelemente in der embrionalen Entwicklung und im postfetalen Leben den Saugetiere " ("Fol. Haematology", Vol. VIII) was published in 1909.
Дифференцировка СКК • Alexander A. Maximow (1874 -1928) • "Der Lymphozyt als gemeinsame Stammzelle der verschiedenen Blutelemente in der embrionalen Entwicklung und im postfetalen Leben den Saugetiere " ("Fol. Haematology", Vol. VIII) was published in 1909.
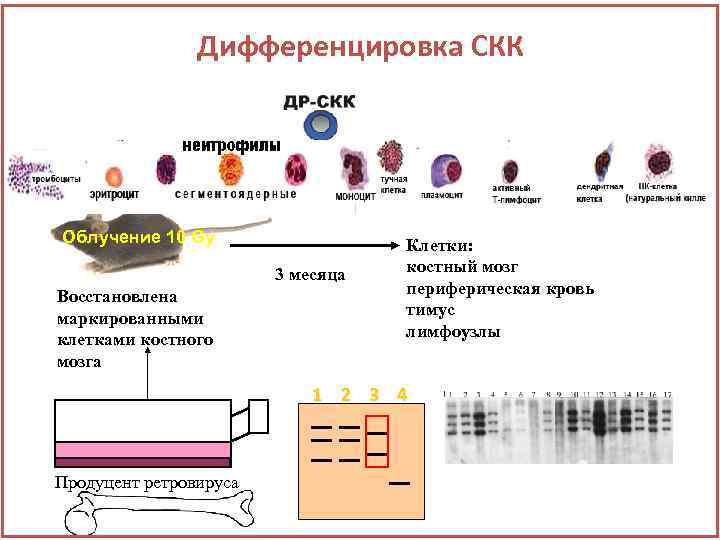 Дифференцировка СКК Облучение 10 Gy 3 месяца Восстановлена маркированными клетками костного мозга Клетки: костный мозг периферическая кровь тимус лимфоузлы 1 2 3 4 Продуцент ретровируса
Дифференцировка СКК Облучение 10 Gy 3 месяца Восстановлена маркированными клетками костного мозга Клетки: костный мозг периферическая кровь тимус лимфоузлы 1 2 3 4 Продуцент ретровируса
 Выбор направления дифференцировки 1. Случайный выбор (стохастическая модель) 2. В зависимости от внутренних факторов 3. В зависимости от внешних факторов
Выбор направления дифференцировки 1. Случайный выбор (стохастическая модель) 2. В зависимости от внутренних факторов 3. В зависимости от внешних факторов
 1. Случайный выбор (стохастическая модель)
1. Случайный выбор (стохастическая модель)
 2. В зависимости от внутренних факторов • Зависимость от эпигенетических факторов (уровня метилирования ДНК) • Метилирование ДНК — это обратимая модификация молекулы ДНК без изменения самой нуклеотидной последовательности ДНК, что можно рассматривать как часть эпигенетической составляющей генома. Метилирование заключается в переносе метильной группы с Sаденозилметионина (SAM) на 5' позицию цитозина. Эту реакцию осуществляет ДНК- метилтрансфераза (DNMT). Для позвоночных характерно метилирование цитозина, когда он находится в составе динуклеотида CG. Не все CG- последовательности метилированы, они формируют специфический паттерн (образ). У человека метилирование осуществляется с помощью ферментов DNMT 1, DNMT 3 a (альфа), DNMT 3 b (бета). Предполагается, что DNMT 3 a и DNMT 3 b функционируют на ранних стадиях развития, когда происходит формирование паттерна метилирования. DNMT 1 поддерживает метилирование ДНК на более поздних стадиях развития организма и отвечает за присоединение метильной группы на комплементарной цепи при репликации ДНК дочерней клетки.
2. В зависимости от внутренних факторов • Зависимость от эпигенетических факторов (уровня метилирования ДНК) • Метилирование ДНК — это обратимая модификация молекулы ДНК без изменения самой нуклеотидной последовательности ДНК, что можно рассматривать как часть эпигенетической составляющей генома. Метилирование заключается в переносе метильной группы с Sаденозилметионина (SAM) на 5' позицию цитозина. Эту реакцию осуществляет ДНК- метилтрансфераза (DNMT). Для позвоночных характерно метилирование цитозина, когда он находится в составе динуклеотида CG. Не все CG- последовательности метилированы, они формируют специфический паттерн (образ). У человека метилирование осуществляется с помощью ферментов DNMT 1, DNMT 3 a (альфа), DNMT 3 b (бета). Предполагается, что DNMT 3 a и DNMT 3 b функционируют на ранних стадиях развития, когда происходит формирование паттерна метилирования. DNMT 1 поддерживает метилирование ДНК на более поздних стадиях развития организма и отвечает за присоединение метильной группы на комплементарной цепи при репликации ДНК дочерней клетки.
 2. В зависимости от внутренних факторов Неактивный ген соединён с метильной группой. Когда в результате химических реакций метильная группа отделяется от гена, тот активируется. Метильная группа выполняет роль предохранителя. Чем меньше метильных групп, тем более дифференцирована клетка. Чем больше степень метилирования ДНК, тем меньше степень дифференцировки, тем клетка моложе.
2. В зависимости от внутренних факторов Неактивный ген соединён с метильной группой. Когда в результате химических реакций метильная группа отделяется от гена, тот активируется. Метильная группа выполняет роль предохранителя. Чем меньше метильных групп, тем более дифференцирована клетка. Чем больше степень метилирования ДНК, тем меньше степень дифференцировки, тем клетка моложе.
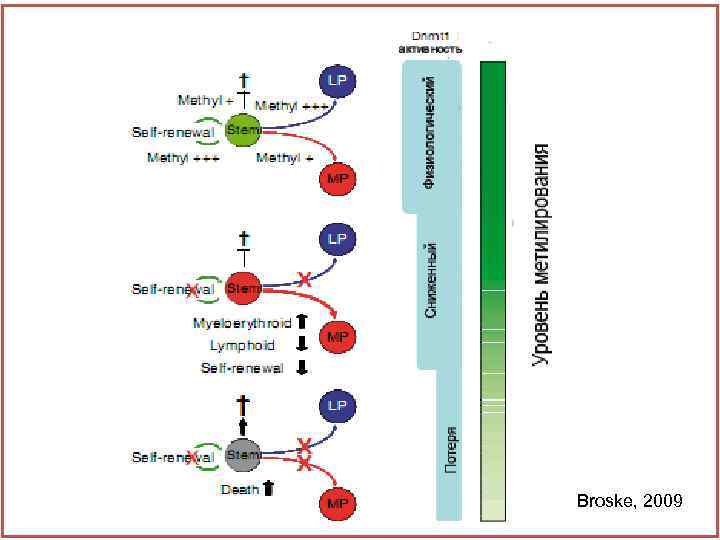 Broske, 2009
Broske, 2009
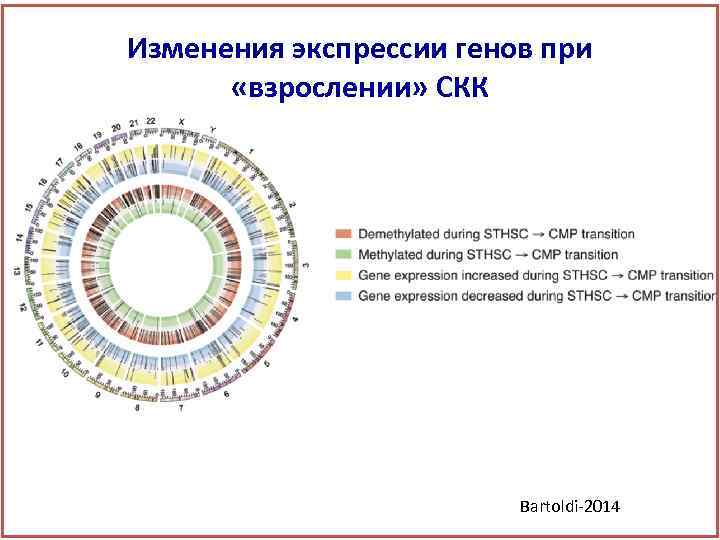 Изменения экспрессии генов при «взрослении» СКК Bartoldi-2014
Изменения экспрессии генов при «взрослении» СКК Bartoldi-2014
 3. В зависимости от внешних факторов • Могут ли внешние сигналы регулировать дифференцировку клеток крови? До настоящего времени такие сигналы не известны для стволовых клеток, однако, существуют примеры для более зрелых клеток-предшественников, выбор дифференцировки которых зависит от действия специфических ростовых факторов. • Как внешние сигналы влияют на такую дифференцировку? • Необходимы определенные факторы для созревания клеток крови, например, Г-КСФ для гранулоцитов или тромбопоэтин для созревания мегакариоцитов.
3. В зависимости от внешних факторов • Могут ли внешние сигналы регулировать дифференцировку клеток крови? До настоящего времени такие сигналы не известны для стволовых клеток, однако, существуют примеры для более зрелых клеток-предшественников, выбор дифференцировки которых зависит от действия специфических ростовых факторов. • Как внешние сигналы влияют на такую дифференцировку? • Необходимы определенные факторы для созревания клеток крови, например, Г-КСФ для гранулоцитов или тромбопоэтин для созревания мегакариоцитов.
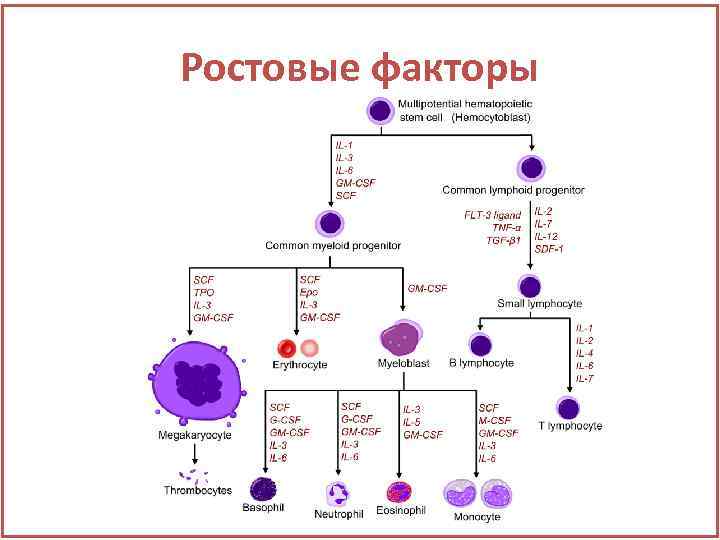 Ростовые факторы
Ростовые факторы
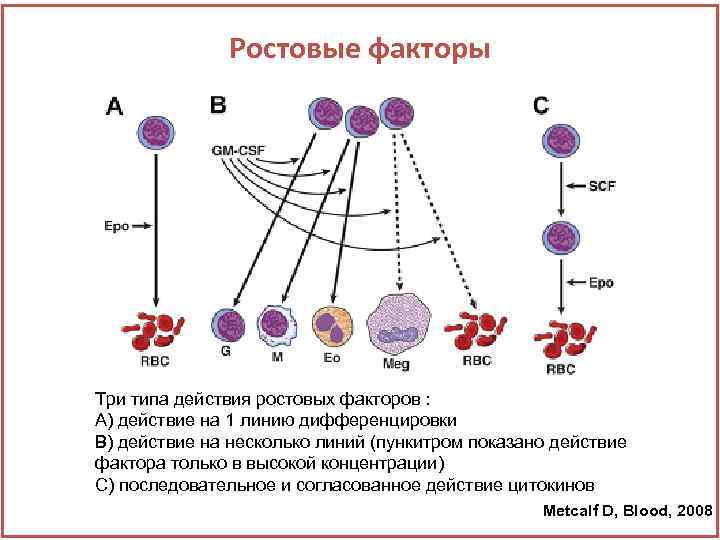 Ростовые факторы Три типа действия ростовых факторов : А) действие на 1 линию дифференцировки В) действие на несколько линий (пункитром показано действие фактора только в высокой концентрации) С) последовательное и согласованное действие цитокинов Metcalf D, Blood, 2008
Ростовые факторы Три типа действия ростовых факторов : А) действие на 1 линию дифференцировки В) действие на несколько линий (пункитром показано действие фактора только в высокой концентрации) С) последовательное и согласованное действие цитокинов Metcalf D, Blood, 2008
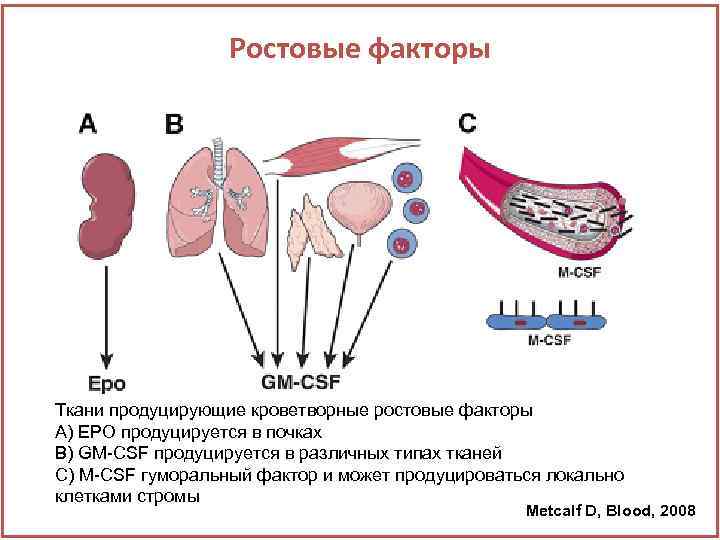 Ростовые факторы Ткани продуцирующие кроветворные ростовые факторы А) ЕРО продуцируется в почках В) GM-CSF продуцируется в различных типах тканей С) M-CSF гуморальный фактор и может продуцироваться локально клетками стромы Metcalf D, Blood, 2008
Ростовые факторы Ткани продуцирующие кроветворные ростовые факторы А) ЕРО продуцируется в почках В) GM-CSF продуцируется в различных типах тканей С) M-CSF гуморальный фактор и может продуцироваться локально клетками стромы Metcalf D, Blood, 2008
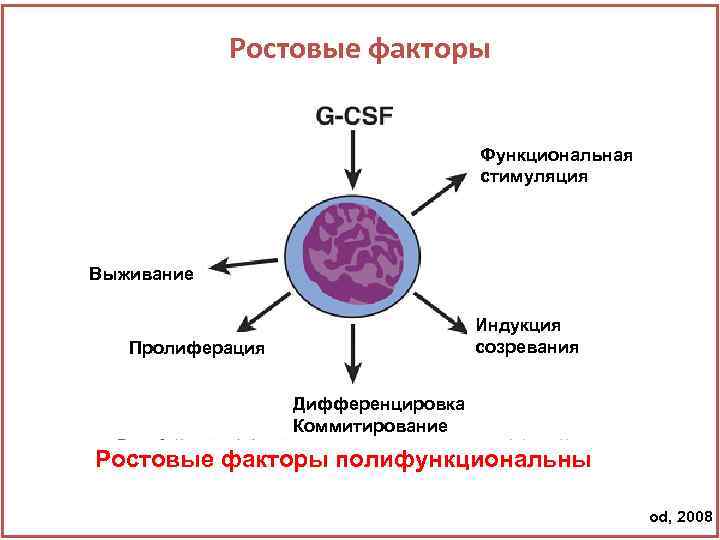 Ростовые факторы Функциональная стимуляция Выживание Индукция созревания Пролиферация Дифференцировка Коммитирование Ростовые факторы полифункциональны Metcalf D, Blood, 2008
Ростовые факторы Функциональная стимуляция Выживание Индукция созревания Пролиферация Дифференцировка Коммитирование Ростовые факторы полифункциональны Metcalf D, Blood, 2008
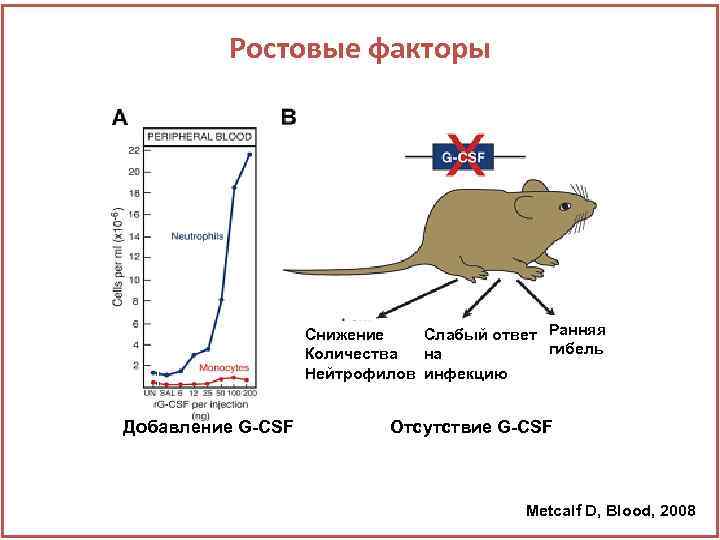 Ростовые факторы Снижение Слабый ответ Ранняя гибель Количества на Нейтрофилов инфекцию Добавление G-CSF Отсутствие G-CSF Metcalf D, Blood, 2008
Ростовые факторы Снижение Слабый ответ Ранняя гибель Количества на Нейтрофилов инфекцию Добавление G-CSF Отсутствие G-CSF Metcalf D, Blood, 2008
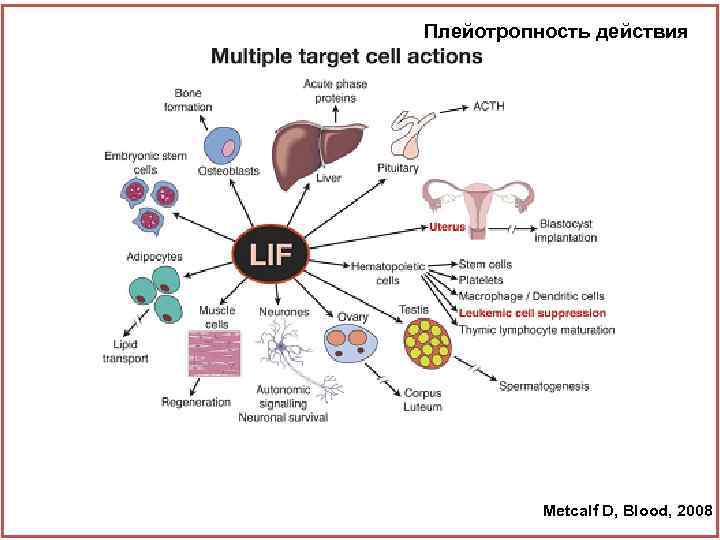 Плейотропность действия Ростовые факторы Metcalf D, Blood, 2008
Плейотропность действия Ростовые факторы Metcalf D, Blood, 2008
 Ростовые факторы Функция Гемопоэтины Цитокины Факторы роста Т-лф Факторы роста В-лф IL-2, IL-4, IL-7, IL-9, IL-15 Факторы роста фибр. , эндотелия др. PDGF, b. FGF, a. FGF, VEGF Хемокины Ингибиторы роста Супрессоры Участвующие в апоптозе Провоспалительные Антивирусные IL-8, MCP-1, MIP-1, SLC SCF, Flt-3 -ligand, G-CSF, GM-CSF, LIF, IL-3, IL-4, IL-5, IL-6, IL -9, IL-11, IL-12, TPO, EPO IL-4, IL-5, IL-6, IL-14, CD 40 Oncostatin M, TNF, TGFb IL-4, IL-10, IL-13, TGFb TNF, FAS-ligand, TRAIL IL-1, IL-6, TNF, хемокины Интерфероны
Ростовые факторы Функция Гемопоэтины Цитокины Факторы роста Т-лф Факторы роста В-лф IL-2, IL-4, IL-7, IL-9, IL-15 Факторы роста фибр. , эндотелия др. PDGF, b. FGF, a. FGF, VEGF Хемокины Ингибиторы роста Супрессоры Участвующие в апоптозе Провоспалительные Антивирусные IL-8, MCP-1, MIP-1, SLC SCF, Flt-3 -ligand, G-CSF, GM-CSF, LIF, IL-3, IL-4, IL-5, IL-6, IL -9, IL-11, IL-12, TPO, EPO IL-4, IL-5, IL-6, IL-14, CD 40 Oncostatin M, TNF, TGFb IL-4, IL-10, IL-13, TGFb TNF, FAS-ligand, TRAIL IL-1, IL-6, TNF, хемокины Интерфероны
 Ростовые факторы Дистальная регуляция кроветворения 1) Позднедействующие линейно специфические факторы. EPO, TPO, IL 5, G-CSF, M-CSF 2) Среднедействующие линейно неспецифические факторы. IL-3, IL-4, GM-CSF 3) Факторы, влияющие на кинетику клеточного цикла дремлющих примитивных предшественников. SCF, Flt-3 ligand, G-CSF, IL-6, IL-11, IL-12, LIF
Ростовые факторы Дистальная регуляция кроветворения 1) Позднедействующие линейно специфические факторы. EPO, TPO, IL 5, G-CSF, M-CSF 2) Среднедействующие линейно неспецифические факторы. IL-3, IL-4, GM-CSF 3) Факторы, влияющие на кинетику клеточного цикла дремлющих примитивных предшественников. SCF, Flt-3 ligand, G-CSF, IL-6, IL-11, IL-12, LIF
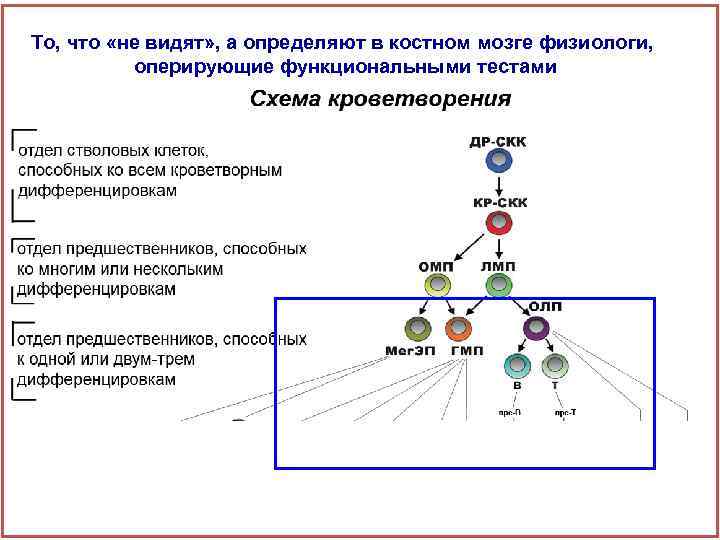 То, что «не видят» , а определяют в костном мозге физиологи, оперирующие функциональными тестами
То, что «не видят» , а определяют в костном мозге физиологи, оперирующие функциональными тестами
 Функциональные тесты Б. Полипотентные кроветворные клетки - предшественницы 1. Колониеобразующие единицы в селезенке (КОЕс-CFU-S). 2. Колониеобразующие единицы в культуре (КОЕк- КОЕ-ГМ, КОЕ-Э, КОЕ-М, БОЕ-Э). (CFU-C-CFU-GM, CFU-E, CFU-M, BFU-E) 3. Клетки образующие области булыжника в культуре (КООБ-CAFC).
Функциональные тесты Б. Полипотентные кроветворные клетки - предшественницы 1. Колониеобразующие единицы в селезенке (КОЕс-CFU-S). 2. Колониеобразующие единицы в культуре (КОЕк- КОЕ-ГМ, КОЕ-Э, КОЕ-М, БОЕ-Э). (CFU-C-CFU-GM, CFU-E, CFU-M, BFU-E) 3. Клетки образующие области булыжника в культуре (КООБ-CAFC).
 Donald Metcalf
Donald Metcalf
 Колониеобразующие единицы в культуре КОЕк • Выжить кроветворные предшественники в культуре могут только в присутствии соответствующих регуляторных молекул • В отсутствии внешнего регулятора время полу жизни предшественника составляет 22 -24 часа
Колониеобразующие единицы в культуре КОЕк • Выжить кроветворные предшественники в культуре могут только в присутствии соответствующих регуляторных молекул • В отсутствии внешнего регулятора время полу жизни предшественника составляет 22 -24 часа
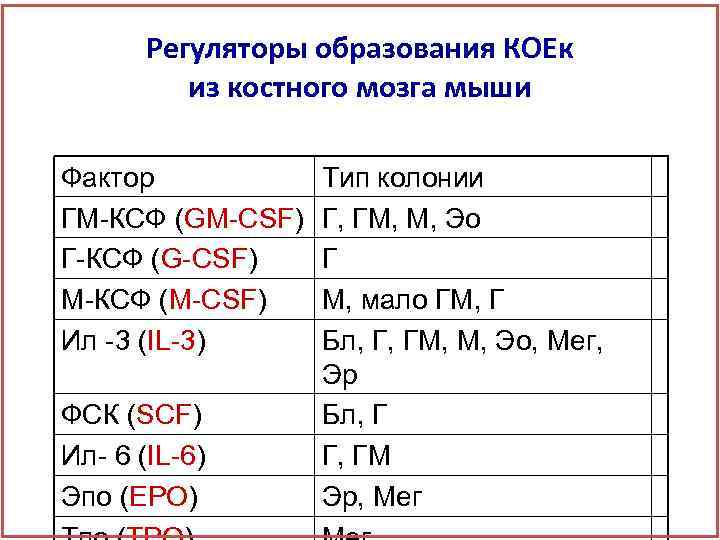 Регуляторы образования КОЕк из костного мозга мыши Фактор ГМ-КСФ (GM-CSF) Г-КСФ (G-CSF) М-КСФ (M-CSF) Ил -3 (IL-3) ФСК (SCF) Ил- 6 (IL-6) Эпо (EPO) Тип колонии Г, ГМ, М, Эо Г М, мало ГМ, Г Бл, Г, ГМ, М, Эо, Мег, Эр Бл, Г Г, ГМ Эр, Мег
Регуляторы образования КОЕк из костного мозга мыши Фактор ГМ-КСФ (GM-CSF) Г-КСФ (G-CSF) М-КСФ (M-CSF) Ил -3 (IL-3) ФСК (SCF) Ил- 6 (IL-6) Эпо (EPO) Тип колонии Г, ГМ, М, Эо Г М, мало ГМ, Г Бл, Г, ГМ, М, Эо, Мег, Эр Бл, Г Г, ГМ Эр, Мег
 Колониеобразующие единицы в культуре КОЕк Клетки погибают от: • Подсыхания культур; • Истощения среды; • Накопления продуктов распада (токсичность); • Тесноты
Колониеобразующие единицы в культуре КОЕк Клетки погибают от: • Подсыхания культур; • Истощения среды; • Накопления продуктов распада (токсичность); • Тесноты
 Полужидкие среды для клонирования предшественников • Агаровые культуры • Плохо поддерживают рост эритроидных предшественников из тканей взрослого животного • В-лимфоцитарные колонии растут только в агаре • Легко фиксировать и окрашивать колонии • Культуры в метилцеллулозе • Удобно выделять колонии и ретрансплантировать • Образуют монослой на дне чашки, что затрудняет счет колоний
Полужидкие среды для клонирования предшественников • Агаровые культуры • Плохо поддерживают рост эритроидных предшественников из тканей взрослого животного • В-лимфоцитарные колонии растут только в агаре • Легко фиксировать и окрашивать колонии • Культуры в метилцеллулозе • Удобно выделять колонии и ретрансплантировать • Образуют монослой на дне чашки, что затрудняет счет колоний
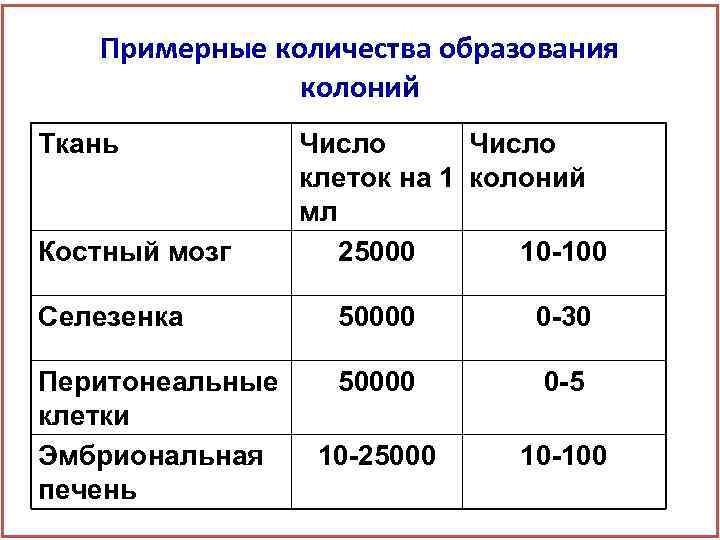 Примерные количества образования колоний Ткань Костный мозг Число клеток на 1 колоний мл 25000 10 -100 Селезенка 50000 0 -30 Перитонеальные клетки Эмбриональная печень 50000 0 -5 10 -25000 10 -100
Примерные количества образования колоний Ткань Костный мозг Число клеток на 1 колоний мл 25000 10 -100 Селезенка 50000 0 -30 Перитонеальные клетки Эмбриональная печень 50000 0 -5 10 -25000 10 -100
 Концентрации различных факторов на 1 мл культуры. • • GM-CSF (10 ng/ml) G-CSF (10 ng/ml) M-CSF (10 ng/ml) IL-3 (10 ng/ml) SCF (100 ng/ml) IL-6 (100 ng/ml) EPO (2 units/ml) TPO (50 ng/ml) Кондиционированная среда 10% от объема. WEHI 3 B продуцирует GM-CSF, G-CSF, IL-3 L 929 продуцирует M-CSF Stem cell technologies http: //www. stemcell. com Metocult
Концентрации различных факторов на 1 мл культуры. • • GM-CSF (10 ng/ml) G-CSF (10 ng/ml) M-CSF (10 ng/ml) IL-3 (10 ng/ml) SCF (100 ng/ml) IL-6 (100 ng/ml) EPO (2 units/ml) TPO (50 ng/ml) Кондиционированная среда 10% от объема. WEHI 3 B продуцирует GM-CSF, G-CSF, IL-3 L 929 продуцирует M-CSF Stem cell technologies http: //www. stemcell. com Metocult
 Колонии и подсчет 3 дня КОЕэ, 7 дней КОЕ-ГМ, 14 дней БОЕэ
Колонии и подсчет 3 дня КОЕэ, 7 дней КОЕ-ГМ, 14 дней БОЕэ
 Колонии и подсчет
Колонии и подсчет
 Колонии и подсчет
Колонии и подсчет
 Колонии и подсчет
Колонии и подсчет
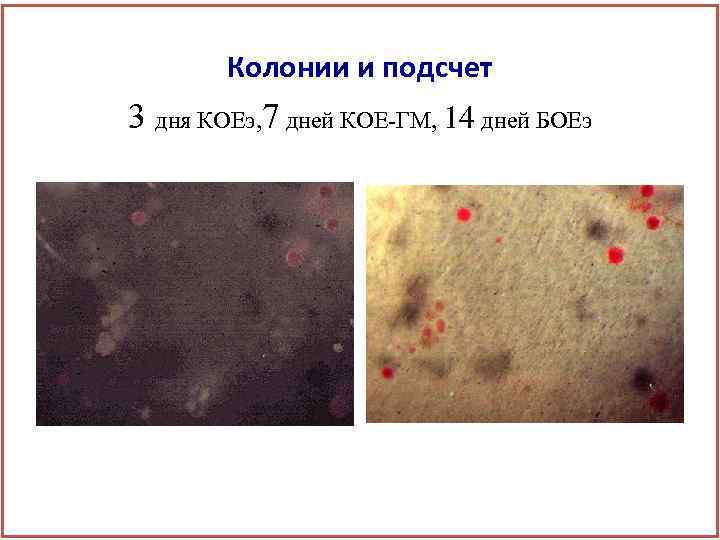 Колонии и подсчет 3 дня КОЕэ, 7 дней КОЕ-ГМ, 14 дней БОЕэ
Колонии и подсчет 3 дня КОЕэ, 7 дней КОЕ-ГМ, 14 дней БОЕэ
 Гранулоцитарные колонии
Гранулоцитарные колонии
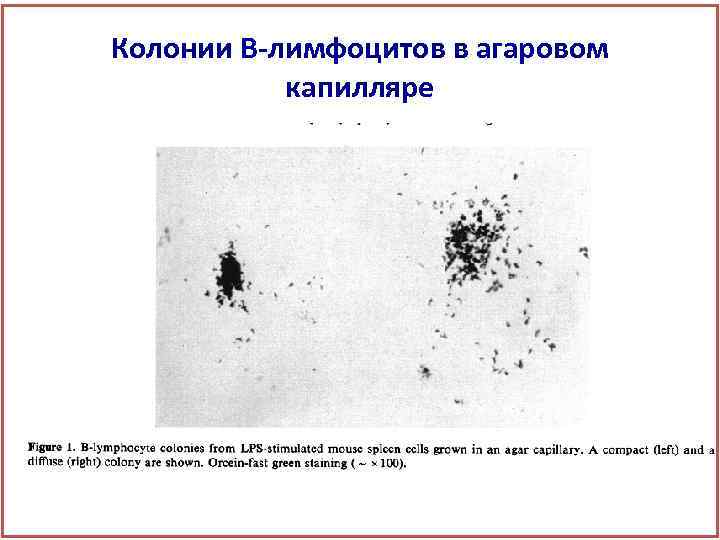 Колонии В-лимфоцитов в агаровом капилляре
Колонии В-лимфоцитов в агаровом капилляре
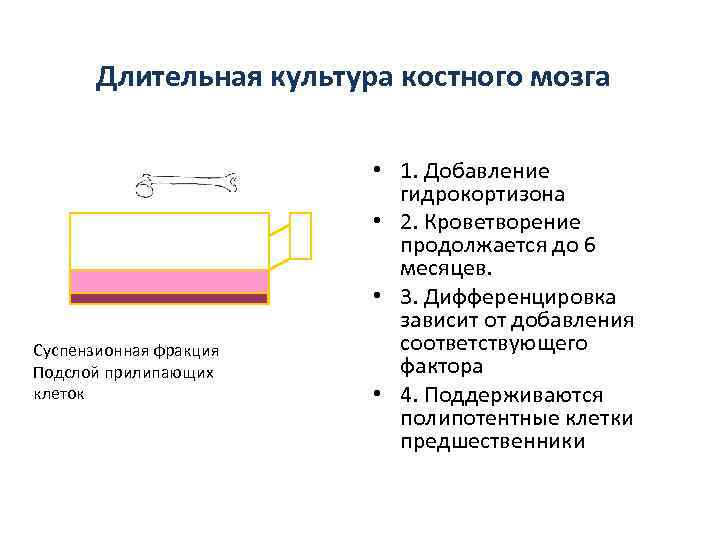 Длительная культура костного мозга Суспензионная фракция Подслой прилипающих клеток • 1. Добавление гидрокортизона • 2. Кроветворение продолжается до 6 месяцев. • 3. Дифференцировка зависит от добавления соответствующего фактора • 4. Поддерживаются полипотентные клетки предшественники
Длительная культура костного мозга Суспензионная фракция Подслой прилипающих клеток • 1. Добавление гидрокортизона • 2. Кроветворение продолжается до 6 месяцев. • 3. Дифференцировка зависит от добавления соответствующего фактора • 4. Поддерживаются полипотентные клетки предшественники
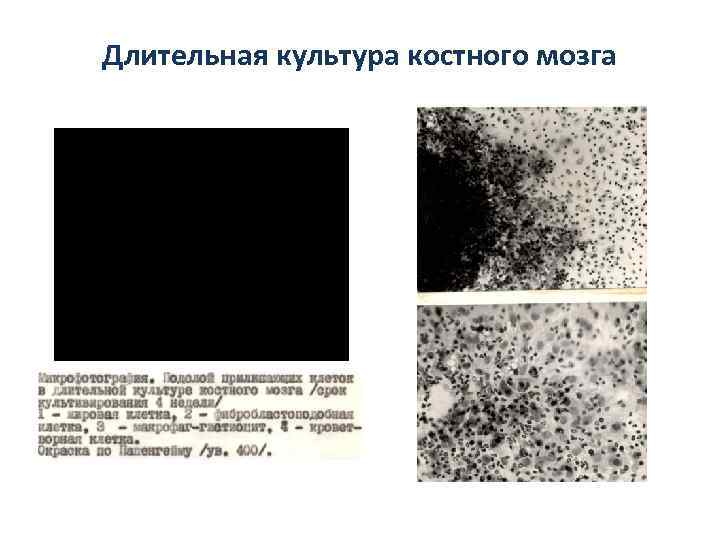 Длительная культура костного мозга
Длительная культура костного мозга
 КООБ • Для поддержания предшественников необходим стромальный подслой • Варианты подслоя: • А) для длительной культуры костного мозга • Б) клеточные линии: CFC 034; 2012; AFT 024; FBMD-1, MS-5
КООБ • Для поддержания предшественников необходим стромальный подслой • Варианты подслоя: • А) для длительной культуры костного мозга • Б) клеточные линии: CFC 034; 2012; AFT 024; FBMD-1, MS-5
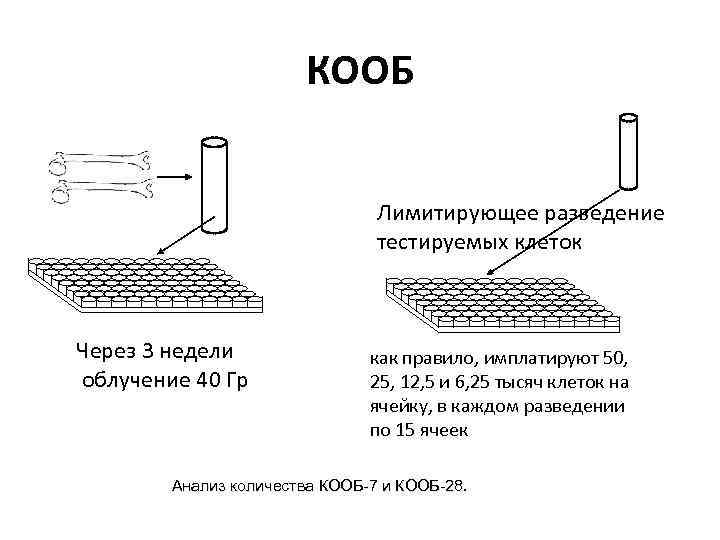 КООБ Лимитирующее разведение тестируемых клеток Через 3 недели облучение 40 Гр как правило, имплатируют 50, 25, 12, 5 и 6, 25 тысяч клеток на ячейку, в каждом разведении по 15 ячеек Анализ количества КООБ-7 и КООБ-28.
КООБ Лимитирующее разведение тестируемых клеток Через 3 недели облучение 40 Гр как правило, имплатируют 50, 25, 12, 5 и 6, 25 тысяч клеток на ячейку, в каждом разведении по 15 ячеек Анализ количества КООБ-7 и КООБ-28.
 КООБ
КООБ
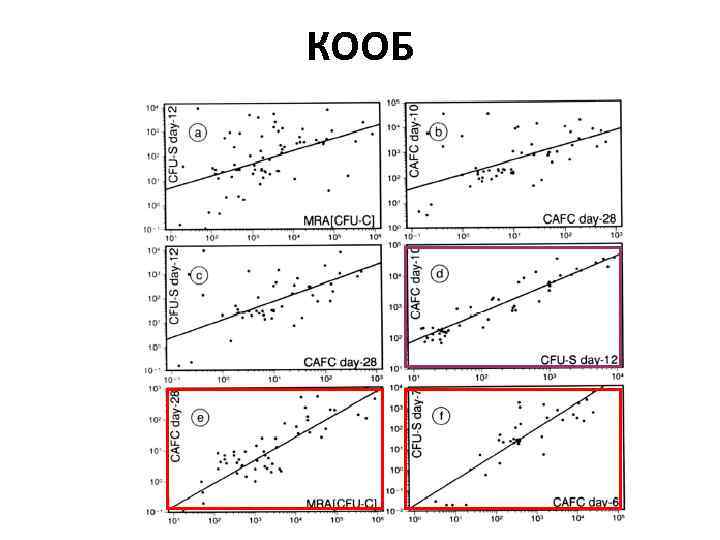 КООБ
КООБ
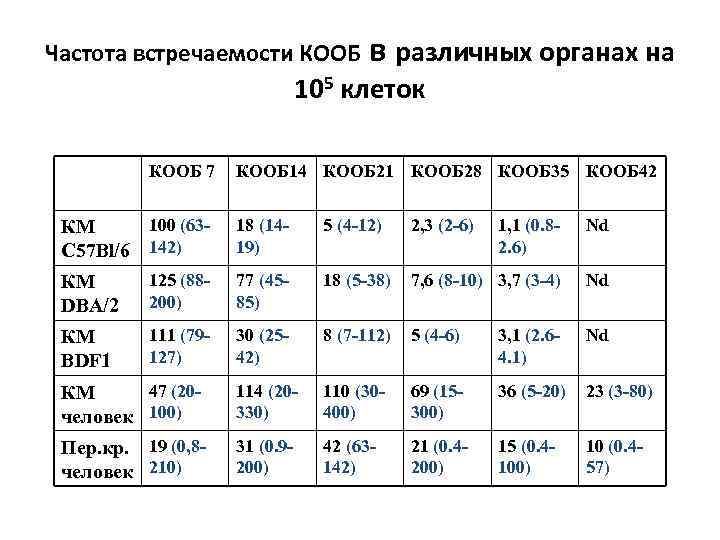 Частота встречаемости КООБ в различных органах на 105 клеток КООБ 7 КООБ 14 КООБ 21 КООБ 28 КООБ 35 КООБ 42 100 (63 КМ C 57 Bl/6 142) 18 (1419) 5 (4 -12) 2, 3 (2 -6) 1, 1 (0. 82. 6) Nd КМ DBA/2 125 (88200) 77 (4585) 18 (5 -38) 7, 6 (8 -10) 3, 7 (3 -4) Nd КМ BDF 1 111 (79127) 30 (2542) 8 (7 -112) 5 (4 -6) 3, 1 (2. 64. 1) Nd 47 (20 КМ человек 100) 114 (20330) 110 (30400) 69 (15300) 36 (5 -20) 23 (3 -80) Пер. кр. 19 (0, 8 человек 210) 31 (0. 9200) 42 (63142) 21 (0. 4200) 15 (0. 4100) 10 (0. 457)
Частота встречаемости КООБ в различных органах на 105 клеток КООБ 7 КООБ 14 КООБ 21 КООБ 28 КООБ 35 КООБ 42 100 (63 КМ C 57 Bl/6 142) 18 (1419) 5 (4 -12) 2, 3 (2 -6) 1, 1 (0. 82. 6) Nd КМ DBA/2 125 (88200) 77 (4585) 18 (5 -38) 7, 6 (8 -10) 3, 7 (3 -4) Nd КМ BDF 1 111 (79127) 30 (2542) 8 (7 -112) 5 (4 -6) 3, 1 (2. 64. 1) Nd 47 (20 КМ человек 100) 114 (20330) 110 (30400) 69 (15300) 36 (5 -20) 23 (3 -80) Пер. кр. 19 (0, 8 человек 210) 31 (0. 9200) 42 (63142) 21 (0. 4200) 15 (0. 4100) 10 (0. 457)
 КООБ • Преимущества метода • Минимальное использование животных • Пригоден не только для мышиных, но и для человеческих клетокпредшественников • Возможно анализировать сразу 2 типа предшественников из иерархии • Недостатки метода • Не известно, что за клетки анализируют • Очень трудоемкий метод (нельзя использовать труд лаборантов)
КООБ • Преимущества метода • Минимальное использование животных • Пригоден не только для мышиных, но и для человеческих клетокпредшественников • Возможно анализировать сразу 2 типа предшественников из иерархии • Недостатки метода • Не известно, что за клетки анализируют • Очень трудоемкий метод (нельзя использовать труд лаборантов)
 Методы изучения пролиферации предшественников • Инкубация клеток с циклоспецифическими цитостатиками • Определение выжившей фракции • Расчет числа пролиферировавших клетокпредшественников • Пролиферирующую фракцию клеток определяют по разности числа клеток-предшественников в образцах, не инкубировавшихся с цитостатиками, и после их воздействия по следующей формуле: • N=[(Nбез цит-Nс цит)/Nбез цит]х100% , • где N – искомая доля пролиферирующих клеток, Nбез цит – количество клеток-предшественников, не инкубировавшихся с цитостатикм, а Nс цит – количество клеток, подвергшихся предварительной инкубации с цитостатиками
Методы изучения пролиферации предшественников • Инкубация клеток с циклоспецифическими цитостатиками • Определение выжившей фракции • Расчет числа пролиферировавших клетокпредшественников • Пролиферирующую фракцию клеток определяют по разности числа клеток-предшественников в образцах, не инкубировавшихся с цитостатиками, и после их воздействия по следующей формуле: • N=[(Nбез цит-Nс цит)/Nбез цит]х100% , • где N – искомая доля пролиферирующих клеток, Nбез цит – количество клеток-предшественников, не инкубировавшихся с цитостатикм, а Nс цит – количество клеток, подвергшихся предварительной инкубации с цитостатиками
 Методы изучения пролиферации предшественников Используемые цитостатики Оксимочевина (HU) концентрация 1 мг/мл Арабинозид-цитозина (Аra. C) концентрация 2 х10 -6 моль/мл Метод Клетки в концентрации 106/мл инкубируют с оксимочевиной в течение 2 часов, либо с Ara-C в течение 1 часа в среде для культивирования с 2% эмбриональной телячьей сыворотки (ЭТС) при температуре 37 С и 5% СО 2. • Затем клетки отмывают средой и тестируют на КОЕк, КОЕс или , КООБ находящихся на разных стадиях дифференцировки • В качестве контроля используют клетки с которыми проделывают те же процедуры, но инкубируют в среде без цитостатиков. • • •
Методы изучения пролиферации предшественников Используемые цитостатики Оксимочевина (HU) концентрация 1 мг/мл Арабинозид-цитозина (Аra. C) концентрация 2 х10 -6 моль/мл Метод Клетки в концентрации 106/мл инкубируют с оксимочевиной в течение 2 часов, либо с Ara-C в течение 1 часа в среде для культивирования с 2% эмбриональной телячьей сыворотки (ЭТС) при температуре 37 С и 5% СО 2. • Затем клетки отмывают средой и тестируют на КОЕк, КОЕс или , КООБ находящихся на разных стадиях дифференцировки • В качестве контроля используют клетки с которыми проделывают те же процедуры, но инкубируют в среде без цитостатиков. • • •
 Периферическая кровь
Периферическая кровь
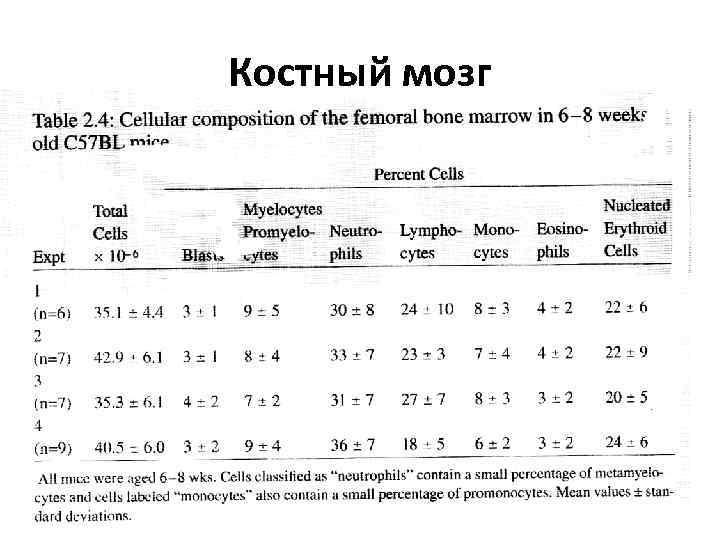 Костный мозг
Костный мозг
 Селезенка
Селезенка
 Программа транскрипции в кроветворных клетках
Программа транскрипции в кроветворных клетках
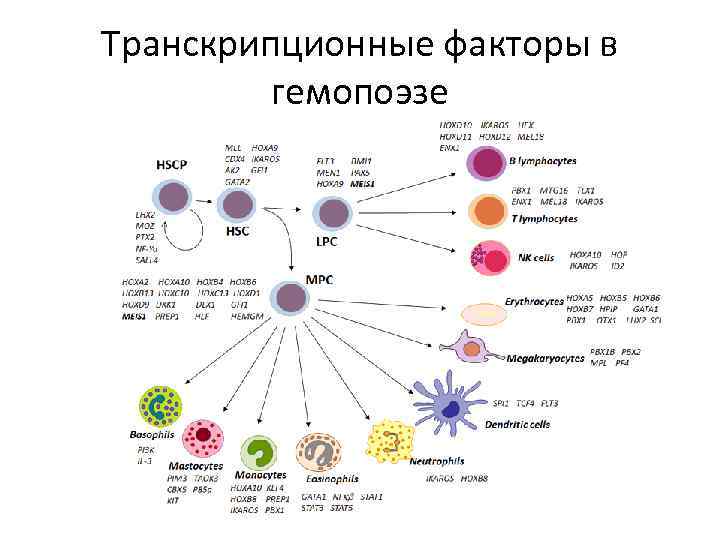 Транскрипционные факторы в гемопоэзе
Транскрипционные факторы в гемопоэзе
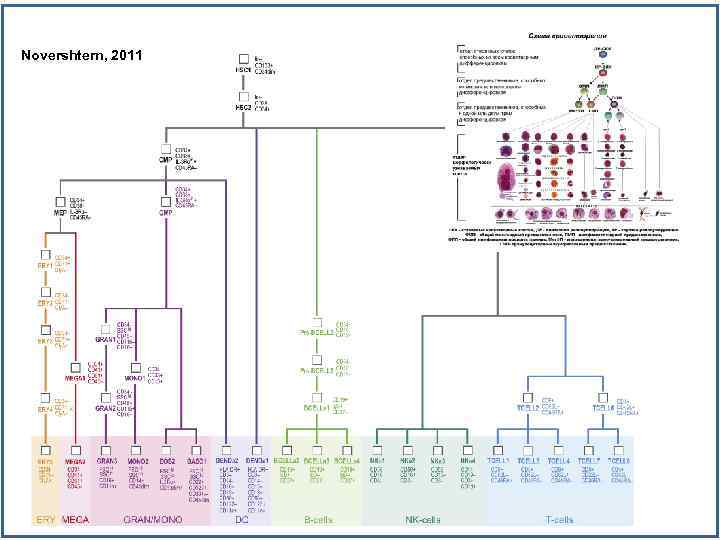 Novershtern, 2011
Novershtern, 2011
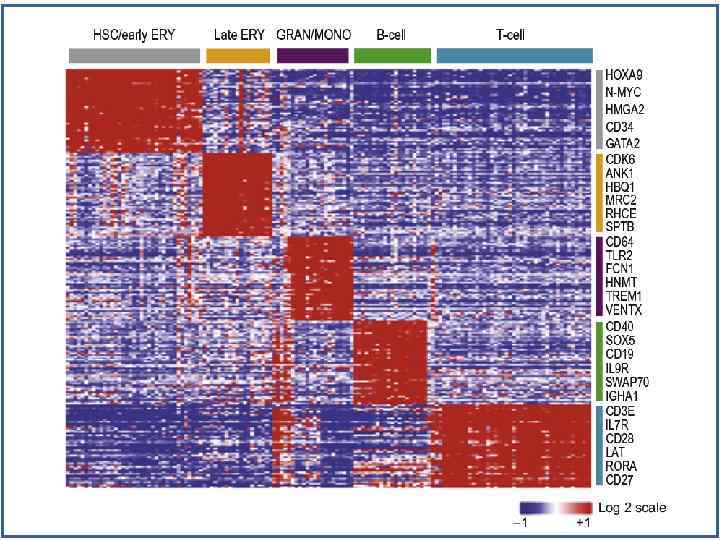
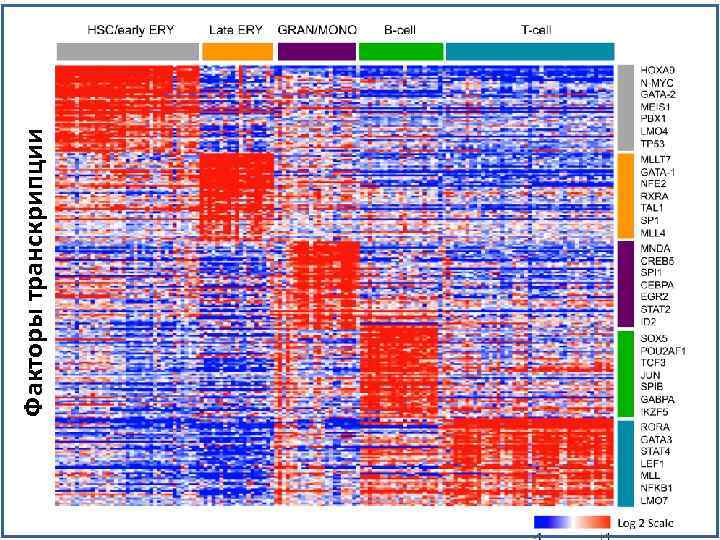 Факторы транскрипции
Факторы транскрипции
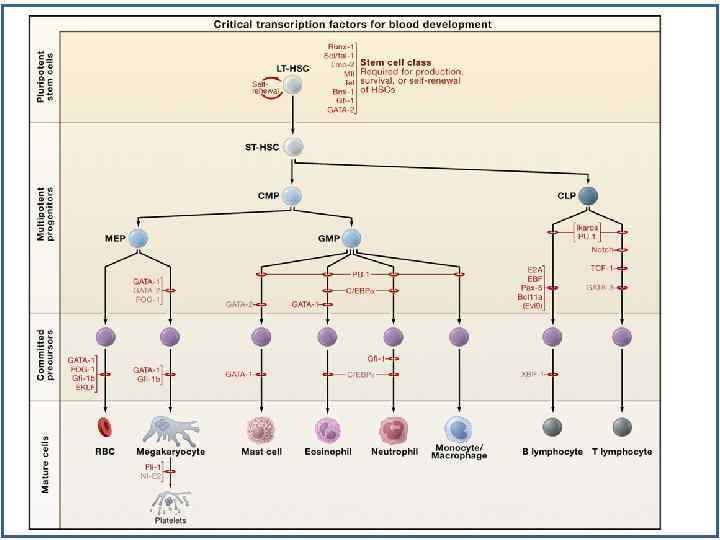
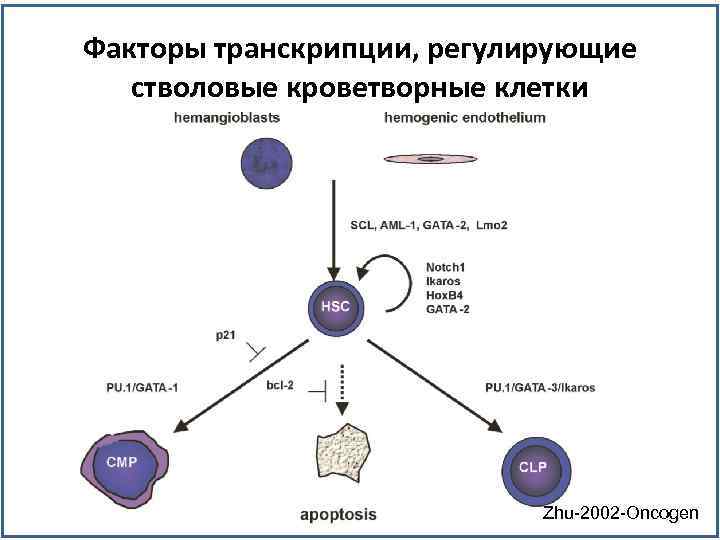 Факторы транскрипции, регулирующие стволовые кроветворные клетки Zhu-2002 -Oncogen
Факторы транскрипции, регулирующие стволовые кроветворные клетки Zhu-2002 -Oncogen
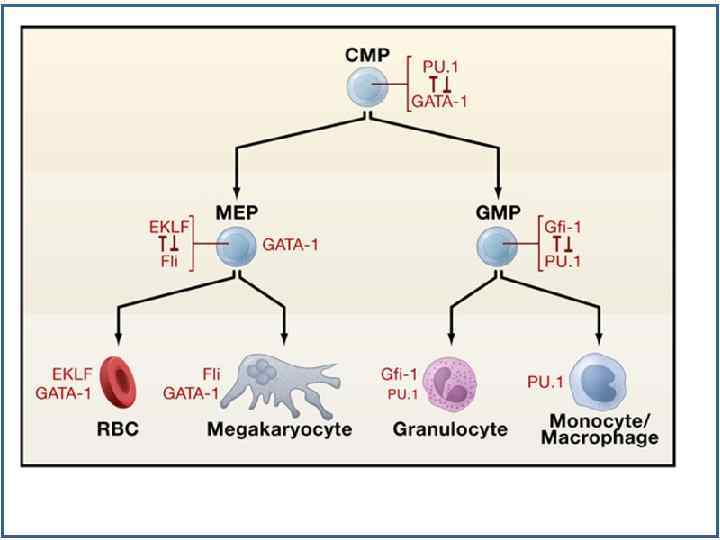
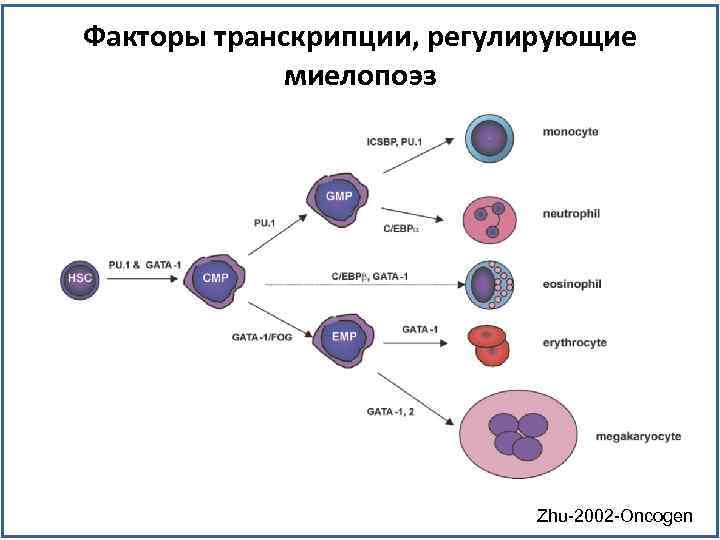 Факторы транскрипции, регулирующие миелопоэз Zhu-2002 -Oncogen
Факторы транскрипции, регулирующие миелопоэз Zhu-2002 -Oncogen
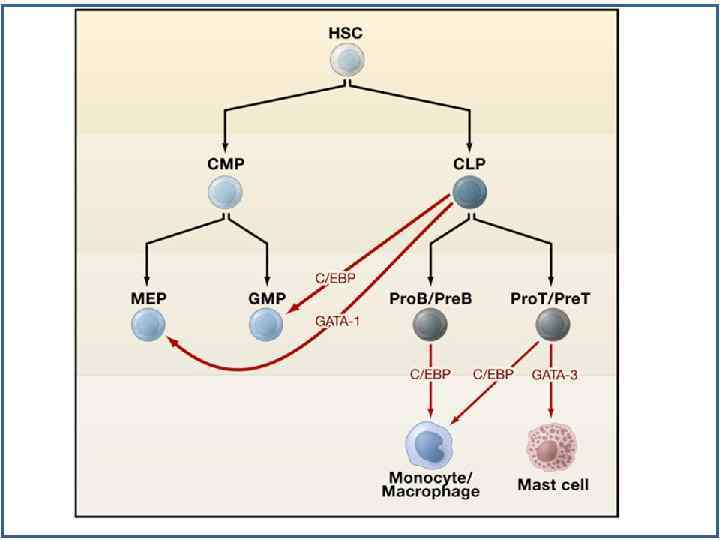
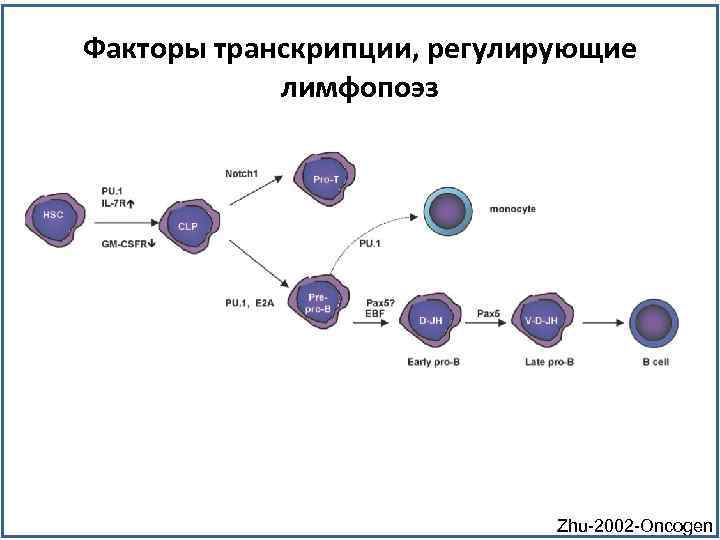 Факторы транскрипции, регулирующие лимфопоэз Zhu-2002 -Oncogen
Факторы транскрипции, регулирующие лимфопоэз Zhu-2002 -Oncogen
 Методы для определения факторов транскрипции • 1. нокаутные мыши • 2. Арреи • 3. Определение транскриптом
Методы для определения факторов транскрипции • 1. нокаутные мыши • 2. Арреи • 3. Определение транскриптом
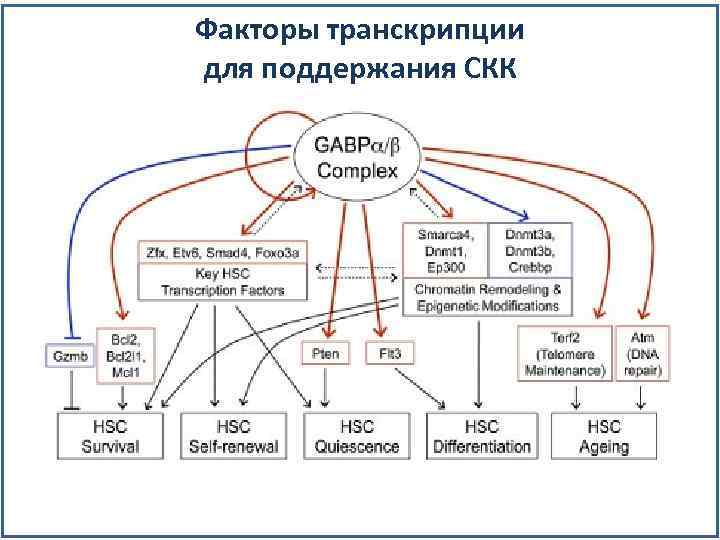 Факторы транскрипции для поддержания СКК
Факторы транскрипции для поддержания СКК
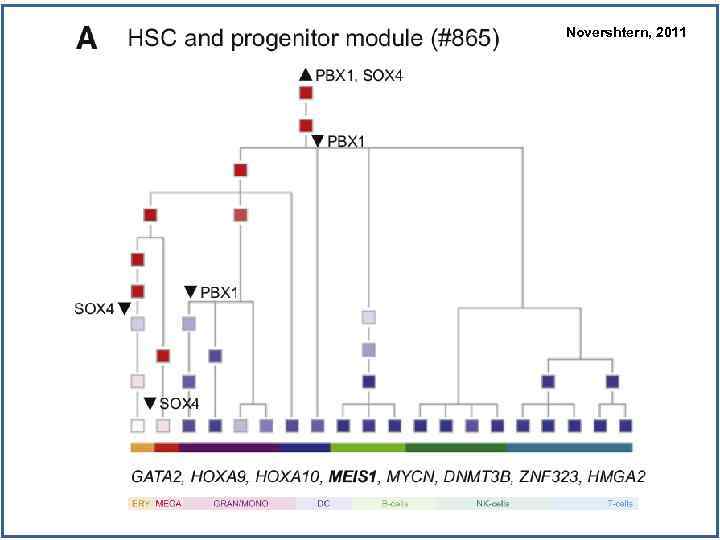 Novershtern, 2011
Novershtern, 2011
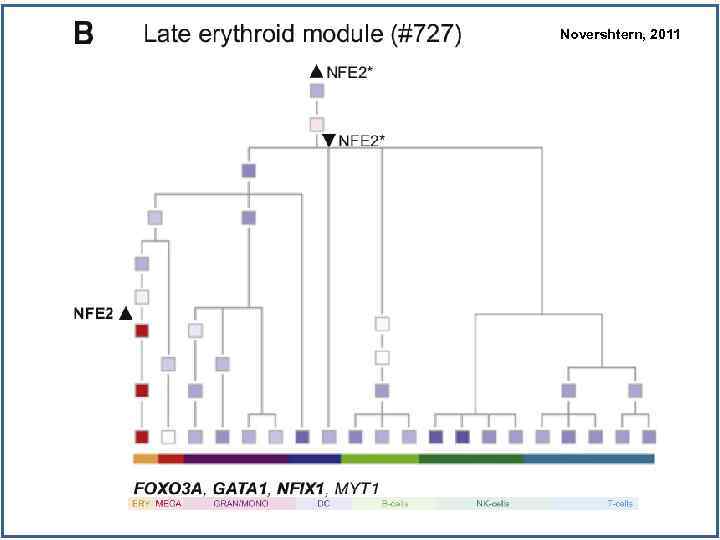 Novershtern, 2011
Novershtern, 2011
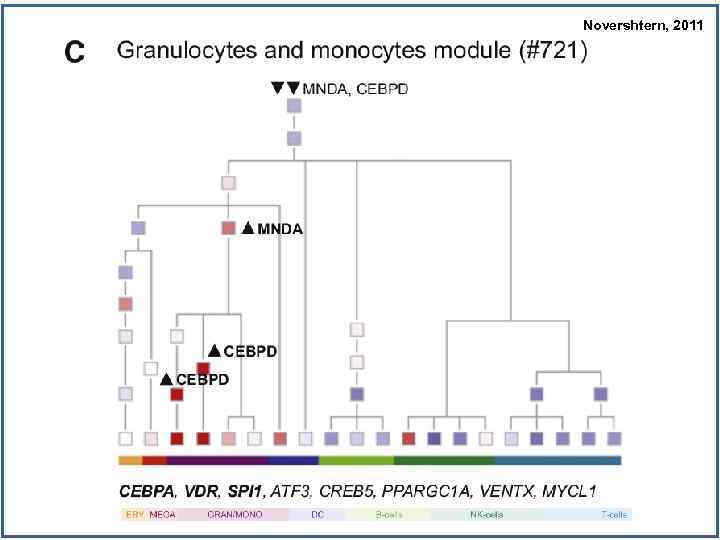 Novershtern, 2011
Novershtern, 2011
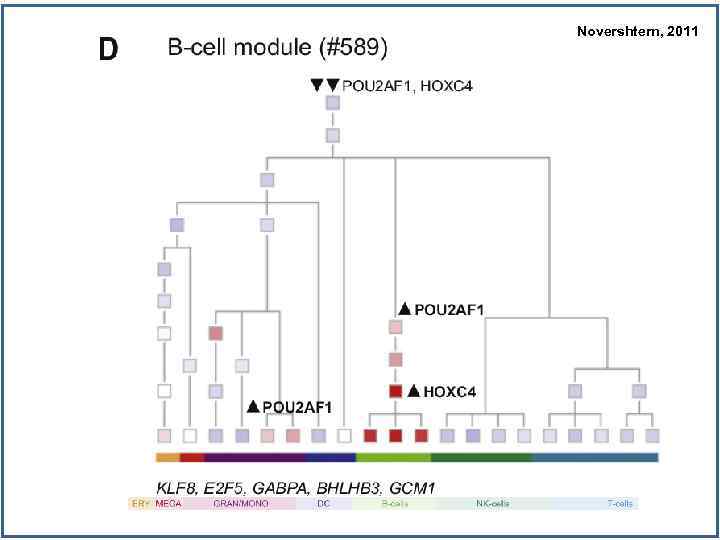 Novershtern, 2011
Novershtern, 2011
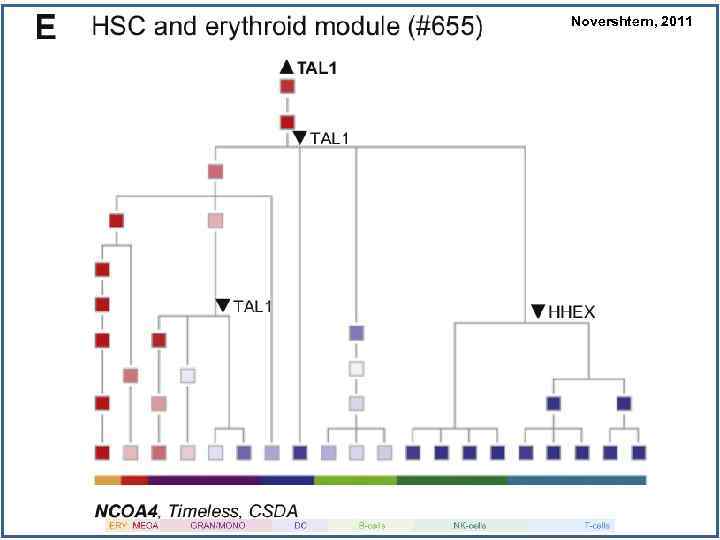 Novershtern, 2011
Novershtern, 2011
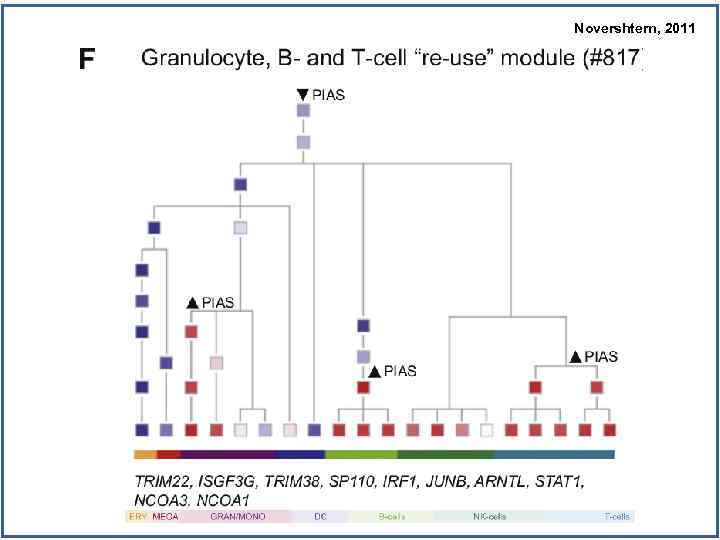 Novershtern, 2011
Novershtern, 2011
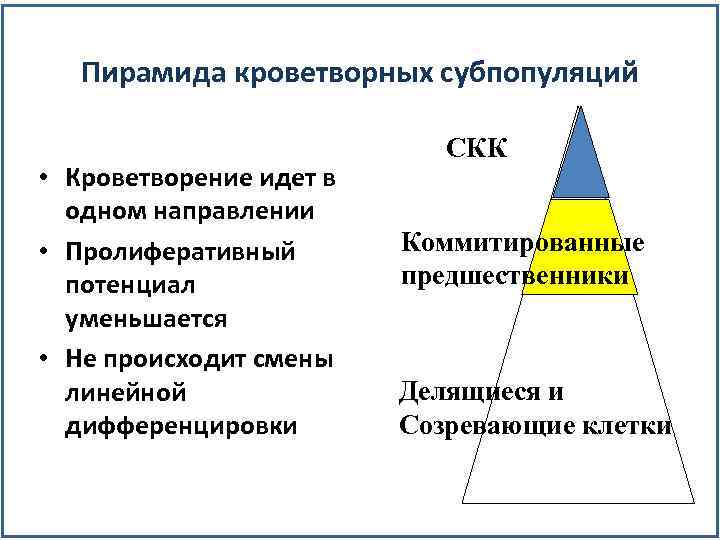 Пирамида кроветворных субпопуляций • Кроветворение идет в одном направлении • Пролиферативный потенциал уменьшается • Не происходит смены линейной дифференцировки СКК Коммитированные предшественники Делящиеся и Созревающие клетки
Пирамида кроветворных субпопуляций • Кроветворение идет в одном направлении • Пролиферативный потенциал уменьшается • Не происходит смены линейной дифференцировки СКК Коммитированные предшественники Делящиеся и Созревающие клетки
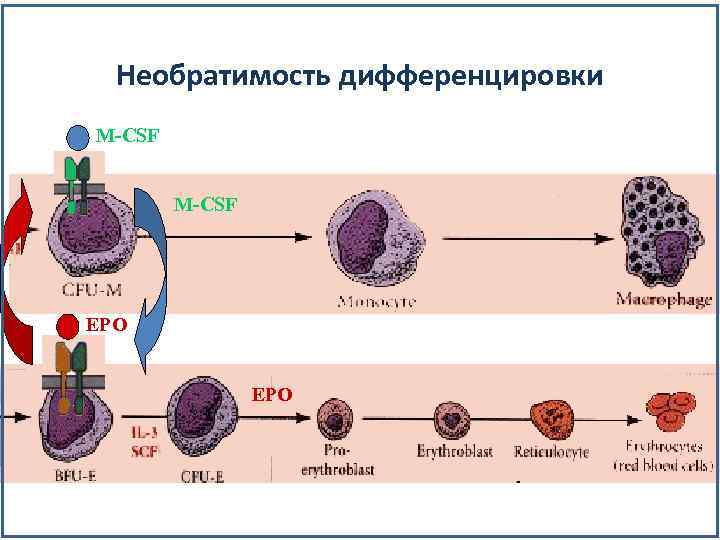 Необратимость дифференцировки M-CSF EPO
Необратимость дифференцировки M-CSF EPO
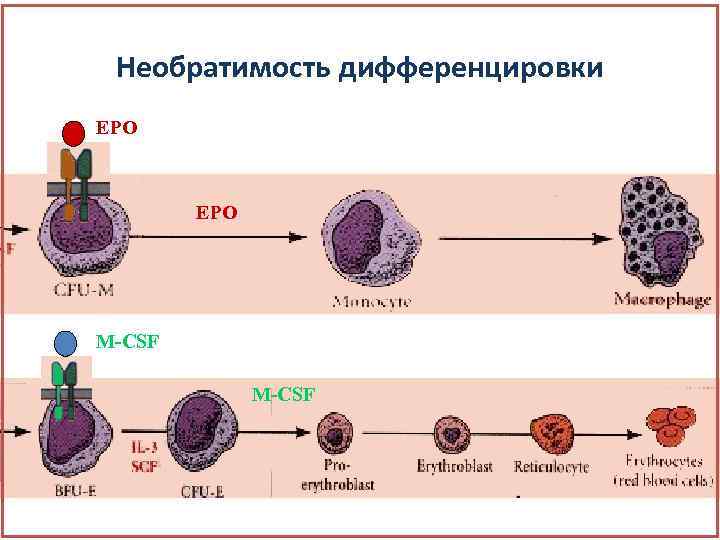 Необратимость дифференцировки EPO M-CSF
Необратимость дифференцировки EPO M-CSF
 Предшественники миелоидной дифференцировки Pronk-2007 -Cell stem Cell
Предшественники миелоидной дифференцировки Pronk-2007 -Cell stem Cell
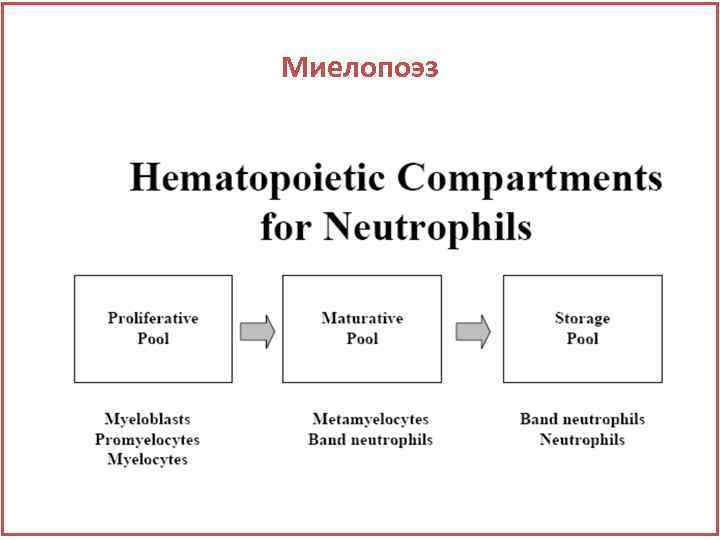 Миелопоэз
Миелопоэз
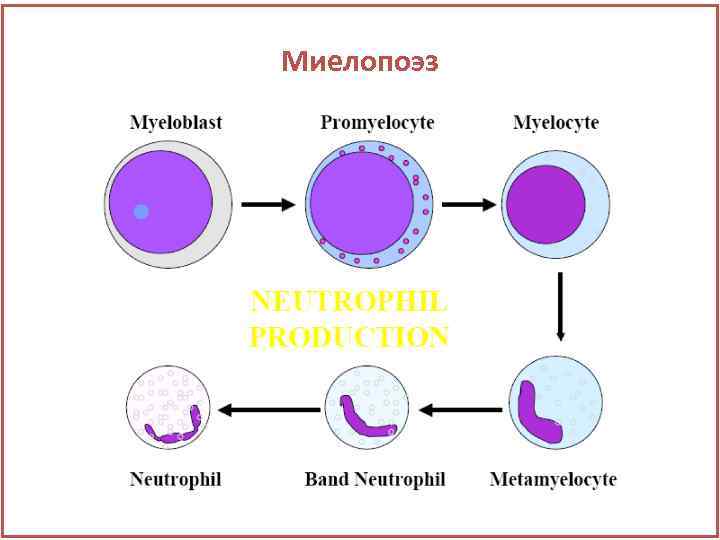 Миелопоэз
Миелопоэз
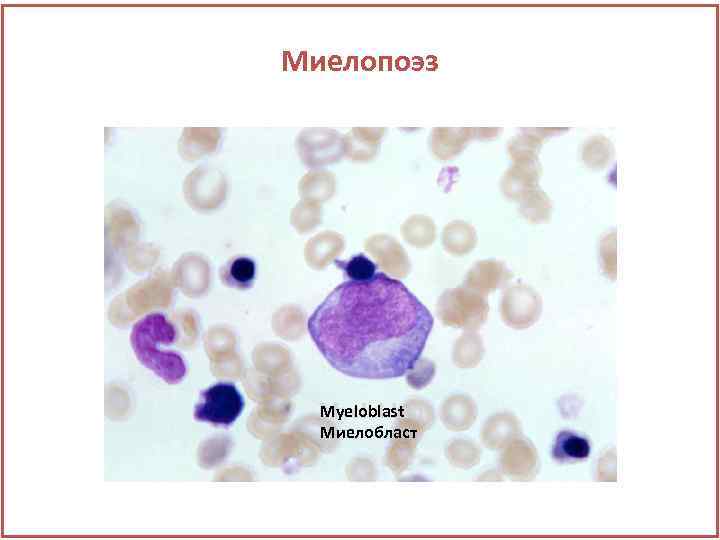 Миелопоэз Myeloblast Миелобласт
Миелопоэз Myeloblast Миелобласт
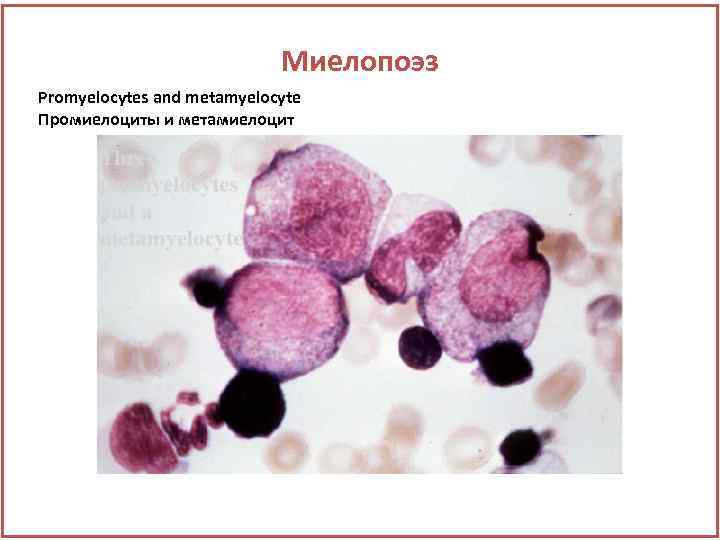 Миелопоэз Promyelocytes and metamyelocyte Промиелоциты и метамиелоцит
Миелопоэз Promyelocytes and metamyelocyte Промиелоциты и метамиелоцит
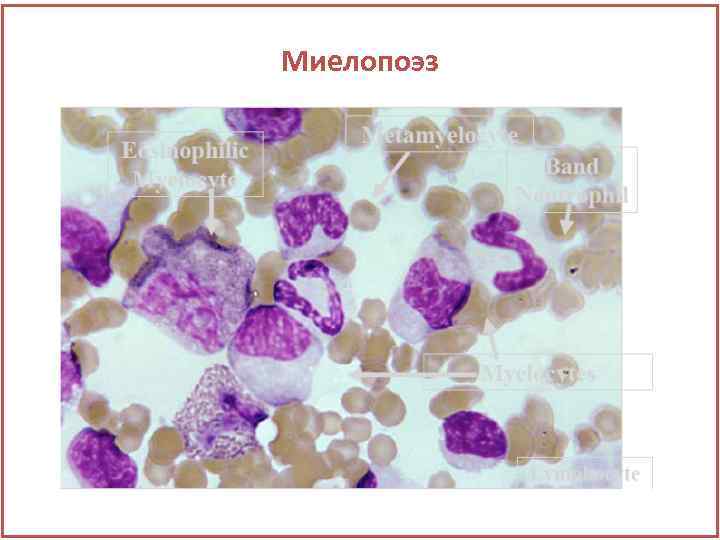 Миелопоэз
Миелопоэз
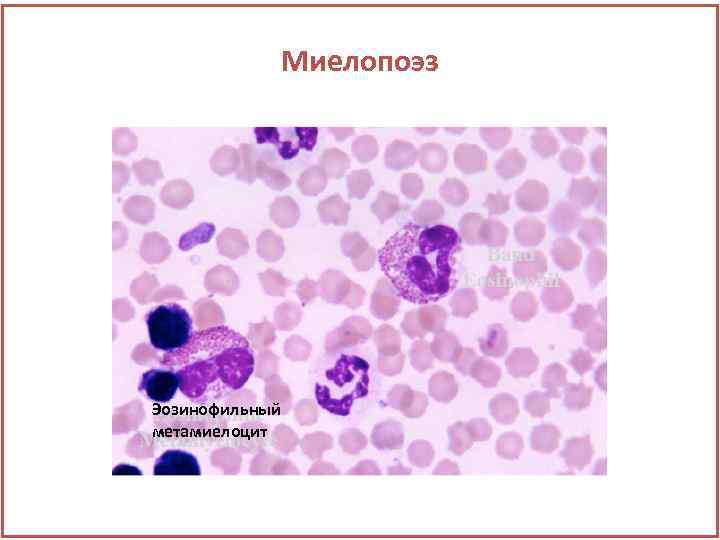 Миелопоэз Эозинофильный метамиелоцит
Миелопоэз Эозинофильный метамиелоцит
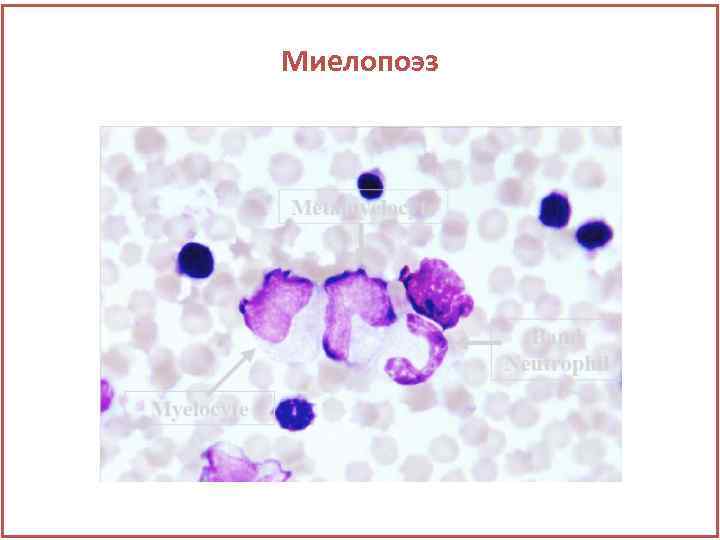 Миелопоэз
Миелопоэз
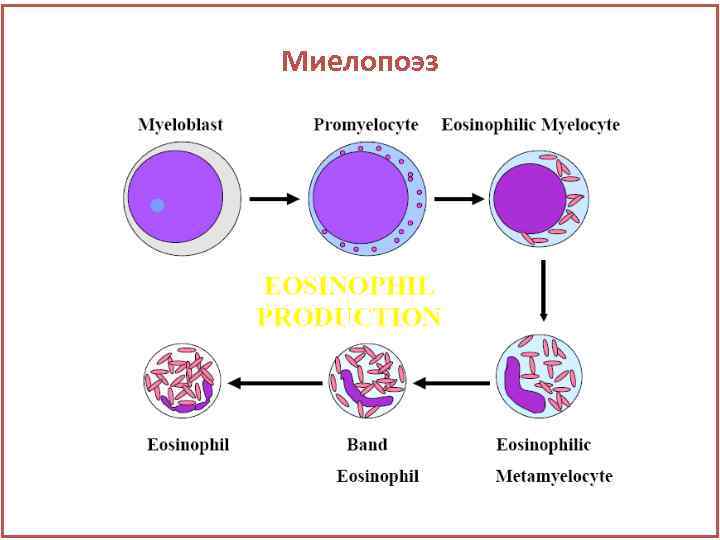 Миелопоэз
Миелопоэз
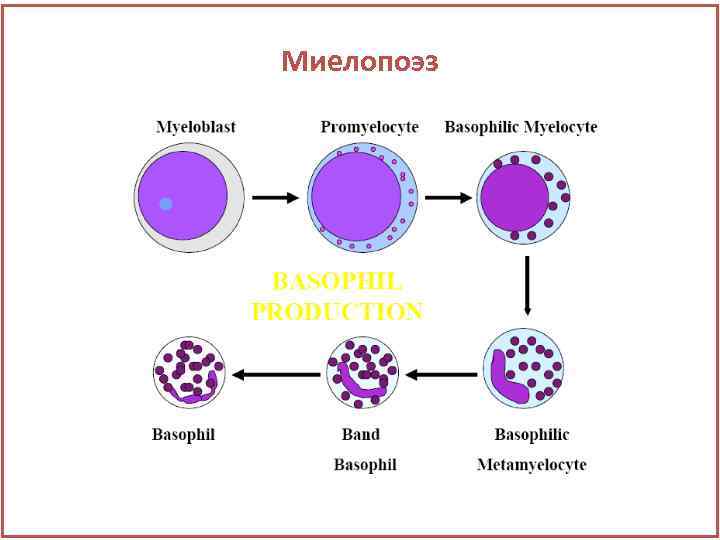 Миелопоэз
Миелопоэз
 Моноцитопоэз • Продукция моноцитов • На ранних стадиях это одни и те же с миелоцитами клетки • После действия ГМ-КСФ разделяются на 2 отдельных линии • После действия М-КСФ развиваются в монобласты и промоноциты
Моноцитопоэз • Продукция моноцитов • На ранних стадиях это одни и те же с миелоцитами клетки • После действия ГМ-КСФ разделяются на 2 отдельных линии • После действия М-КСФ развиваются в монобласты и промоноциты
 Моноцитопоэз • Морфологически монобласты и промоноциты плохо отличимы от миелобластов и промиелоцитов • Моноциты быстро попадают в кровоток. • Пула их в костном мозге нет. • Моноциты попадающие в ткани становятся макрофагами.
Моноцитопоэз • Морфологически монобласты и промоноциты плохо отличимы от миелобластов и промиелоцитов • Моноциты быстро попадают в кровоток. • Пула их в костном мозге нет. • Моноциты попадающие в ткани становятся макрофагами.
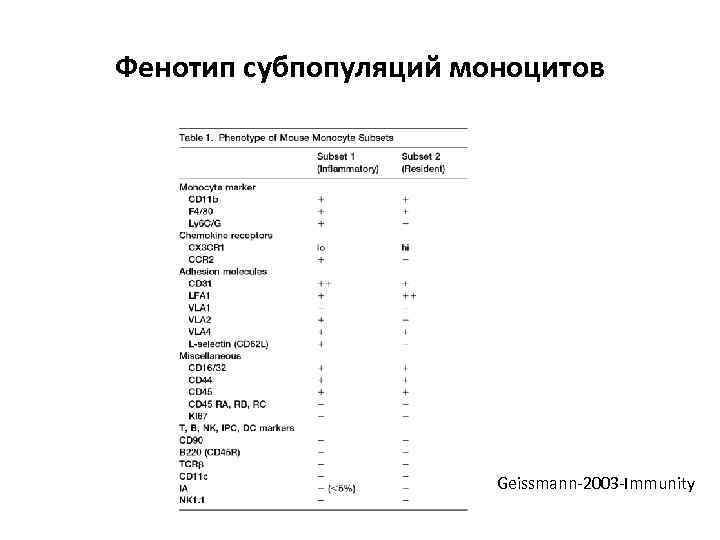 Фенотип субпопуляций моноцитов Geissmann-2003 -Immunity
Фенотип субпопуляций моноцитов Geissmann-2003 -Immunity
 Как это удалось установить ? С помощью метода радиоавтографии Крысам внутрибрюшинно вводили радиоактивный тимидин в течение 7 дней
Как это удалось установить ? С помощью метода радиоавтографии Крысам внутрибрюшинно вводили радиоактивный тимидин в течение 7 дней
 Радиоавтография
Радиоавтография
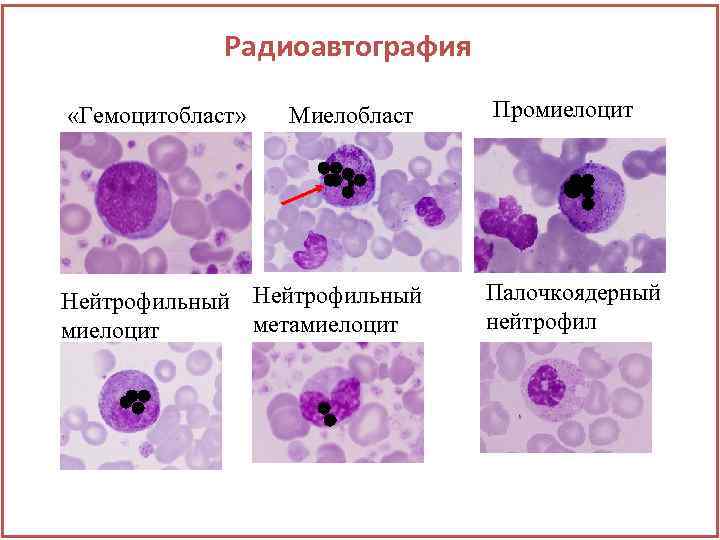 Радиоавтография «Гемоцитобласт» Миелобласт Нейтрофильный метамиелоцит Промиелоцит Палочкоядерный нейтрофил
Радиоавтография «Гемоцитобласт» Миелобласт Нейтрофильный метамиелоцит Промиелоцит Палочкоядерный нейтрофил
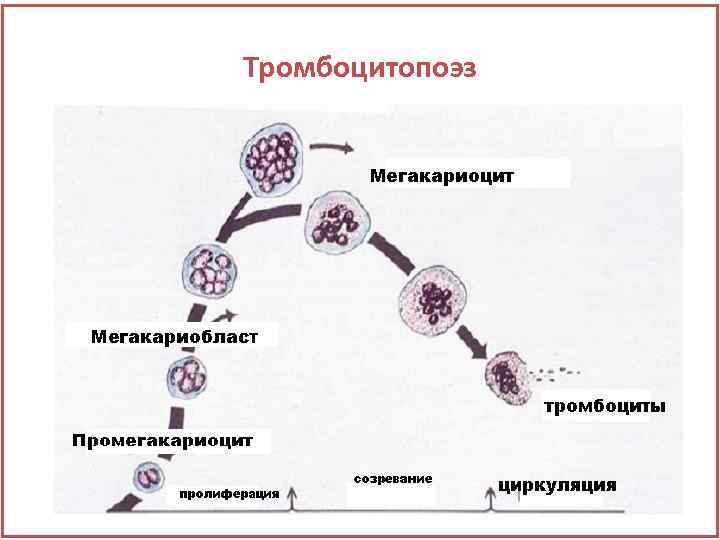 Тромбоцитопоэз
Тромбоцитопоэз
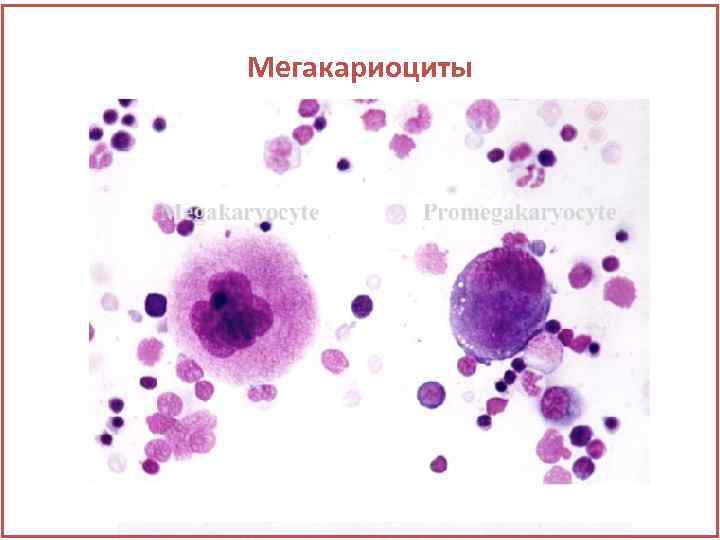 Мегакариоциты
Мегакариоциты
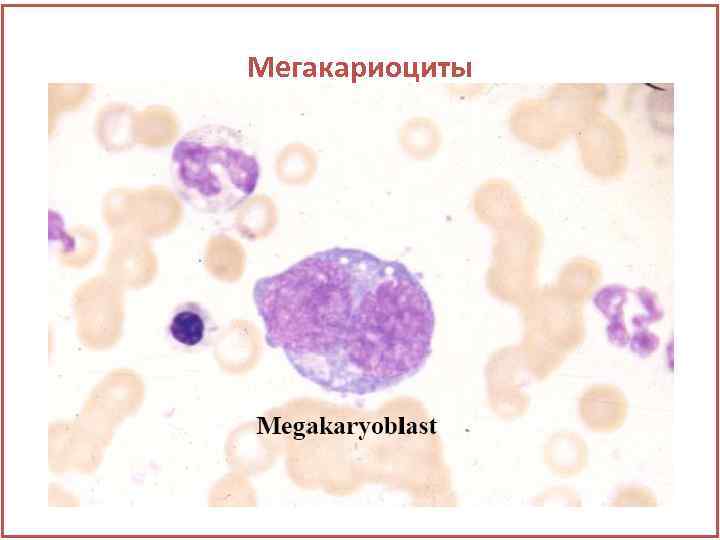 Мегакариоциты
Мегакариоциты
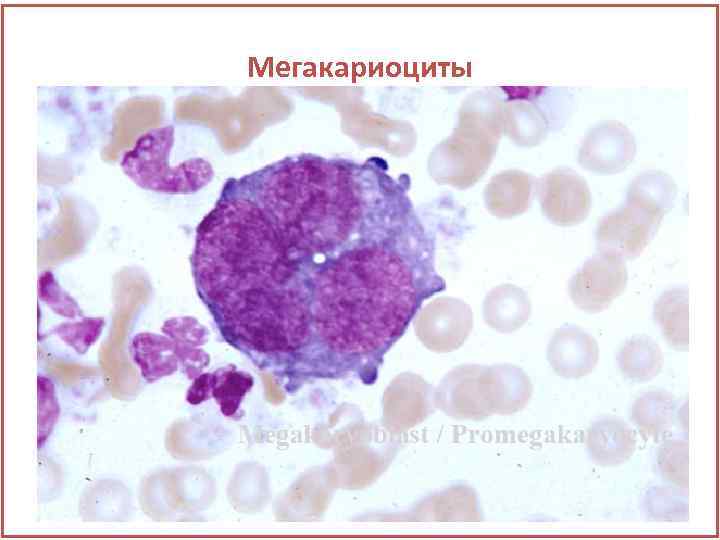 Мегакариоциты
Мегакариоциты
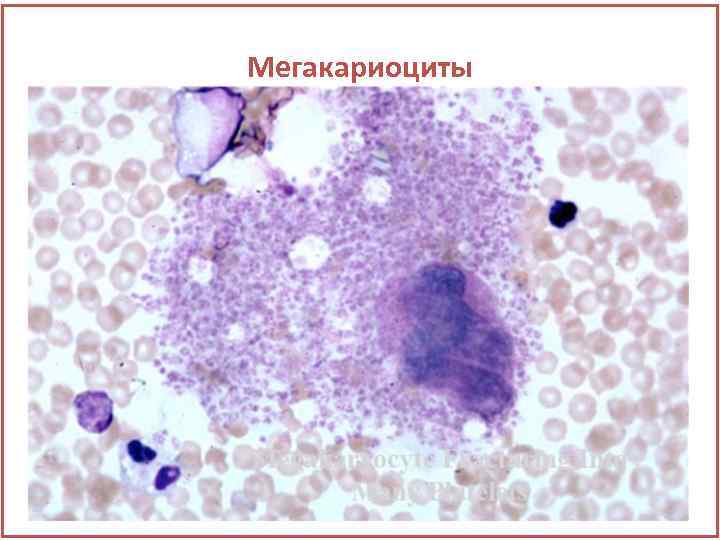 Мегакариоциты
Мегакариоциты
 Мегакариоцит
Мегакариоцит
 Эритропоэз • Основой является эритробластный островок. • В центре находится макрофаг-кормушка, вокруг которого образуются кольца развивающихся эритроидных предшественников. • В развивающиеся клетки железо из ферритина.
Эритропоэз • Основой является эритробластный островок. • В центре находится макрофаг-кормушка, вокруг которого образуются кольца развивающихся эритроидных предшественников. • В развивающиеся клетки железо из ферритина.
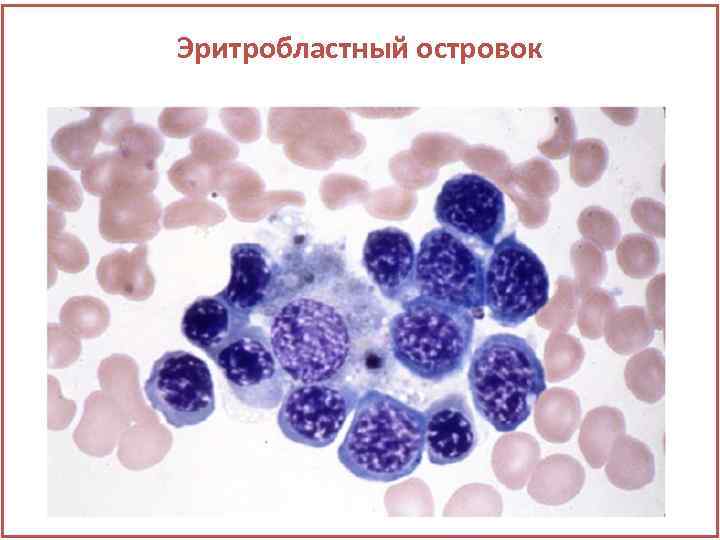 Эритробластный островок
Эритробластный островок
 Эритропоэз • Схема развития клеток эритроидного ряда: СКК→БОЕ-Э →КОЕ-Е →эритробласт →проэритробласт →базофильный нормобласт → полихроматофильный нормобласт → метахроматофильный нормобласт → оксифильный нормобласт→ ретикулоцит → эритроцит
Эритропоэз • Схема развития клеток эритроидного ряда: СКК→БОЕ-Э →КОЕ-Е →эритробласт →проэритробласт →базофильный нормобласт → полихроматофильный нормобласт → метахроматофильный нормобласт → оксифильный нормобласт→ ретикулоцит → эритроцит
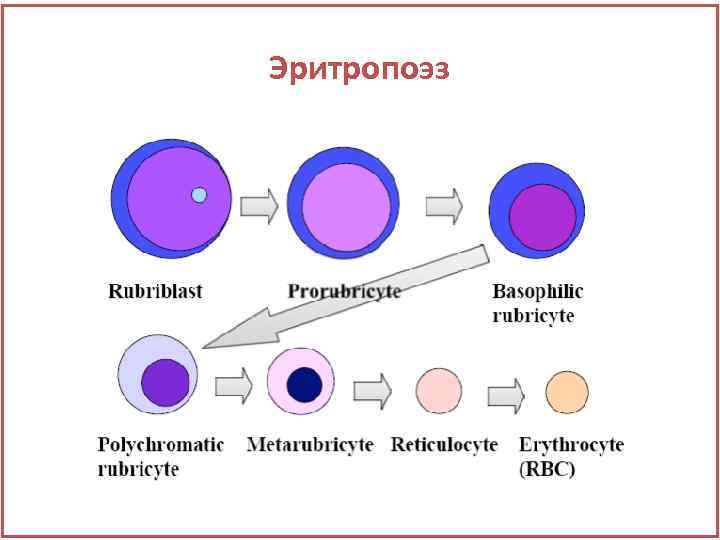 Эритропоэз
Эритропоэз
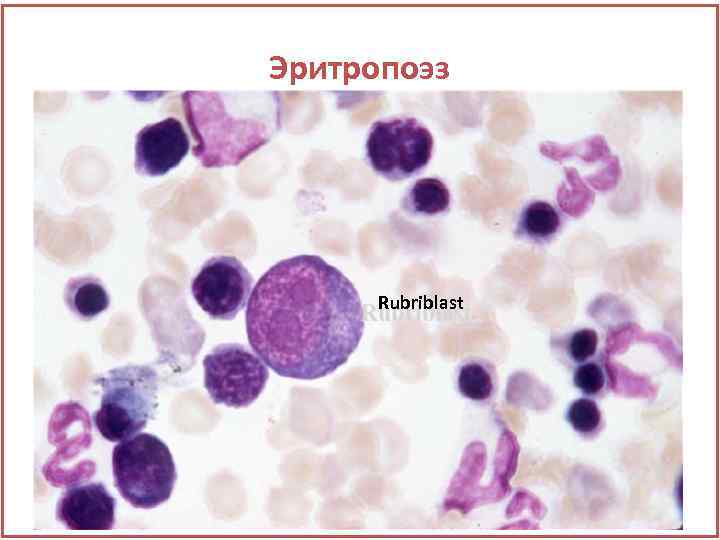 Эритропоэз Rubriblast
Эритропоэз Rubriblast
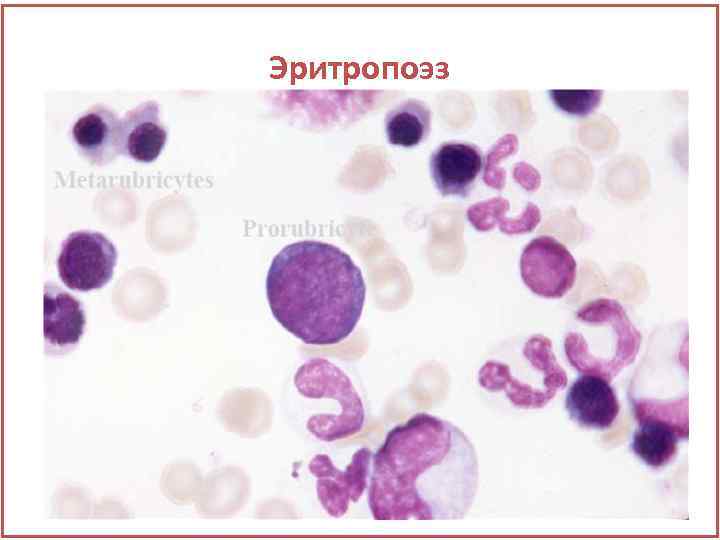 Эритропоэз Rubriblast
Эритропоэз Rubriblast
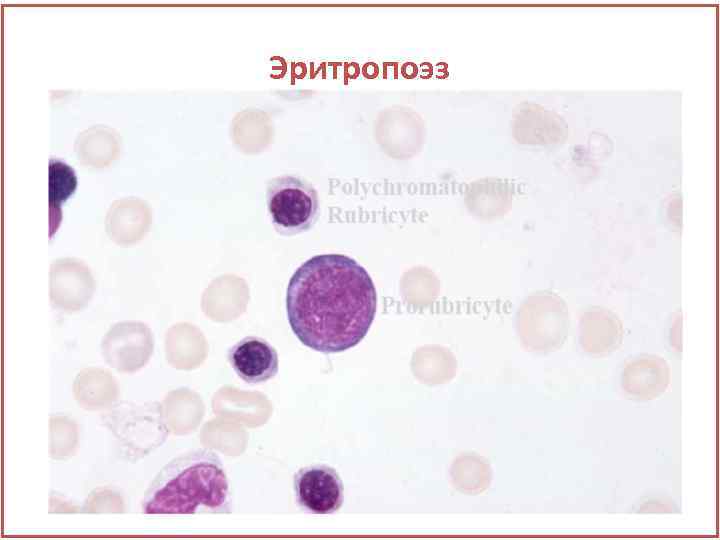 Эритропоэз
Эритропоэз
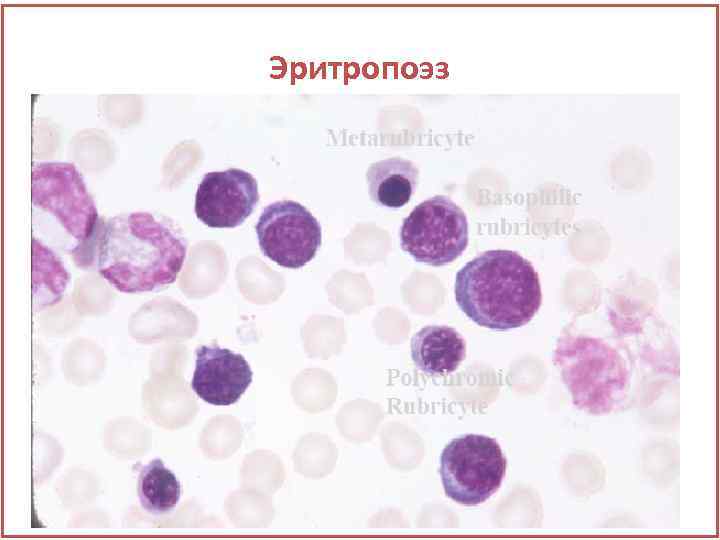 Эритропоэз
Эритропоэз
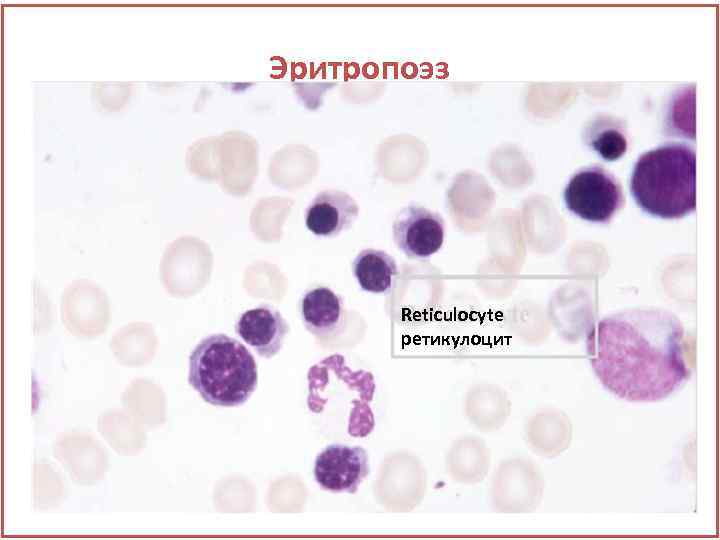 Эритропоэз Reticulocyte ретикулоцит
Эритропоэз Reticulocyte ретикулоцит
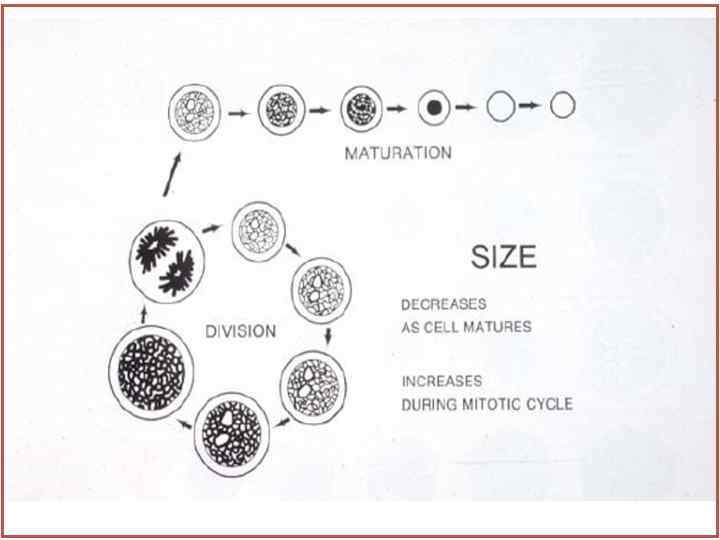
 Схема взросления эритроидных клеток • 1. Уменьшается размер клетки. • 2. Уменьшается размер ядра. • 3. Усиливается конденсация хроматина. • 4. Цитоплазма перестает быть базофильной и становится краснооранжевой, так как рибосомальные РНК заменяются гемоглобином.
Схема взросления эритроидных клеток • 1. Уменьшается размер клетки. • 2. Уменьшается размер ядра. • 3. Усиливается конденсация хроматина. • 4. Цитоплазма перестает быть базофильной и становится краснооранжевой, так как рибосомальные РНК заменяются гемоглобином.
 Продукция эритроцитов • Время необходимое для продукции эритроцитов от эритробласта до эритроцита Человек : 8 дней Собака: 4 дня Корова 4, 5 дня • Значительное количество эритроцитов появляется в крови через 3 дня после стимуляции эритропоэза, связанной с гипоксией или анемией.
Продукция эритроцитов • Время необходимое для продукции эритроцитов от эритробласта до эритроцита Человек : 8 дней Собака: 4 дня Корова 4, 5 дня • Значительное количество эритроцитов появляется в крови через 3 дня после стимуляции эритропоэза, связанной с гипоксией или анемией.
 Как регулируется продукция эритроцитов ? Известно, что при гипоксии увеличивается количество эритроцитов. Почему это происходит? Давление кислорода падает, ткани начинают страдать от его нехватки и в почках начинает синтезироваться больше гормона эритропоэтина. Эритропоэтин – первый из открытых факторов роста кроветворных клеток. Без него не возможна дифференцировка эритрона.
Как регулируется продукция эритроцитов ? Известно, что при гипоксии увеличивается количество эритроцитов. Почему это происходит? Давление кислорода падает, ткани начинают страдать от его нехватки и в почках начинает синтезироваться больше гормона эритропоэтина. Эритропоэтин – первый из открытых факторов роста кроветворных клеток. Без него не возможна дифференцировка эритрона.
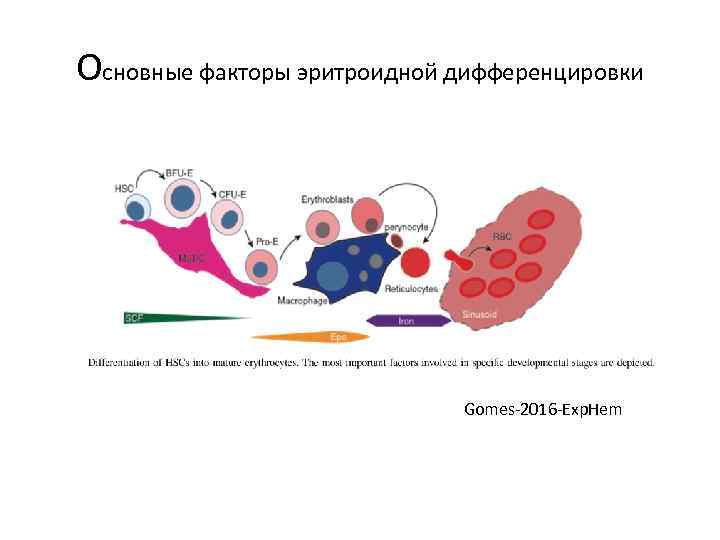 Основные факторы эритроидной дифференцировки Gomes-2016 -Exp. Hem
Основные факторы эритроидной дифференцировки Gomes-2016 -Exp. Hem
 Как обеспечить своевременную гибель клеток? Апоптоз – запрограммированная гибель клеток. Используется в регуляции кроветворения на всех этапах дифференцировки.
Как обеспечить своевременную гибель клеток? Апоптоз – запрограммированная гибель клеток. Используется в регуляции кроветворения на всех этапах дифференцировки.
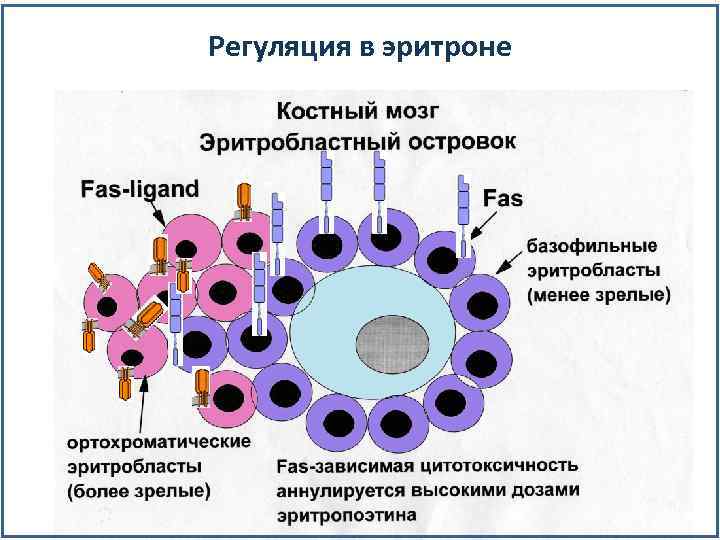 Регуляция в эритроне
Регуляция в эритроне
 Как клетки крови попадают из костного мозга в кровоток? • Эндотелиальные клетки и поддерживающая строма представляют барьер между кровотоком и костным мозгом. • Большинство клеток двигаются между клетками эндотелия для выхода в кровоток. • Возможно давление индуцированное пролиферацией проталкивает эритроциты в кровоток. • Лейкоциты двигаются вдоль клеток стромы и эндотелия с помощью межклеточных молекул адгезии (ICAM), находящихся на их поверхности и клеток фиброзной ткани и эндотелия.
Как клетки крови попадают из костного мозга в кровоток? • Эндотелиальные клетки и поддерживающая строма представляют барьер между кровотоком и костным мозгом. • Большинство клеток двигаются между клетками эндотелия для выхода в кровоток. • Возможно давление индуцированное пролиферацией проталкивает эритроциты в кровоток. • Лейкоциты двигаются вдоль клеток стромы и эндотелия с помощью межклеточных молекул адгезии (ICAM), находящихся на их поверхности и клеток фиброзной ткани и эндотелия.
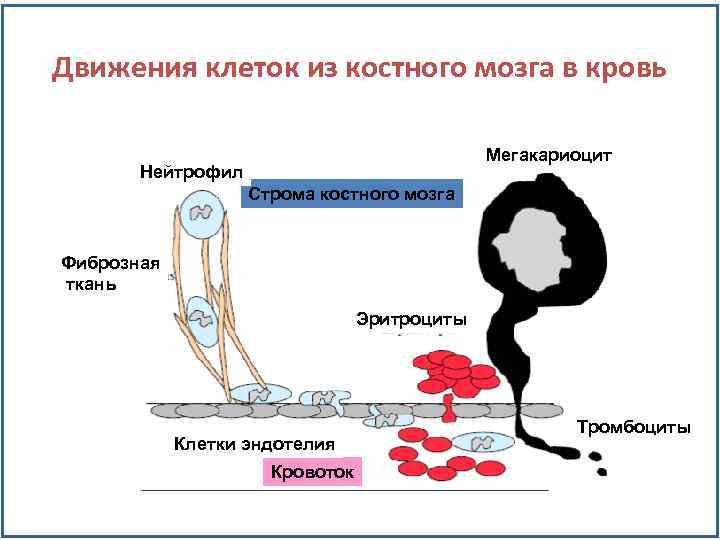 Движения клеток из костного мозга в кровь Мегакариоцит Нейтрофил Строма костного мозга Фиброзная ткань Эритроциты Клетки эндотелия Кровоток Тромбоциты
Движения клеток из костного мозга в кровь Мегакариоцит Нейтрофил Строма костного мозга Фиброзная ткань Эритроциты Клетки эндотелия Кровоток Тромбоциты
 Мегакариоциты
Мегакариоциты
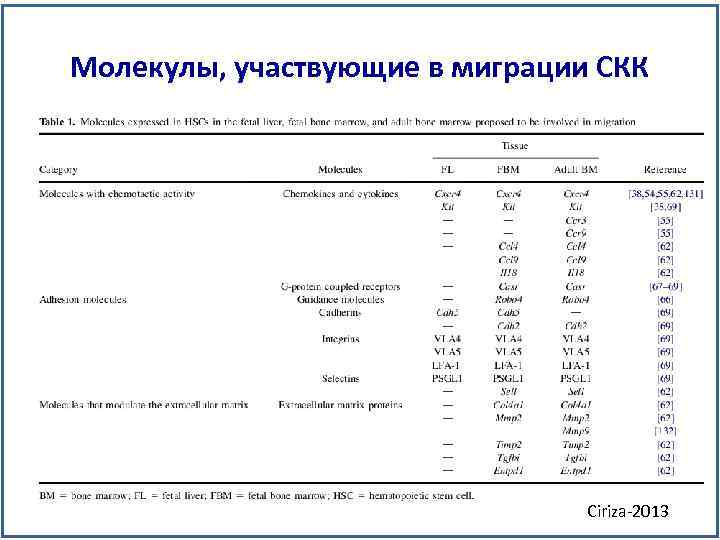 Молекулы, участвующие в миграции СКК Ciriza-2013
Молекулы, участвующие в миграции СКК Ciriza-2013
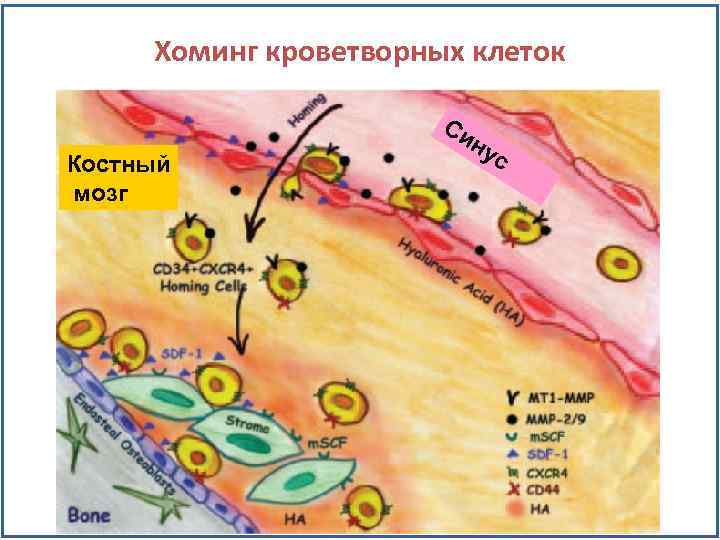 Хоминг кроветворных клеток Костный мозг Си н ус
Хоминг кроветворных клеток Костный мозг Си н ус
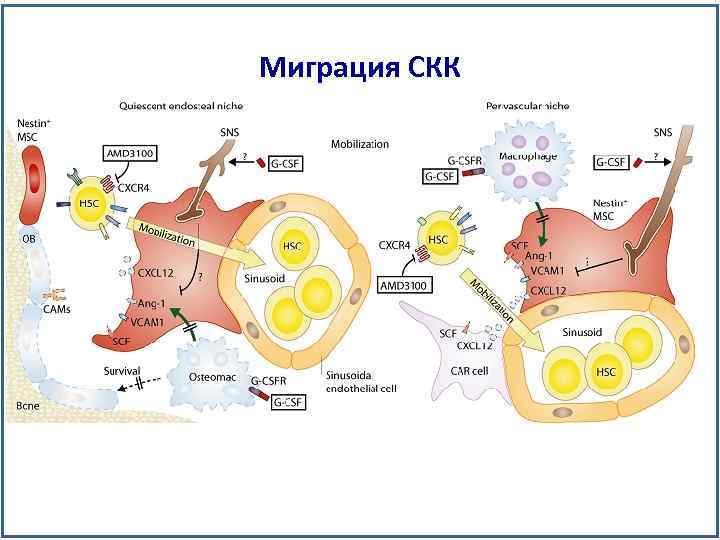 Миграция СКК
Миграция СКК
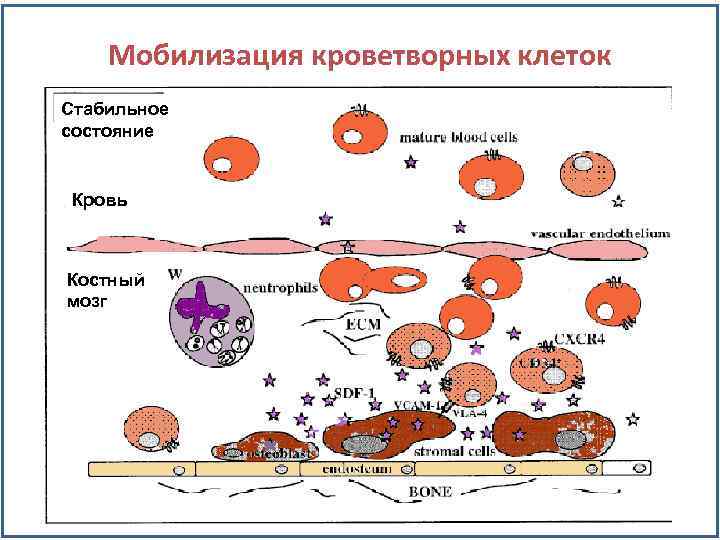 Мобилизация кроветворных клеток Стабильное состояние Кровь Костный мозг
Мобилизация кроветворных клеток Стабильное состояние Кровь Костный мозг
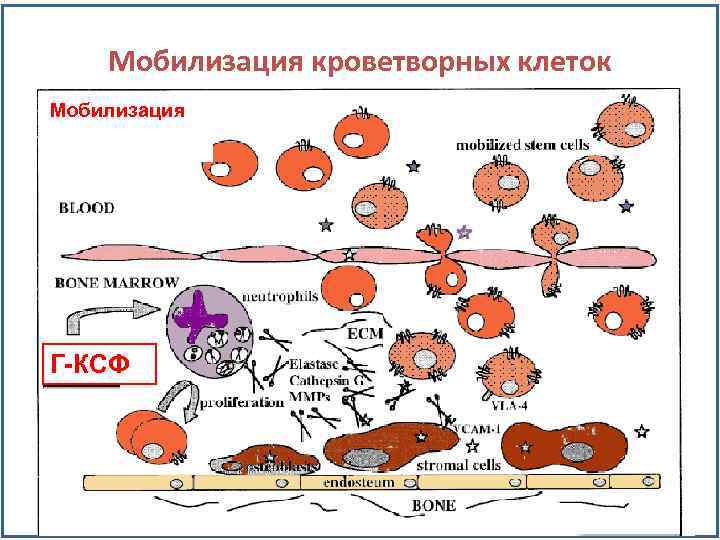 Мобилизация кроветворных клеток Мобилизация Кровь Костный мозг Г-КСФ
Мобилизация кроветворных клеток Мобилизация Кровь Костный мозг Г-КСФ
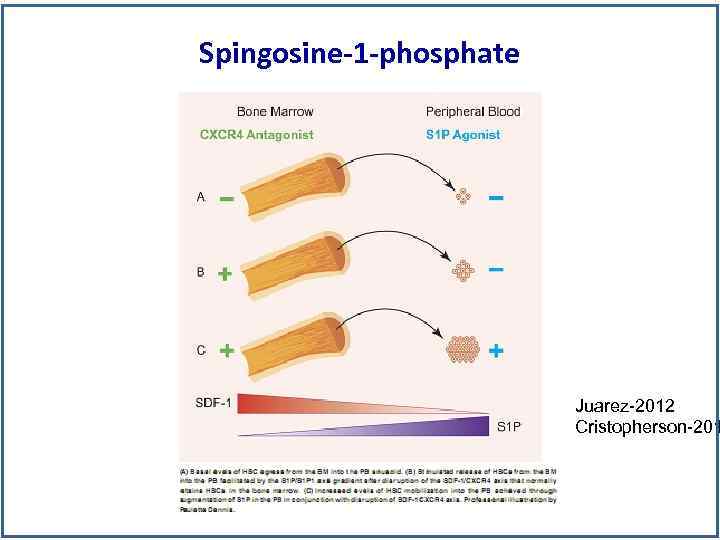 Spingosine-1 -phosphate Juarez-2012 Cristopherson-201
Spingosine-1 -phosphate Juarez-2012 Cristopherson-201
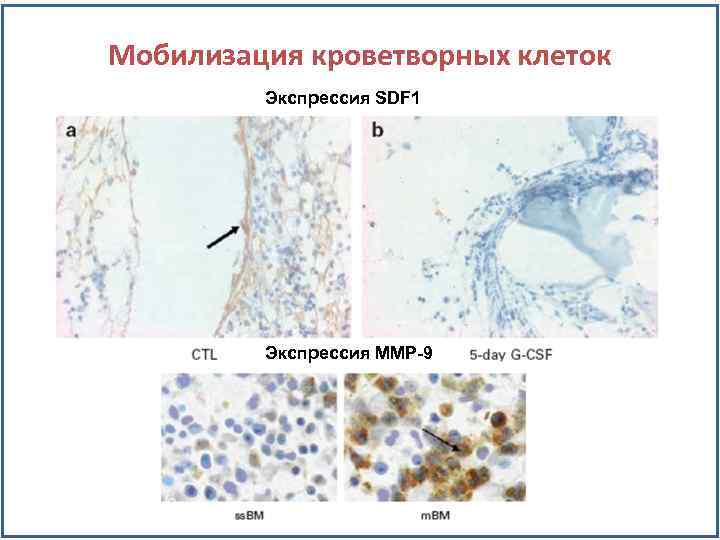 Мобилизация кроветворных клеток Экспрессия SDF 1 Экспрессия MMP-9
Мобилизация кроветворных клеток Экспрессия SDF 1 Экспрессия MMP-9
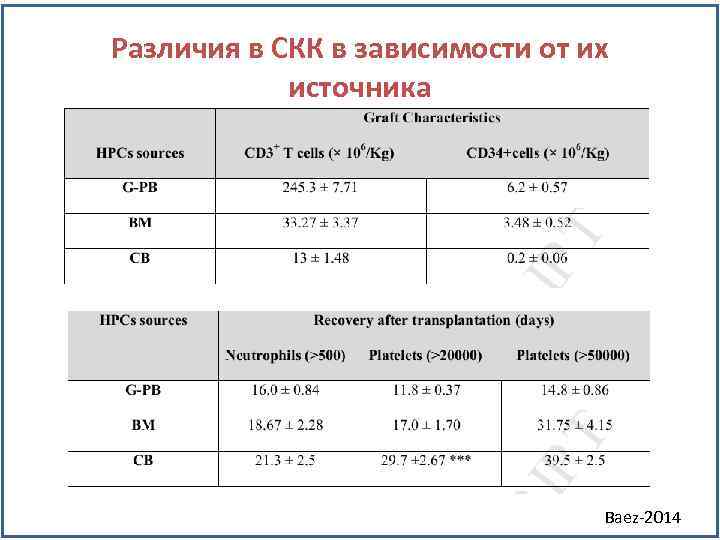 Различия в СКК в зависимости от их источника Baez-2014
Различия в СКК в зависимости от их источника Baez-2014
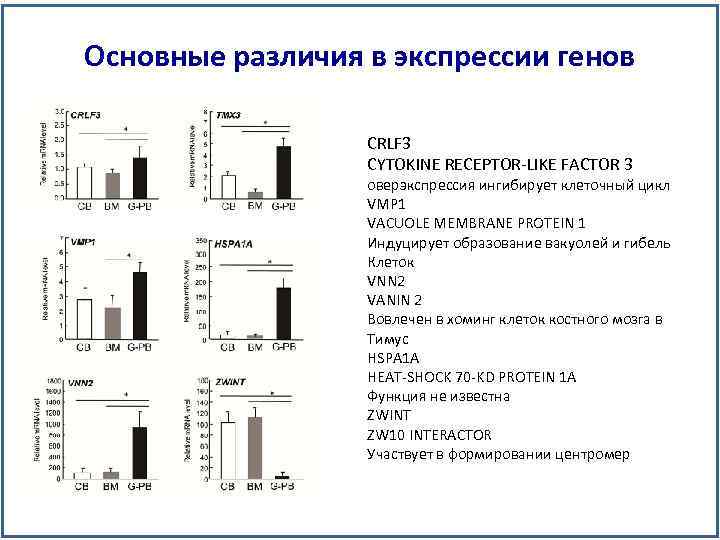 Основные различия в экспрессии генов CRLF 3 CYTOKINE RECEPTOR-LIKE FACTOR 3 оверэкспрессия ингибирует клеточный цикл VMP 1 VACUOLE MEMBRANE PROTEIN 1 Индуцирует образование вакуолей и гибель Клеток VNN 2 VANIN 2 Вовлечен в хоминг клеток костного мозга в Тимус HSPA 1 A HEAT-SHOCK 70 -KD PROTEIN 1 A Функция не известна ZWINT ZW 10 INTERACTOR Участвует в формировании центромер
Основные различия в экспрессии генов CRLF 3 CYTOKINE RECEPTOR-LIKE FACTOR 3 оверэкспрессия ингибирует клеточный цикл VMP 1 VACUOLE MEMBRANE PROTEIN 1 Индуцирует образование вакуолей и гибель Клеток VNN 2 VANIN 2 Вовлечен в хоминг клеток костного мозга в Тимус HSPA 1 A HEAT-SHOCK 70 -KD PROTEIN 1 A Функция не известна ZWINT ZW 10 INTERACTOR Участвует в формировании центромер
 Основные различия в экспрессии генов В мобилизованных клетках снижена экспрессия (GHDC, IGLL 1, KIAA 0101, PDE 4 B, PHIP, SVOPL, TUBB 2 A, TYMS, ZFP 91, ZWINT) повышена экспрессия (AHNAK, DPYSL 3, GABRA 1, HIST 2 H 2 BE, HOXA 9, HSPA 1 A, IDS, LMNA, NACAD, NEAT 1, NKX 2 -1, NR 1 H 3, TPM 2 and ZBTB 20) большинство генов вовлечены в регуляцию клеточного цикла, роста и пролиферации клеток, выживание, дифференцировку и иммунный ответ.
Основные различия в экспрессии генов В мобилизованных клетках снижена экспрессия (GHDC, IGLL 1, KIAA 0101, PDE 4 B, PHIP, SVOPL, TUBB 2 A, TYMS, ZFP 91, ZWINT) повышена экспрессия (AHNAK, DPYSL 3, GABRA 1, HIST 2 H 2 BE, HOXA 9, HSPA 1 A, IDS, LMNA, NACAD, NEAT 1, NKX 2 -1, NR 1 H 3, TPM 2 and ZBTB 20) большинство генов вовлечены в регуляцию клеточного цикла, роста и пролиферации клеток, выживание, дифференцировку и иммунный ответ.


