Глушен Kostiunina.ppt
- Количество слайдов: 22

Дифференцировка мезенхимальных стволовых клеток в фибриновом геле Магистерская диссертация Костюниной В. С. Научные руководители: к. б. н. , доцент Глушен С. В. Биологический факультет БГУ к. х. н. , вед. научн. сотр. Петевка Н. В. ГУ РНПЦ гематологии и трансфузиологии

Цель работы: v получение трёхмерной конструкции на основе фибринового геля как носителя для мультипотентных мезенхимальных стромальных клеток человека (ММСК) и изучение их хондрогенного потенциала под воздействием регуляторных факторов.

Задачи: v v получить конструкции фибринового геля с различной концентрацией фибриногена и оценить жизнеспособность включенных в них клеток; охарактеризовать эффективность хондрогенной дифференцировки в гелях с различной концентрацией фибриногена по продукции клетками веществ, специфических для хондрогенной дифференцировки; выявить оптимальные комбинации дифференцировочных факторов для индукции хондрогенеза; провести сравнительный анализ дифференцировочного потенциала двух типов клеток − ММСК КМ и клеток предшественников хондроцитов (КПХ).

Получение клетокпредшественников хондроцитов Фрагмент нативного хряща Хрящ, обработанный коллагеназой Высев клеток из экспланта хрящевой ткани

Морфология клеток-предшественников хряща и мультипотентных мезенхимальных стволовых клеток КПХ ММСК КМ

Фенотипическая характеристика ММСК КМ и КПХ Источник Иммунофенотипические маркеры (%) клеток CD 34 CD 45 CD 90 CD 105 Костный 0, 18 0, 25 99, 1 98, 4 мозг КПХ 1, 2 0, 7 96, 7 98, 5

Экспрессия маркеров хондрогенеза в дифференцированных клетках хряща 1 - β-2 -микроглобулин (ген домашнего хозяйства) 2 - аггрекан 3 - коллаген II типа 4 - коллаген I типа

Количественная оценка экспрессии хондрогенных маркеров ММСК КМ и КПХ по отношению к дифференцированным клеткам хряща

Морфология ММСК КМ в фибриновом геле 8 мг/мл фибриногена 2 мг/мл фибриногена

Высев клеток из фибриновой конструции и фрагмента хрящевой ткани Фибриновая конструкция Хрящевая ткань

Исследование хондрогенной дифференцировки, индуцируемой различными сочетаниями регуляторных факторов v 10 нг/мл TGFβ 3, 100 нг/мл BMP-6 v 10 нг/мл TGFβ 1, 10 нг/мл TGFβ 3 v 20 нг/мл TGFβ 1. TGFβ – Transforming growth factor beta – трансформирующий фактор роста β BMP – Bone morphogenetic protein – белок морфогенеза кости

Индукция хондрогенеза ММСК КМ альциановый синий (1, 4), толуидиновый синий (2, 6), сафранин О (3, 5)

Сравнение эффективности протоколов хондродифференцировки ММСК КМ (2 мг/мл ФГ)

Сравнение эффективности протоколов хондродифференцировки ММСК КМ (8 мг/мл ФГ)
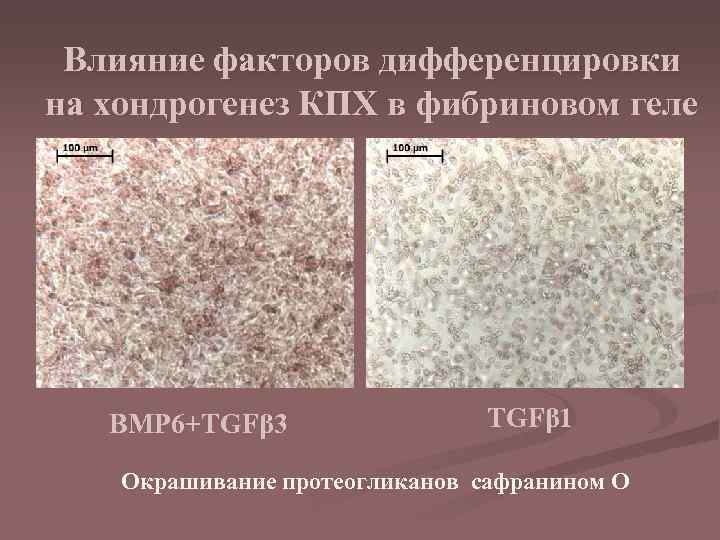
Влияние факторов дифференцировки на хондрогенез КПХ в фибриновом геле BMP 6+TGFβ 3 TGFβ 1 Окрашивание протеогликанов сафранином О
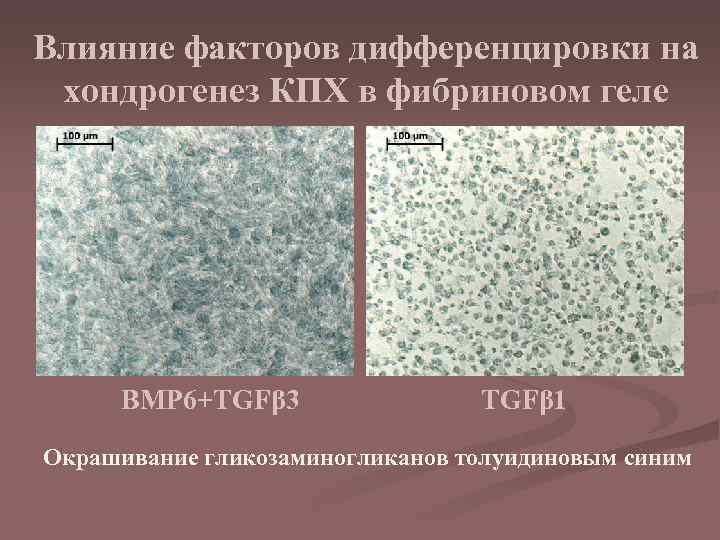
Влияние факторов дифференцировки на хондрогенез КПХ в фибриновом геле BMP 6+TGFβ 3 TGFβ 1 Окрашивание гликозаминогликанов толуидиновым синим
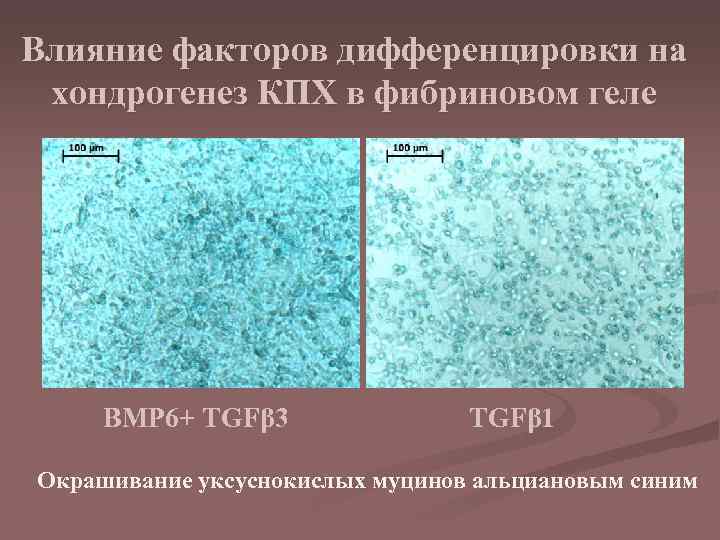
Влияние факторов дифференцировки на хондрогенез КПХ в фибриновом геле BMP 6+ TGFβ 3 TGFβ 1 Окрашивание уксуснокислых муцинов альциановым синим

Сравнение дифференцировочного потенциала КПХ и ММСК КМ в составе конструкций 5. 0 протеогликаны 4. 5 гликозаминогликаны О. П. КПХ/О. П. ММСК КМ 4. 0 кислые мукоидные вещества 3. 5 3. 0 2. 5 2. 0 1. 5 1. 0 0. 5 0. 0 BMP 6 + TGFβ 3

Влияние плотности фибринового геля на дифференцировку ММСК КМ Окрашивание гликозаминогликанов толуидиновым синим

Влияние плотности фибринового геля на дифференцировку ММСК КМ Окрашивание уксуснокислых муцинов альциановым синим

ВЫВОДЫ v v v В результате проведенных исследований показана возможность создания биодеградируемой конструкции-носителя стволовых клеток, пригодной для их доставки в место повреждения плотных тканей (на основе гемостатического препарата «Фибриностат» производства ГУ РНПЦ ГТ). Показана возможность получения методом высева из эксплантов хрящевой ткани человека длительно (до 10 пассажей) пролиферирующих клеток (КПХ), прекоммитированных по сравнению с ММСК КМ в хондрогенном направлении, но отличающихся от зрелых хондроцитов профилем экспрессии специфических маркеров – аггрекана и коллагенов I-го и II-го типов. Показана способность ММСК КМ и КПХ, заключенных в фибриновый гель отвечать на стимулы дифференцировки в хондрогенном направлении. Показано влияние плотности матрицы-носителя на жизнеспособность и эффективность хондрогенеза как ММСК КМ, так и КПХ. Показано, что наилучшие показатели эффективности cреди исследованных комбинаций дифференцировочных факторов для индукции хондрогенеза в фибриновом геле получены при использовании TGFβ 3 в сочетании с BMP 6 Дифференцировка КПХ в фибриновом матриксе более выражена по сравнению с ММСК КМ, что может иметь в дальнейшем преимущество при их использовании в клеточной терапии повреждений хрящевой ткани.

Спасибо за внимание!
Глушен Kostiunina.ppt