физкал.Лекция ЗФО ФКХ Термический анализ.pptx
- Количество слайдов: 34
 ДИАГРАММЫ СОСТОЯНИЯ И ТЕРМИЧЕСКИЙ АНАЛИЗ. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ. 1. Фазовое равновесие. Правило фаз Гиббса. 2. Понятие термического анализа. 3. Диаграмма состояния однокомпонентной системы. 4. Диаграммы состояния двухкомпонентных систем. 5. Коллигативные свойства растворов.
ДИАГРАММЫ СОСТОЯНИЯ И ТЕРМИЧЕСКИЙ АНАЛИЗ. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ. 1. Фазовое равновесие. Правило фаз Гиббса. 2. Понятие термического анализа. 3. Диаграмма состояния однокомпонентной системы. 4. Диаграммы состояния двухкомпонентных систем. 5. Коллигативные свойства растворов.
 ФАЗОВОЕ РАВНОВЕСИЕ. Фаза – часть гетерогенной системы, ограниченная поверхностью раздела и характеризующаяся отсутствием сил внешнего поля, одинаковыми физическими и химическими свойствами во всех своих точках. Составляющее вещество – вещество, которое можно выделить из системы и которое способно существовать вне системы. Компонент – химически однородная составная часть системы, которая может быть выделена из системы и существовать вне ее.
ФАЗОВОЕ РАВНОВЕСИЕ. Фаза – часть гетерогенной системы, ограниченная поверхностью раздела и характеризующаяся отсутствием сил внешнего поля, одинаковыми физическими и химическими свойствами во всех своих точках. Составляющее вещество – вещество, которое можно выделить из системы и которое способно существовать вне системы. Компонент – химически однородная составная часть системы, которая может быть выделена из системы и существовать вне ее.
 Ø Если вещества, образующие систему, не взаимодействуют друг с другом, то число компонентов равно числу веществ в системе. Ø При химических взаимодействиях число компонентов меньше числа составляющих веществ на число связей q. q - число независимых уравнений реакции
Ø Если вещества, образующие систему, не взаимодействуют друг с другом, то число компонентов равно числу веществ в системе. Ø При химических взаимодействиях число компонентов меньше числа составляющих веществ на число связей q. q - число независимых уравнений реакции
 Число степеней свободы – число параметров состояния системы, которые могут быть одновременно произвольно изменены в некоторых пределах без изменения числа и природы фаз в системе. Правило фаз Гиббса: Число степеней свободы равновесной термодинамической системы (С) равно числу независимых компонентов системы (К) минус число фаз (Ф) плюс число внешних факторов (n), влияющих на равновесие. С = К – Ф + n
Число степеней свободы – число параметров состояния системы, которые могут быть одновременно произвольно изменены в некоторых пределах без изменения числа и природы фаз в системе. Правило фаз Гиббса: Число степеней свободы равновесной термодинамической системы (С) равно числу независимых компонентов системы (К) минус число фаз (Ф) плюс число внешних факторов (n), влияющих на равновесие. С = К – Ф + n
 С = К – Ф + n С =2 - система бивариантная С =1 - система моновариантная С =0 - система инвариантная Фазовый переход – изменение агрегатного состояния вещества (переход из одного состояния в другое) при изменении внешних параметров (температуры, давления).
С = К – Ф + n С =2 - система бивариантная С =1 - система моновариантная С =0 - система инвариантная Фазовый переход – изменение агрегатного состояния вещества (переход из одного состояния в другое) при изменении внешних параметров (температуры, давления).
 ТЕРМИЧЕСКИЙ АНАЛИЗ это метод определения зависимости температур плавления или кристаллизации от состава, основанный на изучении скорости охлаждения расплавов. визуальный метод; применима в области невысоких температур и в небольшом температурном интервале метод кривых (время – t 0 C). более универсален
ТЕРМИЧЕСКИЙ АНАЛИЗ это метод определения зависимости температур плавления или кристаллизации от состава, основанный на изучении скорости охлаждения расплавов. визуальный метод; применима в области невысоких температур и в небольшом температурном интервале метод кривых (время – t 0 C). более универсален
 Построение кривых и их анализ осуществляется по двум принципам Курнакова: принцип непрерывности при непрерывном изменении параметров, определяющих состояние системы, свойства отдельных фаз изменяются также непрерывно, свойства же всей системы в целом изменяются непрерывно лишь до тех пор, пока не меняется число или природа ее фаз принцип соответствия на диаграмме состояния при равновесии каждому комплексу фаз и каждой фазе в отдельности соответствует свой геометрический образ: плоскость, линия, точка.
Построение кривых и их анализ осуществляется по двум принципам Курнакова: принцип непрерывности при непрерывном изменении параметров, определяющих состояние системы, свойства отдельных фаз изменяются также непрерывно, свойства же всей системы в целом изменяются непрерывно лишь до тех пор, пока не меняется число или природа ее фаз принцип соответствия на диаграмме состояния при равновесии каждому комплексу фаз и каждой фазе в отдельности соответствует свой геометрический образ: плоскость, линия, точка.
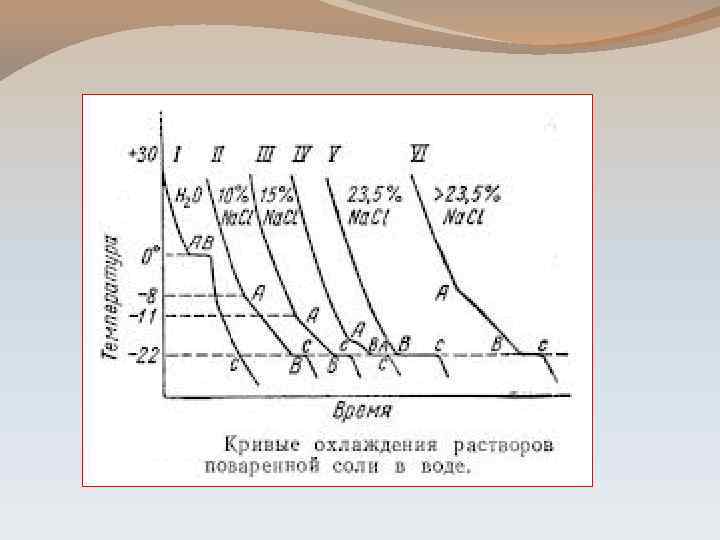
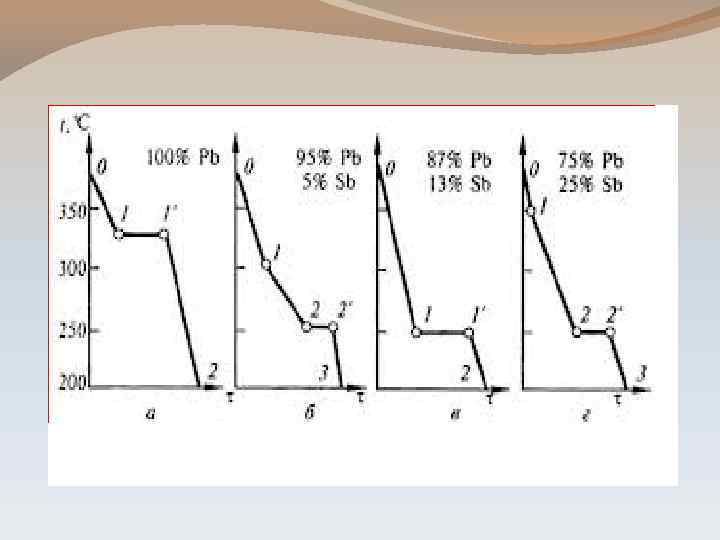
 ЭТАПЫ ТЕРМИЧЕСКОГО АНАЛИЗА: 1 ЭТАП: Построение кривых охлаждения. - это кривые, изображающие зависимость температуры системы от времени её охлаждения (Т-t) - по остановкам и перегибам этих кривых, вызванных тепловым эффектом превращений, определяют температуру превращения
ЭТАПЫ ТЕРМИЧЕСКОГО АНАЛИЗА: 1 ЭТАП: Построение кривых охлаждения. - это кривые, изображающие зависимость температуры системы от времени её охлаждения (Т-t) - по остановкам и перегибам этих кривых, вызванных тепловым эффектом превращений, определяют температуру превращения
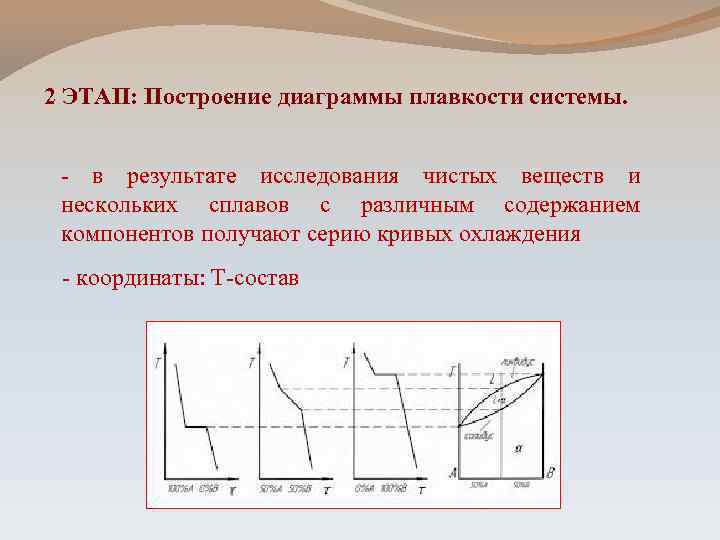 2 ЭТАП: Построение диаграммы плавкости системы. - в результате исследования чистых веществ и нескольких сплавов с различным содержанием компонентов получают серию кривых охлаждения - координаты: Т-состав
2 ЭТАП: Построение диаграммы плавкости системы. - в результате исследования чистых веществ и нескольких сплавов с различным содержанием компонентов получают серию кривых охлаждения - координаты: Т-состав
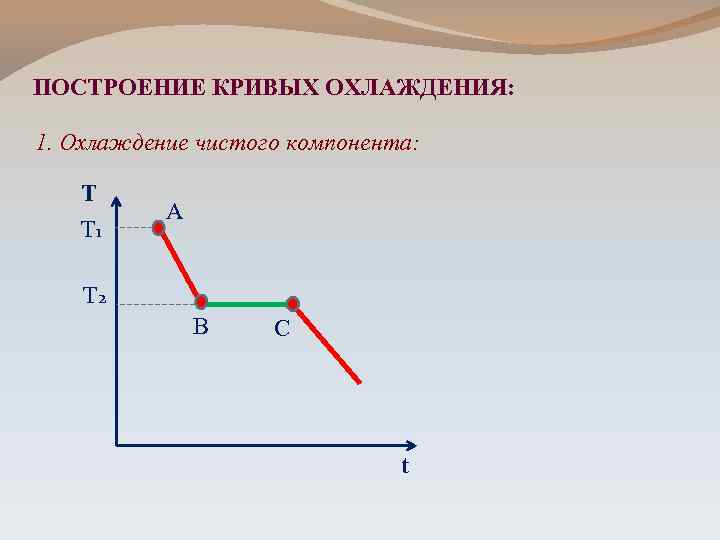 ПОСТРОЕНИЕ КРИВЫХ ОХЛАЖДЕНИЯ: 1. Охлаждение чистого компонента: Т Т 1 А Т 2 В С t
ПОСТРОЕНИЕ КРИВЫХ ОХЛАЖДЕНИЯ: 1. Охлаждение чистого компонента: Т Т 1 А Т 2 В С t
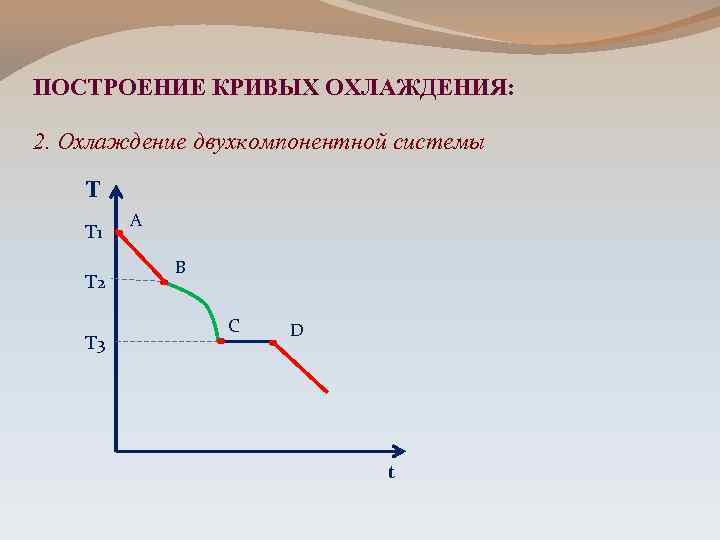 ПОСТРОЕНИЕ КРИВЫХ ОХЛАЖДЕНИЯ: 2. Охлаждение двухкомпонентной системы Т Т 1 Т 2 Т 3 А В С D t
ПОСТРОЕНИЕ КРИВЫХ ОХЛАЖДЕНИЯ: 2. Охлаждение двухкомпонентной системы Т Т 1 Т 2 Т 3 А В С D t
 ПОСТРОЕНИЕ ДИАГРАММ СОСТОЯНИЯ Для систем с фазовыми переходами обычно рассматривают графическую зависимость состояния системы от внешних условий – т. н. диаграммы состояния. Диаграммы состояния - геометрическое построение, устанавливающее связь между: а) свойствами системы и внешними факторами; б) свойствами составом системы.
ПОСТРОЕНИЕ ДИАГРАММ СОСТОЯНИЯ Для систем с фазовыми переходами обычно рассматривают графическую зависимость состояния системы от внешних условий – т. н. диаграммы состояния. Диаграммы состояния - геометрическое построение, устанавливающее связь между: а) свойствами системы и внешними факторами; б) свойствами составом системы.
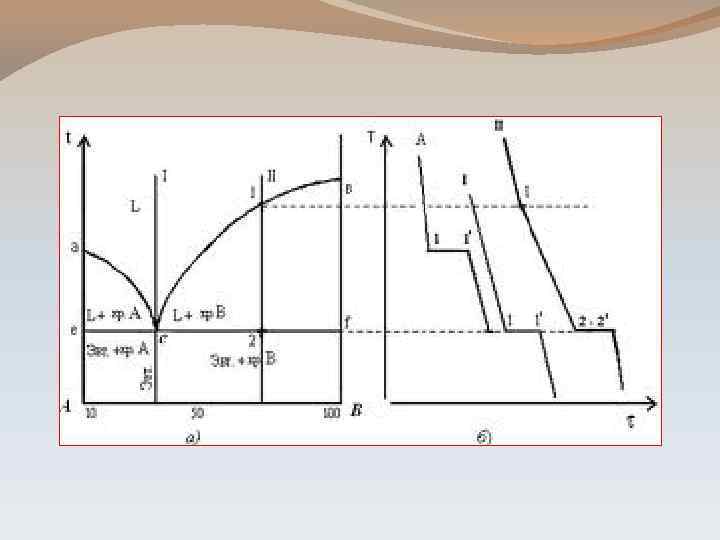
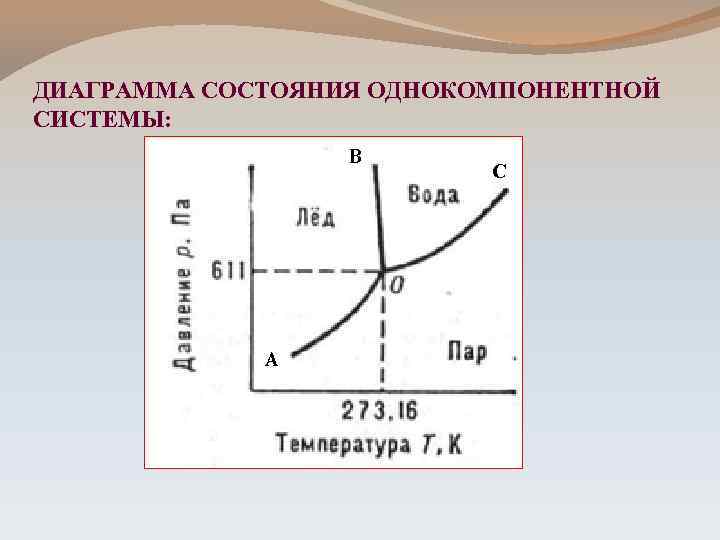 ДИАГРАММА СОСТОЯНИЯ ОДНОКОМПОНЕНТНОЙ СИСТЕМЫ: В А С
ДИАГРАММА СОСТОЯНИЯ ОДНОКОМПОНЕНТНОЙ СИСТЕМЫ: В А С
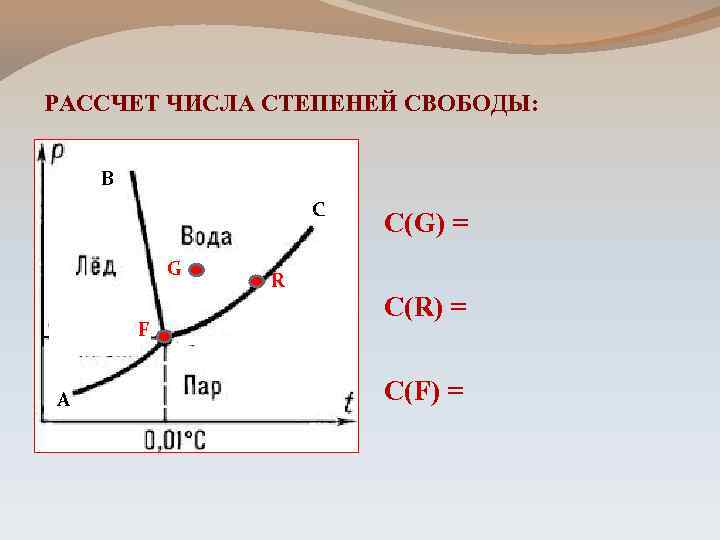 РАССЧЕТ ЧИСЛА СТЕПЕНЕЙ СВОБОДЫ: В С G F А R C(G) = C(R) = C(F) =
РАССЧЕТ ЧИСЛА СТЕПЕНЕЙ СВОБОДЫ: В С G F А R C(G) = C(R) = C(F) =
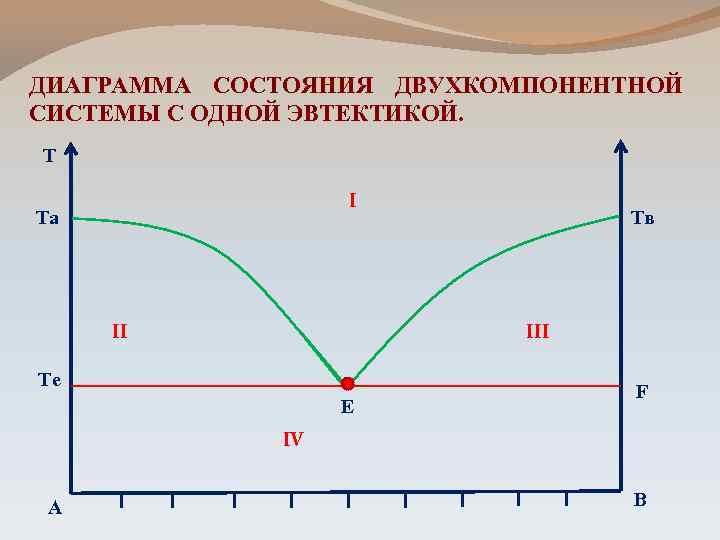 ДИАГРАММА СОСТОЯНИЯ ДВУХКОМПОНЕНТНОЙ СИСТЕМЫ С ОДНОЙ ЭВТЕКТИКОЙ. Т I Та II Тв III Те Е F IV А В
ДИАГРАММА СОСТОЯНИЯ ДВУХКОМПОНЕНТНОЙ СИСТЕМЫ С ОДНОЙ ЭВТЕКТИКОЙ. Т I Та II Тв III Те Е F IV А В
 Эвтектический расплав – расплав, состав которого соответствует точке эвтектики Эвтектическая температура соответствующая точке эвтектики – температура, Твердая эвтектика - смесь кристаллов А и В, которая одновременно выпадает при эвтектической температуре - две фазы, равномерно распределенные мельчайшие кристаллы обоих компонентов
Эвтектический расплав – расплав, состав которого соответствует точке эвтектики Эвтектическая температура соответствующая точке эвтектики – температура, Твердая эвтектика - смесь кристаллов А и В, которая одновременно выпадает при эвтектической температуре - две фазы, равномерно распределенные мельчайшие кристаллы обоих компонентов
 КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ - свойства растворов, зависящие от количества имеющихся молекул или ионов растворенного вещества (количества кинетических единиц) и от их теплового движения, а не от природы растворенных частиц. 1. Понижение давления пара растворителя 2. Повышение температуры кипения растворителя 3. Понижение температуры замерзания растворителя 4. Явления осмотического давления.
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ - свойства растворов, зависящие от количества имеющихся молекул или ионов растворенного вещества (количества кинетических единиц) и от их теплового движения, а не от природы растворенных частиц. 1. Понижение давления пара растворителя 2. Повышение температуры кипения растворителя 3. Понижение температуры замерзания растворителя 4. Явления осмотического давления.
 Уравнения, описывающие коллигативные свойства растворов, достаточно точны для большинства разбавленных растворов!!! 1. Коллигативные свойства позволили Аррениусу показать, что в растворе содержится больше частиц, чем имелось в наличии молекул растворенного вещества. 2. Коллигативные свойства позволили судить о числе частиц имеющегося в наличии растворенного вещества, а следовательно, о его молекулярной массе и степени ионизации в растворе.
Уравнения, описывающие коллигативные свойства растворов, достаточно точны для большинства разбавленных растворов!!! 1. Коллигативные свойства позволили Аррениусу показать, что в растворе содержится больше частиц, чем имелось в наличии молекул растворенного вещества. 2. Коллигативные свойства позволили судить о числе частиц имеющегося в наличии растворенного вещества, а следовательно, о его молекулярной массе и степени ионизации в растворе.
 ПОНИЖЕНИЕ ДАВЛЕНИЯ ПАРА РАСТВОРИТЕЛЯ Насыщенный пар – пар над жидкостью в состоянии равновесия. Давление насыщенного пара – характерная величина для данного вещества и зависит от температуры. ØЕсли в жидкости растворены нелетучие вещества, то давление ее пара понижается!
ПОНИЖЕНИЕ ДАВЛЕНИЯ ПАРА РАСТВОРИТЕЛЯ Насыщенный пар – пар над жидкостью в состоянии равновесия. Давление насыщенного пара – характерная величина для данного вещества и зависит от температуры. ØЕсли в жидкости растворены нелетучие вещества, то давление ее пара понижается!
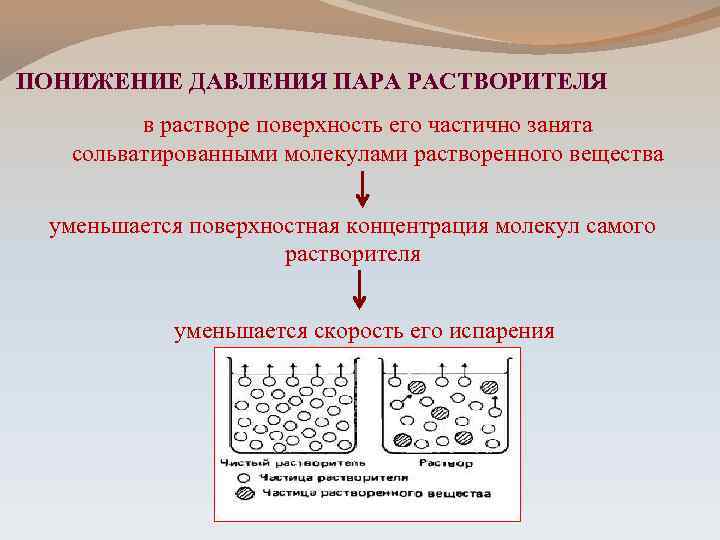 ПОНИЖЕНИЕ ДАВЛЕНИЯ ПАРА РАСТВОРИТЕЛЯ в растворе поверхность его частично занята сольватированными молекулами растворенного вещества уменьшается поверхностная концентрация молекул самого растворителя уменьшается скорость его испарения
ПОНИЖЕНИЕ ДАВЛЕНИЯ ПАРА РАСТВОРИТЕЛЯ в растворе поверхность его частично занята сольватированными молекулами растворенного вещества уменьшается поверхностная концентрация молекул самого растворителя уменьшается скорость его испарения
 ПОНИЖЕНИЕ ДАВЛЕНИЯ ПАРА РАСТВОРИТЕЛЯ ΔР = Р 0 - Р • Понижение давления пара раствора прямо пропорционально мольной доле растворенного вещества в растворе или пропорционально отношению числа молей растворенного вещества к общему числу молей, содержащихся в растворе
ПОНИЖЕНИЕ ДАВЛЕНИЯ ПАРА РАСТВОРИТЕЛЯ ΔР = Р 0 - Р • Понижение давления пара раствора прямо пропорционально мольной доле растворенного вещества в растворе или пропорционально отношению числа молей растворенного вещества к общему числу молей, содержащихся в растворе
 ПЕРВЫЙ ЗАКОН РАУЛЯ: 1886 -1887 г. г. Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества Nв-ва. ΔР = Р 0 Nв-ва
ПЕРВЫЙ ЗАКОН РАУЛЯ: 1886 -1887 г. г. Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества Nв-ва. ΔР = Р 0 Nв-ва
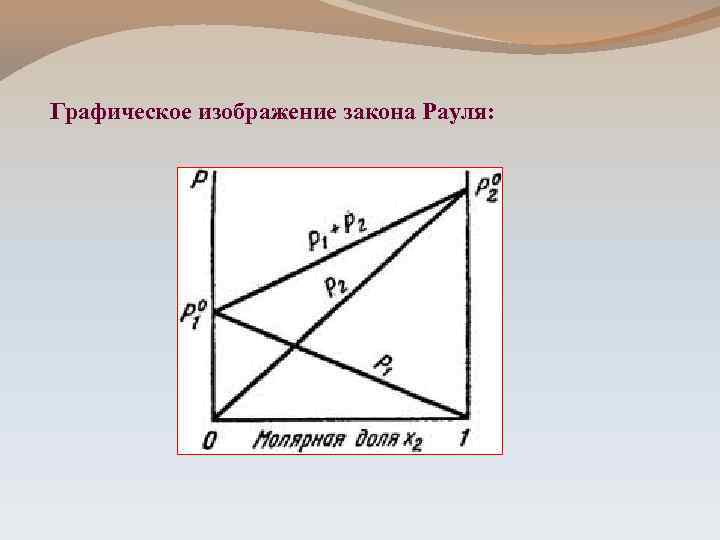 Графическое изображение закона Рауля:
Графическое изображение закона Рауля:
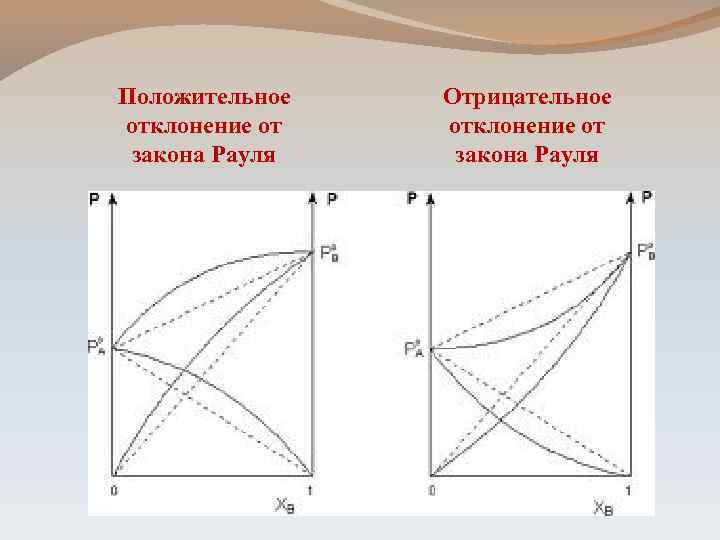 Положительное отклонение от закона Рауля Отрицательное отклонение от закона Рауля
Положительное отклонение от закона Рауля Отрицательное отклонение от закона Рауля
 Положительное отклонение от закона Рауля Отрицательное отклонение от закона Рауля 1. Взаимодействие между одноименными молекулами больше, чем между разноименными 1. Взаимодействие между разноименными молекулами больше, чем между одноименными 2. Выход в паровую фазу облегчен 3. ПРИМЕРЫ: - вода-метанол - ССl 4 – бензол - вода – ацетон - ССl 4 – метил-бензол 2. Выход в паровую фазу затруднен 3. ПРИМЕРЫ: - вода-азотная кислота - вода- соляная кислота - ацетон-хлорметил - бензол-хлорметил
Положительное отклонение от закона Рауля Отрицательное отклонение от закона Рауля 1. Взаимодействие между одноименными молекулами больше, чем между разноименными 1. Взаимодействие между разноименными молекулами больше, чем между одноименными 2. Выход в паровую фазу облегчен 3. ПРИМЕРЫ: - вода-метанол - ССl 4 – бензол - вода – ацетон - ССl 4 – метил-бензол 2. Выход в паровую фазу затруднен 3. ПРИМЕРЫ: - вода-азотная кислота - вода- соляная кислота - ацетон-хлорметил - бензол-хлорметил
 ИМЕНЕНИЕ ТЕМПЕРАТУР КИПЕНИЯ И ЗАМЕРЗАНИЯ РАСТВОРОВ Понижение давления пара над растворами приводит к тому, что они кипят и замерзают при температурах, отличающихся от соответствующих температур для чистых растворителей. Жидкость закипает, когда давление ее насыщенного пара становится равным внешнему давлению Жидкость кристаллизуется, когда давление ее насыщенных паров становится равной давлению над твердой фазой, в которую она переходит
ИМЕНЕНИЕ ТЕМПЕРАТУР КИПЕНИЯ И ЗАМЕРЗАНИЯ РАСТВОРОВ Понижение давления пара над растворами приводит к тому, что они кипят и замерзают при температурах, отличающихся от соответствующих температур для чистых растворителей. Жидкость закипает, когда давление ее насыщенного пара становится равным внешнему давлению Жидкость кристаллизуется, когда давление ее насыщенных паров становится равной давлению над твердой фазой, в которую она переходит
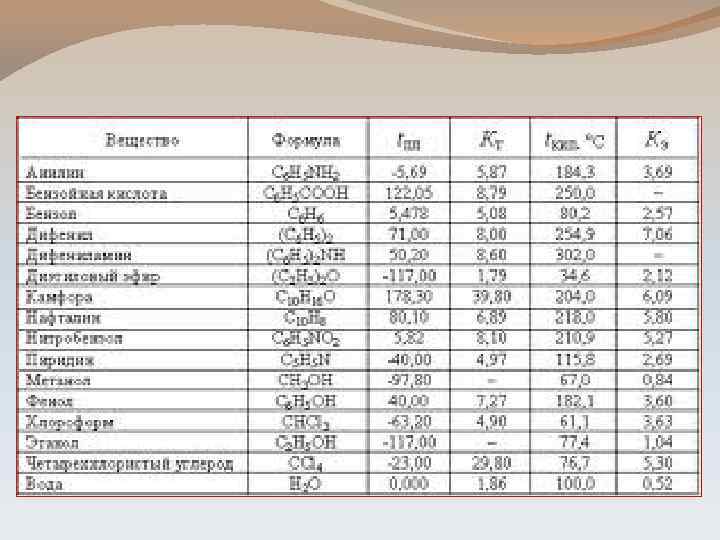
 Раствор какого-либо вещества будет замерзать при температуре более низкой, чем вода. Тз р-ля > Тз р-ра Тз р-ля - Тз р-ра = ∆ Тз ∆Тз = К См К – криоскопическая константа
Раствор какого-либо вещества будет замерзать при температуре более низкой, чем вода. Тз р-ля > Тз р-ра Тз р-ля - Тз р-ра = ∆ Тз ∆Тз = К См К – криоскопическая константа
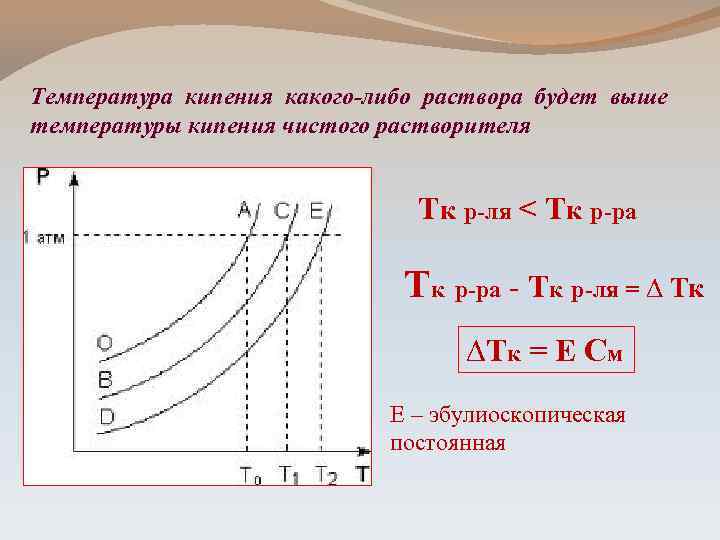 Температура кипения какого-либо раствора будет выше температуры кипения чистого растворителя Тк р-ля < Тк р-ра - Тк р-ля = ∆ Тк ∆Тк = Е См Е – эбулиоскопическая постоянная
Температура кипения какого-либо раствора будет выше температуры кипения чистого растворителя Тк р-ля < Тк р-ра - Тк р-ля = ∆ Тк ∆Тк = Е См Е – эбулиоскопическая постоянная
 ВТОРОЙ ЗАКОН РАУЛЯ: Повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем пропорциональны моляльной концентрации растворенного вещества.
ВТОРОЙ ЗАКОН РАУЛЯ: Повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем пропорциональны моляльной концентрации растворенного вещества.
 СПАСИБО ЗА ВНИМАНИЕ!
СПАСИБО ЗА ВНИМАНИЕ!


