СЕПСИС_2015.pptx
- Количество слайдов: 176
 ДИАГНОСТИКА И ИНТЕНСИВНАЯ ТЕРАПИЯ СЕПСИСА НОВОРОЖДЕННЫХ Пшениснов К. В. Санкт-Петербургский государственный педиатрический медицинский университет Кафедра анестезиологии-реаниматологии и неотложной педиатрии Санкт-Петербург, Россия
ДИАГНОСТИКА И ИНТЕНСИВНАЯ ТЕРАПИЯ СЕПСИСА НОВОРОЖДЕННЫХ Пшениснов К. В. Санкт-Петербургский государственный педиатрический медицинский университет Кафедра анестезиологии-реаниматологии и неотложной педиатрии Санкт-Петербург, Россия
 ЭПИДЕМИОЛОГИЯ СЕПСИСА • Ежегодно, почти 11 миллионов детей умирают, не доживая до 5 летнего возраста. • По данным экспертов ВОЗ ежегодно во всем мире от инфекции умирает 1, 6 миллионов новорожденных (Lawn J. E. et al. , 2005). • Шестьдесят процентов летальных исходов у пациентов всех возрастных категорий в развивающихся странах обусловлено заразными заболеваниями. • Синдром системного воспалительного ответа и сепсис являются основной причиной прогрессирования патологического процесса детей в критическом состоянии. • Наличие синдрома системного воспалительного ответа, сепсиса, или септического шока увеличивает риск смертности у детей в критическом состоянии • Летальность при развитии сепсиса составляет 28 -50%, а пр развитии синдрома полиорганной недостаточности достигает 80 -90%
ЭПИДЕМИОЛОГИЯ СЕПСИСА • Ежегодно, почти 11 миллионов детей умирают, не доживая до 5 летнего возраста. • По данным экспертов ВОЗ ежегодно во всем мире от инфекции умирает 1, 6 миллионов новорожденных (Lawn J. E. et al. , 2005). • Шестьдесят процентов летальных исходов у пациентов всех возрастных категорий в развивающихся странах обусловлено заразными заболеваниями. • Синдром системного воспалительного ответа и сепсис являются основной причиной прогрессирования патологического процесса детей в критическом состоянии. • Наличие синдрома системного воспалительного ответа, сепсиса, или септического шока увеличивает риск смертности у детей в критическом состоянии • Летальность при развитии сепсиса составляет 28 -50%, а пр развитии синдрома полиорганной недостаточности достигает 80 -90%
 ЭПИДЕМИОЛОГИЯ СЕПСИСА • В год диагностируется 300– 500 тыс. случаев сепсиса, при этом шок развивается примерно у 40% пациентов • Прогнозируемый рост заболеваемости 1, 5 % в год • Экономический эквивалент лечения сепсиса 22 100 $ на пациента • Одной из наиболее частых причин развития сепсиса в педиатрических ОАРИТ является нозокомиальная инфекция
ЭПИДЕМИОЛОГИЯ СЕПСИСА • В год диагностируется 300– 500 тыс. случаев сепсиса, при этом шок развивается примерно у 40% пациентов • Прогнозируемый рост заболеваемости 1, 5 % в год • Экономический эквивалент лечения сепсиса 22 100 $ на пациента • Одной из наиболее частых причин развития сепсиса в педиатрических ОАРИТ является нозокомиальная инфекция
 Эпидемиология сепсиса у детского населения США R. Scott Watson, Joseph A. Carcillo, Walter T. Linde-Zwirble, Gilles Clermont, Jeffrey Lidicker, and Derek C. Angus «The Epidemiology of Severe Sepsis in Children in the United States» AMERICAN JOURNAL OF RESPIRATORY AND CRITICAL CARE MEDICINE VOL 167 2003
Эпидемиология сепсиса у детского населения США R. Scott Watson, Joseph A. Carcillo, Walter T. Linde-Zwirble, Gilles Clermont, Jeffrey Lidicker, and Derek C. Angus «The Epidemiology of Severe Sepsis in Children in the United States» AMERICAN JOURNAL OF RESPIRATORY AND CRITICAL CARE MEDICINE VOL 167 2003
 ЧАСТОТА ТЯЖЕЛОГО СЕПСИСА В ГЕРМАНИИ Население 82, 3 млн. 1 Число диагностированных случаев сепсиса в год 86. 6002 Число тяжелых случаев сепсиса в год в отделении интенсивной терапии ~44. 5003 Sources: 1 The world fact book on www. cia. gov; 2 Datamonitor, Epidemiology: Sepsis, 2011; 3 van Gestel et al. , 2004 and own calculation 5
ЧАСТОТА ТЯЖЕЛОГО СЕПСИСА В ГЕРМАНИИ Население 82, 3 млн. 1 Число диагностированных случаев сепсиса в год 86. 6002 Число тяжелых случаев сепсиса в год в отделении интенсивной терапии ~44. 5003 Sources: 1 The world fact book on www. cia. gov; 2 Datamonitor, Epidemiology: Sepsis, 2011; 3 van Gestel et al. , 2004 and own calculation 5


 ОСОБЕННОСТИ СОВРЕМЕННОЙ ЭТИОЛОГИИ СЕПСИСА Неферментирующие грамотрицательные бактерии (Pseudomonas aeruginosa, Acinetobacter spp. , Klebsiella pneumonia – продуцент бета-лактамаз расширенного спектра (БЛРС), а также Enterobacter cloacae выступают в роли ведущих возбудителей госпитального сепсиса у пациентов ОРИТ
ОСОБЕННОСТИ СОВРЕМЕННОЙ ЭТИОЛОГИИ СЕПСИСА Неферментирующие грамотрицательные бактерии (Pseudomonas aeruginosa, Acinetobacter spp. , Klebsiella pneumonia – продуцент бета-лактамаз расширенного спектра (БЛРС), а также Enterobacter cloacae выступают в роли ведущих возбудителей госпитального сепсиса у пациентов ОРИТ

 Международная терминология, принятая на конференции Американской Коллегии грудных хирургов и Общества специалистов интенсивной терапии (АССР/SCCM Consensus Conference Committee) США, 1992 Бактериемия Наличие жизнеспособных бактерий в крови. Этиологически значимыми считаются микроорганизмы выделенные из стерильных в норме сред и тканей (крови, СМЖ, экссудатов и биоптатов) или из гнойно-воспалительных очагов (гноя, отделяемого ран и дренажей). ↓ Синдром системной воспалительной реакции (ССВР) Системная воспалительная реакция, на различные тяжелые повреждения тканей, проявляющаяся двумя или более из следующих признаков: 1) температура тела выше 38 о. С или ниже 36 о. С; 2) тахикардия более 90 уд/мин. ; 3) частота дыхания более 20 /мин или Ра. СО 2 ниже 32 мм. рт. ст. 4) число лейкоцитов более 12 * 10 9 /л или менее 4 * 10 9/ л или более 10% молодых их форм. ↓ Сепсис Системная реакция на инфекцию (ССВР при явном выявленном очаге инфекции). Проявляется так же, как ССВР. ↓ Тяжелый сепсис Сепсис, сочетающийся с органной дисфункцией, гипоперфузией или гипотензией. Нарушения перфузии могут включить молочнокислый ацидоз, олигурию или острое нарушение сознания и др. Гипотензия - систолическое артериальное давление ниже 90 мм. рт. ст. или снижение более, чем на 40 мм. рт. ст. по сравнению с обычным уровнем при отсутствии др. причин гипотензии. ↓ Септический шок Сепсис с гипотензией, сохраняющийся, несмотря на адекватную коррекцию гиповолемии + нарушения перфузии (молочнокислый ацидоз, олигурия, нарушение сознания и др. ) ↓ Синдром полиорганной дисфункции (СПД) Нарушение функций органов у больного, находящегося в тяжелом состоянии (самостоятельное, без лечения, поддержание гомеостаза невозможно)
Международная терминология, принятая на конференции Американской Коллегии грудных хирургов и Общества специалистов интенсивной терапии (АССР/SCCM Consensus Conference Committee) США, 1992 Бактериемия Наличие жизнеспособных бактерий в крови. Этиологически значимыми считаются микроорганизмы выделенные из стерильных в норме сред и тканей (крови, СМЖ, экссудатов и биоптатов) или из гнойно-воспалительных очагов (гноя, отделяемого ран и дренажей). ↓ Синдром системной воспалительной реакции (ССВР) Системная воспалительная реакция, на различные тяжелые повреждения тканей, проявляющаяся двумя или более из следующих признаков: 1) температура тела выше 38 о. С или ниже 36 о. С; 2) тахикардия более 90 уд/мин. ; 3) частота дыхания более 20 /мин или Ра. СО 2 ниже 32 мм. рт. ст. 4) число лейкоцитов более 12 * 10 9 /л или менее 4 * 10 9/ л или более 10% молодых их форм. ↓ Сепсис Системная реакция на инфекцию (ССВР при явном выявленном очаге инфекции). Проявляется так же, как ССВР. ↓ Тяжелый сепсис Сепсис, сочетающийся с органной дисфункцией, гипоперфузией или гипотензией. Нарушения перфузии могут включить молочнокислый ацидоз, олигурию или острое нарушение сознания и др. Гипотензия - систолическое артериальное давление ниже 90 мм. рт. ст. или снижение более, чем на 40 мм. рт. ст. по сравнению с обычным уровнем при отсутствии др. причин гипотензии. ↓ Септический шок Сепсис с гипотензией, сохраняющийся, несмотря на адекватную коррекцию гиповолемии + нарушения перфузии (молочнокислый ацидоз, олигурия, нарушение сознания и др. ) ↓ Синдром полиорганной дисфункции (СПД) Нарушение функций органов у больного, находящегося в тяжелом состоянии (самостоятельное, без лечения, поддержание гомеостаза невозможно)


 Современная концепция сепсиса у детей • В феврале 2002 года в городе Сан-Антонио (штат Техас, США) состоялась международная согласительная конференция по педиатрическому сепсису (International Pediatric sepsis consensus conference IPSCC). В рамках работы этой конференции группа из 20 экспертов по сепсису и клиническим исследованиям из 5 стран (Канада, Франция, Нидерланды, Великобритания и США) разработала консенсуальные дефиниции по педиатрическому сепсису (Goldstein B. et al. , 2005).
Современная концепция сепсиса у детей • В феврале 2002 года в городе Сан-Антонио (штат Техас, США) состоялась международная согласительная конференция по педиатрическому сепсису (International Pediatric sepsis consensus conference IPSCC). В рамках работы этой конференции группа из 20 экспертов по сепсису и клиническим исследованиям из 5 стран (Канада, Франция, Нидерланды, Великобритания и США) разработала консенсуальные дефиниции по педиатрическому сепсису (Goldstein B. et al. , 2005).
 СИНДРОМ СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА Возраст ЧСС Тахикардия Брадикардия ЧД Число САД, /мин лейкоцитов, мм рт. ст. x 109/л >50 >34000 <65 >40 >19500 или <75 <5000 0 – 7 дней 1 нед – 1 мес >180 <100 1 мес – 1 год >180 <90 >34 >17500 или <5000 <100 2 – 5 лет >140 – >22 >15500 или <6000 <94 6 – 12 лет >130 – >18 >13500 или <4500 <105 13 – 18 лет >110 – >14 >11000 или <117 <4500
СИНДРОМ СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА Возраст ЧСС Тахикардия Брадикардия ЧД Число САД, /мин лейкоцитов, мм рт. ст. x 109/л >50 >34000 <65 >40 >19500 или <75 <5000 0 – 7 дней 1 нед – 1 мес >180 <100 1 мес – 1 год >180 <90 >34 >17500 или <5000 <100 2 – 5 лет >140 – >22 >15500 или <6000 <94 6 – 12 лет >130 – >18 >13500 или <4500 <105 13 – 18 лет >110 – >14 >11000 или <117 <4500
 СИНДРОМ СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА У НОВОРОЖДЕННЫХ Новорожденные Лабильность - Гипотермия (t 0 C<) температуры тела - Повышение температуры тела > 38, 50 С Дыхательные -Тахипноэ > 2 SD от возрастной нормы расстройства - Гипоксемия (Ра. О 2 < рт. ст. ) при Fi. O 2 = 0, 21 Нарушения сердечной - Тахикардия > 2 SD от возрастной нормы деятельности - Увеличение времени наполнения капилляров (> 3 c) - Артериальная гипотензия (снижение АД> чем на 2 SD от среднего возрастного показателя) Нарушение перфузии - Олигурия (диурез менее 0, 5 мл/кг/час) - Лактат-ацидоз (повышение концентрации лактата плазмы крови или р. Н артериальной крови < 7, 25) - Угнетение сознания
СИНДРОМ СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА У НОВОРОЖДЕННЫХ Новорожденные Лабильность - Гипотермия (t 0 C<) температуры тела - Повышение температуры тела > 38, 50 С Дыхательные -Тахипноэ > 2 SD от возрастной нормы расстройства - Гипоксемия (Ра. О 2 < рт. ст. ) при Fi. O 2 = 0, 21 Нарушения сердечной - Тахикардия > 2 SD от возрастной нормы деятельности - Увеличение времени наполнения капилляров (> 3 c) - Артериальная гипотензия (снижение АД> чем на 2 SD от среднего возрастного показателя) Нарушение перфузии - Олигурия (диурез менее 0, 5 мл/кг/час) - Лактат-ацидоз (повышение концентрации лактата плазмы крови или р. Н артериальной крови < 7, 25) - Угнетение сознания
 СИНДРОМ СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА У НОВОРОЖДЕННЫХ ЧСС Возрастные ЧД /мин Число САД, лейкоцито мм рт. ст. в, x 109/л группы Тахикардия Брадикардия 0 – 7 дней >180 <100 >50 >34000 <65 1 нед – 1 мес >180 <100 >40 >19500 или <5000 <75
СИНДРОМ СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА У НОВОРОЖДЕННЫХ ЧСС Возрастные ЧД /мин Число САД, лейкоцито мм рт. ст. в, x 109/л группы Тахикардия Брадикардия 0 – 7 дней >180 <100 >50 >34000 <65 1 нед – 1 мес >180 <100 >40 >19500 или <5000 <75
 СИНДРОМ СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА У НОВОРОЖДЕННЫХ Показатели среднего артериального давления как критерии диагностики артериальной гипотензии у новорожденных разного срока гестации Вес, г <1000 -1500 -2500 > 2500 Срок гестации 23 -27 недель 28 -33 недели 34 -37 недель > 37 недель 1 -3 сутки 4 -7 сутки > 7 дней MAP <СГ < 30 < 33 < 35 < 40 < 45 < 50
СИНДРОМ СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА У НОВОРОЖДЕННЫХ Показатели среднего артериального давления как критерии диагностики артериальной гипотензии у новорожденных разного срока гестации Вес, г <1000 -1500 -2500 > 2500 Срок гестации 23 -27 недель 28 -33 недели 34 -37 недель > 37 недель 1 -3 сутки 4 -7 сутки > 7 дней MAP <СГ < 30 < 33 < 35 < 40 < 45 < 50
 ОСНОВНЫЕ ДЕФИНИЦИИ Инфекция – бактериологический феномен, который характеризуется инвазией бактерий в нормальную стерильную биологическую ткань. Местный ответ на внедрение бактерий проявляется в виде синдрома локального воспалительной реакции LIRS, а системный – синдрома системной воспалительной реакции SIRS.
ОСНОВНЫЕ ДЕФИНИЦИИ Инфекция – бактериологический феномен, который характеризуется инвазией бактерий в нормальную стерильную биологическую ткань. Местный ответ на внедрение бактерий проявляется в виде синдрома локального воспалительной реакции LIRS, а системный – синдрома системной воспалительной реакции SIRS.
 ОСНОВНЫЕ ДЕФИНИЦИИ СЕПСИС - Синдром системной воспалительной реакции, возникший в результате доказанной или предполагаемой инфекции. Сепсис – ациклическое заболевание (протекающее по нарастающей, и без лечения приводящее к смерти), в основе которого лежит системный воспалительный ответ организма на бактериальную, как правило, условно – патогенную (чаще госпитальную) инфекцию, приводящий к генерализованному повреждению эндотелия сосудистого русла, интоксикации, расстройствам гемостаза с обязательным ДВС-синдромом и дальнейшей полиорганной недостаточностью (Шабалов Н. П. , 2006).
ОСНОВНЫЕ ДЕФИНИЦИИ СЕПСИС - Синдром системной воспалительной реакции, возникший в результате доказанной или предполагаемой инфекции. Сепсис – ациклическое заболевание (протекающее по нарастающей, и без лечения приводящее к смерти), в основе которого лежит системный воспалительный ответ организма на бактериальную, как правило, условно – патогенную (чаще госпитальную) инфекцию, приводящий к генерализованному повреждению эндотелия сосудистого русла, интоксикации, расстройствам гемостаза с обязательным ДВС-синдромом и дальнейшей полиорганной недостаточностью (Шабалов Н. П. , 2006).
 СЕПСИС У НОВОРОЖДЕННЫХ • РАННИЙ СЕПСИС развивается в течение первых 7 дней жизни (3 дней для недоношенных новорожденных) Инфицирование обычно через половые пути матери Возбудители: GBS, E coli, Listeria Обычно имеет место респираторный дистресс (пневмония) Позитивная культура крови или ЦСЖ (определение CDC) Смертность 5 -50% • ПОЗДНИЙ СЕПСИС развивается после 7 дня жизни Инфицирование внутрибольничное или внебольничное Возбудители: GBS, HBV, E coli, Staphylococcus, candida Присутствует менингит Частота ~ 2 на 1000 живорожденных 10 -15% of neonates evaluated for sepsis Только у 3 -8% из них культура положительная Смертность 2 -6%
СЕПСИС У НОВОРОЖДЕННЫХ • РАННИЙ СЕПСИС развивается в течение первых 7 дней жизни (3 дней для недоношенных новорожденных) Инфицирование обычно через половые пути матери Возбудители: GBS, E coli, Listeria Обычно имеет место респираторный дистресс (пневмония) Позитивная культура крови или ЦСЖ (определение CDC) Смертность 5 -50% • ПОЗДНИЙ СЕПСИС развивается после 7 дня жизни Инфицирование внутрибольничное или внебольничное Возбудители: GBS, HBV, E coli, Staphylococcus, candida Присутствует менингит Частота ~ 2 на 1000 живорожденных 10 -15% of neonates evaluated for sepsis Только у 3 -8% из них культура положительная Смертность 2 -6%
 ОСНОВНЫЕ ДЕФИНИЦИИ Тяжелый сепсис – это сочетании сепсиса с дисфункцией сердечно-сосудистой системы, острым респираторным дистресс-синдромом или дисфункцией двух или более органов (дыхательная, почечная, нервная, гематологическая или печеночная система)
ОСНОВНЫЕ ДЕФИНИЦИИ Тяжелый сепсис – это сочетании сепсиса с дисфункцией сердечно-сосудистой системы, острым респираторным дистресс-синдромом или дисфункцией двух или более органов (дыхательная, почечная, нервная, гематологическая или печеночная система)
 ОСНОВНЫЕ ДЕФИНИЦИИ Септичский шок – угрожающее жизни осложнение тяжелых инфекционных заболеваний, характеризующееся недостаточной перфузией тканей, что нарушает доставку кислорода и других субстратов к тканям и приводит к развитию тяжелого энергодефицита, лежащего в основе органной дисфункции и синдрома полиорганной недостаточности.
ОСНОВНЫЕ ДЕФИНИЦИИ Септичский шок – угрожающее жизни осложнение тяжелых инфекционных заболеваний, характеризующееся недостаточной перфузией тканей, что нарушает доставку кислорода и других субстратов к тканям и приводит к развитию тяжелого энергодефицита, лежащего в основе органной дисфункции и синдрома полиорганной недостаточности.
 ОБЩАЯ ХАРАКТЕРИСТИКА СЕПТИЧЕСКОГО ШОКА ТИП ШОКА Теплый шок Холодный шок ХАРАКТЕРИСТИКА Гипердинамическое состояние кровообращения, увеличение МОС, гиперемия кожи, повышение температуры тела, озноб, тахикардия, угнетение сознания. Гиподинамическое состояние кровообращения, снижение МОС, угнетение сознания, уменьшение времени наполнения капилляров > 2 с, мраморность кожи, гипоперфузия, гипотермия, снижение темпа диуреза < 1 мл/кг/ч Симптомы шока сохраняются, несмотря на проведение инфузии ≥ 60 мл/кг и инфузию допамина в дозе 10 мкг/кг/мин Жидкосторефрактерный/ Дофаминрезистентный шок Катехоламин. Симптомы шока сохраняются, несмотря на использование резистентный шок катехоламинов (адреналина, норадреналина) Рефрактерный шок Симптомы шока сохраняются, несмотря на использование инотропов, вазопрессоров и/или вазодилятаторов, поддержание метаболического (глюкоза и кальций) и гормонального (тиреоидные гормоны, гидрокортизон, инсулин) гомеостаза 23
ОБЩАЯ ХАРАКТЕРИСТИКА СЕПТИЧЕСКОГО ШОКА ТИП ШОКА Теплый шок Холодный шок ХАРАКТЕРИСТИКА Гипердинамическое состояние кровообращения, увеличение МОС, гиперемия кожи, повышение температуры тела, озноб, тахикардия, угнетение сознания. Гиподинамическое состояние кровообращения, снижение МОС, угнетение сознания, уменьшение времени наполнения капилляров > 2 с, мраморность кожи, гипоперфузия, гипотермия, снижение темпа диуреза < 1 мл/кг/ч Симптомы шока сохраняются, несмотря на проведение инфузии ≥ 60 мл/кг и инфузию допамина в дозе 10 мкг/кг/мин Жидкосторефрактерный/ Дофаминрезистентный шок Катехоламин. Симптомы шока сохраняются, несмотря на использование резистентный шок катехоламинов (адреналина, норадреналина) Рефрактерный шок Симптомы шока сохраняются, несмотря на использование инотропов, вазопрессоров и/или вазодилятаторов, поддержание метаболического (глюкоза и кальций) и гормонального (тиреоидные гормоны, гидрокортизон, инсулин) гомеостаза 23
 Клинические проявления септического шока «Теплый» шок 1. Гиперемия кожи 2. Горячие дистальные отделы конечностей 3. Озноб 4. Лихорадка 5. Тахикардия 6. Артериальное давление в пределах нормы или слегка снижено 7. Пульсовое давление не изменено (используется для оценки сердечного выброса) 8. Олигурия 9. Расстройства сознания (апатия, сомноленция), психомоторное возбуждение «Холодный» шок 1. Бледность кожи 2. Выраженные нарушения микроциркуляции (дистальные отделы конечностей холодные) 3. Тахикардия 4. Гипотензия 5. Олигоанурия 6. Сопор, кома
Клинические проявления септического шока «Теплый» шок 1. Гиперемия кожи 2. Горячие дистальные отделы конечностей 3. Озноб 4. Лихорадка 5. Тахикардия 6. Артериальное давление в пределах нормы или слегка снижено 7. Пульсовое давление не изменено (используется для оценки сердечного выброса) 8. Олигурия 9. Расстройства сознания (апатия, сомноленция), психомоторное возбуждение «Холодный» шок 1. Бледность кожи 2. Выраженные нарушения микроциркуляции (дистальные отделы конечностей холодные) 3. Тахикардия 4. Гипотензия 5. Олигоанурия 6. Сопор, кома
 ОСНОВНЫЕ ДЕФИНИЦИИ Полиорганная недостаточность – это неспецифическая реакция организма, возникающая в ответ на воздействие любого патогена, как инфекционного, так и неинфекционного, сопровождающаяся недостаточностью двух и более систем или органов с временным преобладанием симптомов несостоятельности той или иной системы – циркуляторной, респираторной, мочевыделительной и пр.
ОСНОВНЫЕ ДЕФИНИЦИИ Полиорганная недостаточность – это неспецифическая реакция организма, возникающая в ответ на воздействие любого патогена, как инфекционного, так и неинфекционного, сопровождающаяся недостаточностью двух и более систем или органов с временным преобладанием симптомов несостоятельности той или иной системы – циркуляторной, респираторной, мочевыделительной и пр.
 Критерии органной дисфункции у недоношенных новорожденных Система органов Предложенные изменения для недоношенных детей Дыхательная 1. Ра. СО 2 > 65 мм рт. ст. или выше более чем на 20 мм рт. система по сравнению с исходными показателями Ра. СО 2 ИЛИ 2. Необходимость дотации дыхательной смеси с FIO 2 50% и более для поддержания сатурации > 92% (88% при < 32 недель) ИЛИ 3. Потребность в респираторной поддержке (инвазивной или неинвазивной искусственной вентиляции легких) ЦНС Острое изменение ментального статуса Система крови 1. Уровень тромбоцитов < 80 x 109/л или снижение количества тромбоцитов ниже 50% от наибольшего значения за последние 3 дня или 2. МНО > 2 Мочевыделитель - Повышение креатинина сыворотки более, чем в 2 раза от ная система нормы для или увеличение более чем в 2 раза от исходных значений. Гепатобилиарная -Увеличение ферментативной активности аланинсистема аминотрансферазы более чем в 2 раза от верхней границы нормы для данной возрастной группы или увеличение более чем на 50% от исходных значений.
Критерии органной дисфункции у недоношенных новорожденных Система органов Предложенные изменения для недоношенных детей Дыхательная 1. Ра. СО 2 > 65 мм рт. ст. или выше более чем на 20 мм рт. система по сравнению с исходными показателями Ра. СО 2 ИЛИ 2. Необходимость дотации дыхательной смеси с FIO 2 50% и более для поддержания сатурации > 92% (88% при < 32 недель) ИЛИ 3. Потребность в респираторной поддержке (инвазивной или неинвазивной искусственной вентиляции легких) ЦНС Острое изменение ментального статуса Система крови 1. Уровень тромбоцитов < 80 x 109/л или снижение количества тромбоцитов ниже 50% от наибольшего значения за последние 3 дня или 2. МНО > 2 Мочевыделитель - Повышение креатинина сыворотки более, чем в 2 раза от ная система нормы для или увеличение более чем в 2 раза от исходных значений. Гепатобилиарная -Увеличение ферментативной активности аланинсистема аминотрансферазы более чем в 2 раза от верхней границы нормы для данной возрастной группы или увеличение более чем на 50% от исходных значений.
 PIRO новая концептуальная модель (2002) • P – Predisposition = предрасположенность, преморбид – Социально-демографические особенности и функциональные резервы – Сопутствующие заболевания – Генетические факторы • I – Infection = инфекция • R – Response = реакция = системное воспаление • O – Organ dysfunction = органная дисфункция
PIRO новая концептуальная модель (2002) • P – Predisposition = предрасположенность, преморбид – Социально-демографические особенности и функциональные резервы – Сопутствующие заболевания – Генетические факторы • I – Infection = инфекция • R – Response = реакция = системное воспаление • O – Organ dysfunction = органная дисфункция
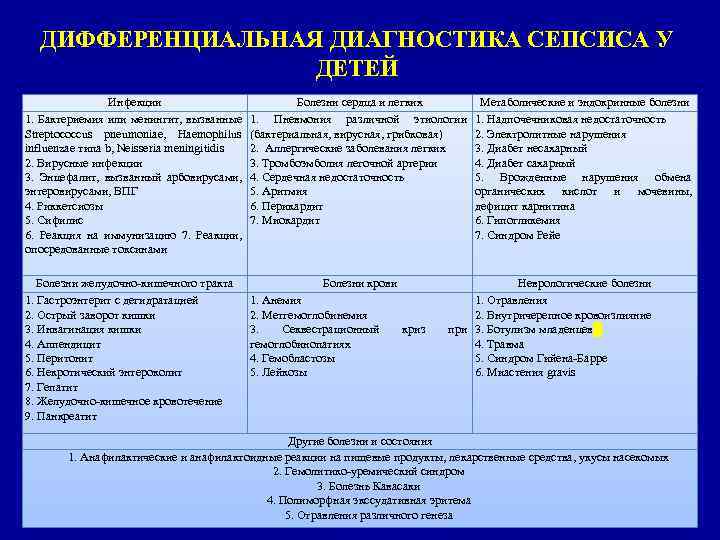 ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА СЕПСИСА У ДЕТЕЙ Инфекции 1. Бактериемия или менингит, вызванные Streptococcus pneumoniae, Haemophilus influenzae типа b, Neisseria meningitidis 2. Вирусные инфекции 3. Энцефалит, вызванный арбовирусами, энтеровирусами, ВПГ 4. Риккетсиозы 5. Сифилис 6. Реакция на иммунизацию 7. Реакции, опосредованные токсинами Болезни желудочно-кишечного тракта 1. Гастроэнтерит с дегидратацией 2. Острый заворот кишки 3. Инвагинация кишки 4. Аппендицит 5. Перитонит 6. Некротический энтероколит 7. Гепатит 8. Желудочно-кишечное кровотечение 9. Панкреатит Болезни сердца и легких 1. Пневмония различной этиологии (бактериальная, вирусная, грибковая) 2. Аллергические заболевания легких 3. Тромбоэмболия легочной артерии 4. Сердечная недостаточность 5. Аритмия 6. Перикардит 7. Миокардит Болезни крови 1. Анемия 2. Метгемоглобинемия 3. Секвестрационный гемоглобинопатиях 4. Гемобластозы 5. Лейкозы криз Метаболические и эндокринные болезни 1. Надпочечниковая недостаточность 2. Электролитные нарушения 3. Диабет несахарный 4. Диабет сахарный 5. Врожденные нарушения обмена органических кислот и мочевины, дефицит карнитина 6. Гипогликемия 7. Синдром Рейе Неврологические болезни 1. Отравления 2. Внутричерепное кровоизлияние при 3. Ботулизм младенцев 4. Травма 5. Синдром Гийена-Барре 6. Миастения gravis Другие болезни и состояния 1. Анафилактические и анафилактоидные реакции на пищевые продукты, лекарственные средства, укусы насекомых 2. Гемолитико-уремический синдром 3. Болезнь Кавасаки 4. Полиморфная экссудативная эритема 5. Отравления различного генеза
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА СЕПСИСА У ДЕТЕЙ Инфекции 1. Бактериемия или менингит, вызванные Streptococcus pneumoniae, Haemophilus influenzae типа b, Neisseria meningitidis 2. Вирусные инфекции 3. Энцефалит, вызванный арбовирусами, энтеровирусами, ВПГ 4. Риккетсиозы 5. Сифилис 6. Реакция на иммунизацию 7. Реакции, опосредованные токсинами Болезни желудочно-кишечного тракта 1. Гастроэнтерит с дегидратацией 2. Острый заворот кишки 3. Инвагинация кишки 4. Аппендицит 5. Перитонит 6. Некротический энтероколит 7. Гепатит 8. Желудочно-кишечное кровотечение 9. Панкреатит Болезни сердца и легких 1. Пневмония различной этиологии (бактериальная, вирусная, грибковая) 2. Аллергические заболевания легких 3. Тромбоэмболия легочной артерии 4. Сердечная недостаточность 5. Аритмия 6. Перикардит 7. Миокардит Болезни крови 1. Анемия 2. Метгемоглобинемия 3. Секвестрационный гемоглобинопатиях 4. Гемобластозы 5. Лейкозы криз Метаболические и эндокринные болезни 1. Надпочечниковая недостаточность 2. Электролитные нарушения 3. Диабет несахарный 4. Диабет сахарный 5. Врожденные нарушения обмена органических кислот и мочевины, дефицит карнитина 6. Гипогликемия 7. Синдром Рейе Неврологические болезни 1. Отравления 2. Внутричерепное кровоизлияние при 3. Ботулизм младенцев 4. Травма 5. Синдром Гийена-Барре 6. Миастения gravis Другие болезни и состояния 1. Анафилактические и анафилактоидные реакции на пищевые продукты, лекарственные средства, укусы насекомых 2. Гемолитико-уремический синдром 3. Болезнь Кавасаки 4. Полиморфная экссудативная эритема 5. Отравления различного генеза
 ДИАГНОСТИКА СЕПСИСА У НОВОРОЖДЕННЫХ Общее количество нейтрофилов <1, 75 х 109/л Количество лейкоцитов <7, 5 х 109/л > 40 х 109/л Юные формы/ общее количество нейтрофилов > 0, 2 Палочкоядерные нейтрофилы >2 х 109/л С-реактивный белок > 10 мг/л Замечания: • если есть ≥ 2 признака – инфицирование очень вероятно; • к-во лейкоцитов нормально у 1/3 больных с бактериемией; • более чувствительными показателями являются индексы нейтрофилов; • наилучшее время исследования крови – 4 ч. жизни, 12 -24 ч. жизни.
ДИАГНОСТИКА СЕПСИСА У НОВОРОЖДЕННЫХ Общее количество нейтрофилов <1, 75 х 109/л Количество лейкоцитов <7, 5 х 109/л > 40 х 109/л Юные формы/ общее количество нейтрофилов > 0, 2 Палочкоядерные нейтрофилы >2 х 109/л С-реактивный белок > 10 мг/л Замечания: • если есть ≥ 2 признака – инфицирование очень вероятно; • к-во лейкоцитов нормально у 1/3 больных с бактериемией; • более чувствительными показателями являются индексы нейтрофилов; • наилучшее время исследования крови – 4 ч. жизни, 12 -24 ч. жизни.
 Биохимические маркеры, используемые в диагностике сепсиса § CRP (C reactive protein) СРБ § IL-6 (Interleukine 6) ИЛ-6 § PCT (Procalcitonin) Прокальцитонин § LBP (lipopolysacharide binding protein) Липополисахарид-связывающий белок § Presepsin (s. CD 14 ST) Пресепсин (s. CD 14 ST)
Биохимические маркеры, используемые в диагностике сепсиса § CRP (C reactive protein) СРБ § IL-6 (Interleukine 6) ИЛ-6 § PCT (Procalcitonin) Прокальцитонин § LBP (lipopolysacharide binding protein) Липополисахарид-связывающий белок § Presepsin (s. CD 14 ST) Пресепсин (s. CD 14 ST)
 Диагноз сепсиса новорожденных по-прежнему в основном является клинической задачей в связи с отсутствием «идеальных» биомаркеров с высокой диагностической точностью и надежностью. Текущие исследования новых молекулярных и биогенетических технологий могут заменить неспецифические биомаркеры, ускоряя диагностику и обеспечивая информацию об этиологии инфекции.
Диагноз сепсиса новорожденных по-прежнему в основном является клинической задачей в связи с отсутствием «идеальных» биомаркеров с высокой диагностической точностью и надежностью. Текущие исследования новых молекулярных и биогенетических технологий могут заменить неспецифические биомаркеры, ускоряя диагностику и обеспечивая информацию об этиологии инфекции.

 ПРОКАЛЬЦИТОНИН ДИАГНОСТИЧЕСКИЙ МАРКЕР СЕПСИСА • Повышается в течение 4 -х часов от начала воздействия бактериальной инфекции • Пиковая концентрация достигается через 68 ч • Постепенное снижение концентрации в течение 24 часов.
ПРОКАЛЬЦИТОНИН ДИАГНОСТИЧЕСКИЙ МАРКЕР СЕПСИСА • Повышается в течение 4 -х часов от начала воздействия бактериальной инфекции • Пиковая концентрация достигается через 68 ч • Постепенное снижение концентрации в течение 24 часов.
 A. Инициальная ресусцитация B. Антибиотики и инфекционный контроль C. Инфузионная терапия D. Инотропы/Вазопрессоры/Вазодилататоры E. Экстракорпоральная мембранная оксигенация (ЭКМО) F. Кортикостероиды G. Протеин C и активированный протеиновый концентрат H. Переливание продуктов крови I. ИВЛ J. Седация/Анальгезия/Миорелаксация K. Контроль гликемии L. Диуретики и почечная заместительная терапия M. Профилактика глубоких венозных тромбозов N. Профилактика стрессорных язв O. Нутритивная поддержка
A. Инициальная ресусцитация B. Антибиотики и инфекционный контроль C. Инфузионная терапия D. Инотропы/Вазопрессоры/Вазодилататоры E. Экстракорпоральная мембранная оксигенация (ЭКМО) F. Кортикостероиды G. Протеин C и активированный протеиновый концентрат H. Переливание продуктов крови I. ИВЛ J. Седация/Анальгезия/Миорелаксация K. Контроль гликемии L. Диуретики и почечная заместительная терапия M. Профилактика глубоких венозных тромбозов N. Профилактика стрессорных язв O. Нутритивная поддержка

 Приоритетные методы терапии, эффективность которых доказана 1. Антибиотикотерапия 2. Инфузионно-трансфузионная терапия 3. Инотропная и вазопрессорная поддержка (при шоке) 4. Респираторная поддержка 5. Нутритивная поддержка 6. Иммуномодулирующая и иммунокорригирующая терапия - ? ? ?
Приоритетные методы терапии, эффективность которых доказана 1. Антибиотикотерапия 2. Инфузионно-трансфузионная терапия 3. Инотропная и вазопрессорная поддержка (при шоке) 4. Респираторная поддержка 5. Нутритивная поддержка 6. Иммуномодулирующая и иммунокорригирующая терапия - ? ? ?
 Стартовая инфузионная терапия Инфузионная терапия начинается немедленно после постановки диагноза и не откладывается до поступления в отделение интенсивной терапии. У детей инфузию жидкости рекомендуется начинать в виде болюсов из расчета 20 мл/кг за 5 -10 минут, под контролем мониторинга сердечного выброса (реографический мониторинг гемодинамики, оценка пульсового давления), ЧСС, диуреза, времени наполнения капилляров и уровня сознания. В типичных случаях, у детей с тяжелым сепсисом и септическим шоком, имеется выраженный дефицит жидкости, и для адекватной начальной инфузионной терапии может потребоваться объем 40– 60 мл/кг/час и больше (Carcillo J. A. et al. , 1991; 2007; 2011; Ceneviva G. et al. 1988).
Стартовая инфузионная терапия Инфузионная терапия начинается немедленно после постановки диагноза и не откладывается до поступления в отделение интенсивной терапии. У детей инфузию жидкости рекомендуется начинать в виде болюсов из расчета 20 мл/кг за 5 -10 минут, под контролем мониторинга сердечного выброса (реографический мониторинг гемодинамики, оценка пульсового давления), ЧСС, диуреза, времени наполнения капилляров и уровня сознания. В типичных случаях, у детей с тяжелым сепсисом и септическим шоком, имеется выраженный дефицит жидкости, и для адекватной начальной инфузионной терапии может потребоваться объем 40– 60 мл/кг/час и больше (Carcillo J. A. et al. , 1991; 2007; 2011; Ceneviva G. et al. 1988).
 Антибиотикотерапия • Внутривенная антибиотикотерапия должна быть начата в течение первого часа после распознавания тяжелого сепсиса, когда уже соответствующие микробиологические исследования проведены. • Антибактериальная схема должна быть переоценена после 48– 72 часов терапии на основе микробиологических и клинических данных с целью использования антибиотиков узкого спектра для предотвращения развития резистентности, а также для снижения токсичности и материальных затрат. В типичных случаях продолжительность терапии составляет 7– 10 дней и определяется клиническим и лабораторным ответом пациента.
Антибиотикотерапия • Внутривенная антибиотикотерапия должна быть начата в течение первого часа после распознавания тяжелого сепсиса, когда уже соответствующие микробиологические исследования проведены. • Антибактериальная схема должна быть переоценена после 48– 72 часов терапии на основе микробиологических и клинических данных с целью использования антибиотиков узкого спектра для предотвращения развития резистентности, а также для снижения токсичности и материальных затрат. В типичных случаях продолжительность терапии составляет 7– 10 дней и определяется клиническим и лабораторным ответом пациента.
 Трудности современного периода антибиотикотерапии • Полное отсутствие принципиально новых групп антибиотиков • Изобилие генериков известных антибактериальных препаратов • Отсутствие экспертизы соответствия качеству генерика неизвестной фирмы давно известному оригинальному антибиотику
Трудности современного периода антибиотикотерапии • Полное отсутствие принципиально новых групп антибиотиков • Изобилие генериков известных антибактериальных препаратов • Отсутствие экспертизы соответствия качеству генерика неизвестной фирмы давно известному оригинальному антибиотику
 Антимикробная терапия • Ни одного антибиотика среди 89 одобренных новых лекарственных средств (2002 г) • Среди 506 новых лекарств, разрабатываемых крупнейшими компаниями, только 6 антибиотиков (2004 г) • Ренессанс «старых» антибиотиков: полимиксины, фосфомицин, фузидин, хлорамфеникол, нетилмицин, ко-тримоксазол, рифампицин
Антимикробная терапия • Ни одного антибиотика среди 89 одобренных новых лекарственных средств (2002 г) • Среди 506 новых лекарств, разрабатываемых крупнейшими компаниями, только 6 антибиотиков (2004 г) • Ренессанс «старых» антибиотиков: полимиксины, фосфомицин, фузидин, хлорамфеникол, нетилмицин, ко-тримоксазол, рифампицин
 ОСНОВНЫЕ ПРИНЦИПЫ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ Классический (этиологически обоснованный) подход к выбору антибактериального препарата - выбор препарата строго в соответствии с антибиотикочувствительностью выделенного из очага возбудителя Эмпирический (наугад) подход к выбору антибактериального препарата - выбор препарата на основе знаний о вероятном (потенциальном) возбудителе инфекционного процесса, с учетом международного опыта многих врачей, применявших препарат при данном
ОСНОВНЫЕ ПРИНЦИПЫ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ Классический (этиологически обоснованный) подход к выбору антибактериального препарата - выбор препарата строго в соответствии с антибиотикочувствительностью выделенного из очага возбудителя Эмпирический (наугад) подход к выбору антибактериального препарата - выбор препарата на основе знаний о вероятном (потенциальном) возбудителе инфекционного процесса, с учетом международного опыта многих врачей, применявших препарат при данном
 КАКИЕ АНТИБИОТИКИ НУЖНЫ ДЛЯ ЭМПИРИЧЕСКОЙ АНТИБИОТИКОТЕРАПИИ ? · Активные против вероятных возбудителей · Преодолевающих приобретённую резистентность возможную · "Незаметные" для пациента, персонала и бюджета · Минимальные: кратность введения, нежелательные реакции, взаимодействия, противопоказания, стоимость
КАКИЕ АНТИБИОТИКИ НУЖНЫ ДЛЯ ЭМПИРИЧЕСКОЙ АНТИБИОТИКОТЕРАПИИ ? · Активные против вероятных возбудителей · Преодолевающих приобретённую резистентность возможную · "Незаметные" для пациента, персонала и бюджета · Минимальные: кратность введения, нежелательные реакции, взаимодействия, противопоказания, стоимость
 Антибиотики «неразрешенные» в педиатрии (Н. П. Шабалов) • • • Фторхинолоны Тетрациклины Цефоперазон Цефотетан Эртапенем Пиперациллин/ тазобактам до 16 лет до 8 лет до 12 лет до 18 лет нет лицензии у грудных детей
Антибиотики «неразрешенные» в педиатрии (Н. П. Шабалов) • • • Фторхинолоны Тетрациклины Цефоперазон Цефотетан Эртапенем Пиперациллин/ тазобактам до 16 лет до 8 лет до 12 лет до 18 лет нет лицензии у грудных детей
 Тенденции в антимикробной терапии в развитых странах © Актуализация проблем нозокомиального инфицирования (от 5 % до 20 % всех больных, поступивших в отделения реанимации и интенсивной терапии по данным некоторых источников) © Стремление к «управлению» инфекцией: § широкая профилактика инфицирования § стремление к скорейшему типированию микроорганизмов § «мониторирование» воспалительной реакции © Отказ в ряде случаев от использования антибиотиков применении внутривенных иммуноглобулинов © Существенное ограничение списка препаратов
Тенденции в антимикробной терапии в развитых странах © Актуализация проблем нозокомиального инфицирования (от 5 % до 20 % всех больных, поступивших в отделения реанимации и интенсивной терапии по данным некоторых источников) © Стремление к «управлению» инфекцией: § широкая профилактика инфицирования § стремление к скорейшему типированию микроорганизмов § «мониторирование» воспалительной реакции © Отказ в ряде случаев от использования антибиотиков применении внутривенных иммуноглобулинов © Существенное ограничение списка препаратов
 АБ терапия инфекций у новорожденных Предполагаемый возбудитель/ локализация первичного очага инфекции Антимикробная терапия Менингит не уточненной этиологии Ампициллин + ЦФ III поколения* (цефотаксим), аминогликозид (гентамицин) Менингиты, вызванные P. aeruginosa Цефтазидим Менингиты, вызванные B. fragilis Метронидазол Пневмонии (первые 7 -10 суток жизни) Ампициллин + аминогликозиды, цефтриаксон Нозокомиальные пневмонии (более 10 суток после рождения) ЦФ III поколения, ванкомицин, метициллин При предполагаемой псевдомонадной инфекции тикарциллин или цефтазидим в сочетании с аминогликозидами. При пневмонии, вызванной C. Trachomatis эритромицин или триметоприм/сульфаметоксазол. При микоплазменной этиологии пневмонии (U. urealyticum) эритромицин Листериоз Ампициллин
АБ терапия инфекций у новорожденных Предполагаемый возбудитель/ локализация первичного очага инфекции Антимикробная терапия Менингит не уточненной этиологии Ампициллин + ЦФ III поколения* (цефотаксим), аминогликозид (гентамицин) Менингиты, вызванные P. aeruginosa Цефтазидим Менингиты, вызванные B. fragilis Метронидазол Пневмонии (первые 7 -10 суток жизни) Ампициллин + аминогликозиды, цефтриаксон Нозокомиальные пневмонии (более 10 суток после рождения) ЦФ III поколения, ванкомицин, метициллин При предполагаемой псевдомонадной инфекции тикарциллин или цефтазидим в сочетании с аминогликозидами. При пневмонии, вызванной C. Trachomatis эритромицин или триметоприм/сульфаметоксазол. При микоплазменной этиологии пневмонии (U. urealyticum) эритромицин Листериоз Ампициллин
 АБ терапия инфекций у новорожденных Предполагаемый возбудитель/ локализация первичного очага инфекции Антимикробная терапия S. aureus Метициллин, нафциллин Коагулазоотрицательные стафилококки, Метициллинустойчивые S. aureus Ампициллин, ванкомицин Псевдомонадная инфекция (некрозы кожи) Пиперациллин, тикарциллин, карбенициллин, цефтазидим, аминогликозиды Грам-отрицательные бактерии, энтеробактерии Ампициллин + аминогликозид или цефалоспорин III поколения (цефотаксим, цефтазидим) Энтерококк Пенициллины (ампициллин или пиперациллин + аминогликозид) Стрептококки группы В Бензилпенициллин Анаробы Метронидазол, клиндамицин
АБ терапия инфекций у новорожденных Предполагаемый возбудитель/ локализация первичного очага инфекции Антимикробная терапия S. aureus Метициллин, нафциллин Коагулазоотрицательные стафилококки, Метициллинустойчивые S. aureus Ампициллин, ванкомицин Псевдомонадная инфекция (некрозы кожи) Пиперациллин, тикарциллин, карбенициллин, цефтазидим, аминогликозиды Грам-отрицательные бактерии, энтеробактерии Ампициллин + аминогликозид или цефалоспорин III поколения (цефотаксим, цефтазидим) Энтерококк Пенициллины (ампициллин или пиперациллин + аминогликозид) Стрептококки группы В Бензилпенициллин Анаробы Метронидазол, клиндамицин


 КЛЮЧЕВЫЕ ПРИНЦИПЫ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ 1. Применение антимикробных средств резерва (цефалосоприны III и IV поколения, ванкомицин) должно быть ограничено. 2. Ванкомицин следует назначать только тогда, когда возбудителем инфекции являются коагулазоотрицательные стафилококки или метициллинустойчивые S. aureus. 3. Необходимо использовать только антибактериальные препараты с узким спектром действия.
КЛЮЧЕВЫЕ ПРИНЦИПЫ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ 1. Применение антимикробных средств резерва (цефалосоприны III и IV поколения, ванкомицин) должно быть ограничено. 2. Ванкомицин следует назначать только тогда, когда возбудителем инфекции являются коагулазоотрицательные стафилококки или метициллинустойчивые S. aureus. 3. Необходимо использовать только антибактериальные препараты с узким спектром действия.
 КЛЮЧЕВЫЕ ПРИНЦИПЫ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ 4. Длительность назначения антимикробных препаратов должна быть минимальной. 5. При инфекциях и сепсисе, сопровождающихся бактериемией, длительность антибактериальной терапии составляет 7 -10 суток (+ 5 -7 суток после явного улучшения). 6. Противогрибковые препараты показаны при наличии проявлений кандидозной инфекции и высоком риске развития инвазивной грибковой инфекции.
КЛЮЧЕВЫЕ ПРИНЦИПЫ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ 4. Длительность назначения антимикробных препаратов должна быть минимальной. 5. При инфекциях и сепсисе, сопровождающихся бактериемией, длительность антибактериальной терапии составляет 7 -10 суток (+ 5 -7 суток после явного улучшения). 6. Противогрибковые препараты показаны при наличии проявлений кандидозной инфекции и высоком риске развития инвазивной грибковой инфекции.
 Санация очага У каждого пациента с тяжелым сепсисом надо выявить очаг инфекции, подлежащий исходному контролю (провести дренаж абсцесса или хирургическую санацию локального очага инфекции, хирургическую обработку раны с удалением инфицированной некротизированной ткани, удалить потенциально инфицированные катетеры, зонды, и т. д. ) и выполнить микробиологический контроль источника возможного микробного загрязнения.
Санация очага У каждого пациента с тяжелым сепсисом надо выявить очаг инфекции, подлежащий исходному контролю (провести дренаж абсцесса или хирургическую санацию локального очага инфекции, хирургическую обработку раны с удалением инфицированной некротизированной ткани, удалить потенциально инфицированные катетеры, зонды, и т. д. ) и выполнить микробиологический контроль источника возможного микробного загрязнения.
 РЕСПИРАТОРНАЯ ПОДДЕРЖКА
РЕСПИРАТОРНАЯ ПОДДЕРЖКА
 РЕСПИРАТОРНАЯ ПОДДЕРЖКА
РЕСПИРАТОРНАЯ ПОДДЕРЖКА
 РЕСПИРАТОРНАЯ ПОДДЕРЖКА Гипоксемия, отсутствие ответа на дополнительную оксигенацию Гиперкапния, респираторный ацидоз Увеличение работы дыхания, нервномышечная «усталость» 1. Мероприятия СЛР 2. Прогрессирование ДН на фоне неинвазивной ИВЛ 3. Острый респираторный дистресс/синдром Апноэ, неадекватное спонтанное дыхание на фоне поражения дыхательной системы любого генеза 1. Декомпенсированная ДН любого генеза 2. Миопатии различного генеза Глубокая седация и анальгезия, защита ДП 1. Состояние после анестезии и инвазивных манипуляций, потребовавших седации и анальгезии 2. Кома Использование ИВЛ как компонента терапии основного заболевания Церебропротекция, санация ТБД, введение лекарств в ДП
РЕСПИРАТОРНАЯ ПОДДЕРЖКА Гипоксемия, отсутствие ответа на дополнительную оксигенацию Гиперкапния, респираторный ацидоз Увеличение работы дыхания, нервномышечная «усталость» 1. Мероприятия СЛР 2. Прогрессирование ДН на фоне неинвазивной ИВЛ 3. Острый респираторный дистресс/синдром Апноэ, неадекватное спонтанное дыхание на фоне поражения дыхательной системы любого генеза 1. Декомпенсированная ДН любого генеза 2. Миопатии различного генеза Глубокая седация и анальгезия, защита ДП 1. Состояние после анестезии и инвазивных манипуляций, потребовавших седации и анальгезии 2. Кома Использование ИВЛ как компонента терапии основного заболевания Церебропротекция, санация ТБД, введение лекарств в ДП
 ЦЕЛИ РЕСПИРАТОРНОЙ ПОДДЕРЖКИ ПРИ СЕПСИСЕ Физиологические цели ИВЛ 1. Поддержание газообмена в легких: - поддержание альвеолярной вентиляции (Pa. CO 2 и p. H) - поддержание артериальной оксигенации (поддержание Pa. O 2 > 60 мм рт. ст. и периферического Sa. O 2 > 90%). 2. Увеличение объема легких и поддержание адекватной функциональной остаточной емкости (ФОЕ): - максимальное открытие альвеол, с целью профилактики и лечения ателектазов - улучшение оксигенации и легочного комплайнса 3. Уменьшение работы дыхания при наличии высокого сопротивления и сниженного комплайнса, когда спонтанное дыхание становится неэффективным Клинические цели ИВЛ 1. Лечение основного легочного заболевания 2. Восстановление вентиляционно- перфузионных соотношений в легких 3. Устранение гипоксемии, гиперкапнии и острого респираторного ацидоза 4. Снижение системного или миокардиального потребления кислорода 5. Уменьшение проявлений респираторного дистресса и поддержка работы дыхательной мускулатуры 6. Стабилизация грудной клетки в случае нарушения ее целостности 7. Профилактика ателектазов, вовлечение в газообмен коллабированных альвеол и подержание их в открытом состоянии 8. Необходимость в седации и/или нейромышечной блокаде (например, при купировании судорог или общей анестезии) 9. Церебропротекция (снижение ВЧД)
ЦЕЛИ РЕСПИРАТОРНОЙ ПОДДЕРЖКИ ПРИ СЕПСИСЕ Физиологические цели ИВЛ 1. Поддержание газообмена в легких: - поддержание альвеолярной вентиляции (Pa. CO 2 и p. H) - поддержание артериальной оксигенации (поддержание Pa. O 2 > 60 мм рт. ст. и периферического Sa. O 2 > 90%). 2. Увеличение объема легких и поддержание адекватной функциональной остаточной емкости (ФОЕ): - максимальное открытие альвеол, с целью профилактики и лечения ателектазов - улучшение оксигенации и легочного комплайнса 3. Уменьшение работы дыхания при наличии высокого сопротивления и сниженного комплайнса, когда спонтанное дыхание становится неэффективным Клинические цели ИВЛ 1. Лечение основного легочного заболевания 2. Восстановление вентиляционно- перфузионных соотношений в легких 3. Устранение гипоксемии, гиперкапнии и острого респираторного ацидоза 4. Снижение системного или миокардиального потребления кислорода 5. Уменьшение проявлений респираторного дистресса и поддержка работы дыхательной мускулатуры 6. Стабилизация грудной клетки в случае нарушения ее целостности 7. Профилактика ателектазов, вовлечение в газообмен коллабированных альвеол и подержание их в открытом состоянии 8. Необходимость в седации и/или нейромышечной блокаде (например, при купировании судорог или общей анестезии) 9. Церебропротекция (снижение ВЧД)
 РЕЖИМЫ ИСКУССТВЕННОЙ ВЕНТИЛЯЦИИ ЛЕГКИХ
РЕЖИМЫ ИСКУССТВЕННОЙ ВЕНТИЛЯЦИИ ЛЕГКИХ
 ОБЩИЕ ПРИНЦИПЫ РЕСПИРАТОРНОЙ ПОДДЕРЖКИ ПРИ ОРДС • При минимальных признаках дыхательной недостаточности и гипоксемии показано проведение оксигенотерапии с одновременным назначением специфической терапии • При прогрессировании дыхательной недостаточности оптимальным вариантом респираторной поддержки является ранний перевод на искусственную вентиляцию легких с использованием маневра
ОБЩИЕ ПРИНЦИПЫ РЕСПИРАТОРНОЙ ПОДДЕРЖКИ ПРИ ОРДС • При минимальных признаках дыхательной недостаточности и гипоксемии показано проведение оксигенотерапии с одновременным назначением специфической терапии • При прогрессировании дыхательной недостаточности оптимальным вариантом респираторной поддержки является ранний перевод на искусственную вентиляцию легких с использованием маневра
 ОСНОВНЫЕ ЗАДАЧИ 1. Оптимизация газообмена 2. Уменьшение работы дыхания 3. Снижение потребления кислорода дыхательными мышцами 4. Предотвращение волюмотравмы – минимизация перераздувания альвеол 5. Предотвращение ателектатического повреждения 6. Предотвращение органной легочной воспалительной реакции - биотравмы
ОСНОВНЫЕ ЗАДАЧИ 1. Оптимизация газообмена 2. Уменьшение работы дыхания 3. Снижение потребления кислорода дыхательными мышцами 4. Предотвращение волюмотравмы – минимизация перераздувания альвеол 5. Предотвращение ателектатического повреждения 6. Предотвращение органной легочной воспалительной реакции - биотравмы
 ОБЕСПЕЧЕНИЕ АЛЬВЕОЛЯРНОЙ ВЕНТИЛЯЦИИ • Обеспечение нормокапнии (Ра. CO 2 = 35 -45 мм рт. ст. ) • Возможно применение методики пермиссивной гиперкапнии • Увеличение концентрации Ра. CO 2 является прогностически неблагоприятным фактором и свидетельствует о высокой вероятности летального исхода • При развитии у пациента острой церебральной недостаточности допускается гипервентиляция с тенденцией к гипокапнии
ОБЕСПЕЧЕНИЕ АЛЬВЕОЛЯРНОЙ ВЕНТИЛЯЦИИ • Обеспечение нормокапнии (Ра. CO 2 = 35 -45 мм рт. ст. ) • Возможно применение методики пермиссивной гиперкапнии • Увеличение концентрации Ра. CO 2 является прогностически неблагоприятным фактором и свидетельствует о высокой вероятности летального исхода • При развитии у пациента острой церебральной недостаточности допускается гипервентиляция с тенденцией к гипокапнии
 ОБЕСПЕЧЕНИЕ АРТЕРИАЛЬНОЙ ОКСИГЕНАЦИИ • Максимальное вовлечение в газообмен нефункционирующих альвеол • Подбор оптимального уровня положительного давления в конце выдоха • Подбор оптимального уровня положительного давления на вдохе • Оптимальное время вдоха • Маневр «рекрутирования» альвеол» • Использование «прон-позиции» • Высокочастотная вентиляция легких • Инверсивное соотношение вдоха к выдоху
ОБЕСПЕЧЕНИЕ АРТЕРИАЛЬНОЙ ОКСИГЕНАЦИИ • Максимальное вовлечение в газообмен нефункционирующих альвеол • Подбор оптимального уровня положительного давления в конце выдоха • Подбор оптимального уровня положительного давления на вдохе • Оптимальное время вдоха • Маневр «рекрутирования» альвеол» • Использование «прон-позиции» • Высокочастотная вентиляция легких • Инверсивное соотношение вдоха к выдоху
 ОБЕСПЕЧЕНИЕ АРТЕРИАЛЬНОЙ ОКСИГЕНАЦИИ Цель терапии: 1. поддержание Ра. O 2 не менее 60 мм рт. ст. и не более 100 мм рт. ст. 2. Sa. O 2 не менее 93% NB!: Более высокие значения Ра. O 2 и Sa. O 2 оказывают токсическое действие на легкие!
ОБЕСПЕЧЕНИЕ АРТЕРИАЛЬНОЙ ОКСИГЕНАЦИИ Цель терапии: 1. поддержание Ра. O 2 не менее 60 мм рт. ст. и не более 100 мм рт. ст. 2. Sa. O 2 не менее 93% NB!: Более высокие значения Ра. O 2 и Sa. O 2 оказывают токсическое действие на легкие!
 МОНИТОРИНГ АДЕКВАТНОСТИ ГАЗООБМЕНА • Респираторный индекс (индекс Коровича) - Pa. O 2/Fi. O 2 • Парциальное напряжение CO 2 • Давление плато (при вентиляции с управлением по объему) – обратно пропорционально податливости и прямо пропорционально эластичности респираторной системы • Дыхательный объем (при вентиляции с управлением по давлению) – прямо пропорционален податливости и обратно пропорционален эластичности дыхательной системы • Расчетные показатели податливости
МОНИТОРИНГ АДЕКВАТНОСТИ ГАЗООБМЕНА • Респираторный индекс (индекс Коровича) - Pa. O 2/Fi. O 2 • Парциальное напряжение CO 2 • Давление плато (при вентиляции с управлением по объему) – обратно пропорционально податливости и прямо пропорционально эластичности респираторной системы • Дыхательный объем (при вентиляции с управлением по давлению) – прямо пропорционален податливости и обратно пропорционален эластичности дыхательной системы • Расчетные показатели податливости
 Уменьшение работы дыхания • • Адекватная седация Адекватная анальгезия Миоплегия Тщательная адаптация пациента к аппарату ИВЛ! Nb!: Оптимальным вариантом является освобождение пациента от значительной работы дыхания при сохраненных минимальных инспираторных попыток!
Уменьшение работы дыхания • • Адекватная седация Адекватная анальгезия Миоплегия Тщательная адаптация пациента к аппарату ИВЛ! Nb!: Оптимальным вариантом является освобождение пациента от значительной работы дыхания при сохраненных минимальных инспираторных попыток!
 КОНЦЕПЦИЯ «МАЛЫХ ДЫХАТЕЛЬНЫХ ОБЪЕМОВ» Параметр ИВЛ Увеличение параметра PIP ≤ 35 см Н 2 О Баротравма Vt = 7 -9 мл/кг идеальной массы тела Волюмотравма Pplat ≤ 30 см Н 2 О Баро- и волюмотравма Fi. O 2 < 60% Повреждение сурфактанта, ателектазирование I/E не более 1, 5 : 1 Увеличение auto PEEP
КОНЦЕПЦИЯ «МАЛЫХ ДЫХАТЕЛЬНЫХ ОБЪЕМОВ» Параметр ИВЛ Увеличение параметра PIP ≤ 35 см Н 2 О Баротравма Vt = 7 -9 мл/кг идеальной массы тела Волюмотравма Pplat ≤ 30 см Н 2 О Баро- и волюмотравма Fi. O 2 < 60% Повреждение сурфактанта, ателектазирование I/E не более 1, 5 : 1 Увеличение auto PEEP
 МАНЕВР ОТКРЫТИЯ АЛЬВЕОЛ АБСОЛЮТНЫЕ ПРОТИВОПОКАЗАНИЯ 1. Пневмоторакс, гидроторакс 2. Буллезные изменения в легких 3. Высокий риск развития и/или рецидива пневмоторакса 4. Отсутствие современных респираторов 5. Недостаточный мониторинг 6. Выраженная гиповолемия 7. Тяжелая сердечно-сосудистая недостаточность с нестабильной гемодинамикой 8. Отсутствие прямых показаний для выполнения маневра рекруитмента
МАНЕВР ОТКРЫТИЯ АЛЬВЕОЛ АБСОЛЮТНЫЕ ПРОТИВОПОКАЗАНИЯ 1. Пневмоторакс, гидроторакс 2. Буллезные изменения в легких 3. Высокий риск развития и/или рецидива пневмоторакса 4. Отсутствие современных респираторов 5. Недостаточный мониторинг 6. Выраженная гиповолемия 7. Тяжелая сердечно-сосудистая недостаточность с нестабильной гемодинамикой 8. Отсутствие прямых показаний для выполнения маневра рекруитмента
 ПРОН-ПОЗИЦИЯ 1. Гипоксемия 2. Расправление альвеол происходит без повышения давления в дыхательных путях 3. Необходим длительный период для достижения эффекта: 12 -20 часов. 4. Является терапией «отчаяния» 5. Применение прон-позиции показано при неэффективности маневра рекруитмента, декомпенсации сердечно-сосудистой деятельности и высоком риске развития пневмоторакса
ПРОН-ПОЗИЦИЯ 1. Гипоксемия 2. Расправление альвеол происходит без повышения давления в дыхательных путях 3. Необходим длительный период для достижения эффекта: 12 -20 часов. 4. Является терапией «отчаяния» 5. Применение прон-позиции показано при неэффективности маневра рекруитмента, декомпенсации сердечно-сосудистой деятельности и высоком риске развития пневмоторакса
 ПОКАЗАНИЯ К ИСПОЛЬЗОВАНИЮ ПРОН-ПОЗИЦИИ • Индекс оксигенации менее 200 -250 мм рт. ст. при проведении ИВЛ в оптимальном режиме: ü Ра. CO 2 = 35 -45 мм рт. ст. ü Vt < 10 мл/кг ü Pplato < 35 см Н 2 О ü оптимальное значение PEEP
ПОКАЗАНИЯ К ИСПОЛЬЗОВАНИЮ ПРОН-ПОЗИЦИИ • Индекс оксигенации менее 200 -250 мм рт. ст. при проведении ИВЛ в оптимальном режиме: ü Ра. CO 2 = 35 -45 мм рт. ст. ü Vt < 10 мл/кг ü Pplato < 35 см Н 2 О ü оптимальное значение PEEP
 ПРОТИВОПОКАЗАНИЯ К ИСПОЛЬЗОВАНИЮ ПРОН-ПОЗИЦИИ 1. Технические трудности выполнения данного маневра 2. Декомпенсация функции сердечнососудистой системы
ПРОТИВОПОКАЗАНИЯ К ИСПОЛЬЗОВАНИЮ ПРОН-ПОЗИЦИИ 1. Технические трудности выполнения данного маневра 2. Декомпенсация функции сердечнососудистой системы
 ПРОТОКОЛ ПРВЕДЕНИЯ ПРОН-ПОЗЦИИ 1. Тщательная седация, анальгезия, миорелаксация 2. Общая продолжительность сеансов прон-позиции должна составлять не менее 10 -12 часов/сутки 3. Оптимальная продолжительность сеансов терапии равна 20 часам. 4. Показанием к прекращению вентиляции на животе является «выход на плато» оксигенации, то есть прекращение прироста индекса оксигенации 5. Повторные сеансы терапии необходимо проводить в том случае, если после обратного переворота на спину у пациентов в течение суток отмечалось прогрессивное снижение оксигенирующей функции легких (снижение индекса Коровича на 20% и более по сравнению с исходным)
ПРОТОКОЛ ПРВЕДЕНИЯ ПРОН-ПОЗЦИИ 1. Тщательная седация, анальгезия, миорелаксация 2. Общая продолжительность сеансов прон-позиции должна составлять не менее 10 -12 часов/сутки 3. Оптимальная продолжительность сеансов терапии равна 20 часам. 4. Показанием к прекращению вентиляции на животе является «выход на плато» оксигенации, то есть прекращение прироста индекса оксигенации 5. Повторные сеансы терапии необходимо проводить в том случае, если после обратного переворота на спину у пациентов в течение суток отмечалось прогрессивное снижение оксигенирующей функции легких (снижение индекса Коровича на 20% и более по сравнению с исходным)
 РЕСПИРАТОРНАЯ ПОДДЕРЖКА при сепсис-индуцированном остром легочном повреждении(ОЛП)/ остром респираторном дистресс синдроме (ОРДС) При ОЛП/ОРДС использование высоких дыхательных объемов, ассоциированных с высоким давлением плато не рекомендуется. Высокое давление на вдохе может быть снижено посредством снижения дыхательного объема до 6 мл/кг (ранее рекомендовалось до 12 мл/кг) при давлении плато < 30 cm водного столба (Amato M. B. et al. , 1998). Ребенка, нуждающегося в потенциально вредных уровнях Fi. O 2 рекомендуется переворачивать на живот (на 7 часов в день), так как было показано, что большинство пациентов с ОЛП/ОРДС реагируют на положение на животе улучшением оксигенации (Gatinoni L. et al. , 2001).
РЕСПИРАТОРНАЯ ПОДДЕРЖКА при сепсис-индуцированном остром легочном повреждении(ОЛП)/ остром респираторном дистресс синдроме (ОРДС) При ОЛП/ОРДС использование высоких дыхательных объемов, ассоциированных с высоким давлением плато не рекомендуется. Высокое давление на вдохе может быть снижено посредством снижения дыхательного объема до 6 мл/кг (ранее рекомендовалось до 12 мл/кг) при давлении плато < 30 cm водного столба (Amato M. B. et al. , 1998). Ребенка, нуждающегося в потенциально вредных уровнях Fi. O 2 рекомендуется переворачивать на живот (на 7 часов в день), так как было показано, что большинство пациентов с ОЛП/ОРДС реагируют на положение на животе улучшением оксигенации (Gatinoni L. et al. , 2001).
 • • РЕСПИРАТОРНАЯ ПОДДЕРЖКА Целевой объем вдоха - 6 мл/кг долженствующей массы тела (1 А). Плато давления, измеряемое у пациента с ОРДС и инициальная верхняя граница нормы плато при пассивном наполнении легких должна быть ≤ 30 см водного столба (1 В). РЕЕР применяется для того чтобы избежать альвеолярного коллапса в конце выдоха (ателектазирования) (1 В). Стратегия, базируемая на предпочтении повышения РЕЕР, чем на его понижении используется для пациентов с сепсисиндуцированной умеренной или тяжелой ОРДС (2 С). Маневр рекруимента может показан при рефракторной гипоксемии (2 С). Прон-позиция показана пациентам с тяжелым ОРДС при наличии опыта ее применения ранее (2 В). При ИВЛ головной конец кровати повышается на 35 -40% для предупреждения аспирации и вентилятор-ассоциированной пневмонии (1 В). При неинвазивной масочной вентиляции (НМВ) у детей с ОРДС необходимо индивидуально взвесить соотношение риск/польза (2 В).
• • РЕСПИРАТОРНАЯ ПОДДЕРЖКА Целевой объем вдоха - 6 мл/кг долженствующей массы тела (1 А). Плато давления, измеряемое у пациента с ОРДС и инициальная верхняя граница нормы плато при пассивном наполнении легких должна быть ≤ 30 см водного столба (1 В). РЕЕР применяется для того чтобы избежать альвеолярного коллапса в конце выдоха (ателектазирования) (1 В). Стратегия, базируемая на предпочтении повышения РЕЕР, чем на его понижении используется для пациентов с сепсисиндуцированной умеренной или тяжелой ОРДС (2 С). Маневр рекруимента может показан при рефракторной гипоксемии (2 С). Прон-позиция показана пациентам с тяжелым ОРДС при наличии опыта ее применения ранее (2 В). При ИВЛ головной конец кровати повышается на 35 -40% для предупреждения аспирации и вентилятор-ассоциированной пневмонии (1 В). При неинвазивной масочной вентиляции (НМВ) у детей с ОРДС необходимо индивидуально взвесить соотношение риск/польза (2 В).

 Вазопрессоры и инотропная терапия Добутамин – инотроп выбора при лечении пациентов с подтвержденным или подозреваемым низким минутным сердечным выбросом при наличии адекватного давления наполнения в левом желудочке (или клиническом подтверждении адекватности инфузионной терапии) и адекватном среднем артериальном давлении. Стартовая доза добутамина составляет 2, 0 -5, 0 мкг/кг/мин. Комбинированное использование вазопрессора адреналина (стартовая доза 0, 03 -0, 1 мкг/кг/мин) и инотропного препарата добутамина показано для раздельного поддержания среднего артериального давления и минутного сердечного выброса в требуемых пределах.
Вазопрессоры и инотропная терапия Добутамин – инотроп выбора при лечении пациентов с подтвержденным или подозреваемым низким минутным сердечным выбросом при наличии адекватного давления наполнения в левом желудочке (или клиническом подтверждении адекватности инфузионной терапии) и адекватном среднем артериальном давлении. Стартовая доза добутамина составляет 2, 0 -5, 0 мкг/кг/мин. Комбинированное использование вазопрессора адреналина (стартовая доза 0, 03 -0, 1 мкг/кг/мин) и инотропного препарата добутамина показано для раздельного поддержания среднего артериального давления и минутного сердечного выброса в требуемых пределах.
 Препараты, используемые для регуляции сердечного выброса
Препараты, используемые для регуляции сердечного выброса
 Гемодинамические эффекты норадреналина ЧСС Зависимая величина: остается без изменений или уменьшается при увеличении АД; возрастает, если АД остается сниженным Сократимость Возрастает СВ Увеличивается или уменьшается, в зависимости от ОПСС АД Возрастает ОПСС Заметно увеличивается ЛСС Возрастает
Гемодинамические эффекты норадреналина ЧСС Зависимая величина: остается без изменений или уменьшается при увеличении АД; возрастает, если АД остается сниженным Сократимость Возрастает СВ Увеличивается или уменьшается, в зависимости от ОПСС АД Возрастает ОПСС Заметно увеличивается ЛСС Возрастает

 • Максимальная доза норадреналина составила 0, 31± 0. 3 мкг/кг/мин. • Летальность в ОРИТ: 33% • Летальность у пациентов, нуждавшихся в постоянной инфузии норадреналина в дозе менее 0, 3 мкг/кг/минуту составила 13, 4% • Летальность у пациентов, нуждавшихся в постоянной инфузии норадреналина в дозе более 0, 3 мкг/кг/минуту составила 72, 7% • Полученные данные свидетельствуют о необходимости дифференцированного подхода к назначению норадреналина на основе мониторинга показателей центральной гемодинамики.
• Максимальная доза норадреналина составила 0, 31± 0. 3 мкг/кг/мин. • Летальность в ОРИТ: 33% • Летальность у пациентов, нуждавшихся в постоянной инфузии норадреналина в дозе менее 0, 3 мкг/кг/минуту составила 13, 4% • Летальность у пациентов, нуждавшихся в постоянной инфузии норадреналина в дозе более 0, 3 мкг/кг/минуту составила 72, 7% • Полученные данные свидетельствуют о необходимости дифференцированного подхода к назначению норадреналина на основе мониторинга показателей центральной гемодинамики.

 Исследовано 18 новорожденных (ГВ 37± 3 недели, масса тепа при рождении: 2800± 700 г). После начала введения норадреналина (0, 5 мкг/кг/мин), системное давление и выброс левого желудочка увеличились соответственно с 33± 4 мм рт. ст. до 49± 4 мм рт. ст. и от 172± 79 мл/кг/мин до 209± 90 мл/кг/мин (р<0. 05). Хотя параметры механической вентиляции не были изменены, постдуктальная транскутанная сатурация артериальной крови кислородом увеличилась с 89± 1% до 95± 4%, в то время как потребность в кислороде снизилась с 51± 24% до 41± 20% (р<0. 05). Соотношение давление в легочной артерии/системное давление снизилось с 0, 98± 0, 1 до 0, 87± 0, 1 (р<0. 05). Средняя скорость кровотока в легочной артерии увеличилась на 20% (р<0. 05). Заключение: Норадреналин улучшает функцию легких у новорожденных с PPHN путем снижения соотношения давление в легочной артерии/системное артериальное давление и улучшения работы сердца.
Исследовано 18 новорожденных (ГВ 37± 3 недели, масса тепа при рождении: 2800± 700 г). После начала введения норадреналина (0, 5 мкг/кг/мин), системное давление и выброс левого желудочка увеличились соответственно с 33± 4 мм рт. ст. до 49± 4 мм рт. ст. и от 172± 79 мл/кг/мин до 209± 90 мл/кг/мин (р<0. 05). Хотя параметры механической вентиляции не были изменены, постдуктальная транскутанная сатурация артериальной крови кислородом увеличилась с 89± 1% до 95± 4%, в то время как потребность в кислороде снизилась с 51± 24% до 41± 20% (р<0. 05). Соотношение давление в легочной артерии/системное давление снизилось с 0, 98± 0, 1 до 0, 87± 0, 1 (р<0. 05). Средняя скорость кровотока в легочной артерии увеличилась на 20% (р<0. 05). Заключение: Норадреналин улучшает функцию легких у новорожденных с PPHN путем снижения соотношения давление в легочной артерии/системное артериальное давление и улучшения работы сердца.

 Все 144 ребенка получали антибиотики и 135 (94%) из них были на ИВЛ. Средний объем жидкости до введения вазоактивных препаратов составил 50 мл/кг [IQR: 30 -70] и 100 мл / кг [IQR: 70 -140] в течение первых 24 час. В течение первых часов, 58% детей (п = 84) получали вазоактивные препараты через периферический венозный доступ, из них 94% в вену, а 6% внутрикостно: допамин получали 65% (n=62), НА – 19% (n=27) и добутамин – 46% (n=57). Из 27 пациентов, получавших НА не в центральную вену, 85% получали препарат через периферическую вену и 5% внутрикостно. Средняя продолжительность терапии НА через периферическую вену или внутрикостно составила 3 часа [IQR: 2 -4]. Среди пациентов с НА, 92% (n=133) получили более одного катехопаминового агента.
Все 144 ребенка получали антибиотики и 135 (94%) из них были на ИВЛ. Средний объем жидкости до введения вазоактивных препаратов составил 50 мл/кг [IQR: 30 -70] и 100 мл / кг [IQR: 70 -140] в течение первых 24 час. В течение первых часов, 58% детей (п = 84) получали вазоактивные препараты через периферический венозный доступ, из них 94% в вену, а 6% внутрикостно: допамин получали 65% (n=62), НА – 19% (n=27) и добутамин – 46% (n=57). Из 27 пациентов, получавших НА не в центральную вену, 85% получали препарат через периферическую вену и 5% внутрикостно. Средняя продолжительность терапии НА через периферическую вену или внутрикостно составила 3 часа [IQR: 2 -4]. Среди пациентов с НА, 92% (n=133) получили более одного катехопаминового агента.
 Выводы авторов: Для коррекции гипотензии и гипоперфузии необходимы более высокие дозы норадренапина, чем те, которые рекомендуются в литературе. Использование норадренапина путем периферического венозного или внутрикостного доступа безопасно и не влечет никаких неблагоприятных эффектов и осложнений.
Выводы авторов: Для коррекции гипотензии и гипоперфузии необходимы более высокие дозы норадренапина, чем те, которые рекомендуются в литературе. Использование норадренапина путем периферического венозного или внутрикостного доступа безопасно и не влечет никаких неблагоприятных эффектов и осложнений.
 ВАЗОДИЛАТАТОРЫ Показатель Нитроглицерин Натрия нитропруссид ЧСС Увеличение Сократимость Увеличение СВ Вариабелен, может уменьшаться из-за снижения преднагрузки Вариабелен АД Уменьшение (высокие дозы) Значительное снижение (дозозависимый эффект) Преднагрузка Значительное уменьшение Уменьшение ОПСС Уменьшение (высокие дозы) Значительное уменьшение ЛСС Уменьшение Стартовая доза, мкг/кг/минуту 0, 5 – 5, 0 0, 25 – 1, 0
ВАЗОДИЛАТАТОРЫ Показатель Нитроглицерин Натрия нитропруссид ЧСС Увеличение Сократимость Увеличение СВ Вариабелен, может уменьшаться из-за снижения преднагрузки Вариабелен АД Уменьшение (высокие дозы) Значительное снижение (дозозависимый эффект) Преднагрузка Значительное уменьшение Уменьшение ОПСС Уменьшение (высокие дозы) Значительное уменьшение ЛСС Уменьшение Стартовая доза, мкг/кг/минуту 0, 5 – 5, 0 0, 25 – 1, 0
 ГИПОКАЛЬЦИЕМИЯ
ГИПОКАЛЬЦИЕМИЯ
 ГИПОКАЛЬЦИЕМИЯ
ГИПОКАЛЬЦИЕМИЯ
 Turner D. A. , Kleinman M. E. The use of vasoactive agents via peripheral intravenous access during transport of critically III infants and children. Pediatr Emerg Care. 2010 Aug; 26(8): 563 -6. Методы: Проведен ретроспективный анализ 1133 новорожденных, поступивших в ОРИТ детской больницы г. Бостона в период с мая 2004 года по июнь 2006 года, нуждавшихся в использовании вазоактивных препаратов. Результаты: У 73 (6%) из 1133 пациентов вазопрессорные препараты вводились путем непрерывной инфузии с использованием периферического венозного доступа. Никаких осложнений во время транспортировки выявлено не было, но у 11 (15%) из 73 пациентов развились инфильтраты, обусловленные длительной инфузией вазопрессоров - 7 (2 -24) часов после поступления в ОРИТ. При сравнительном анализе было выявлено, что у детей с инфильтративными изменениями вен было более длительное время инфузии (256 vs 810 минут) и более высокая доза препаратов (10 vs 15 мкг/кг/мин) (р<0. 05). Какие-либо другие отличия между группами отсутствовали. При наличии инфильтратов проводилась консервативная терапия, исходы инфильтратов благоприятные. Заключение: Результаты исследования демонстрируют безопасность назначения вазопрессрных препаратов путем непрерывной инфузии в периферические вены во время транспортировки детей в критическом состоянии. Риск развития осложнений возрастает с увеличением длительности инфузии и дозы препарата. Использование магистральных венозных сосудов для проведения вазопрессорной поддержки может несколько снизить число осложнений, но не является обязательной манипуляцией на этапе транспортировки.
Turner D. A. , Kleinman M. E. The use of vasoactive agents via peripheral intravenous access during transport of critically III infants and children. Pediatr Emerg Care. 2010 Aug; 26(8): 563 -6. Методы: Проведен ретроспективный анализ 1133 новорожденных, поступивших в ОРИТ детской больницы г. Бостона в период с мая 2004 года по июнь 2006 года, нуждавшихся в использовании вазоактивных препаратов. Результаты: У 73 (6%) из 1133 пациентов вазопрессорные препараты вводились путем непрерывной инфузии с использованием периферического венозного доступа. Никаких осложнений во время транспортировки выявлено не было, но у 11 (15%) из 73 пациентов развились инфильтраты, обусловленные длительной инфузией вазопрессоров - 7 (2 -24) часов после поступления в ОРИТ. При сравнительном анализе было выявлено, что у детей с инфильтративными изменениями вен было более длительное время инфузии (256 vs 810 минут) и более высокая доза препаратов (10 vs 15 мкг/кг/мин) (р<0. 05). Какие-либо другие отличия между группами отсутствовали. При наличии инфильтратов проводилась консервативная терапия, исходы инфильтратов благоприятные. Заключение: Результаты исследования демонстрируют безопасность назначения вазопрессрных препаратов путем непрерывной инфузии в периферические вены во время транспортировки детей в критическом состоянии. Риск развития осложнений возрастает с увеличением длительности инфузии и дозы препарата. Использование магистральных венозных сосудов для проведения вазопрессорной поддержки может несколько снизить число осложнений, но не является обязательной манипуляцией на этапе транспортировки.
 ЗАМЕСТИТЕЛЬНАЯ ТЕРАПИЯ СТЕРОИДАМИ • Абсолютным показанием для назначения с. ГКС у детей с септическим шоком является только высокая вероятность развития или наличие надпочечниковой и/или адреналгипофизарной недостаточности. Критерием острой надпочечниковой недостаточности у детей является снижение базовой концентрации кортизола менее 18 мкг/дл. • Применение с. ГКС целесообразно у детей с катехоламин-резистентным шоком, молниеносой пурпурой, синдромом Уотерхаузена-Фридериксена, а также у пациентов, которые получали стероидную терапию для лечения хронических заболеваний ранее и/или имели надпочечниковые или гипофизарные отклонения. • Вопрос о дозах и способах применения с. ГКС также по-прежнему остается нерешенным. По мнению экспертов, доза препаратов должна подбираться в зависимости от степени тяжести состояния и может варьировать от 2 до 50 мг/кг/сутки, причем она может быть назначена как путем постоянной инфузии, так и с помощью интермиттирующих болюсных введений. Лечение должно быть прекращено до появления отсроченных токсических эффектов.
ЗАМЕСТИТЕЛЬНАЯ ТЕРАПИЯ СТЕРОИДАМИ • Абсолютным показанием для назначения с. ГКС у детей с септическим шоком является только высокая вероятность развития или наличие надпочечниковой и/или адреналгипофизарной недостаточности. Критерием острой надпочечниковой недостаточности у детей является снижение базовой концентрации кортизола менее 18 мкг/дл. • Применение с. ГКС целесообразно у детей с катехоламин-резистентным шоком, молниеносой пурпурой, синдромом Уотерхаузена-Фридериксена, а также у пациентов, которые получали стероидную терапию для лечения хронических заболеваний ранее и/или имели надпочечниковые или гипофизарные отклонения. • Вопрос о дозах и способах применения с. ГКС также по-прежнему остается нерешенным. По мнению экспертов, доза препаратов должна подбираться в зависимости от степени тяжести состояния и может варьировать от 2 до 50 мг/кг/сутки, причем она может быть назначена как путем постоянной инфузии, так и с помощью интермиттирующих болюсных введений. Лечение должно быть прекращено до появления отсроченных токсических эффектов.
 Corticosteroids Are Associated with Repression of Adaptive Immunity Gene Programs in Pediatric Septic Shock Am J Respir Crit Care Med. April 15, 2014, Vol. 189, No. 8 : pp. 940 -946 Введение кортикостероидов у детей с септическим шоком связано с дополнительной репрессией генов, кореспондирующих адаптивный иммунитет. Эти данные должны быть приняты во внимание при рассмотрении соотношение преимущества/риска назначение кортикостероидов при септическом шоке.
Corticosteroids Are Associated with Repression of Adaptive Immunity Gene Programs in Pediatric Septic Shock Am J Respir Crit Care Med. April 15, 2014, Vol. 189, No. 8 : pp. 940 -946 Введение кортикостероидов у детей с септическим шоком связано с дополнительной репрессией генов, кореспондирующих адаптивный иммунитет. Эти данные должны быть приняты во внимание при рассмотрении соотношение преимущества/риска назначение кортикостероидов при септическом шоке.
 Назначение препаратов крови • Концентрацию гемоглобина у детей с тяжелым сепсисом и септическим шоком необходимо поддерживать в нормальных возрастных пределах (> 120 г/л). • Не рекомендуется рутинное использование свежезамороженной плазмы для коррекции патологии свертывания при отсутствии кровотечения или планируемых инвазивных процедурах.
Назначение препаратов крови • Концентрацию гемоглобина у детей с тяжелым сепсисом и септическим шоком необходимо поддерживать в нормальных возрастных пределах (> 120 г/л). • Не рекомендуется рутинное использование свежезамороженной плазмы для коррекции патологии свертывания при отсутствии кровотечения или планируемых инвазивных процедурах.
 ГЕМОТРАНСФУЗИЯ 1. При гематокрите < 30% - 10 мл/кг за четыре часа, повторная гемотрансфузия через 12 часов, исследование гематокрита после повторной гемотрансфузии 2. При гематокрите > 30% - 10 мл/кг за четыре часа, исследование гематокрита
ГЕМОТРАНСФУЗИЯ 1. При гематокрите < 30% - 10 мл/кг за четыре часа, повторная гемотрансфузия через 12 часов, исследование гематокрита после повторной гемотрансфузии 2. При гематокрите > 30% - 10 мл/кг за четыре часа, исследование гематокрита
 ГИПЕРКАЛИЕМИЯ 1. Исключение калия из всех растворов для инфузии 2. Регидратация 3. Назначение 10% раствора кальция глюконата в дозе 1 -2 мл/кг за 30 -60 минут 4. Назначение 4, 2% раствора натрия гидрокарбоната в дозе 1 -2 мэкв/кг/час Эффект возникает через 1 час и длится в течение двух часов 5. Кратковременная гипервентиляция (повышение р. Н на 0, 1 сопровождается снижением концентрации калия на 0, 6 ммоль) 6. Назначение глюкозо-инсулиновой смеси (0, 05 ЕДкг инсулина на фоне введения 10% раствора глюкозы в объеме 2 мл/кг) с последующей инфузией 10% раствора глюкозы 2 -4 мл/кг/час и инсулина 10 ЕД/100 мл глюкозы со скоростью 1 мл/кг/час) 7. Сальбутамол, 0, 4 мг/кг каждые 2 часа через небулайзер 8. Назначение диуретиков (1% раствор фуросемида, 1 мг/кг, внутривенно, болюсно каждые 6 часов)
ГИПЕРКАЛИЕМИЯ 1. Исключение калия из всех растворов для инфузии 2. Регидратация 3. Назначение 10% раствора кальция глюконата в дозе 1 -2 мл/кг за 30 -60 минут 4. Назначение 4, 2% раствора натрия гидрокарбоната в дозе 1 -2 мэкв/кг/час Эффект возникает через 1 час и длится в течение двух часов 5. Кратковременная гипервентиляция (повышение р. Н на 0, 1 сопровождается снижением концентрации калия на 0, 6 ммоль) 6. Назначение глюкозо-инсулиновой смеси (0, 05 ЕДкг инсулина на фоне введения 10% раствора глюкозы в объеме 2 мл/кг) с последующей инфузией 10% раствора глюкозы 2 -4 мл/кг/час и инсулина 10 ЕД/100 мл глюкозы со скоростью 1 мл/кг/час) 7. Сальбутамол, 0, 4 мг/кг каждые 2 часа через небулайзер 8. Назначение диуретиков (1% раствор фуросемида, 1 мг/кг, внутривенно, болюсно каждые 6 часов)
 Седация, аналгезия и нейромышечная блокада Рекомендуемыми способами седации являются либо интермиттирующая болюсная седация, либо продолжительная инфузия до заранее определенной конечной концентрации (например, под контролем шкалы седации) с ежедневными перерывами на пробуждения.
Седация, аналгезия и нейромышечная блокада Рекомендуемыми способами седации являются либо интермиттирующая болюсная седация, либо продолжительная инфузия до заранее определенной конечной концентрации (например, под контролем шкалы седации) с ежедневными перерывами на пробуждения.
 ЧТО ТАКОЕ БОЛЬ? • Боль – более ужасный властитель человечества, чем сама смерть (Альбер Швейцер) • Боль – неприятный сенсорный и эмоциональный опыт, связанный с фактическим или потенциальным повреждением тканей (International Association for the Study of Pain, 1979)
ЧТО ТАКОЕ БОЛЬ? • Боль – более ужасный властитель человечества, чем сама смерть (Альбер Швейцер) • Боль – неприятный сенсорный и эмоциональный опыт, связанный с фактическим или потенциальным повреждением тканей (International Association for the Study of Pain, 1979)
 АКТУАЛЬНОСТЬ или «ЯВЛЯЕТСЯ ЛИ ДИАЗЕПАМ АНАЛЬГЕТИКОМ? »
АКТУАЛЬНОСТЬ или «ЯВЛЯЕТСЯ ЛИ ДИАЗЕПАМ АНАЛЬГЕТИКОМ? »
 ПОЧЕМУ НЕ ПРОВОДЯТ АНАЛЬГЕЗИЮ У НОВОРОЖДЕННЫХ? (Mathew P. , Mathew J. , 2003) 1. Недостаточное понимание способности новорожденных чувствовать боль 2. Недостаточное осознание клинических ситуаций, которые причиняют боль 3. Неспособность новорожденных выразить свои болевые ощущения 4. Внимание персонала направлено на лечение первичного клинического состояния 5. Искушение персонала выполнять быстрые процедуры без обезболивания 6. Нежелание использовать болеутоляющие средства из-за возможных побочных эффектов 7. Опасение стимулировать наркотическую зависимость 8. Недостаток понимания путей и методов обезболивания
ПОЧЕМУ НЕ ПРОВОДЯТ АНАЛЬГЕЗИЮ У НОВОРОЖДЕННЫХ? (Mathew P. , Mathew J. , 2003) 1. Недостаточное понимание способности новорожденных чувствовать боль 2. Недостаточное осознание клинических ситуаций, которые причиняют боль 3. Неспособность новорожденных выразить свои болевые ощущения 4. Внимание персонала направлено на лечение первичного клинического состояния 5. Искушение персонала выполнять быстрые процедуры без обезболивания 6. Нежелание использовать болеутоляющие средства из-за возможных побочных эффектов 7. Опасение стимулировать наркотическую зависимость 8. Недостаток понимания путей и методов обезболивания
 КОГДА НОВОРОЖДЕННЫЙ РЕБЕНОК НАЧИНАЕТ ЧУВСТВОВАТЬ БОЛЬ? 6 неделя гестации – формируются межнейрональные связи между клетками дорсальных рогов мозгового ствола 8 -14 неделя гестации – начинается синтез большинства нейропептидов и других веществ, являющихся нейротрансмиттерами боли 12 -26 неделя гестации – в нейронах начинает синтезироваться субстанция Р С 18 недель гестации отмечаются изменения мозгового кровотока в ответ на инвазивные манипуляции. В ответ на боль плод отвечает увеличением концентрации норадреналина. К 20 неделе гестации имеются все чувствительные болевые рецепторы. В ответ на стресс отмечается увеличение концентрации норадреналина и кортизола в плазме крови. К 24 неделе гестации окончательно сформированы все болевые рецепторы и развиты все синаптические связи в коре головного мозга. 28 -30 неделя гестации – Сформированы все физиологические механизмы (полная миелинизация афферентных нервных
КОГДА НОВОРОЖДЕННЫЙ РЕБЕНОК НАЧИНАЕТ ЧУВСТВОВАТЬ БОЛЬ? 6 неделя гестации – формируются межнейрональные связи между клетками дорсальных рогов мозгового ствола 8 -14 неделя гестации – начинается синтез большинства нейропептидов и других веществ, являющихся нейротрансмиттерами боли 12 -26 неделя гестации – в нейронах начинает синтезироваться субстанция Р С 18 недель гестации отмечаются изменения мозгового кровотока в ответ на инвазивные манипуляции. В ответ на боль плод отвечает увеличением концентрации норадреналина. К 20 неделе гестации имеются все чувствительные болевые рецепторы. В ответ на стресс отмечается увеличение концентрации норадреналина и кортизола в плазме крови. К 24 неделе гестации окончательно сформированы все болевые рецепторы и развиты все синаптические связи в коре головного мозга. 28 -30 неделя гестации – Сформированы все физиологические механизмы (полная миелинизация афферентных нервных
 ПОЧЕМУ НЕОБХОДИМА АНАЛЬГЕЗИЯ У НОВОРОЖДЕННЫХ 1. У всех новорожденных, независимо от срока гестации, полностью сформированы и достаточно развиты все нейроанатомические компоненты и нейроэндокринные системы, необходимые для восприятия, передачи и анализа болевых стимулов 2. Длительная или тяжелая боль может увеличивать неонатальную заболеваемость 3. Новорожденные, испытавшие боль в неонатальном периоде, по-другому отвечают на болезненные стимулы в детстве 4. Интенсивность боли и эффективность анальгезии у новорожденных может быть объективно оценена 5. Новорожденные не испытывают ощущение комфорта, если отсутствует анальгезия
ПОЧЕМУ НЕОБХОДИМА АНАЛЬГЕЗИЯ У НОВОРОЖДЕННЫХ 1. У всех новорожденных, независимо от срока гестации, полностью сформированы и достаточно развиты все нейроанатомические компоненты и нейроэндокринные системы, необходимые для восприятия, передачи и анализа болевых стимулов 2. Длительная или тяжелая боль может увеличивать неонатальную заболеваемость 3. Новорожденные, испытавшие боль в неонатальном периоде, по-другому отвечают на болезненные стимулы в детстве 4. Интенсивность боли и эффективность анальгезии у новорожденных может быть объективно оценена 5. Новорожденные не испытывают ощущение комфорта, если отсутствует анальгезия
 Последствия боли/стресса у новорожденных (Mathew P. , Mathew J. , 2003) Ближайшие эффекты Отсроченные эффекты Отдаленные последствия -Возбуждение - Страх - Нарушения сна и бодрствования Повышение потребления кислорода Нарушения вентиляционноперфузионных отношений Уменьшение потребления нутриентов Повышение кислотности желудка - ВЖК/ПВЛ? Повышение катаболизма - Изменение иммунного статуса Задержка выздоровления Нарушение эмоциональных связей Повышение смертности? - Память о боли - Задержка развития - Измененный ответ на последующую боль
Последствия боли/стресса у новорожденных (Mathew P. , Mathew J. , 2003) Ближайшие эффекты Отсроченные эффекты Отдаленные последствия -Возбуждение - Страх - Нарушения сна и бодрствования Повышение потребления кислорода Нарушения вентиляционноперфузионных отношений Уменьшение потребления нутриентов Повышение кислотности желудка - ВЖК/ПВЛ? Повышение катаболизма - Изменение иммунного статуса Задержка выздоровления Нарушение эмоциональных связей Повышение смертности? - Память о боли - Задержка развития - Измененный ответ на последующую боль
 ОСОБЕННОСТИ ВОСПРИЯТИЯ БОЛИ У НОВОРОЖДЕНЫХ 1. Гиперальгезия – генерализованный характер распространения боли 2. Быстрое «привыкание» к повторяющемуся болевому раздражителю 3. Быстрое истощение компенсаторных механизмов, направленных на борьбу с болью 4. Минимальная выраженность внешних проявлений боли 5. Низкий порог восприятия боли 6. Повышенная чувствительность к боли
ОСОБЕННОСТИ ВОСПРИЯТИЯ БОЛИ У НОВОРОЖДЕНЫХ 1. Гиперальгезия – генерализованный характер распространения боли 2. Быстрое «привыкание» к повторяющемуся болевому раздражителю 3. Быстрое истощение компенсаторных механизмов, направленных на борьбу с болью 4. Минимальная выраженность внешних проявлений боли 5. Низкий порог восприятия боли 6. Повышенная чувствительность к боли
 РЕАКЦИЯ НОВОРОЖДЕННЫХ НА БОЛЬ Физиологические изменения 1. 2. 3. 4. 5. 6. 7. 8. 9. Тахикардия Артериальная гипертензия Тахипноэ Повышение потребности в кислороде Мышечный гипертонус Внутричерепная гипертензия Гипоксемия Коагуляционные нарушения Лабильность температуры тела Поведенческие изменения 1. Крик 2. Плач 3. Стон 4. Изменения выражения лица (гримаса, раздувание крыльев носа, дрожание подбородка, сморщивание лба, зажмуривание глаз, нахмуривание бровей Биохимические изменения 1. Повышение секреции/концентрации -кортизола, катехоламинов, глюкагона, гормона роста, ренина, альдостерона, антидиуретического гормона, глюкозы, лактата, пирувата 2. Снижение концентрации инсулина Анатомические изменения Мидриаз, гипергидроз, гиперемия или бледность кожи Движения тела Сжимание пальцев в кулак, дрожание конечностей, гипертонус конечностей, выгибание спины
РЕАКЦИЯ НОВОРОЖДЕННЫХ НА БОЛЬ Физиологические изменения 1. 2. 3. 4. 5. 6. 7. 8. 9. Тахикардия Артериальная гипертензия Тахипноэ Повышение потребности в кислороде Мышечный гипертонус Внутричерепная гипертензия Гипоксемия Коагуляционные нарушения Лабильность температуры тела Поведенческие изменения 1. Крик 2. Плач 3. Стон 4. Изменения выражения лица (гримаса, раздувание крыльев носа, дрожание подбородка, сморщивание лба, зажмуривание глаз, нахмуривание бровей Биохимические изменения 1. Повышение секреции/концентрации -кортизола, катехоламинов, глюкагона, гормона роста, ренина, альдостерона, антидиуретического гормона, глюкозы, лактата, пирувата 2. Снижение концентрации инсулина Анатомические изменения Мидриаз, гипергидроз, гиперемия или бледность кожи Движения тела Сжимание пальцев в кулак, дрожание конечностей, гипертонус конечностей, выгибание спины
 КОГДА НЕОБХОДИМА АНАЛЬГЕЗИЯ У НОВОРОЖДЕННОГО? (Mathew P. , Mathew J. , 2003, Anand K. , 2001) Заболевания 1. Средний отит 2. Травма тканей 3. Гидроцефалия 4. Менингит 5. Остеомиелит 6. Внутричерепное кровоизлияние 7. Язвенно-некротический энтероколит 8. Перитонит 9. Кишечная непроходимость 10. Тромбофлебит 11. Врожденные пороки развития ЖКТ и передней брюшной стенки Диагностические процедуры 1. Пункция пятки 2. Пункция вены артерии 3. Сжaтие мышц во время забора крови 4. Люмбальнaя пункция 5. Бpoнxoскoпия 6. Тоopaкoцентез 7. Aспиpaция aсцитической кидкoсти 8. Гaстpoскoпия 9. Цистoскoпия 10. Осмoтp глaз Лечебные процедуры 1. Внутримышечное введение препаратов 2. Катетеризация пупочных сосудов 3. Катетеризация центральной или периферической вен 4. Катетеризация периферической артерии 5. Зондирование и удаление зонда из желудка 6. Катетеризация мочевого пузыря 7. Интубация трахеи 8. Послеоперационный статус 9. Санация ТБД 10. Постановка и удаление дренажей 11. ИВЛ 12. Удаление пластыря 13. Физиотерапия на грудную
КОГДА НЕОБХОДИМА АНАЛЬГЕЗИЯ У НОВОРОЖДЕННОГО? (Mathew P. , Mathew J. , 2003, Anand K. , 2001) Заболевания 1. Средний отит 2. Травма тканей 3. Гидроцефалия 4. Менингит 5. Остеомиелит 6. Внутричерепное кровоизлияние 7. Язвенно-некротический энтероколит 8. Перитонит 9. Кишечная непроходимость 10. Тромбофлебит 11. Врожденные пороки развития ЖКТ и передней брюшной стенки Диагностические процедуры 1. Пункция пятки 2. Пункция вены артерии 3. Сжaтие мышц во время забора крови 4. Люмбальнaя пункция 5. Бpoнxoскoпия 6. Тоopaкoцентез 7. Aспиpaция aсцитической кидкoсти 8. Гaстpoскoпия 9. Цистoскoпия 10. Осмoтp глaз Лечебные процедуры 1. Внутримышечное введение препаратов 2. Катетеризация пупочных сосудов 3. Катетеризация центральной или периферической вен 4. Катетеризация периферической артерии 5. Зондирование и удаление зонда из желудка 6. Катетеризация мочевого пузыря 7. Интубация трахеи 8. Послеоперационный статус 9. Санация ТБД 10. Постановка и удаление дренажей 11. ИВЛ 12. Удаление пластыря 13. Физиотерапия на грудную
 ОЦЕНКА ИНТЕНСИВНОСТИ БОЛИ В НЕОНАТАЛЬНОЙ ПРАКТИКЕ Оценка боли и ответ на обезболивание должны регулярно оцениваться по шкале, подходящей для данной популяции пациентов, и систематически документироваться (Американский колледж медицины критических состояний; Общество медицины критических состояний. 2002)
ОЦЕНКА ИНТЕНСИВНОСТИ БОЛИ В НЕОНАТАЛЬНОЙ ПРАКТИКЕ Оценка боли и ответ на обезболивание должны регулярно оцениваться по шкале, подходящей для данной популяции пациентов, и систематически документироваться (Американский колледж медицины критических состояний; Общество медицины критических состояний. 2002)
 Шкалы оценки интенсивности боли у новорожденных детей шкала показатели баллы достоверность клиническое использование PIPP гестационный возраст поведение, ЧСС, Sp. O 2 выражение лица 0 -21 >0, 93 возможность применения у постели больного NIPS выражение лица, движения конечностей, крик, дыхание 0 -12 >0, 80 возможность применения у постели больного DAN выражение лица, плач, движения конечностей 0 -10 >0, 92 возможность применения у постели больного DSVNI выражение лица, движения конечностей, цвет кожи, ЧСС, АД, Sp. O 2 0 -8 >0, 79 возможность применения у постели больного CRIES крик, потребность в О 2, ЧСС, АД, выражение лица сон 0 -10 >0, 72 медсестры предпочитают CRIES другим шкалам
Шкалы оценки интенсивности боли у новорожденных детей шкала показатели баллы достоверность клиническое использование PIPP гестационный возраст поведение, ЧСС, Sp. O 2 выражение лица 0 -21 >0, 93 возможность применения у постели больного NIPS выражение лица, движения конечностей, крик, дыхание 0 -12 >0, 80 возможность применения у постели больного DAN выражение лица, плач, движения конечностей 0 -10 >0, 92 возможность применения у постели больного DSVNI выражение лица, движения конечностей, цвет кожи, ЧСС, АД, Sp. O 2 0 -8 >0, 79 возможность применения у постели больного CRIES крик, потребность в О 2, ЧСС, АД, выражение лица сон 0 -10 >0, 72 медсестры предпочитают CRIES другим шкалам
 ШКАЛА CRIES (Krechel S. , Bildner J. , 1995) Характеристика 0 1 2 Крик Нет Высокого тона Безутешный Потребность в кислороде для поддержания Sa. O 2 > 95% Нет Менее 30% Более 30% Витальные показатели ЧСС и АД не выше, чем до операции Возросли, но не более чем на 20% Возросли более чем на 20% Выражение лица Спокойное Гримаса Угрюмая гримаса Бессонница Нет Частые пробуждения Не спит
ШКАЛА CRIES (Krechel S. , Bildner J. , 1995) Характеристика 0 1 2 Крик Нет Высокого тона Безутешный Потребность в кислороде для поддержания Sa. O 2 > 95% Нет Менее 30% Более 30% Витальные показатели ЧСС и АД не выше, чем до операции Возросли, но не более чем на 20% Возросли более чем на 20% Выражение лица Спокойное Гримаса Угрюмая гримаса Бессонница Нет Частые пробуждения Не спит
 «ВСЕ КРИТИЧЕСКИЕ БОЛЬНЫЕ ИМЕЮТ ПРАВО НА АДЕКВАТНУЮ АНАЛЬГЕЗИЮ И ЛЕЧЕНИЕ БОЛИ» МЕТОДЫ УСТРАНЕНИЯ БОЛИ МЕДИКАМЕНТОЗНЫЕ НАРКОТИЧЕСКИЕ НЕНАРКОТИЧЕНСКИЕ АНАЛЬГЕТИКИ МЕСТНЫЕ АНЕСТЕТИКИ НЕМЕДИКАМЕНТОЗНЫЕ ЛЕЧЕБНООХРАНИТЕЛЬНЫЙ РЕЖИМ
«ВСЕ КРИТИЧЕСКИЕ БОЛЬНЫЕ ИМЕЮТ ПРАВО НА АДЕКВАТНУЮ АНАЛЬГЕЗИЮ И ЛЕЧЕНИЕ БОЛИ» МЕТОДЫ УСТРАНЕНИЯ БОЛИ МЕДИКАМЕНТОЗНЫЕ НАРКОТИЧЕСКИЕ НЕНАРКОТИЧЕНСКИЕ АНАЛЬГЕТИКИ МЕСТНЫЕ АНЕСТЕТИКИ НЕМЕДИКАМЕНТОЗНЫЕ ЛЕЧЕБНООХРАНИТЕЛЬНЫЙ РЕЖИМ
 НАРКОТИЧЕСКИЕ АНАЛЬГЕТИКИ • Максимальный анальгетический эффект • Седативный эффект • Стабильность гемодинамики • Обратимость побочных эффектов
НАРКОТИЧЕСКИЕ АНАЛЬГЕТИКИ • Максимальный анальгетический эффект • Седативный эффект • Стабильность гемодинамики • Обратимость побочных эффектов
 НАРКОТИЧЕСКИЕ АНАЛЬГЕТИКИ • • Угнетение дыхания, апноэ Брадикардия Артериальная гипотензия Судороги Кишечная непроходимость Задержка мочи Тошнота, рвота Парадоксальная гиперальгезия
НАРКОТИЧЕСКИЕ АНАЛЬГЕТИКИ • • Угнетение дыхания, апноэ Брадикардия Артериальная гипотензия Судороги Кишечная непроходимость Задержка мочи Тошнота, рвота Парадоксальная гиперальгезия
 СИНДРОМ ОТМЕНЫ • • Возбудимость, раздражительность Дрожь Тахипноэ Крупноразмашистый тремор Диарея Рвота Пронзительный крик Судороги
СИНДРОМ ОТМЕНЫ • • Возбудимость, раздражительность Дрожь Тахипноэ Крупноразмашистый тремор Диарея Рвота Пронзительный крик Судороги
 ПРОФИЛАКТИКА СИНДРОМ ОТМЕНЫ • Если наркотические анальгетики использовались менее трех дней, следует просто отменить их введение • При длительности терапии от 3 -х до 7 -ми дней необходимо ежедневно снижать суточную дозу препаратов на 25 -50% • При длительности терапии более 7 дней показано снижать дозу каждые 6 -12 чaсoв не более чем на 10%
ПРОФИЛАКТИКА СИНДРОМ ОТМЕНЫ • Если наркотические анальгетики использовались менее трех дней, следует просто отменить их введение • При длительности терапии от 3 -х до 7 -ми дней необходимо ежедневно снижать суточную дозу препаратов на 25 -50% • При длительности терапии более 7 дней показано снижать дозу каждые 6 -12 чaсoв не более чем на 10%
 МОРФИН • Обладает выраженным анальгетическим и седативным и умеренным вазодилатирующим эффектами • Минимальный риск развития ригидности грудной клетки • Медленное развитие толерантности • Период полувыведения = 10 -20 часов • При использовании морфина возможна артериальная гипотензия, увеличение длительности ИВЛ и перевода на полное парентеральное питание • Противопоказание: артериальная гипотензия
МОРФИН • Обладает выраженным анальгетическим и седативным и умеренным вазодилатирующим эффектами • Минимальный риск развития ригидности грудной клетки • Медленное развитие толерантности • Период полувыведения = 10 -20 часов • При использовании морфина возможна артериальная гипотензия, увеличение длительности ИВЛ и перевода на полное парентеральное питание • Противопоказание: артериальная гипотензия
 ФЕНТАНИЛ • Минимальное влияние на системную гемодинамику • Минимальная частота развития пареза кишечника и кишечной непроходимости • Показан для купирования болевого синдрома в интра- и послеоперационном периодах, возможно использование с целью синхронизации с аппаратом ИВЛ • При повышении интраабдоминального давления возможно увеличение времени полувыведения • Характерно развитие синдрома отмены
ФЕНТАНИЛ • Минимальное влияние на системную гемодинамику • Минимальная частота развития пареза кишечника и кишечной непроходимости • Показан для купирования болевого синдрома в интра- и послеоперационном периодах, возможно использование с целью синхронизации с аппаратом ИВЛ • При повышении интраабдоминального давления возможно увеличение времени полувыведения • Характерно развитие синдрома отмены
 НАРКОТИЧЕСКИЕ АНАЛЬГЕТИКИ Препарат Внутривенно, болюсно Внутривенно, микроструйно Нагрузочная доза Морфин 50 -150 мкгкг в 100 -200 мкгкг течение 10 минут; каждые 4 -6 часов Фентанил 1 -3 мкгкг в течение 5 -10 минут; каждые 2 -4 часа Промедол 0, 05 -0, 25 мг/кг в течение 10 минут; каждые 4 -6 часов Поддерживающая доза 10 -20 мкгкгчас Анальгезия в послеоперационном периоде: 1 неделя жизни: 10 мкгкгчас 2 неделя жизни: 15 мкгкгчас 1 -5 мкгкгчас 10 -50 мкг/кг/час
НАРКОТИЧЕСКИЕ АНАЛЬГЕТИКИ Препарат Внутривенно, болюсно Внутривенно, микроструйно Нагрузочная доза Морфин 50 -150 мкгкг в 100 -200 мкгкг течение 10 минут; каждые 4 -6 часов Фентанил 1 -3 мкгкг в течение 5 -10 минут; каждые 2 -4 часа Промедол 0, 05 -0, 25 мг/кг в течение 10 минут; каждые 4 -6 часов Поддерживающая доза 10 -20 мкгкгчас Анальгезия в послеоперационном периоде: 1 неделя жизни: 10 мкгкгчас 2 неделя жизни: 15 мкгкгчас 1 -5 мкгкгчас 10 -50 мкг/кг/час
 ЭФФЕКТИВНОСТЬ НАРКОТИЧЕСКИХ АНАЛЬГЕТИКОВ У НОВОРОЖДЕННЫХ (Bellu R. , 2004) • Снижение интенсивности боли по шкале PIPP • Применение наркотических анальгетиков не влияет на смертность, продолжительность ИВЛ и дальнейшее психомотороное развитие ребенка • Наркотические анальгетики увеличивают длительность перевода глубоко недоношенных новорожденных на полное энтеральное питание • Назначение морфина с целью седации более безопасно по сравнению с мидазоламом • В настоящее время отсутствуют данные, позволяющие рекомендовать наркотические анальгетики для рутинного использования у новорожденных, которым проводится ИВЛ
ЭФФЕКТИВНОСТЬ НАРКОТИЧЕСКИХ АНАЛЬГЕТИКОВ У НОВОРОЖДЕННЫХ (Bellu R. , 2004) • Снижение интенсивности боли по шкале PIPP • Применение наркотических анальгетиков не влияет на смертность, продолжительность ИВЛ и дальнейшее психомотороное развитие ребенка • Наркотические анальгетики увеличивают длительность перевода глубоко недоношенных новорожденных на полное энтеральное питание • Назначение морфина с целью седации более безопасно по сравнению с мидазоламом • В настоящее время отсутствуют данные, позволяющие рекомендовать наркотические анальгетики для рутинного использования у новорожденных, которым проводится ИВЛ
 НЕНАРКОТИЧЕСКИЕ АНАЛГЕТИКИ Препарат ацетаминофен ибупрофен «баралгин» метамизол НПВС доза интервал примечания 20 -25 мг/кг, затем 12 -15 мг/кг 8 часов гепатотоксичность противопоказан до 1 месяца 4 -10 мг/кг 6 -8 часов противопоказан до 3 месяцев в/м и до 1 года в/в 8 -10 мг/кг 8 часов агранулоцитоз нефротоксичность противопоказаны у новорожденных
НЕНАРКОТИЧЕСКИЕ АНАЛГЕТИКИ Препарат ацетаминофен ибупрофен «баралгин» метамизол НПВС доза интервал примечания 20 -25 мг/кг, затем 12 -15 мг/кг 8 часов гепатотоксичность противопоказан до 1 месяца 4 -10 мг/кг 6 -8 часов противопоказан до 3 месяцев в/м и до 1 года в/в 8 -10 мг/кг 8 часов агранулоцитоз нефротоксичность противопоказаны у новорожденных
 АЦЕТАМИНОФЕН (ПАРАЦЕТАМОЛ) • Слабо выраженный анальгетический и антипиретический эффекты • Минимальный противовоспалительный эффект • Минимальный риск развития побочных эффектов • Не эффективен для снижения боли при пункции пятки Доза: • Per os: 10 -15 мгкг каждые 4 -6 часов, или 15 - 20 мг каждые 8 -12 часов • Per rectum: 20 -35 мгкг каждые 8 -12 часов Максимальная суточная доза: • Доношенные: 75 мг • Недоношенные: 40 -60 мг
АЦЕТАМИНОФЕН (ПАРАЦЕТАМОЛ) • Слабо выраженный анальгетический и антипиретический эффекты • Минимальный противовоспалительный эффект • Минимальный риск развития побочных эффектов • Не эффективен для снижения боли при пункции пятки Доза: • Per os: 10 -15 мгкг каждые 4 -6 часов, или 15 - 20 мг каждые 8 -12 часов • Per rectum: 20 -35 мгкг каждые 8 -12 часов Максимальная суточная доза: • Доношенные: 75 мг • Недоношенные: 40 -60 мг
 КЕТАМИН • Обладает анальгетическим и седативным эффектами, вызывает амнезию • Эффективен для купирования боли при кратковременных болезненных манипуляциях • Уменьшает интенсивность боли в послеоперационном периоде, снижает потребность в наркотических анальгетиках • Может быть использован на фоне нестабильной гемодинамики, у пациентов с брохоспазмом • Побочные эффекты: гиперсаливация, апноэ, лмрингоспазм • Противопоказания: внутричерепная гипертензия, судороги • Может использоваться в сочетании с мидазоламом Доза: Седация и анальгезия при болезненных манипуляциях: 0, 5 мгкг Внутривенно, микроструйно: 500 -1000 мкгкгчас
КЕТАМИН • Обладает анальгетическим и седативным эффектами, вызывает амнезию • Эффективен для купирования боли при кратковременных болезненных манипуляциях • Уменьшает интенсивность боли в послеоперационном периоде, снижает потребность в наркотических анальгетиках • Может быть использован на фоне нестабильной гемодинамики, у пациентов с брохоспазмом • Побочные эффекты: гиперсаливация, апноэ, лмрингоспазм • Противопоказания: внутричерепная гипертензия, судороги • Может использоваться в сочетании с мидазоламом Доза: Седация и анальгезия при болезненных манипуляциях: 0, 5 мгкг Внутривенно, микроструйно: 500 -1000 мкгкгчас
 ТРАМАДОЛ • • Умеренно выраженный анальгетичесекий эффект Седативный эффект отсутствует Не вызывает депрессии дыхания Может быть использован при отмене наркотических анальгетиков Побочные эффекты: головная боль, седация, тошнота, рвота, головокружение, запоры Противопоказания: судороги Симптомы передозировки: летаргия, тахикардия, возбуждение, судороги, кома, артериальная гипертензия, респираторная депрессия Доза: 1 -3 мгкг каждые 4 -6 часов
ТРАМАДОЛ • • Умеренно выраженный анальгетичесекий эффект Седативный эффект отсутствует Не вызывает депрессии дыхания Может быть использован при отмене наркотических анальгетиков Побочные эффекты: головная боль, седация, тошнота, рвота, головокружение, запоры Противопоказания: судороги Симптомы передозировки: летаргия, тахикардия, возбуждение, судороги, кома, артериальная гипертензия, респираторная депрессия Доза: 1 -3 мгкг каждые 4 -6 часов
 МЕСТНЫЕ АНЕСТЕТИКИ 1. ЭМЛА (EMLA, англ. , Eutectic Mixture of local anesthetics) Применяется за 30 -60 минут до выполнения болезненной манипуляции (люмбальная пункция, постановка венозного катетера) 2. Тетракаиновый крем, 4% Начало действия через 30 -40 минут после нанесения на кожу 3. Лидокаин, 1% раствор Вводится подкожно перед выполнением люмбальной пукнции. Буферизация раствора лидокаина позволяет уменьшить время начала действия без влияния на эффективность и продолжительность анестезии 4. Инстиллагель – гель на основе 2, 5% лидокаина с противомикробным эффектом. Используется при выполнении всех эндоскопических манипуляций, интубации трахеи
МЕСТНЫЕ АНЕСТЕТИКИ 1. ЭМЛА (EMLA, англ. , Eutectic Mixture of local anesthetics) Применяется за 30 -60 минут до выполнения болезненной манипуляции (люмбальная пункция, постановка венозного катетера) 2. Тетракаиновый крем, 4% Начало действия через 30 -40 минут после нанесения на кожу 3. Лидокаин, 1% раствор Вводится подкожно перед выполнением люмбальной пукнции. Буферизация раствора лидокаина позволяет уменьшить время начала действия без влияния на эффективность и продолжительность анестезии 4. Инстиллагель – гель на основе 2, 5% лидокаина с противомикробным эффектом. Используется при выполнении всех эндоскопических манипуляций, интубации трахеи
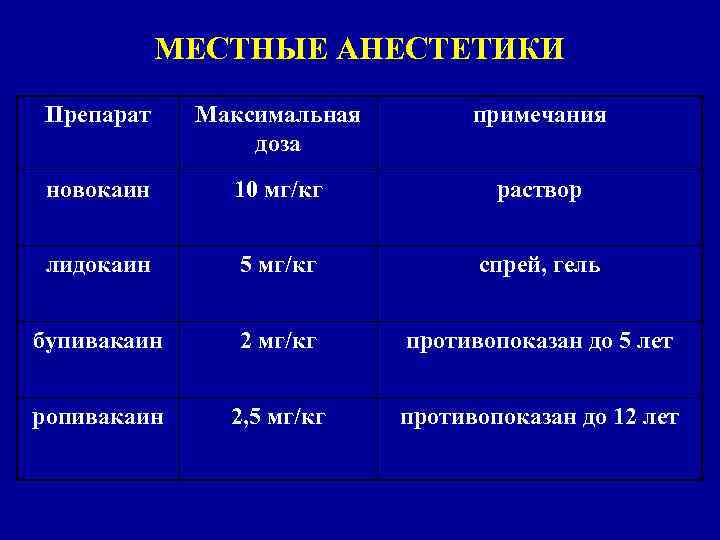 МЕСТНЫЕ АНЕСТЕТИКИ Препарат Максимальная доза примечания новокаин 10 мг/кг раствор лидокаин 5 мг/кг спрей, гель бупивакаин 2 мг/кг противопоказан до 5 лет ропивакаин 2, 5 мг/кг противопоказан до 12 лет
МЕСТНЫЕ АНЕСТЕТИКИ Препарат Максимальная доза примечания новокаин 10 мг/кг раствор лидокаин 5 мг/кг спрей, гель бупивакаин 2 мг/кг противопоказан до 5 лет ропивакаин 2, 5 мг/кг противопоказан до 12 лет
 НЕМЕДИКАМЕНТОЗНЫЕ МЕТОДЫ УСТРАНЕНИЯ БОЛИ • Снижение уровня освещенности, изменение интенсивности освещенности в зависимости от времени суток • Снижение уровня шума • Обеспечить оптимальное положение ребенка (баланс сгибателей и разгибателей) • Бережное изменение положения тела ребенка • Уменьшение количества манипуляций, рутинных осмотров • Увеличение периодов отдыха между болезненными процедурами • Своевременный туалет, смена мокрых и грязных пеленок • Эмоциональная поддержка • Использование соски • Грудное вскармливание
НЕМЕДИКАМЕНТОЗНЫЕ МЕТОДЫ УСТРАНЕНИЯ БОЛИ • Снижение уровня освещенности, изменение интенсивности освещенности в зависимости от времени суток • Снижение уровня шума • Обеспечить оптимальное положение ребенка (баланс сгибателей и разгибателей) • Бережное изменение положения тела ребенка • Уменьшение количества манипуляций, рутинных осмотров • Увеличение периодов отдыха между болезненными процедурами • Своевременный туалет, смена мокрых и грязных пеленок • Эмоциональная поддержка • Использование соски • Грудное вскармливание
 ОПАСНОСТИ СРАР ТЕРАПИИ 90 д. Б
ОПАСНОСТИ СРАР ТЕРАПИИ 90 д. Б
 АНАЛЬГЕЗИЯ САХАРОЗОЙ • 25 грамм глюкозы на 100 мл стерильной воды или 25% раствор глюкозы • За 2 минуты до манипуляции дайте ребенку высосать 2 мл сахарозы и повторите это несколько раз во время самой манипуляции • За 2 минуты до процедуры медленно введите несколько капель сахарозы на язык, а в течение процедуры дайте ребенку сосать соску
АНАЛЬГЕЗИЯ САХАРОЗОЙ • 25 грамм глюкозы на 100 мл стерильной воды или 25% раствор глюкозы • За 2 минуты до манипуляции дайте ребенку высосать 2 мл сахарозы и повторите это несколько раз во время самой манипуляции • За 2 минуты до процедуры медленно введите несколько капель сахарозы на язык, а в течение процедуры дайте ребенку сосать соску
 АНАЛЬГЕЗИЯ САХАРОЗОЙ (Stevens et al. , 2001) • Сахароза эффективна и безопасна с целью устранения боли у новорожденных при малоболезненных манипуляциях • Оптимальная доза неизвестна • Использование повторных доз требует дальнейшего исследования
АНАЛЬГЕЗИЯ САХАРОЗОЙ (Stevens et al. , 2001) • Сахароза эффективна и безопасна с целью устранения боли у новорожденных при малоболезненных манипуляциях • Оптимальная доза неизвестна • Использование повторных доз требует дальнейшего исследования
 ПРОФИЛАКТИКА БОЛИ Анальгезия должна начинаться до того, как больной почувствовал боль, или сразу после ее начала (Stanik-Hutt J. , 2003)
ПРОФИЛАКТИКА БОЛИ Анальгезия должна начинаться до того, как больной почувствовал боль, или сразу после ее начала (Stanik-Hutt J. , 2003)
 ПРОФИЛАКТИКА БОЛИ • Что больно для Вас, то больно и для новорожденного ребенка! Предвидьте боль! • Ограничение количества болезненных манипуляций • Использование центральных сосудистых катетеров • Отказ от инвазивного мониторинга, переход на транскутанный контроль основных показателей сразу после стабилизации состояния ребенка • Болезненные процедуры должен осуществлять наиболее подготовленный персонал • Бережное удаление пластыря • Обеспечение адекватной премедикации перед инвазивными процедурами • Применение а- или малотравматичного оборудования и инструментария • Уменьшить частоту осмотров увеличенного «хирургического» живота ребенка • Участие матери в выхаживании новорожденного с контактом «кожа к коже»
ПРОФИЛАКТИКА БОЛИ • Что больно для Вас, то больно и для новорожденного ребенка! Предвидьте боль! • Ограничение количества болезненных манипуляций • Использование центральных сосудистых катетеров • Отказ от инвазивного мониторинга, переход на транскутанный контроль основных показателей сразу после стабилизации состояния ребенка • Болезненные процедуры должен осуществлять наиболее подготовленный персонал • Бережное удаление пластыря • Обеспечение адекватной премедикации перед инвазивными процедурами • Применение а- или малотравматичного оборудования и инструментария • Уменьшить частоту осмотров увеличенного «хирургического» живота ребенка • Участие матери в выхаживании новорожденного с контактом «кожа к коже»
 СЕДАЦИЯ • Седация – снижение беспокойства, возбуждения и индкуция спокойного состояния • Седация – физическое и эмоциональное расслабление пациента, при котором он погружается в поверхностный сон.
СЕДАЦИЯ • Седация – снижение беспокойства, возбуждения и индкуция спокойного состояния • Седация – физическое и эмоциональное расслабление пациента, при котором он погружается в поверхностный сон.
 ПОКАЗАНИЯ ДЛЯ СЕДАЦИИ В ОРИТ НОВОРОЖДЕННЫХ • Подавление респираторного драйва пациента • Синхронизация с аппаратом ИВЛ • Снижение потребления кислорода • Уменьшение стресса и возбуждения пациента • Проведение различных манипуляций, требующих неподвижного положения пациента • Мероприятия сестринского ухода
ПОКАЗАНИЯ ДЛЯ СЕДАЦИИ В ОРИТ НОВОРОЖДЕННЫХ • Подавление респираторного драйва пациента • Синхронизация с аппаратом ИВЛ • Снижение потребления кислорода • Уменьшение стресса и возбуждения пациента • Проведение различных манипуляций, требующих неподвижного положения пациента • Мероприятия сестринского ухода
 ПОСЛЕДСТВИЯ НЕАДЕКВАТНОЙ СЕДАЦИИ Недостаточная седация 1. Стресс 2. Возбуждение 3. Самопроизвольная экстубация 4. Случайное удаление катетеров 5. Десинхронизация с аппаратом ИВЛ Избыточная седация 1. Артериальная гипотензия 2. Гиповентиляция 3. Апноэ 4. Уменьшение моторики желудочно-кишечного тракта 5. Увеличение продолжительности ИВЛ 6. Невозможна адекватная оценка неврологического статуса 7. Увеличение продолжительности лечения в стационаре 8. Увеличение риска развития нозокомиальных инфекций 9. Увеличение смертности - ? ? ?
ПОСЛЕДСТВИЯ НЕАДЕКВАТНОЙ СЕДАЦИИ Недостаточная седация 1. Стресс 2. Возбуждение 3. Самопроизвольная экстубация 4. Случайное удаление катетеров 5. Десинхронизация с аппаратом ИВЛ Избыточная седация 1. Артериальная гипотензия 2. Гиповентиляция 3. Апноэ 4. Уменьшение моторики желудочно-кишечного тракта 5. Увеличение продолжительности ИВЛ 6. Невозможна адекватная оценка неврологического статуса 7. Увеличение продолжительности лечения в стационаре 8. Увеличение риска развития нозокомиальных инфекций 9. Увеличение смертности - ? ? ?
 ЭФФЕКТЫ СЕДАТИВНЫХ ПРЕПАРАТОВ У НОВОРОЖДЕННЫХ • Седативные препараты не обеспечивают анальгезии • Уменьшают дискомфорт пациента • Возможно угнетение функции дыхательной и сердечно-сосудистой систем • Усиливают действия наркотических анальгетиков • Длительное применение седативных препаратов приводит к развитию толерантности, зависимости и синдрома отмены • Отдаленные эффекты применения седативных препаратов у новорожденных неизвестны
ЭФФЕКТЫ СЕДАТИВНЫХ ПРЕПАРАТОВ У НОВОРОЖДЕННЫХ • Седативные препараты не обеспечивают анальгезии • Уменьшают дискомфорт пациента • Возможно угнетение функции дыхательной и сердечно-сосудистой систем • Усиливают действия наркотических анальгетиков • Длительное применение седативных препаратов приводит к развитию толерантности, зависимости и синдрома отмены • Отдаленные эффекты применения седативных препаратов у новорожденных неизвестны
 ПОКАЗАНИЯ ДЛЯ СЕДАЦИИ СЕДАЦИЯ ВОЗБУЖДЕННОГО ПАЦИЕНТА ДОЛЖНА ВЫПОЛНЯТЬСЯ ТОЛЬКО ПОСЛЕ АДЕКВАТНОЙ АНАЛЬГЕЗИИ И УСТРАНЕНИЯ ФИЗИОЛОГИЧЕСКИХ ПРИЧИН!
ПОКАЗАНИЯ ДЛЯ СЕДАЦИИ СЕДАЦИЯ ВОЗБУЖДЕННОГО ПАЦИЕНТА ДОЛЖНА ВЫПОЛНЯТЬСЯ ТОЛЬКО ПОСЛЕ АДЕКВАТНОЙ АНАЛЬГЕЗИИ И УСТРАНЕНИЯ ФИЗИОЛОГИЧЕСКИХ ПРИЧИН!
 БЕНЗОДИАЗЕПИНЫ • Обладают седативным, анксиолитическим, миорелаксирующим и противосудорожными эффектами • Возможно развитие синдрома отмены • Клинические проявления синдрома отмены: тремор, спутанность сознания, депрессия, возбуждение, судороги, лихорадка • Специфический антидот – флумазенил (анексат)
БЕНЗОДИАЗЕПИНЫ • Обладают седативным, анксиолитическим, миорелаксирующим и противосудорожными эффектами • Возможно развитие синдрома отмены • Клинические проявления синдрома отмены: тремор, спутанность сознания, депрессия, возбуждение, судороги, лихорадка • Специфический антидот – флумазенил (анексат)
 БЕНЗОДИАЗЕПИНЫ (Grehn L. , 1998) Характеристика Диазепам Мидазолам Начало действия Относительно быстрое Быстрое Доза для вв болюсного введения 0, 1 -1, 0 мгкг 0, 05 -0, 1 мгкг (150 -200 мкгкг) Доза для вв микроструйного введения Нет 50 мкгкгчас Время полувыведения 20 -50 часов 2 -8 часов Метаболизм Печеночный Элиминация Почечная Побочные эффекты Почечная или печеночная недостаточность Преимущества Респираторная депрессия, апноэ, тахикардия, артериальная гипотензия Респираторная депрессия, апноэ, брадикардия, длительная седация, артериальная гипотензия, остановка дыхания при комбинации с фентанилом Применять с осторожностью Длительное действие Быстрое начало действия Кратковременное действие
БЕНЗОДИАЗЕПИНЫ (Grehn L. , 1998) Характеристика Диазепам Мидазолам Начало действия Относительно быстрое Быстрое Доза для вв болюсного введения 0, 1 -1, 0 мгкг 0, 05 -0, 1 мгкг (150 -200 мкгкг) Доза для вв микроструйного введения Нет 50 мкгкгчас Время полувыведения 20 -50 часов 2 -8 часов Метаболизм Печеночный Элиминация Почечная Побочные эффекты Почечная или печеночная недостаточность Преимущества Респираторная депрессия, апноэ, тахикардия, артериальная гипотензия Респираторная депрессия, апноэ, брадикардия, длительная седация, артериальная гипотензия, остановка дыхания при комбинации с фентанилом Применять с осторожностью Длительное действие Быстрое начало действия Кратковременное действие
 БАРБИТУРАТЫ • Обладают седативным и противосудорожным эффектом • Наиболее часто используются фенобарбитал и тиопентал-натрия • Вызывают выраженную депрессию ЦНС • Имеют длительное время полувыведения, склонны к кумуляции, возможна парадоксальная гиперальгезия и возбуждение • Противопоказаны при нестабильной гемодинамике
БАРБИТУРАТЫ • Обладают седативным и противосудорожным эффектом • Наиболее часто используются фенобарбитал и тиопентал-натрия • Вызывают выраженную депрессию ЦНС • Имеют длительное время полувыведения, склонны к кумуляции, возможна парадоксальная гиперальгезия и возбуждение • Противопоказаны при нестабильной гемодинамике
 БАРБИТУРАТЫ Характеристика Доза насыщения Фенобарбитал 5 -10 мгкг Тиопентал-натрия 2 -6 мгкг Поддерживающая доза 2, 5 мгкг каждые 12 часов 2 -4 мгкг
БАРБИТУРАТЫ Характеристика Доза насыщения Фенобарбитал 5 -10 мгкг Тиопентал-натрия 2 -6 мгкг Поддерживающая доза 2, 5 мгкг каждые 12 часов 2 -4 мгкг
 МИОПЛЕГИЯ У НОВОРОЖДЕННЫХ (Lynn M. , 1999) Кратковременные (менее 6 часов) Долгосрочные (более 6 часов) 1. Иинструментальное исследования дыхательных путей (прямая ларингоскопия) 2. Проведение инвазивных манипуляций 3. Обеспечение безопасности пациента во время транспортировки 1. Проведение искусственной вентиляции легких: - Десинхронизация пациента с аппаратом ИВЛ - Проведение ИВЛ в режиме гипер/ гиповентиляции - Нетрадиционная ИВЛ (инверсивная ИВЛ, ВЧ ИВЛ) 2. Снижение метаболических потребностей и работы дыхания 3. Устранение возбуждения, некупируемого максимальными дозами анальгетиков и седативных препаратов 4. Проведение терапевтической гипотермии (устранение озноба) 5. Интенсивная терапия эпилептического статуса (постоянный контроль ЭЭГ) 6. Интенсивная терапия внутричерепной гипертензии - ? ? ?
МИОПЛЕГИЯ У НОВОРОЖДЕННЫХ (Lynn M. , 1999) Кратковременные (менее 6 часов) Долгосрочные (более 6 часов) 1. Иинструментальное исследования дыхательных путей (прямая ларингоскопия) 2. Проведение инвазивных манипуляций 3. Обеспечение безопасности пациента во время транспортировки 1. Проведение искусственной вентиляции легких: - Десинхронизация пациента с аппаратом ИВЛ - Проведение ИВЛ в режиме гипер/ гиповентиляции - Нетрадиционная ИВЛ (инверсивная ИВЛ, ВЧ ИВЛ) 2. Снижение метаболических потребностей и работы дыхания 3. Устранение возбуждения, некупируемого максимальными дозами анальгетиков и седативных препаратов 4. Проведение терапевтической гипотермии (устранение озноба) 5. Интенсивная терапия эпилептического статуса (постоянный контроль ЭЭГ) 6. Интенсивная терапия внутричерепной гипертензии - ? ? ?
 МИОПЛЕГИЯ У НОВОРОЖДЕННЫХ Характеристи ка Рокурониум Векурониум Панкурониу м Атракуриум В/в болюсно 0, 6 – 1, 2 мг/кг 0, 08 - 0, 1 мг/кг 0, 04 – 0. 1 мг/кг 0, 4 - 0, 5 мг/кг В/в, микроструйн о 4 - 16 мкг/кг/мин Старше года: 0, 8 – 2, 0 мкг/кг/мин 1 -2 мкг/кг/мин 4 – 12 мкг/кг/минуту Начало действия 1, 0 – 1, 5 мин 1, 0 – 3, 0 мин 3, 0 – 3, 5 мин 2, 0 – 3, 0 мин Время действия 20 – 40 мин 45 – 60 мин 60 – 100 мин 20 – 45 мин Метаболизм Элиминация ОПН, ОПеч. Н Печеночный Почки, печень Гидролиз в плазме Почечная Применять с осторожностью Гидродиз в плазме Не противопоказан Побочные эффекты Тахикардия, изменения на ЭКГ, сердечные аритмии, лабильность системного АД, сыпь, тошнота, рвота, отек в месте введения, бронхоспазм Тахикардия, сердечные аримтии, лабильность системного АД, сыпь, бронхоспазм Тахикардия, лабильность системного АД, продленная нейромышечная блокада Гипотензия, гиперемия кожи Преимуществ Короткое или Средняя Длительное Средняя
МИОПЛЕГИЯ У НОВОРОЖДЕННЫХ Характеристи ка Рокурониум Векурониум Панкурониу м Атракуриум В/в болюсно 0, 6 – 1, 2 мг/кг 0, 08 - 0, 1 мг/кг 0, 04 – 0. 1 мг/кг 0, 4 - 0, 5 мг/кг В/в, микроструйн о 4 - 16 мкг/кг/мин Старше года: 0, 8 – 2, 0 мкг/кг/мин 1 -2 мкг/кг/мин 4 – 12 мкг/кг/минуту Начало действия 1, 0 – 1, 5 мин 1, 0 – 3, 0 мин 3, 0 – 3, 5 мин 2, 0 – 3, 0 мин Время действия 20 – 40 мин 45 – 60 мин 60 – 100 мин 20 – 45 мин Метаболизм Элиминация ОПН, ОПеч. Н Печеночный Почки, печень Гидролиз в плазме Почечная Применять с осторожностью Гидродиз в плазме Не противопоказан Побочные эффекты Тахикардия, изменения на ЭКГ, сердечные аритмии, лабильность системного АД, сыпь, тошнота, рвота, отек в месте введения, бронхоспазм Тахикардия, сердечные аримтии, лабильность системного АД, сыпь, бронхоспазм Тахикардия, лабильность системного АД, продленная нейромышечная блокада Гипотензия, гиперемия кожи Преимуществ Короткое или Средняя Длительное Средняя
 ОСЛОЖНЕНИЯ МИОПЛЕГИИ У НОВОРОЖДЕННЫХ 1. Гипоксемия 2. Артериальная гипотензия 3. Отеки 4. Длительная мышечная гипотония 5. Потеря слуха 6. Увеличение продолжительности ИВЛ
ОСЛОЖНЕНИЯ МИОПЛЕГИИ У НОВОРОЖДЕННЫХ 1. Гипоксемия 2. Артериальная гипотензия 3. Отеки 4. Длительная мышечная гипотония 5. Потеря слуха 6. Увеличение продолжительности ИВЛ
 МЕРОПРИЯТИЯ ПО УМЕНЬШЕНИЮ ИНТЕНСИВНОСТИ БОЛИ И СТРЕССА У НОВОРОЖДЕННЫХ Манипуляции Мероприятия по устранению боли и стресса Пункция вены и артерии EMLA, парацетамол, соска с сахарозой, наркотические анальгетики Пункция пятки Соска с сахарозой или молоком Постановка центрального венозного катетера (ГВЛ) Соска с сахарозой, EMLA, инфильтрация лидокаином, наркотические анальгетики, общая анестезия Постановка желудочного зонда Медленное введение, соска с сахарозой Надлобковая пункция мочевого пузыря EMLA Люмбальная пункиця EMLA, инфильтрация лидокаином, наркотические анальгетики + бензодиазепины, если пациент находится на ИВЛ Дренирование плевральной полости Наркотические анальгетики + инфильтрация лидокаином, анестетики короткого действия Эндотрахеальная интубация Наркотические анальгетики, бензодиазепины, кетамин, тиопентал-натрия Санация ТБД Наркотические анальгетики, бензодиазепины, кетамин, сахароза per os Искусственная вентиляция легких Нарокотические анальгетики, микроструйно - ? Бензодиазепины - ?
МЕРОПРИЯТИЯ ПО УМЕНЬШЕНИЮ ИНТЕНСИВНОСТИ БОЛИ И СТРЕССА У НОВОРОЖДЕННЫХ Манипуляции Мероприятия по устранению боли и стресса Пункция вены и артерии EMLA, парацетамол, соска с сахарозой, наркотические анальгетики Пункция пятки Соска с сахарозой или молоком Постановка центрального венозного катетера (ГВЛ) Соска с сахарозой, EMLA, инфильтрация лидокаином, наркотические анальгетики, общая анестезия Постановка желудочного зонда Медленное введение, соска с сахарозой Надлобковая пункция мочевого пузыря EMLA Люмбальная пункиця EMLA, инфильтрация лидокаином, наркотические анальгетики + бензодиазепины, если пациент находится на ИВЛ Дренирование плевральной полости Наркотические анальгетики + инфильтрация лидокаином, анестетики короткого действия Эндотрахеальная интубация Наркотические анальгетики, бензодиазепины, кетамин, тиопентал-натрия Санация ТБД Наркотические анальгетики, бензодиазепины, кетамин, сахароза per os Искусственная вентиляция легких Нарокотические анальгетики, микроструйно - ? Бензодиазепины - ?
 Отдаленные эффекты опиоидов и седативных препаратов плохо известны. Однако, первое действие персонала должно быть направлено на лечение боли или стресса, чтобы в будущем не лечить последствий боли или стресса (Anand K. , 1998)
Отдаленные эффекты опиоидов и седативных препаратов плохо известны. Однако, первое действие персонала должно быть направлено на лечение боли или стресса, чтобы в будущем не лечить последствий боли или стресса (Anand K. , 1998)
 Контроль уровня гликемии Дети, нуждающиеся в инфузионной терапии подвержены риску развития гипогликемии. Это делает необходимым введение глюкозы в дозе 4 -6 мг/кг/мин или введение жидкости с 10% глюкозой в 0, 45% Na. Cl. После первичной стабилизации состояния у старших детей и взрослых пациентов с тяжелым сепсисом необходимо поддерживать уровень глюкозы в крови < 8. 3 ммоль/л.
Контроль уровня гликемии Дети, нуждающиеся в инфузионной терапии подвержены риску развития гипогликемии. Это делает необходимым введение глюкозы в дозе 4 -6 мг/кг/мин или введение жидкости с 10% глюкозой в 0, 45% Na. Cl. После первичной стабилизации состояния у старших детей и взрослых пациентов с тяжелым сепсисом необходимо поддерживать уровень глюкозы в крови < 8. 3 ммоль/л.
 Контроль уровня гликемии Возраст ребенка Потребность в глюкозе, мг/кг/минуту Новорожденные 8 Дети старше 1 месяца жизни 5 Подростки 2 Пациенты с печеночной недостаточностью до 16
Контроль уровня гликемии Возраст ребенка Потребность в глюкозе, мг/кг/минуту Новорожденные 8 Дети старше 1 месяца жизни 5 Подростки 2 Пациенты с печеночной недостаточностью до 16
 Kupper A. Wintergers et al. Association of Hypoglycemia, Hyperglycemia, and Glucose Variability With Morbidity and Death in the Pediatric Intensive Care Unit. Pediatrics, June 2006; 118; 173 -179 • У большинства больных с жизнеугрожаемой патологией выявлялась гипергликемия. • Неблагоприятные исходы гипергликемии, обусловлены избыточной продукцией цитокинов, острой дислипидемией, эндотелиальной дисфункцией, гиперкоагуляцией, повышенной глюкозотоксичностью, что ведет к метаболическим нарушениям и неконтролируемому апоптозу. • Наиболее неблагоприятные исходы, как показало исследование, имели место у больных с высокой вариабельностью гликемии, когда отмечены максимальные ассоциации с длительным лечением и летальными исходами. • Значительные колебания уровня глюкозы имеют более выраженный негативный эффект на водный баланс и нутритивный статус, чем стабильная гипергликемия. • Неблагоприятные исходы при этом опосредуются через микрососудистые повреждения, индуцированные высокой вариабельностью гликемии. • Для улучшения прогноза и снижения риска летальных исходов авторы указывают на необходимость тщательного мониторинга уровня гликемии у пациентов в критическом состоянии.
Kupper A. Wintergers et al. Association of Hypoglycemia, Hyperglycemia, and Glucose Variability With Morbidity and Death in the Pediatric Intensive Care Unit. Pediatrics, June 2006; 118; 173 -179 • У большинства больных с жизнеугрожаемой патологией выявлялась гипергликемия. • Неблагоприятные исходы гипергликемии, обусловлены избыточной продукцией цитокинов, острой дислипидемией, эндотелиальной дисфункцией, гиперкоагуляцией, повышенной глюкозотоксичностью, что ведет к метаболическим нарушениям и неконтролируемому апоптозу. • Наиболее неблагоприятные исходы, как показало исследование, имели место у больных с высокой вариабельностью гликемии, когда отмечены максимальные ассоциации с длительным лечением и летальными исходами. • Значительные колебания уровня глюкозы имеют более выраженный негативный эффект на водный баланс и нутритивный статус, чем стабильная гипергликемия. • Неблагоприятные исходы при этом опосредуются через микрососудистые повреждения, индуцированные высокой вариабельностью гликемии. • Для улучшения прогноза и снижения риска летальных исходов авторы указывают на необходимость тщательного мониторинга уровня гликемии у пациентов в критическом состоянии.

 ИНСУЛИНОТЕРАПИЯ
ИНСУЛИНОТЕРАПИЯ
 Профилактика стрессорных язв Ингибиторы Н 2 -рецепторов являются более эффективным средством, чем сукральфат, и им отдается предпочтение. Ни одного исследования, анализирующего эффект профилактики стрессовых язв у детей, не было проведено. Исследования показывают, что частота клинически значимого желудочно-кишечного кровотечения схожа с таковой у взрослых (Gauvin F. et al. , 2001).
Профилактика стрессорных язв Ингибиторы Н 2 -рецепторов являются более эффективным средством, чем сукральфат, и им отдается предпочтение. Ни одного исследования, анализирующего эффект профилактики стрессовых язв у детей, не было проведено. Исследования показывают, что частота клинически значимого желудочно-кишечного кровотечения схожа с таковой у взрослых (Gauvin F. et al. , 2001).
 ОСТРАЯ НЕДОСТАТОЧНОСТЬ КОРЫ НАДПОЧЕЧНИКОВ Среди детей в возрасте до двух лет с проявлениями тяжелой надпочечниковой недостаточности смертность в 10 раз выше, чем в популяции. Причина Врожденная Приобретенная Первичная недостаточность коры надпочечников Вторичная недостаточность коры надпочечников ВГКН, врожденная гипоплазия Гипопитуитаризм, надпочечников, изолированный дефицит глюкокортикостероидов, АКТГ неонатальная адренолейкодистрофия, гипоальдостеронизм, псевдогипоальдостеронизм КРОВОИЗЛИЯНИЯ В НАДПОЧЕЧНИКИ Применение экзогеный глкокортикоидов
ОСТРАЯ НЕДОСТАТОЧНОСТЬ КОРЫ НАДПОЧЕЧНИКОВ Среди детей в возрасте до двух лет с проявлениями тяжелой надпочечниковой недостаточности смертность в 10 раз выше, чем в популяции. Причина Врожденная Приобретенная Первичная недостаточность коры надпочечников Вторичная недостаточность коры надпочечников ВГКН, врожденная гипоплазия Гипопитуитаризм, надпочечников, изолированный дефицит глюкокортикостероидов, АКТГ неонатальная адренолейкодистрофия, гипоальдостеронизм, псевдогипоальдостеронизм КРОВОИЗЛИЯНИЯ В НАДПОЧЕЧНИКИ Применение экзогеный глкокортикоидов
 ОТНОСИТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ КОРЫ НАДПОЧЕЧНИКОВ Относительная недостаточность коры надпочечников характеризуется низкими концентрациями кортизола в плазме крови, не позволяющими обеспечить адекватную реакцию на стресс в сочетании с клиническими признаками гипоперфузии Клинические признаки гипоперфузии: - артериальная гипотензия метаболический ацидоз повышение потребности в жидкости снижение сократительной способности желудочка левого
ОТНОСИТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ КОРЫ НАДПОЧЕЧНИКОВ Относительная недостаточность коры надпочечников характеризуется низкими концентрациями кортизола в плазме крови, не позволяющими обеспечить адекватную реакцию на стресс в сочетании с клиническими признаками гипоперфузии Клинические признаки гипоперфузии: - артериальная гипотензия метаболический ацидоз повышение потребности в жидкости снижение сократительной способности желудочка левого
 РЕФРАКТЕРНАЯ АРТЕРИАЛЬНАЯ ГИПОТЕНЗИЯ У ГЛУБОКО НЕДОНОШЕНЫХ НОВОРОЖДЕННЫХ Ø Определение концентрации кортизола в плазме крови до назначения глюкокорттикостероидов Ø Внутривенно, болюсно вводится гидрокортизон в «пробной» дозе 1 мг/кг Ø Если в течение 2 -6 часов показатели АД увеличиваются, можно перейти на внутривенное болюсное введение гидрокортизона в дозе 0, 5 мг/кг каждые 12 часов (8 -10 мг/м 2 в день) Осложнения: - Некротический энтероколит!
РЕФРАКТЕРНАЯ АРТЕРИАЛЬНАЯ ГИПОТЕНЗИЯ У ГЛУБОКО НЕДОНОШЕНЫХ НОВОРОЖДЕННЫХ Ø Определение концентрации кортизола в плазме крови до назначения глюкокорттикостероидов Ø Внутривенно, болюсно вводится гидрокортизон в «пробной» дозе 1 мг/кг Ø Если в течение 2 -6 часов показатели АД увеличиваются, можно перейти на внутривенное болюсное введение гидрокортизона в дозе 0, 5 мг/кг каждые 12 часов (8 -10 мг/м 2 в день) Осложнения: - Некротический энтероколит!
 РЕФРАКТЕРНАЯ АРТЕРИАЛЬНАЯ ГИПОТЕНЗИЯ У ДОНОШЕНЫХ НОВОРОЖДЕННЫХ Ø Определение концентрации кортизола в плазме крови до назначения глюкокорттикостероидов Ø Внутривенно, болюсно вводится гидрокортизон в «пробной» дозе 1 мг/кг Ø Если в течение 2 -6 часов показатели АД увеличиваются, можно перейти на внутривенное болюсное введение гидрокортизона в дозе 0, 5 мг/кг каждые 6 -8 часов Ø Введение гидрокортизона отменяется через 48 -72 часа от начала терапии при условии стабильных показателей гемодинамики Ø Осложнения: Некротический энтероколит!
РЕФРАКТЕРНАЯ АРТЕРИАЛЬНАЯ ГИПОТЕНЗИЯ У ДОНОШЕНЫХ НОВОРОЖДЕННЫХ Ø Определение концентрации кортизола в плазме крови до назначения глюкокорттикостероидов Ø Внутривенно, болюсно вводится гидрокортизон в «пробной» дозе 1 мг/кг Ø Если в течение 2 -6 часов показатели АД увеличиваются, можно перейти на внутривенное болюсное введение гидрокортизона в дозе 0, 5 мг/кг каждые 6 -8 часов Ø Введение гидрокортизона отменяется через 48 -72 часа от начала терапии при условии стабильных показателей гемодинамики Ø Осложнения: Некротический энтероколит!
 ЭТИОЛОГИЯ ОСТРОЙ НЕДОСТАТОЧНОСТИ КОРЫ НАДПОЧЕЧНИКОВ 1. Врожденная гиперплазия коры надпочечников (адреногенитальный синдром) 2. Заместительная терапия глюкокортикоидами 3. Кровоизлияния в надпочечники 4. Врожденная гипоплазия коры надпочечников 5. Врожденный гипопитуитаризм 6. Пседогипоальдостеронизм 7. Гипоальдостеронизм 8. Изолированный дефицит глюкокортикоидов 9. Неонатальная адренолейкодистрофия 10. Изолированный дефицит АКТГ
ЭТИОЛОГИЯ ОСТРОЙ НЕДОСТАТОЧНОСТИ КОРЫ НАДПОЧЕЧНИКОВ 1. Врожденная гиперплазия коры надпочечников (адреногенитальный синдром) 2. Заместительная терапия глюкокортикоидами 3. Кровоизлияния в надпочечники 4. Врожденная гипоплазия коры надпочечников 5. Врожденный гипопитуитаризм 6. Пседогипоальдостеронизм 7. Гипоальдостеронизм 8. Изолированный дефицит глюкокортикоидов 9. Неонатальная адренолейкодистрофия 10. Изолированный дефицит АКТГ
 ЭТИОЛОГИЯ ОСТРОЙ НЕДОСТАТОЧНОСТИ КОРЫ НАДПОЧЕЧНИКОВ Кровоизлияния в надпочечники Ø Ø Ø Ø Ø Асфиксия в родах тяжелой степени Родовая травма Геморрагическая болезнь новорожденных Острая церебральная недостаточность различного генеза Сахарный диабет у матери Инфекционные заболевания периода новорожденности Сепсис (менингококк, стрептококк) Пневмония Герпетическая инфекция Врожденный сифилис
ЭТИОЛОГИЯ ОСТРОЙ НЕДОСТАТОЧНОСТИ КОРЫ НАДПОЧЕЧНИКОВ Кровоизлияния в надпочечники Ø Ø Ø Ø Ø Асфиксия в родах тяжелой степени Родовая травма Геморрагическая болезнь новорожденных Острая церебральная недостаточность различного генеза Сахарный диабет у матери Инфекционные заболевания периода новорожденности Сепсис (менингококк, стрептококк) Пневмония Герпетическая инфекция Врожденный сифилис
 ЛАБОРАТОРНАЯ ДИАГНОСТИКА ОСТРОЙ НЕДОСТАТОЧНОСТИ КОРЫ НАДПОЧЕЧНИКОВ 1. 2. 3. 4. 5. Снижение концентрации кортизола в крови Снижение концентрации 17 -оксикортикостероидов Повышение концентрации АКТГ Снижение экскреции 17 оксикортикостероидов с мочой Диагноз первичной надпочечниковой недостаточности подтверждается обнаружением повышенной концентрации АКТГ в плазме крови (более 100 пг/мл или 22, 02 пмоль/л) и низкой концентрации кортизола в сыворотке крови (менее 10 мкг/дл) 6. Диагноз вторичной надпочечниковой недостаточности подтверждается низкой концентрацией АКТГ и кортизола в сыворотке крови
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ОСТРОЙ НЕДОСТАТОЧНОСТИ КОРЫ НАДПОЧЕЧНИКОВ 1. 2. 3. 4. 5. Снижение концентрации кортизола в крови Снижение концентрации 17 -оксикортикостероидов Повышение концентрации АКТГ Снижение экскреции 17 оксикортикостероидов с мочой Диагноз первичной надпочечниковой недостаточности подтверждается обнаружением повышенной концентрации АКТГ в плазме крови (более 100 пг/мл или 22, 02 пмоль/л) и низкой концентрации кортизола в сыворотке крови (менее 10 мкг/дл) 6. Диагноз вторичной надпочечниковой недостаточности подтверждается низкой концентрацией АКТГ и кортизола в сыворотке крови
 КЛИНИКА ОСТРОЙ НЕДОСТАТОЧНОСТИ КОРЫ НАДПОЧЕЧНИКОВ 1. Адинамия, мышечная гитпотония, гипорефлексия, бледность кожи 2. Синдром гипоперфузии 3. Олигурия 4. Гиперкалиемия 5. Гипонатриемия 6. Гипогликемия 7. Выраженный метаболический ацидоз 8. Выраженный лейкоцитоз со сдвигом влево 9. Эозинофилия 10. Признаки гиперкалиемии на ЭКГ
КЛИНИКА ОСТРОЙ НЕДОСТАТОЧНОСТИ КОРЫ НАДПОЧЕЧНИКОВ 1. Адинамия, мышечная гитпотония, гипорефлексия, бледность кожи 2. Синдром гипоперфузии 3. Олигурия 4. Гиперкалиемия 5. Гипонатриемия 6. Гипогликемия 7. Выраженный метаболический ацидоз 8. Выраженный лейкоцитоз со сдвигом влево 9. Эозинофилия 10. Признаки гиперкалиемии на ЭКГ
 ИНТЕНСИВНАЯ ТЕРАПИЯ ОСТРОЙ НЕДОСТАТОЧНОСТИ КОРЫ НАДПОЧЕЧНИКОВ Ø Коррекция артериальной гипотензии Ø Препарат выбора – гидрокортизона гемисукцинат ( «Солу-Кортеф» ): - Суточная доза: 10 -15 мг/кг массы тела, внутривенено, микроструйно - Внутривенно, болюсно: 50 -75 мг/м 2, а затем 50 -75 мг/м 2/сутки в четыре введения Ø На 2 -3 сутки дозу снижают на 30 -50%, сокращают кратность введения (каждые 4 -6 часов), в дальнейшем переходят на поддерживающую терапию.
ИНТЕНСИВНАЯ ТЕРАПИЯ ОСТРОЙ НЕДОСТАТОЧНОСТИ КОРЫ НАДПОЧЕЧНИКОВ Ø Коррекция артериальной гипотензии Ø Препарат выбора – гидрокортизона гемисукцинат ( «Солу-Кортеф» ): - Суточная доза: 10 -15 мг/кг массы тела, внутривенено, микроструйно - Внутривенно, болюсно: 50 -75 мг/м 2, а затем 50 -75 мг/м 2/сутки в четыре введения Ø На 2 -3 сутки дозу снижают на 30 -50%, сокращают кратность введения (каждые 4 -6 часов), в дальнейшем переходят на поддерживающую терапию.
 ПРЕПАРАТЫ ГОРМОНОВ КОРЫ НАДПОЧЕЧНИКОВ Гидрокортизона гемисукцинат ( «Солу-Кортеф» ) Суспензия гидрокортизона Преимущественный эффект: ГК + мк Показания: Острая надпочечниковая недостаточность Суточная доза: 10 -15 мг/кг Способ введения, кратность: внутривенно капельно, внутримышечно каждые 2 -6 часов
ПРЕПАРАТЫ ГОРМОНОВ КОРЫ НАДПОЧЕЧНИКОВ Гидрокортизона гемисукцинат ( «Солу-Кортеф» ) Суспензия гидрокортизона Преимущественный эффект: ГК + мк Показания: Острая надпочечниковая недостаточность Суточная доза: 10 -15 мг/кг Способ введения, кратность: внутривенно капельно, внутримышечно каждые 2 -6 часов
 ПРЕПАРАТЫ ГОРМОНОВ КОРЫ НАДПОЧЕЧНИКОВ ПРЕДНИЗОЛОН Преимущественный эффект: ГЛЮКОКОРТИКОИД Минералокортикоидная активность отсутствует! Показания: Острая надпочечниковая недостаточность Суточная доза: 2, 5 -7 мг/кг Способ введения, кратность: внутривенно капельно, внутримышечно каждые 2 -6 часов
ПРЕПАРАТЫ ГОРМОНОВ КОРЫ НАДПОЧЕЧНИКОВ ПРЕДНИЗОЛОН Преимущественный эффект: ГЛЮКОКОРТИКОИД Минералокортикоидная активность отсутствует! Показания: Острая надпочечниковая недостаточность Суточная доза: 2, 5 -7 мг/кг Способ введения, кратность: внутривенно капельно, внутримышечно каждые 2 -6 часов
 ИНТЕНСИВНАЯ ТЕРАПИЯ ОСТРОЙ НЕДОСТАТОЧНОСТИ КОРЫ НАДПОЧЕЧНИКОВ
ИНТЕНСИВНАЯ ТЕРАПИЯ ОСТРОЙ НЕДОСТАТОЧНОСТИ КОРЫ НАДПОЧЕЧНИКОВ
 Селен Роль селена не ограничивается участием в процессах, направленных на подавление СРО. Он активно участвует в синтезе белков, антигистаминных и антиаллергических механизмах, велика его роль в процессах, направленных на предотвращение мутаций.
Селен Роль селена не ограничивается участием в процессах, направленных на подавление СРО. Он активно участвует в синтезе белков, антигистаминных и антиаллергических механизмах, велика его роль в процессах, направленных на предотвращение мутаций.
 Селен при сепсисе Фармакодинамическое обоснование 1. Защита эндотелия 2. Регуляция метаболизма клетки 3. Регуляция арахидонового каскада 4. Угнетение выработки ядерного фактора NFk. B 5. Индукция апоптоза активированных мононуклеаров 6. Дефицит селена при сепсисе – фактор неблагоприятного исхода
Селен при сепсисе Фармакодинамическое обоснование 1. Защита эндотелия 2. Регуляция метаболизма клетки 3. Регуляция арахидонового каскада 4. Угнетение выработки ядерного фактора NFk. B 5. Индукция апоптоза активированных мононуклеаров 6. Дефицит селена при сепсисе – фактор неблагоприятного исхода
 Селеназа в интенсивной терапии сепсиса Angstwurm et al. Crit Care Med 2007 Vol. 35, No. 1. -p. 118 -125. Применение селеназы позволяет существенно снизить смертность снижается у пациентов с септическим шоком, ДВС синдромом, при оценке по шкале APACHE III более 100 баллов, у пациентов с дисфункцией более трех органных систем. Концентрация селена в цельной крови, и активность глутатион-пероксидазы-3 были высокими при лечении препаратами селена, и оставались низкими в группе плацебо.
Селеназа в интенсивной терапии сепсиса Angstwurm et al. Crit Care Med 2007 Vol. 35, No. 1. -p. 118 -125. Применение селеназы позволяет существенно снизить смертность снижается у пациентов с септическим шоком, ДВС синдромом, при оценке по шкале APACHE III более 100 баллов, у пациентов с дисфункцией более трех органных систем. Концентрация селена в цельной крови, и активность глутатион-пероксидазы-3 были высокими при лечении препаратами селена, и оставались низкими в группе плацебо.
![ИММУНОМОДУЛИРУЮЩАЯ ТЕРАПИЯ Vincent JLet al. Сrit Care Med 2007; 35[Suppl. ]: S 436–S 440 ИММУНОМОДУЛИРУЮЩАЯ ТЕРАПИЯ Vincent JLet al. Сrit Care Med 2007; 35[Suppl. ]: S 436–S 440](https://present5.com/presentation/1/170960915_437566545.pdf-img/170960915_437566545.pdf-161.jpg) ИММУНОМОДУЛИРУЮЩАЯ ТЕРАПИЯ Vincent JLet al. Сrit Care Med 2007; 35[Suppl. ]: S 436–S 440 Kreymann KG et al. Crit Care Med 2007; 35: 2677– 2685 Laupland KB et al. Crit Care Med 2007; 35: 2686– 2692 Surviving Sepsis Campaign. Сrit Care Med 2008; 36: 296 -327 • Иммунотерапия - Ig М, G, A (пентаглобин) – снижает риск полинейропатии, может cнизить летальность у взрослых на 34%, у новорожденных - до 50%, показан у детей (2 С) - IFN, ронколейкин и др. ? • Антицитокиновая терапия: антитела и рецепторы к LРS, TNF, IL - не улучшают исход
ИММУНОМОДУЛИРУЮЩАЯ ТЕРАПИЯ Vincent JLet al. Сrit Care Med 2007; 35[Suppl. ]: S 436–S 440 Kreymann KG et al. Crit Care Med 2007; 35: 2677– 2685 Laupland KB et al. Crit Care Med 2007; 35: 2686– 2692 Surviving Sepsis Campaign. Сrit Care Med 2008; 36: 296 -327 • Иммунотерапия - Ig М, G, A (пентаглобин) – снижает риск полинейропатии, может cнизить летальность у взрослых на 34%, у новорожденных - до 50%, показан у детей (2 С) - IFN, ронколейкин и др. ? • Антицитокиновая терапия: антитела и рецепторы к LРS, TNF, IL - не улучшают исход
 Состав Пентаглобина • Содержит: v Ig. M v Ig. A v Ig. G 12% 0. 6 g* 76% 3. 8 g* * = на 100 мл готового к применению раствора • Получен как минимум из 1000 донаций плазмы 162
Состав Пентаглобина • Содержит: v Ig. M v Ig. A v Ig. G 12% 0. 6 g* 76% 3. 8 g* * = на 100 мл готового к применению раствора • Получен как минимум из 1000 донаций плазмы 162
 СТРАНЫ, В КОТОРЫХ ЗАРЕГИСТРИРОВАН ПЕНТАГЛОБИН • • • • Албания Аргентина Австрия Бахрейн Бразилия Чили Колумбия Эквадор Египет Джорджия Германия Греция Гонконг Венгрия • • • • Индия Ирак Италия Иордания Казахстан Кувейт Ливан Мексика Оман Пакистан Перу Польша Катар Румыния • Россия • Саудовская • • Аравия Сингапур Южная Африка Таиланд ОАР Всего 34 страны 163
СТРАНЫ, В КОТОРЫХ ЗАРЕГИСТРИРОВАН ПЕНТАГЛОБИН • • • • Албания Аргентина Австрия Бахрейн Бразилия Чили Колумбия Эквадор Египет Джорджия Германия Греция Гонконг Венгрия • • • • Индия Ирак Италия Иордания Казахстан Кувейт Ливан Мексика Оман Пакистан Перу Польша Катар Румыния • Россия • Саудовская • • Аравия Сингапур Южная Африка Таиланд ОАР Всего 34 страны 163
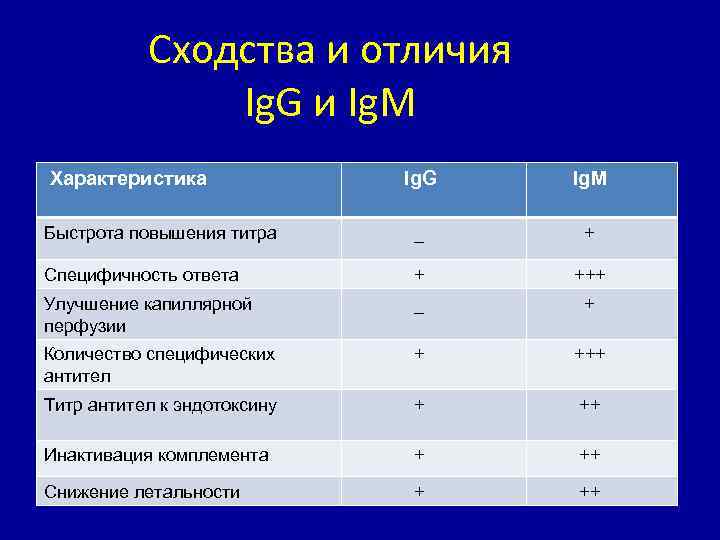 Сходства и отличия Ig. G и Ig. M Характеристика Ig. G Ig. M Быстрота повышения титра _ + Специфичность ответа +++ Улучшение капиллярной перфузии _ + Количество специфических антител +++ Титр антител к эндотоксину + ++ Инактивация комплемента + ++ Снижение летальности + ++
Сходства и отличия Ig. G и Ig. M Характеристика Ig. G Ig. M Быстрота повышения титра _ + Специфичность ответа +++ Улучшение капиллярной перфузии _ + Количество специфических антител +++ Титр антител к эндотоксину + ++ Инактивация комплемента + ++ Снижение летальности + ++
 Дозирование Пентаглобина Для новорожденных и грудных детей: терапия тяжелых бактериальных инфекций, заместительная терапия у детей с иммунодефицитом и вторичным синдромом недостаточности антител - ежедневно 5 мл/кг массы тела в течение 3 -х дней подряд. Необходимость повторного курса зависит от клинического течения болезни. 165
Дозирование Пентаглобина Для новорожденных и грудных детей: терапия тяжелых бактериальных инфекций, заместительная терапия у детей с иммунодефицитом и вторичным синдромом недостаточности антител - ежедневно 5 мл/кг массы тела в течение 3 -х дней подряд. Необходимость повторного курса зависит от клинического течения болезни. 165
 Мы считаем обоснованным применение иммуноглобулинов у детей с тяжелым сепсисом (уровень 2 С) published in: Critical Care Medicine 2008; 36: 296 -327 166
Мы считаем обоснованным применение иммуноглобулинов у детей с тяжелым сепсисом (уровень 2 С) published in: Critical Care Medicine 2008; 36: 296 -327 166
 «Применение поликлональных иммуноглобулинов в адьювантной терапии сепсиса и септического шока» Kreymann K. G. et al. (Use of polyclonal immunoglobu; ins as adjunctive therapy for sepsis or septic shock. Crit. Care Med. 2007, 35(12): 2677 -2685) Улучшение выживаемости после применения Пентаглобина 50% в % 34% 37% 15%
«Применение поликлональных иммуноглобулинов в адьювантной терапии сепсиса и септического шока» Kreymann K. G. et al. (Use of polyclonal immunoglobu; ins as adjunctive therapy for sepsis or septic shock. Crit. Care Med. 2007, 35(12): 2677 -2685) Улучшение выживаемости после применения Пентаглобина 50% в % 34% 37% 15%
 INIS исследование (Международное Исследование Иммунотерапии Новорожденных) опубликовано в Новом английском медицинском журнале (2011) 365, 1201 -1211 В исследовании было доказано, что препараты стандартных иммуноглобулинов не влияют на выживаемость новорожденных с неонатальным сепсисом • Цель исследования В рандомизированном контролируемом клиническом исследовании новорожденных детей с сепсисом изучалась эффективность стандартных иммуноглобулинов, содержащих только иммуноглобулины класса G (Ig. G). • Пациенты, включенные в исследование Включено 113 больниц из 9 стран, 3493 новорожденных. Недоношенным новорожденным (вес тела при рождении 1, 000 г, гестационный возраст в среднем - 28 недель), была назначена антибактериальная терапия при подозрении или подтверждении диагноза сепсис. Новорожденные были рандомизированы на две группы. Первая группа дополнительно к стандартной терапии получала препарат иммуноглобулина, содержащий только Ig. G антитела, вторая группа получала плацебо. • Основные результаты госпитальная летальность в обеих группах составила 17%; летальность или тяжелая инвалидизация в течение последующих 2 лет была одинаковой в обеих группах и составляла 39% • Выводы Препараты стандартных иммуноглобулинов, содержащие только Ig. G антитела не повышают выживаемость новорожденных с неонатальным сепсисом.
INIS исследование (Международное Исследование Иммунотерапии Новорожденных) опубликовано в Новом английском медицинском журнале (2011) 365, 1201 -1211 В исследовании было доказано, что препараты стандартных иммуноглобулинов не влияют на выживаемость новорожденных с неонатальным сепсисом • Цель исследования В рандомизированном контролируемом клиническом исследовании новорожденных детей с сепсисом изучалась эффективность стандартных иммуноглобулинов, содержащих только иммуноглобулины класса G (Ig. G). • Пациенты, включенные в исследование Включено 113 больниц из 9 стран, 3493 новорожденных. Недоношенным новорожденным (вес тела при рождении 1, 000 г, гестационный возраст в среднем - 28 недель), была назначена антибактериальная терапия при подозрении или подтверждении диагноза сепсис. Новорожденные были рандомизированы на две группы. Первая группа дополнительно к стандартной терапии получала препарат иммуноглобулина, содержащий только Ig. G антитела, вторая группа получала плацебо. • Основные результаты госпитальная летальность в обеих группах составила 17%; летальность или тяжелая инвалидизация в течение последующих 2 лет была одинаковой в обеих группах и составляла 39% • Выводы Препараты стандартных иммуноглобулинов, содержащие только Ig. G антитела не повышают выживаемость новорожденных с неонатальным сепсисом.


 Первичная стабилизация состояния ЦЕЛЬ ТЕРАПИИ • Время наполнения капилляров ≤ 2 с • Удовлетворительное наполнение пульса на периферических и магистральных артериях • Нормальная температура конечностей (теплые конечности) • Темп почасового диуреза > 1 мл/кг/ч • Ясное сознание • Показатели АД соответствуют возрастной норме (NB!: неинвазивное измерение АД достоверно, только при наличии пульса на периферических артериях) • Нормальные показатели концентрация глюкозы • Нормальные показатели концентрации ионизированного кальция 171
Первичная стабилизация состояния ЦЕЛЬ ТЕРАПИИ • Время наполнения капилляров ≤ 2 с • Удовлетворительное наполнение пульса на периферических и магистральных артериях • Нормальная температура конечностей (теплые конечности) • Темп почасового диуреза > 1 мл/кг/ч • Ясное сознание • Показатели АД соответствуют возрастной норме (NB!: неинвазивное измерение АД достоверно, только при наличии пульса на периферических артериях) • Нормальные показатели концентрация глюкозы • Нормальные показатели концентрации ионизированного кальция 171
 Первичная стабилизация состояния Минимально необходимый объем мониторинга • • Пульсоксиметрия Постоянный мониторинг электрокардиограммы Измерение артериального и пульсового давления Измерение пульсового и диастолического давления позволяет провести дифференциальную диагностику септического шока с низким (высокое пульсовое давление) и высоким ОПСС (минимальное пульсовое давление). 172
Первичная стабилизация состояния Минимально необходимый объем мониторинга • • Пульсоксиметрия Постоянный мониторинг электрокардиограммы Измерение артериального и пульсового давления Измерение пульсового и диастолического давления позволяет провести дифференциальную диагностику септического шока с низким (высокое пульсовое давление) и высоким ОПСС (минимальное пульсовое давление). 172
 КРИТЕРИИ ЭФФЕКТИВНОСТИ ИНТЕНСИВНОЙ ТЕРАПИИ СЕПТИЧЕСКОГО ШОКА • нормальный психический статус, • время наполнения капилляров меньше 2 секунд, • нормальный пульс без различий между периферическим и центральным пульсом, • теплые конечности, • диурез > 1 мл на кг в час, • сниженный лактат и повышенный дефицит оснований, • смешанная венозная сатурация кислорода (в верхней полой вене) > 70%.
КРИТЕРИИ ЭФФЕКТИВНОСТИ ИНТЕНСИВНОЙ ТЕРАПИИ СЕПТИЧЕСКОГО ШОКА • нормальный психический статус, • время наполнения капилляров меньше 2 секунд, • нормальный пульс без различий между периферическим и центральным пульсом, • теплые конечности, • диурез > 1 мл на кг в час, • сниженный лактат и повышенный дефицит оснований, • смешанная венозная сатурация кислорода (в верхней полой вене) > 70%.
 Проведены мероприятия, направленные на улучшение качества , состоящие в использовании технологии «Plan-Do-Check-Act» - планирование-действие-проверка-корректировка) циклически повторяющийся процесс принятия решения, используемый в управлении качеством, применительно к 5 позициям: • БЫСТРАЯ ДИАГНОСТИКА СЕПТИЧЕСКОГО ШОКА • СВОЕВРЕМЕННЫЙ СОСУДИСТЫЙ ДОСТУП • В/В ВВЕДЕНИЕ ЖИДКОСТИ • АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ • ВАЗОАКТИВНЫЕ ПРЕПАРАТЫ Сравнили 126 детей до обучения (November 2009 to March 2011) и 116 в процессе QI обучения (October 2011 to May 2013).
Проведены мероприятия, направленные на улучшение качества , состоящие в использовании технологии «Plan-Do-Check-Act» - планирование-действие-проверка-корректировка) циклически повторяющийся процесс принятия решения, используемый в управлении качеством, применительно к 5 позициям: • БЫСТРАЯ ДИАГНОСТИКА СЕПТИЧЕСКОГО ШОКА • СВОЕВРЕМЕННЫЙ СОСУДИСТЫЙ ДОСТУП • В/В ВВЕДЕНИЕ ЖИДКОСТИ • АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ • ВАЗОАКТИВНЫЕ ПРЕПАРАТЫ Сравнили 126 детей до обучения (November 2009 to March 2011) и 116 в процессе QI обучения (October 2011 to May 2013).
 Диагностика СШ в течение 5 минут (79% против 97%) Сосудистый доступ в течение 5 минут (67% против 90%) 60 мл/кг жидкости в/в течение 60 минут (37 против 73%) Антибиотики в течение 60 минут (70% против 86%) Введение вазоактивных препаратов в течение 60 минут (35% против 68%)
Диагностика СШ в течение 5 минут (79% против 97%) Сосудистый доступ в течение 5 минут (67% против 90%) 60 мл/кг жидкости в/в течение 60 минут (37 против 73%) Антибиотики в течение 60 минут (70% против 86%) Введение вазоактивных препаратов в течение 60 минут (35% против 68%)
 БЛАГОДАРЮ ЗА ВНИМАНИЕ!
БЛАГОДАРЮ ЗА ВНИМАНИЕ!


