a99ff8887388e729693c704db3dc56a9.ppt
- Количество слайдов: 30
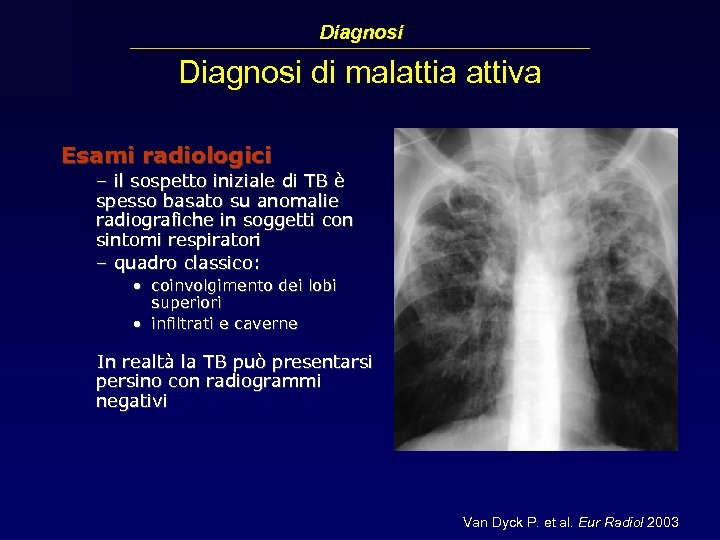 Diagnosi di malattia attiva Esami radiologici – il sospetto iniziale di TB è spesso basato su anomalie radiografiche in soggetti con sintomi respiratori – quadro classico: • coinvolgimento dei lobi superiori • infiltrati e caverne In realtà la TB può presentarsi persino con radiogrammi negativi Van Dyck P. et al. Eur Radiol 2003
Diagnosi di malattia attiva Esami radiologici – il sospetto iniziale di TB è spesso basato su anomalie radiografiche in soggetti con sintomi respiratori – quadro classico: • coinvolgimento dei lobi superiori • infiltrati e caverne In realtà la TB può presentarsi persino con radiogrammi negativi Van Dyck P. et al. Eur Radiol 2003
 Diagnosi di malattia attiva Microscopia diretta – diagnosi presuntiva • bacilli acido-resistenti (AAR) all’esame tradizionale • Ziehl Neelsen - Auramina-Rodamina • la presenza di micobatteri all’esame diretto dell’espettorato, del lavaggio gastrico o del BAL è il segno della massima infettività Esame colturale – diagnosi definitiva • necessarie 4/8 settimane prima di poter rilevare la crescita • l’uso di terreni liquidi con rilevatore radiometrico di crescita può ridurre a 2/3 settimane il tempo necessario Campioni diagnostici: espettorato, frammenti di tessuto… Sebbene le linee guida raccomandino l’analisi di tre campioni raccolti in giorni diversi, recenti studi negano che il secondo e il terzo esame aumentino la sensibilità diagnostica. Eichbaum Q. et al. Am J Clin Pathol 2002 Leonard M. K. et al. Am J Infect Control 2005
Diagnosi di malattia attiva Microscopia diretta – diagnosi presuntiva • bacilli acido-resistenti (AAR) all’esame tradizionale • Ziehl Neelsen - Auramina-Rodamina • la presenza di micobatteri all’esame diretto dell’espettorato, del lavaggio gastrico o del BAL è il segno della massima infettività Esame colturale – diagnosi definitiva • necessarie 4/8 settimane prima di poter rilevare la crescita • l’uso di terreni liquidi con rilevatore radiometrico di crescita può ridurre a 2/3 settimane il tempo necessario Campioni diagnostici: espettorato, frammenti di tessuto… Sebbene le linee guida raccomandino l’analisi di tre campioni raccolti in giorni diversi, recenti studi negano che il secondo e il terzo esame aumentino la sensibilità diagnostica. Eichbaum Q. et al. Am J Clin Pathol 2002 Leonard M. K. et al. Am J Infect Control 2005
 Diagnosi di malattia attiva Amplificazione degli acidi nucleici – può permettere la diagnosi in poche ore – bassa sensibilità (maggiore dell’esame diretto, minore del colturale) – alti costi – oggi possono trovare utilità in: • soggetti con AAR all’esame diretto, per la conferma di malattia • soggetti negativi all’esame diretto, in casi selezionati Test di sensibilità ai farmaci – inizialmente isoniazide, rifampicina ed etambutolo – se vengono rilevate resistenze o se il paziente non risponde alla terapia è necessario testare anche altri antibiotici – tempi richiesti: 3/8 settimane – iniziano ad essere disponibili test molecolari per l’identificazione rapida delle resistenze (es. PCR per mutazioni su rpo. B) American Thoracic Society. Am J Respir Crit Care Med 2000 Vernet G. et al. J Appl Microbiol 2004
Diagnosi di malattia attiva Amplificazione degli acidi nucleici – può permettere la diagnosi in poche ore – bassa sensibilità (maggiore dell’esame diretto, minore del colturale) – alti costi – oggi possono trovare utilità in: • soggetti con AAR all’esame diretto, per la conferma di malattia • soggetti negativi all’esame diretto, in casi selezionati Test di sensibilità ai farmaci – inizialmente isoniazide, rifampicina ed etambutolo – se vengono rilevate resistenze o se il paziente non risponde alla terapia è necessario testare anche altri antibiotici – tempi richiesti: 3/8 settimane – iniziano ad essere disponibili test molecolari per l’identificazione rapida delle resistenze (es. PCR per mutazioni su rpo. B) American Thoracic Society. Am J Respir Crit Care Med 2000 Vernet G. et al. J Appl Microbiol 2004
 Diagnosi di infezione latente Test cutaneo con PPD – utilizzato nello screening di LTBI • limitata sensibilità e specificità per la TB – iniezione intradermica di PPD (mix di antigeni di MTB) –il soggetto che ha immunità specifica produce una papula (lettura dopo 48 -72 h) – si misura l’infiltrato, non l’eritema Cut-off di positività per gruppi di rischio ≥ 5 mm - HIV positivi - contatti recenti di TB - rx compatibile con TB - trapiantati e immunosoppressi ≥ 10 mm ≥ 15 mm - immigrati di recente da aree ad alta prevalenza - tossicodipendenti ev - residenti e operatori di ambienti a rischio - silicosi, diabete mellito, IRC, leucemie, carcinomi… - soggetti senza fattori di rischio American Thoracic Society. Am J Respir Crit Care Med 2000
Diagnosi di infezione latente Test cutaneo con PPD – utilizzato nello screening di LTBI • limitata sensibilità e specificità per la TB – iniezione intradermica di PPD (mix di antigeni di MTB) –il soggetto che ha immunità specifica produce una papula (lettura dopo 48 -72 h) – si misura l’infiltrato, non l’eritema Cut-off di positività per gruppi di rischio ≥ 5 mm - HIV positivi - contatti recenti di TB - rx compatibile con TB - trapiantati e immunosoppressi ≥ 10 mm ≥ 15 mm - immigrati di recente da aree ad alta prevalenza - tossicodipendenti ev - residenti e operatori di ambienti a rischio - silicosi, diabete mellito, IRC, leucemie, carcinomi… - soggetti senza fattori di rischio American Thoracic Society. Am J Respir Crit Care Med 2000
 Diagnosi di infezione latente – falsi positivi – falsi negativi Test cutaneo con PPD • • • legati a cross-reazione con altri micobatteri legati a vaccinazione con BCG effetto booster legati alla somministrazione legati alla lettura • legati al soggetto testato – – infezioni disturbi metabolici fattori nutrizionali farmaci (corticosteroidi, agenti immunosoppressivi…) – malattie degli organi linfoidi (HD, linfomi…) – età (neonati, anziani) – infezione di MTB recente – stress (chirurgia, GVHD…) • legati alla tubercolina – improprio stoccaggio, diluizione… • legati alla somministrazione – ritardo dopo la preparazione della siringa – quantità insufficiente di antigene somministrato • legati alla lettura – inesperienza del lettore – errori consci o inconsci Heubner R. E. et al. Clin Infect Dis 1993
Diagnosi di infezione latente – falsi positivi – falsi negativi Test cutaneo con PPD • • • legati a cross-reazione con altri micobatteri legati a vaccinazione con BCG effetto booster legati alla somministrazione legati alla lettura • legati al soggetto testato – – infezioni disturbi metabolici fattori nutrizionali farmaci (corticosteroidi, agenti immunosoppressivi…) – malattie degli organi linfoidi (HD, linfomi…) – età (neonati, anziani) – infezione di MTB recente – stress (chirurgia, GVHD…) • legati alla tubercolina – improprio stoccaggio, diluizione… • legati alla somministrazione – ritardo dopo la preparazione della siringa – quantità insufficiente di antigene somministrato • legati alla lettura – inesperienza del lettore – errori consci o inconsci Heubner R. E. et al. Clin Infect Dis 1993
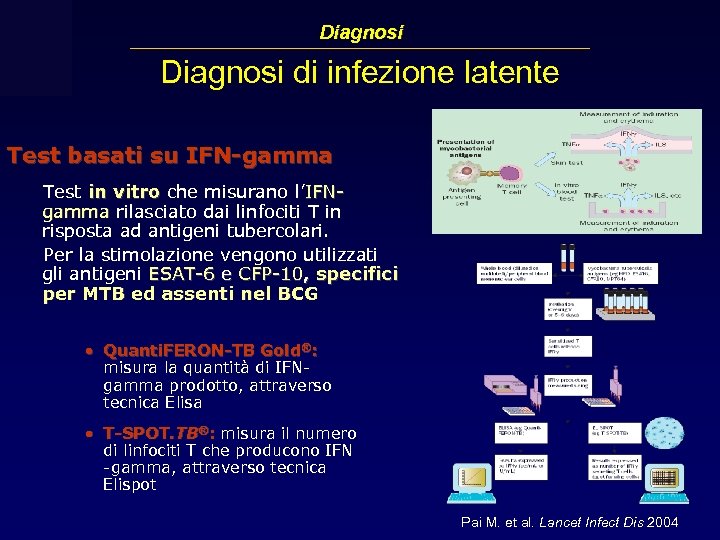 Diagnosi di infezione latente Test basati su IFN-gamma Test in vitro che misurano l’IFNgamma rilasciato dai linfociti T in risposta ad antigeni tubercolari. Per la stimolazione vengono utilizzati gli antigeni ESAT-6 e CFP-10, specifici per MTB ed assenti nel BCG • Quanti. FERON-TB Gold®: misura la quantità di IFNgamma prodotto, attraverso tecnica Elisa • T-SPOT. TB®: misura il numero di linfociti T che producono IFN -gamma, attraverso tecnica Elispot Pai M. et al. Lancet Infect Dis 2004
Diagnosi di infezione latente Test basati su IFN-gamma Test in vitro che misurano l’IFNgamma rilasciato dai linfociti T in risposta ad antigeni tubercolari. Per la stimolazione vengono utilizzati gli antigeni ESAT-6 e CFP-10, specifici per MTB ed assenti nel BCG • Quanti. FERON-TB Gold®: misura la quantità di IFNgamma prodotto, attraverso tecnica Elisa • T-SPOT. TB®: misura il numero di linfociti T che producono IFN -gamma, attraverso tecnica Elispot Pai M. et al. Lancet Infect Dis 2004
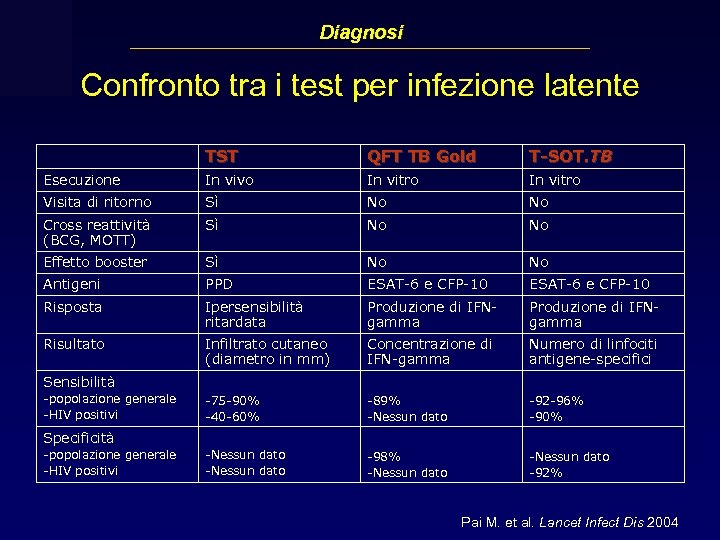 Diagnosi Confronto tra i test per infezione latente TST QFT TB Gold T-SOT. TB Esecuzione In vivo In vitro Visita di ritorno Sì No No Cross reattività (BCG, MOTT) Sì No No Effetto booster Sì No No Antigeni PPD ESAT-6 e CFP-10 Risposta Ipersensibilità ritardata Produzione di IFNgamma Risultato Infiltrato cutaneo (diametro in mm) Concentrazione di IFN-gamma Numero di linfociti antigene-specifici -75 -90% -40 -60% -89% -Nessun dato -92 -96% -90% -Nessun dato -98% -Nessun dato -92% Sensibilità -popolazione generale -HIV positivi Specificità -popolazione generale -HIV positivi Pai M. et al. Lancet Infect Dis 2004
Diagnosi Confronto tra i test per infezione latente TST QFT TB Gold T-SOT. TB Esecuzione In vivo In vitro Visita di ritorno Sì No No Cross reattività (BCG, MOTT) Sì No No Effetto booster Sì No No Antigeni PPD ESAT-6 e CFP-10 Risposta Ipersensibilità ritardata Produzione di IFNgamma Risultato Infiltrato cutaneo (diametro in mm) Concentrazione di IFN-gamma Numero di linfociti antigene-specifici -75 -90% -40 -60% -89% -Nessun dato -92 -96% -90% -Nessun dato -98% -Nessun dato -92% Sensibilità -popolazione generale -HIV positivi Specificità -popolazione generale -HIV positivi Pai M. et al. Lancet Infect Dis 2004
 Strategie per il controllo Punti critici per il controllo della TB Soggetto sano Esposizione Vaccinazione antitubercolare a caso contagioso TB attiva e sintomatica I soggetti possono trasmettere la malattia ad altri. Senza MTB prolifera nello spazio extracellulare e vengono reclutate cellule infiammatorie trattamento, la letalità è del 50% Infezione Trattamento preventivo i macrofagi alveolari (mφ) uccidono MTB Trattamento terapeutico Infezione latente MTB controllato dal sistema immunitario per tutto il resto della vita Non infezione Riattivazione (5% di rischio durante il resto della vita)
Strategie per il controllo Punti critici per il controllo della TB Soggetto sano Esposizione Vaccinazione antitubercolare a caso contagioso TB attiva e sintomatica I soggetti possono trasmettere la malattia ad altri. Senza MTB prolifera nello spazio extracellulare e vengono reclutate cellule infiammatorie trattamento, la letalità è del 50% Infezione Trattamento preventivo i macrofagi alveolari (mφ) uccidono MTB Trattamento terapeutico Infezione latente MTB controllato dal sistema immunitario per tutto il resto della vita Non infezione Riattivazione (5% di rischio durante il resto della vita)
 Strategie per il controllo Misure per il controllo della TB • Principali misure per il controllo della TB: – trattamento farmacologico e gestione dei pazienti con TB – identificazione, sorveglianza e trattamento dei gruppi ad alto rischio • contatti di casi di TB • persone con infezione da HIV • altri gruppi a rischio – vaccinazione con BCG • I ritardi diagnostici contribuiscono ad aumentare i casi di malattia in fase avanzata, con maggiore potenziale di contagio Gazzetta Ufficiale della Repubblica Italiana, 1998 Altet G. M. N. et al. Arch. Broncopneumol 2003
Strategie per il controllo Misure per il controllo della TB • Principali misure per il controllo della TB: – trattamento farmacologico e gestione dei pazienti con TB – identificazione, sorveglianza e trattamento dei gruppi ad alto rischio • contatti di casi di TB • persone con infezione da HIV • altri gruppi a rischio – vaccinazione con BCG • I ritardi diagnostici contribuiscono ad aumentare i casi di malattia in fase avanzata, con maggiore potenziale di contagio Gazzetta Ufficiale della Repubblica Italiana, 1998 Altet G. M. N. et al. Arch. Broncopneumol 2003
 Prevenzione Vaccinazione con BCG • BCG deriva da un ceppo attenuato di M. bovis • La vaccinazione routinaria è raccomandata alla nascita nei paesi ad alta prevalenza di TB • Bassa efficacia: 0 -80% • Protezione dei bambini da forme severe (meningiti e miliari) • Effetti collaterali (1 -10%): ulcerazione locale e linfoadenite • Determina positività al TST, che diminuisce col passare degli anni Brewer T. F. Clin Infect Dis 2000
Prevenzione Vaccinazione con BCG • BCG deriva da un ceppo attenuato di M. bovis • La vaccinazione routinaria è raccomandata alla nascita nei paesi ad alta prevalenza di TB • Bassa efficacia: 0 -80% • Protezione dei bambini da forme severe (meningiti e miliari) • Effetti collaterali (1 -10%): ulcerazione locale e linfoadenite • Determina positività al TST, che diminuisce col passare degli anni Brewer T. F. Clin Infect Dis 2000
 Prevenzione Trattamento dell’infezione latente TB attiva 8 milioni di casi all’anno: la punta dell’iceberg LTBI 2 miliardi di persone: l’epidemia nascosta
Prevenzione Trattamento dell’infezione latente TB attiva 8 milioni di casi all’anno: la punta dell’iceberg LTBI 2 miliardi di persone: l’epidemia nascosta
 Prevenzione Trattamento dell’infezione latente • Ha l’obiettivo di prevenire la progressione da LTBI a TB • Bisogna escludere la presenza di malattia attiva • Deve essere mirata a specifici gruppi a rischio di TB – soggetti con infezione tubercolare recente – soggetti ad alto rischio di progressione verso la malattia • Regimi terapeutici studiati Farmaco Durata HIV- HIV+ Isoniazide 9 mesi A (II) Isoniazide 6 mesi B (I) C (I) Rifamp. - Piraz. 2 mesi B (II) A (I) Rifampicina 4 mesi B (II) B (III) TST ≥ 5 mm TST ≥ 10 mm TST ≥ 15 mm - HIV positivi - contatti recenti di TB - rx compatibile con TB - trapiantati e immunosoppres si - immigrati di recente da aree ad alta prevalenza - tossicodipendenti ev - residenti e operatori di ambienti a rischio - silicosi, diabete mellito, IRC, leucemie, carcinomi… - soggetti senza fattori di rischio • Bassa incidenza di effetti collaterali • Alta percentuale di pazienti che abbandonano il trattamento prima del suo completamento American Thoracic Society. Am J Respir Crit Care Med 2000 Horsburgh C. R. Jr. N Engl J Med 2004
Prevenzione Trattamento dell’infezione latente • Ha l’obiettivo di prevenire la progressione da LTBI a TB • Bisogna escludere la presenza di malattia attiva • Deve essere mirata a specifici gruppi a rischio di TB – soggetti con infezione tubercolare recente – soggetti ad alto rischio di progressione verso la malattia • Regimi terapeutici studiati Farmaco Durata HIV- HIV+ Isoniazide 9 mesi A (II) Isoniazide 6 mesi B (I) C (I) Rifamp. - Piraz. 2 mesi B (II) A (I) Rifampicina 4 mesi B (II) B (III) TST ≥ 5 mm TST ≥ 10 mm TST ≥ 15 mm - HIV positivi - contatti recenti di TB - rx compatibile con TB - trapiantati e immunosoppres si - immigrati di recente da aree ad alta prevalenza - tossicodipendenti ev - residenti e operatori di ambienti a rischio - silicosi, diabete mellito, IRC, leucemie, carcinomi… - soggetti senza fattori di rischio • Bassa incidenza di effetti collaterali • Alta percentuale di pazienti che abbandonano il trattamento prima del suo completamento American Thoracic Society. Am J Respir Crit Care Med 2000 Horsburgh C. R. Jr. N Engl J Med 2004
 Prevenzione • Identificazione dei casi contagiosi e loro appropriato trattamento • Vaccinazione • Chemioprofilassi
Prevenzione • Identificazione dei casi contagiosi e loro appropriato trattamento • Vaccinazione • Chemioprofilassi
 Vaccinazione • • Con BCG: bacillo di Calmette-Guerin da ceppo attenuato di M. Bovis Esistono molti vaccini preparati con BCG con diversa efficacia (0 -80%) • In Italia la vaccinazione con BCG è obbligatoria dal 1970 per alcune categorie di persone cutinegative all’intradermoreazione: – Soggetti di età compresa fra 5 e 15 anni, figli di tubercolotici o abitanti in nuclei familiari di ammalati o ex ammalati di tubercolosi – Figli di personale di assistenza in sanatori – Soldati all’arruolamento – Studenti in medicina al momento dell’iscrizione all’università ? – Addetti agli ospedali, cliniche ed ospedali psichiatrici – Persone tra i 5 e 15 anni che vivono in zone depresse ad alta morbosità • Controindicata in pazienti con infezione HIV sintomatica
Vaccinazione • • Con BCG: bacillo di Calmette-Guerin da ceppo attenuato di M. Bovis Esistono molti vaccini preparati con BCG con diversa efficacia (0 -80%) • In Italia la vaccinazione con BCG è obbligatoria dal 1970 per alcune categorie di persone cutinegative all’intradermoreazione: – Soggetti di età compresa fra 5 e 15 anni, figli di tubercolotici o abitanti in nuclei familiari di ammalati o ex ammalati di tubercolosi – Figli di personale di assistenza in sanatori – Soldati all’arruolamento – Studenti in medicina al momento dell’iscrizione all’università ? – Addetti agli ospedali, cliniche ed ospedali psichiatrici – Persone tra i 5 e 15 anni che vivono in zone depresse ad alta morbosità • Controindicata in pazienti con infezione HIV sintomatica
 Chemioprofilassi (terapia della TBC latente) Il test cutaneo alla tubercolina è l’unico mezzo per diagnosticare una TBC latente Il 5% dei soggetti con TBC latente sviluppa la malattia tubercolare attiva entro 2 anni dall’infezione I candidati alla chemioprofilassi vengono identificati sottoponendo a test cutaneo con PPD gli appartenenti a gruppi a rischio elevato ______________________________ Gruppo a rischio Reazione tubercolina (mm) Infezione HIV 5 Contatti stretti 5 Lesioni fibrotiche al Rx torace 5 Soggetti infettati recentemente 10 Condizioni mediche a rischio elevato* 10 ______________________________ * diabete, terapia prolungata con corticosteroidi, terapia immunosoppressiva, tossicodipendenza, alcune malattie ematologiche, malattia renale allo stadio terminale
Chemioprofilassi (terapia della TBC latente) Il test cutaneo alla tubercolina è l’unico mezzo per diagnosticare una TBC latente Il 5% dei soggetti con TBC latente sviluppa la malattia tubercolare attiva entro 2 anni dall’infezione I candidati alla chemioprofilassi vengono identificati sottoponendo a test cutaneo con PPD gli appartenenti a gruppi a rischio elevato ______________________________ Gruppo a rischio Reazione tubercolina (mm) Infezione HIV 5 Contatti stretti 5 Lesioni fibrotiche al Rx torace 5 Soggetti infettati recentemente 10 Condizioni mediche a rischio elevato* 10 ______________________________ * diabete, terapia prolungata con corticosteroidi, terapia immunosoppressiva, tossicodipendenza, alcune malattie ematologiche, malattia renale allo stadio terminale
 Chemioprofilassi (terapia della TBC latente) La profilassi va somministrata solo dopo aver escluso TBC attiva • Isoniazide 300 mg/dì per 9 mesi In alternativa • Rifampicina 600 mg/dì per 4 mesi oppure • Rifampicina 600 mg/dì + Pirazinamide 20 -25 mg/Kg per 2 mesi
Chemioprofilassi (terapia della TBC latente) La profilassi va somministrata solo dopo aver escluso TBC attiva • Isoniazide 300 mg/dì per 9 mesi In alternativa • Rifampicina 600 mg/dì per 4 mesi oppure • Rifampicina 600 mg/dì + Pirazinamide 20 -25 mg/Kg per 2 mesi
 Terapia della TBC Principi generali • Somministrare in contemporanea almeno due agenti a cui il microrganismo sia sensibile (si riduce il rischio di resistenze) • Trattamento protratto per un lungo periodo (tempo di riproduzione dei micobatteri molto lungo) Spesso l’aderenza a regimi polifarmacologici protratti è scarsa
Terapia della TBC Principi generali • Somministrare in contemporanea almeno due agenti a cui il microrganismo sia sensibile (si riduce il rischio di resistenze) • Trattamento protratto per un lungo periodo (tempo di riproduzione dei micobatteri molto lungo) Spesso l’aderenza a regimi polifarmacologici protratti è scarsa
 Farmaci di 1° scelta • • Isoniazide, rifampicina, pirazinamide, etambutolo, streptomicina Sono dotati di attività battericida e sterilizzatrice Isoniazide • • • E’ il più efficace, meno tossico, meno costoso Posologia – 10 mg/kg/dì per os – nell’adulto 300 mg/dì Metabolizzato – a livello epatico, metaboliti eliminati per via renale Effetti collaterali – neuropatie (associare 10 -25 mg /dì di piridossina-B 6), convulsioni, atassia, epatotossicità Controindicazioni – Epatopatie
Farmaci di 1° scelta • • Isoniazide, rifampicina, pirazinamide, etambutolo, streptomicina Sono dotati di attività battericida e sterilizzatrice Isoniazide • • • E’ il più efficace, meno tossico, meno costoso Posologia – 10 mg/kg/dì per os – nell’adulto 300 mg/dì Metabolizzato – a livello epatico, metaboliti eliminati per via renale Effetti collaterali – neuropatie (associare 10 -25 mg /dì di piridossina-B 6), convulsioni, atassia, epatotossicità Controindicazioni – Epatopatie
 Rifampicina • Posologia – 600 mg/dì per os • Eliminazione – Per via biliare e renale • Effetti collaterali – disturbi intestinali, epatotossicità, alterazioni ematologiche (trombocitopenia, anemia emolitica, leucopenia), nefrite interstiziale, uveite, dismenorrea, s. simil influenzale – I liquidi biologici possono colorarsi di rosso (anche le lenti a contatto) • Importanti interazioni farmacologiche – In particolare riduce l’attività di analgesici, ß-bloccanti, glucocorticoidi, ipoglicemizzanti orali, contraccettivi orali, verapamil, warfarin
Rifampicina • Posologia – 600 mg/dì per os • Eliminazione – Per via biliare e renale • Effetti collaterali – disturbi intestinali, epatotossicità, alterazioni ematologiche (trombocitopenia, anemia emolitica, leucopenia), nefrite interstiziale, uveite, dismenorrea, s. simil influenzale – I liquidi biologici possono colorarsi di rosso (anche le lenti a contatto) • Importanti interazioni farmacologiche – In particolare riduce l’attività di analgesici, ß-bloccanti, glucocorticoidi, ipoglicemizzanti orali, contraccettivi orali, verapamil, warfarin
 Pirazinamide • Posologia – Bambini 15 -30 mg/Kg/dì per os – Adulti <50 Kg = 1. 5 g/dì; >50 Kg = 2 g/dì; >75 Kg = 2. 5 g/dì • Metabolizzato – a livello epatico, eliminato per via renale • Effetti collaterali – Epatotossicità, disturbi intestinali, fotosensibilizzazione, artralgie, iperuricemia • Controindicazioni – Gravidanza
Pirazinamide • Posologia – Bambini 15 -30 mg/Kg/dì per os – Adulti <50 Kg = 1. 5 g/dì; >50 Kg = 2 g/dì; >75 Kg = 2. 5 g/dì • Metabolizzato – a livello epatico, eliminato per via renale • Effetti collaterali – Epatotossicità, disturbi intestinali, fotosensibilizzazione, artralgie, iperuricemia • Controindicazioni – Gravidanza
 Etambutolo • • • Posologia – 20 mg/kg/dì per 2 mesi, poi 15 mg/Kg/dì per os Eliminazione – per via renale Effetti collaterali – Neurite ottica, aumento transaminasi, dermatiti, artralgie, febbre, iperuricemia, reazioni anafilattiche Streptomicina • • Aminoglicoside, utilizzato come sostituto dell’etambutolo nei casi di M. tuberculosis resistente Non supera la barriera emato-encefalica Posologia – 15 mg/Kg/dì i. m. Effetti collaterali (10 -20%) – Tossicità sull’VIII n. c. , tossicità renale, febbre, vertigini
Etambutolo • • • Posologia – 20 mg/kg/dì per 2 mesi, poi 15 mg/Kg/dì per os Eliminazione – per via renale Effetti collaterali – Neurite ottica, aumento transaminasi, dermatiti, artralgie, febbre, iperuricemia, reazioni anafilattiche Streptomicina • • Aminoglicoside, utilizzato come sostituto dell’etambutolo nei casi di M. tuberculosis resistente Non supera la barriera emato-encefalica Posologia – 15 mg/Kg/dì i. m. Effetti collaterali (10 -20%) – Tossicità sull’VIII n. c. , tossicità renale, febbre, vertigini
 I Farmaci di prima scelta e dosaggi in terapia quotidiana I farmaci attualmente considerati di prima scelta nel trattamento antitubercolare sono: • Isoniazide (INI): 5 mg/kg/die (max 300 mg/die) • Rifampicina (RMP): 10 -12 mg/kg/die (max 600 mg) • Pirazinamide (PZA): 25 mg/kg/die (max 2 g/die) • Streptomicina (SM): 15 mg/kg/die (max 1 g/die; se pz. > 65 aa. max 750 mg/die) • Etambutolo (ETB): 20 mg/kg/die (max 2 g/die)
I Farmaci di prima scelta e dosaggi in terapia quotidiana I farmaci attualmente considerati di prima scelta nel trattamento antitubercolare sono: • Isoniazide (INI): 5 mg/kg/die (max 300 mg/die) • Rifampicina (RMP): 10 -12 mg/kg/die (max 600 mg) • Pirazinamide (PZA): 25 mg/kg/die (max 2 g/die) • Streptomicina (SM): 15 mg/kg/die (max 1 g/die; se pz. > 65 aa. max 750 mg/die) • Etambutolo (ETB): 20 mg/kg/die (max 2 g/die)
 II Terapie di 2° linea • • Da utilizzare per forme farmaco-resistenti o quando i farmaci di prima scelta non possono essere impiegati Rifabutina, chinolonici, capreomicina, amikacina, kanamicina, acido paraminosalicilico (PAS), tiacetazone, etionamide, cicloserina ______________________________ Cortisone - Uso controverso - Può essere associato in forma miliare, ipertossica, pericarditi, pleuriti, peritoniti, meningiti ______________________________ Terapia chirurgica - Oggi impiegata raramente
II Terapie di 2° linea • • Da utilizzare per forme farmaco-resistenti o quando i farmaci di prima scelta non possono essere impiegati Rifabutina, chinolonici, capreomicina, amikacina, kanamicina, acido paraminosalicilico (PAS), tiacetazone, etionamide, cicloserina ______________________________ Cortisone - Uso controverso - Può essere associato in forma miliare, ipertossica, pericarditi, pleuriti, peritoniti, meningiti ______________________________ Terapia chirurgica - Oggi impiegata raramente
 SCHEMI DI TERAPIA TBC polmonare Fase iniziale – battericida – durata 2 mesi • Deve di norma includere 4 farmaci • isonizide + rifampicina + pirazinamide + etambutolo (o streptomicina) • (etambutolo o streptomicina fino ai risultati dei test di sensibilità) Fase di consolidamento – durata 4 mesi • isoniazide + rifampicina • Se il paziente è a rischio di deficit vitaminico (alcolismo, denutrizione, gravidanza, HIV, ecc) associare piridossina (10 -25 mg/dì) Schemi alternativi • isoniazide + rifampicina + pirazinamide • isoniazide + rifampicina • rifampicina + etambutolo • isoniazide + etambutolo per 6 mesi per 9 mesi per 12 mesi per 18 -24 mesi
SCHEMI DI TERAPIA TBC polmonare Fase iniziale – battericida – durata 2 mesi • Deve di norma includere 4 farmaci • isonizide + rifampicina + pirazinamide + etambutolo (o streptomicina) • (etambutolo o streptomicina fino ai risultati dei test di sensibilità) Fase di consolidamento – durata 4 mesi • isoniazide + rifampicina • Se il paziente è a rischio di deficit vitaminico (alcolismo, denutrizione, gravidanza, HIV, ecc) associare piridossina (10 -25 mg/dì) Schemi alternativi • isoniazide + rifampicina + pirazinamide • isoniazide + rifampicina • rifampicina + etambutolo • isoniazide + etambutolo per 6 mesi per 9 mesi per 12 mesi per 18 -24 mesi
 TBC extra-polmonare • Negli adulti può essere trattata nello stesso modo della localizzazione polmonare con regimi terapeutici di 6 -9 mesi TBC in gravidanza - Isoniazide e rifampicina per 9 mesi L’etambutolo può essere inizialamente impiegato Evitare pirazinamide e streptomicina Associare piridossina
TBC extra-polmonare • Negli adulti può essere trattata nello stesso modo della localizzazione polmonare con regimi terapeutici di 6 -9 mesi TBC in gravidanza - Isoniazide e rifampicina per 9 mesi L’etambutolo può essere inizialamente impiegato Evitare pirazinamide e streptomicina Associare piridossina
 Trattamento della malattia Tubercolosi multiresistente • Il termine di multiresistenza (MDR) identifica quei bacilli che non sono sensibili (almeno) all’isoniazide ed alla rifampicina • La multiresistenza influenza in maniera significativa la gestione e la prognosi • Il riscontro di una multiresistenza primaria nel soggetto immunocompetente è evento del tutto infrequente (1%) • La stragrande maggioranza dei casi di TB-MDR sono osservati in soggetti già sottoposti a uno o più trattamenti: • MDR secondaria – incongruità terapeutica – mancata compliance del paziente • Scarso successo terapeutico (in Italia il 40% raggiunge guarigione clinica) • Utilizzo di farmaci di seconda linea per lunghi periodi (maggiori effetti collaterali) • La gestione dovrebbe essere affidata a centri specializzati American Thoracic Society. Am J Respir Crit Care Med 2003
Trattamento della malattia Tubercolosi multiresistente • Il termine di multiresistenza (MDR) identifica quei bacilli che non sono sensibili (almeno) all’isoniazide ed alla rifampicina • La multiresistenza influenza in maniera significativa la gestione e la prognosi • Il riscontro di una multiresistenza primaria nel soggetto immunocompetente è evento del tutto infrequente (1%) • La stragrande maggioranza dei casi di TB-MDR sono osservati in soggetti già sottoposti a uno o più trattamenti: • MDR secondaria – incongruità terapeutica – mancata compliance del paziente • Scarso successo terapeutico (in Italia il 40% raggiunge guarigione clinica) • Utilizzo di farmaci di seconda linea per lunghi periodi (maggiori effetti collaterali) • La gestione dovrebbe essere affidata a centri specializzati American Thoracic Society. Am J Respir Crit Care Med 2003
 MDR-TB prevalence in new cases: 1994 -2003 MDR-TB is rampant in the former Soviet Union and China Tomsk (Russia) Lithuania Ivanovo Estonia (Russia) 12. 2 9. 4 9. 3 Latvia 9 13. 7 14. 2 Kazakhstan 13. 2 Uzbekistan Henan 10. 4 (China) 14. 2 Israel Domenican Rep 5 Iran Liaoning (China) 6. 6 Ivory Coast 5. 3 4. 9 Ecuador 3. 1 Ref: DRS Report #3 (in press) 7. 8
MDR-TB prevalence in new cases: 1994 -2003 MDR-TB is rampant in the former Soviet Union and China Tomsk (Russia) Lithuania Ivanovo Estonia (Russia) 12. 2 9. 4 9. 3 Latvia 9 13. 7 14. 2 Kazakhstan 13. 2 Uzbekistan Henan 10. 4 (China) 14. 2 Israel Domenican Rep 5 Iran Liaoning (China) 6. 6 Ivory Coast 5. 3 4. 9 Ecuador 3. 1 Ref: DRS Report #3 (in press) 7. 8
 Second-Line Drug Classes for MDR TB Treatment Aminoglycosides Polypeptides First line drugs Fluoroquinolones Amikacin, Kanamycin Capreomycin Ciprofloxacin, Ofloxacin + Thioamides Serine analogues Ethionamide, Prothionamide Cycloserine PAS WHO. Guidelines for the programmatic management of drug-resistant tuberculosis. 2006.
Second-Line Drug Classes for MDR TB Treatment Aminoglycosides Polypeptides First line drugs Fluoroquinolones Amikacin, Kanamycin Capreomycin Ciprofloxacin, Ofloxacin + Thioamides Serine analogues Ethionamide, Prothionamide Cycloserine PAS WHO. Guidelines for the programmatic management of drug-resistant tuberculosis. 2006.
 XDR_TB Extensively Drug Resistant-Tuberculosis
XDR_TB Extensively Drug Resistant-Tuberculosis
 Key messages • La TB è ancora oggi una delle principali cause di morte nel mondo • La diagnosi eziologica di TB si basa sull’identificazione dell’agente patogeno in campioni biologici (generalmente espettorato). Peraltro un terzo dei casi rimangono microbiologicamente negativi • La terapia della malattia attiva prevede schemi terapeutici standardizzati a più farmaci, per aumentare le probabilità di successo e limitare l’insorgenza di forme resistenti • L’infezione tubercolare latente fin’ora poteva essere dimostrata solo con il test cutaneo alla tubercolina, scarsamente sensibile e specifico. Test in vitro di recente introduzione possono superare i limiti del test cutaneo • Per contenere la diffusione della tubercolosi è fondamentale identificare i soggetti candidati al trattamento dell’infezione latente, soprattutto tra coloro latente che hanno rischio maggiore di sviluppare la malattia attiva
Key messages • La TB è ancora oggi una delle principali cause di morte nel mondo • La diagnosi eziologica di TB si basa sull’identificazione dell’agente patogeno in campioni biologici (generalmente espettorato). Peraltro un terzo dei casi rimangono microbiologicamente negativi • La terapia della malattia attiva prevede schemi terapeutici standardizzati a più farmaci, per aumentare le probabilità di successo e limitare l’insorgenza di forme resistenti • L’infezione tubercolare latente fin’ora poteva essere dimostrata solo con il test cutaneo alla tubercolina, scarsamente sensibile e specifico. Test in vitro di recente introduzione possono superare i limiti del test cutaneo • Per contenere la diffusione della tubercolosi è fondamentale identificare i soggetti candidati al trattamento dell’infezione latente, soprattutto tra coloro latente che hanno rischio maggiore di sviluppare la malattia attiva


