Degidrirovanie_n-butana.pptx
- Количество слайдов: 10

Дегидрирование н-бутана

Термохимическое уравнение CH 3 -CH 2 -CH 3 ↔ CH 3 -CH 2 -CH=CH 2 + H 2 - Q 1; • Q 1 = 30 ккал/моль = 125, 4 к. Дж/моль • , Где: I – интенсивность процесса, • B – выход продукта, • t – время пребывания реагентов.

Термодинамика количественно

Влияние давления и концентрации Pбутилена =Xбутилена*Pобщ. Pводорода=Xводорода*Pобщ. Pбутана =Xбутана *Pобщ. , где Xбутилена, Xводорода, Xбутана - мольные доли бутилена, водорода и бутана в реакционной смеси. • Pобщ. – общее давление в системе. • •

Кинетика • Основная реакция • CH 3 – CH - CH 3 CH 2 = CH – CH 2 – CH 3 + H 2 - Q 1 • • Побочные реакции • • CH 3 - CH 2 –CH 3 – CH 3 + CH 2 = CH 2 - Q 2 • CH 3 – CH 2 - CH 2 – CH 3 + CH 4 + C - Q 3 •

• • • • W 1 =k 1*Pбутана ( 4. 5 ), где: k 1 – константа скорости прямой реакции, Pбутана – парциальное давление бутана. Pбут. = Xбут. *Po. Xбут. – мольная доля бутана в реакционной смеси Po – общее давление газовой смеси W 1 = k 1*Xбут. Po ( 4. 6 ) По Аррениусу: W 1 = k 1 Xбут. Po F

Регенерация катализатора • • C + O 2 →CO 2 + Qэкзо. При этом одновременно идет окисление трехвалентной окиси хрома до шестивалентной окиси хрома по уравнению: • • Cr 2 O 3 + 1, 5 O 2 → 2 Cr. O 3 • Шестивалентная окись хрома не активна в реакции дегидрирования, поэтому ее восстанавливают в активное состояние реакцией: • • 2 Cr. O 3 + 3 H 2 →Cr 2 O 3 + 3 H 2 O •
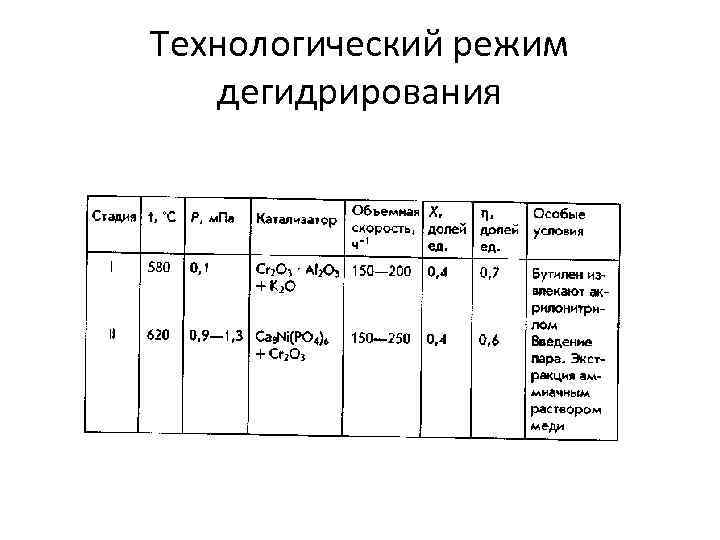
Технологический режим дегидрирования

Принципиальная схема двухстадийного процесса дегидрирования н-бутана • Сu 2(NН 3)4(СН 3 СОО)2+С 4 Н 6 ↔ С 4 Нб(NН 3)3 Сu 2(СН 3 СОО)2+NН 3

Degidrirovanie_n-butana.pptx