60bb2bb04752c91fb96553bc0daa93bb.ppt
- Количество слайдов: 37

DEFICIENCIA DE BIOTINIDASA Qca Biológica Patológica FQBF-UNSL 2017 Dra. María Sofía Giménez mgimenez@unsl. edu. ar

DEFICIENCIA DE BIOTINIDASA

¿Qué funcion cumple esta enzima? Proveer de BIOTINA para la activación de carboxilasas indispensables para el metabolismo celular

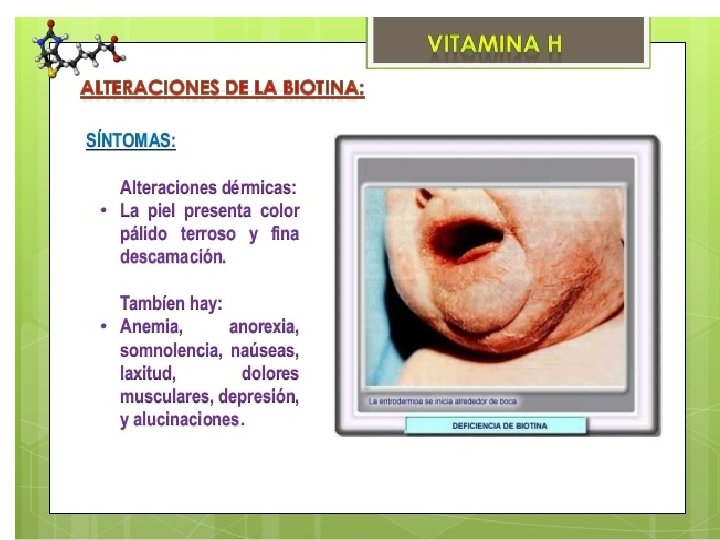
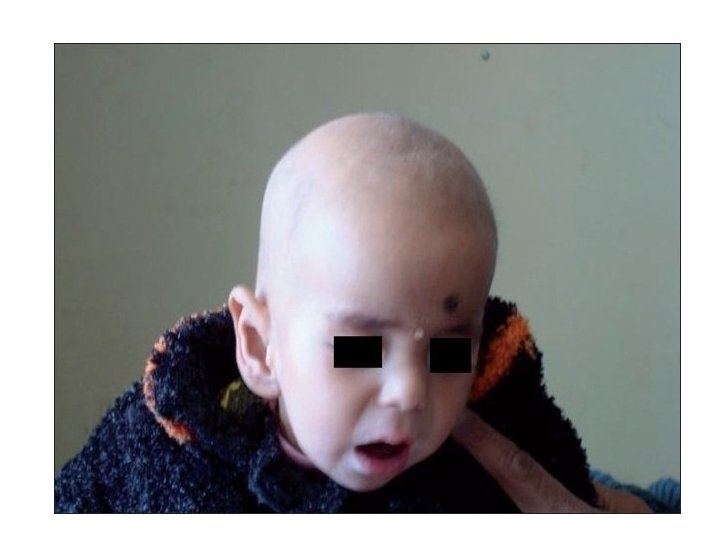
¿Cuáles son los síntomas de la deficiencia de biotinidasa? Cada niño con deficiencia de biotinidasa es diferente. La mayoría de los bebés con deficiencia de biotinidasa parecen normales cuando nacen. Los síntomas de la deficiencia de biotinidasa pueden aparecer poco después del nacimiento, o pueden aparecer más tarde en la infancia. Los síntomas comunes de una deficiencia aguda (severa) de biotinidasa incluyen: Problemas de piel Pérdida de cabello Problemas de audición y/o visión Convulsiones Músculos débiles Retraso en el desarrollo
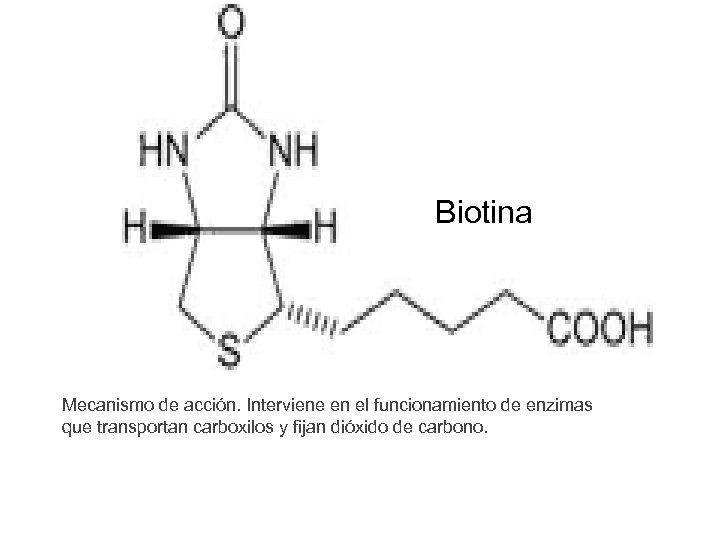
Biotina Mecanismo de acción. Interviene en el funcionamiento de enzimas que transportan carboxilos y fijan dióxido de carbono.

La biotina es una vitamina hidrosoluble que se clasifica generalmente como una vitamina del complejo B. Después del descubrimiento inicial de la biotina, se necesitaron cerca de 40 años de investigación para establecerla como una vitamina. Todos los organismos requieren biotina; sin embargo, ésta sólo puede ser sintetizada por bacterias, levaduras, hongos, algas, y algunas especies de plantas. Se absorbe en el intestino delgado y grueso y la concentración en orina y heces supera la concentracion del suero



Para los veganos o los vegetarianos,
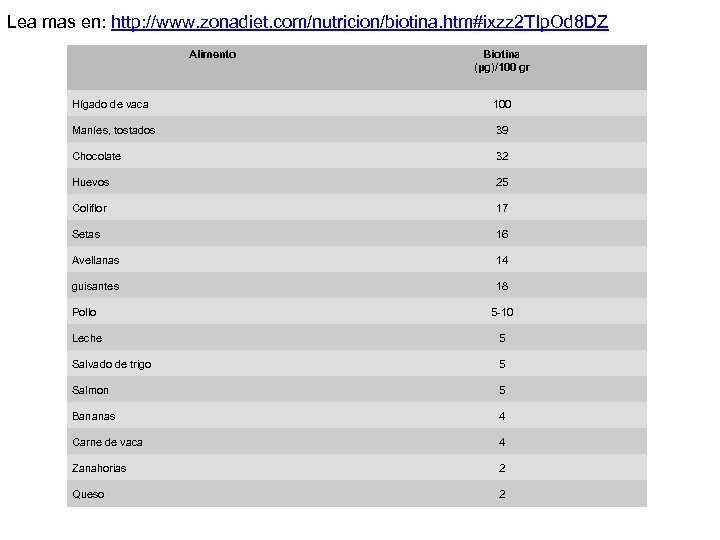
Lea mas en: http: //www. zonadiet. com/nutricion/biotina. htm#ixzz 2 TIp. Od 8 DZ Alimento Biotina (μg)/100 gr Hígado de vaca 100 Maníes, tostados 39 Chocolate 32 Huevos 25 Coliflor 17 Setas 16 Avellanas 14 guisantes 18 Pollo 5 -10 Leche 5 Salvado de trigo 5 Salmon 5 Bananas 4 Carne de vaca 4 Zanahorias 2 Queso 2

Toxicidad Su toxicidad no existe, puesto que al ser hidrosoluble sus excesos son eliminados a través de la orina. De todos modos debe tenerse precaución en consumir ingestas mayores a las recomendadas mencionadas anteriormente. edad Hombres (μg/día) microgramo/dia Mujeres (μg/día) microgramo/dia 0 a 6 meses 5 7 a 12 meses 6 1 a 3 años 8 4 a 8 años 12 9 a 13 años 20 14 a 18 años 25 19 a 70 años 30 >70 años 30 Embarazo 30 Lactancia 35

¿Qué funciones tiene la Biotina? La presencia de Biotina en el organismo ayuda a fortalecer todos aquellos tejidos de rápido crecimiento, como son la piel, uñas y cabello ya que contribuye a la formación de diversos enzimas fundamentales para ellos. Una deficiencia o carencia de biotina es rara, pero puede darse, provocando entre otros síntomas: piel seca, erupciones en la piel, dermatitis, enteritis, alopecia, caída del cabello, pelo débil, uñas quebradizas, etc.


Volviendo a la Biotinidasa Provee de BIOTINA para la activación de carboxilasas indispensables para el metabolismo celular En el suero se encuentran 9 isoformas de esta enzima
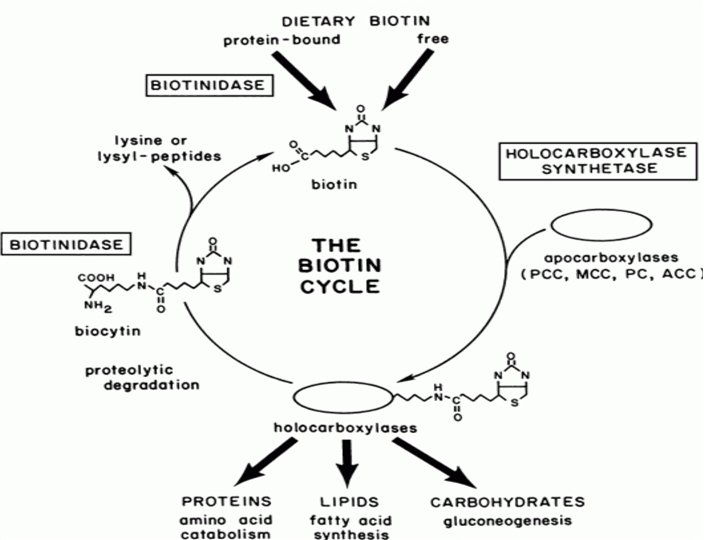
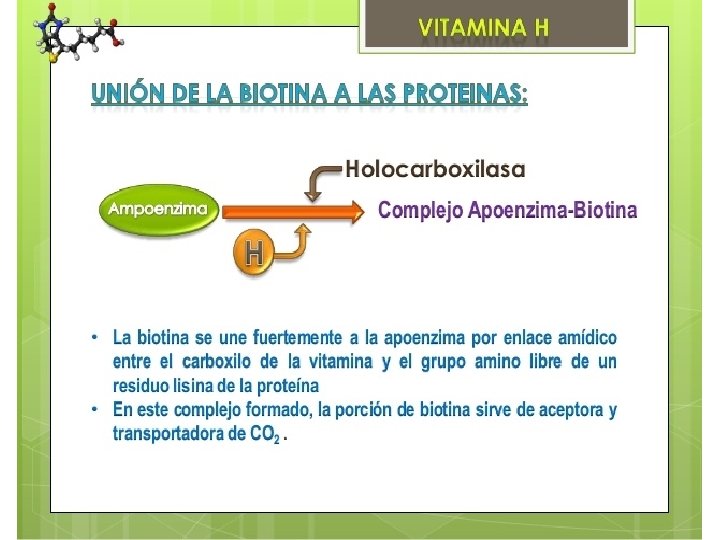

La biotina-proteína ligasa es una enzima que actúa realizando la modificación post-translacional de ciertas enzimas carboxilasas uniendo a ellas el cofactor biotina. Denominada también biotina carboxilasa (BC) (EC 6. 3. 4. 14) Acetil-Co. A carboxilasa. Metilcrotonil-Co. A carboxilasa. Piruvato carboxilasa. Propionil-Co. A carboxilasa.

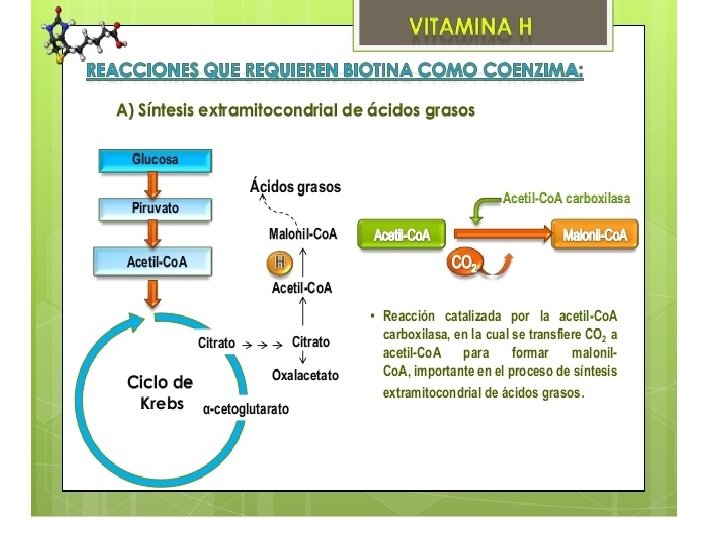
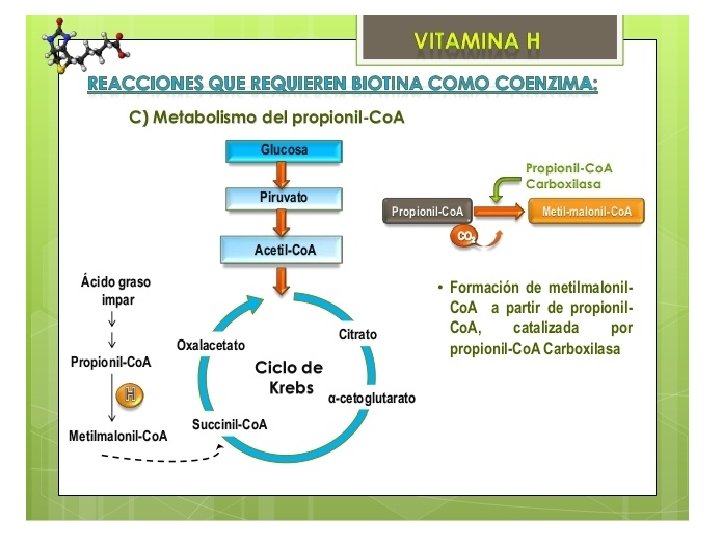
Cada carboxilasa cataliza una reacción metabólica esencial: Acetil-Co. A carboxilasa I y II catalizan la unión de bicarbonato a acetil-Co. A para formar malonil-Co. A. Malonil-Co. A es necesaria para la síntesis de ácidos grasos. La primera es crucial en la síntesis citosólica de ácidos grasos, y la segunda funciona regulando la oxidación mitocondrial de ácidos grasos. Piruvato carboxilasa es una enzima crítica en la gluconeogénesis— la formación de glucosa desde otras fuentes además de carbohidratos, por ejemplo, aminoácidos. Metilcrotonil-Co. A carboxilasa cataliza un paso esencial en el catabolismo de leucina, un aminoácido esencial. Propionil-Co. A carboxilasa ccataliza pasos esenciales en el metabolismo de ciertos aminoácidos, colesterol, y ácidos grasos de cadena impar (ácidos grasos con un número impar de moléculas de carbono)

ENZIMAS QUE REQUIEREN BIOTINA COMO CO-FACTOR • • • Piruvato carboxilasa Acetil-Co. A carboxilasa alfa y beta Propionil-Co. A carboxilasa Metilcrotonil-Co. A carboxilasa Geranoil-Co. A carboxilasa Urea carboxilasa Oxaloacetato decarboxilasa. Metilmalonil-Co. A decarboxilasa. Glutaconil-Co. A decarboxilasa. Metilmalonil-Co. A carboxitransferasa.
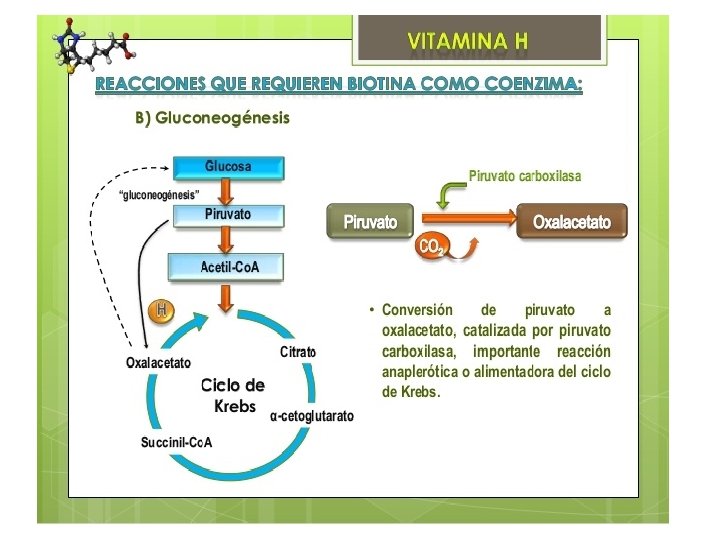

Cual es la causa la deficiencia de biotinidasa? Alteraciones a nivel del gen que codifica para la proteina enzima Se hereda en forma autosomica recesiva

Caracterización molecular del gen de biotinidasa. El gen ha sido localizado en el cromosoma 3 y está organizado en cuatro exones y se extiende por al menos 23 kb El c. DNA que codifica para biotinidasa presente en suero humano ha sido clonado a partir de una biblioteca de hígado humano utilizando oligonucleótidos preparados a partir de las secuencias de aminoácidos de péptidos trípticos de biotinidasa purificada (Gen. Bank UO 3274) El c. DNA codifica para una proteína de 543 residuos de aminoácidos (masa molecular de 56. 661 Da), incluyendo 41 aminoácidos de un péptido señal de potencial La enzima presente en suero proviene fundmentalmente de hígado. Esta también presente en las células intestinales y secreción pancreática

Las mutaciones. Veintiún mutaciones que causan la deficiencia de biotinidasa fueron identificados en los niños. La mutación mas frecuente es la R 538 C, es una mutación en el exón 4 del gen. Esta mutación se encuentra en al menos un alelo de 30 por ciento niños sintomáticos. La proteína aberrante de biotinidasa no era detectable en extractos de fibroblastos de un niño que es homocigótico para la mutación R 538 C (Arginina por Cisteina)

FRECUENCIA: 1: 40. 000 PORTADORES 1: 25. 000

Diagnóstico Se hace mediante el uso de peptidos biotinilados que sirven de sustrato y determinando la biotina liberada, utilizando métodos colorimétricos y fluorométricos. Se ha utilizado como sustrato artificial N-biotinil p-aminobenzoato. El paminobenzoato liberado del sustrato artificial se diazota, junto con un derivado de naftol para formar un colorante azoico, La actividad enzimática se determinó utilizando un método en el que este ensayo ha sido automatizado. Otro método fluorométrico desarrollado mide la liberación de 6 aminoquinolina de un sustrato diferente artificial, N-biotinil 6 -aminoquinoline. La actividad media biotinidasa medido por el método colorimétrico en el suero normal en niños es de 7, 1 nmol de p-aminobenzoato por minuto por mililitro, como valor medio La enzima es estable en una mancha de sangre al menos por 18 meses desde su extracción.

FUNDAMENTO DEL ENSAYO: Ultramicroensayo colorimétrico cualitativo para la detección de la deficiencia de biotinidasa en sangre seca sobre papel de filtro. Este ensayo tiene como fundamento la evaluación de la actividad hidrolítica de la enzima biotinidasa (biotina-amida amidohidrolasa) presente en la muestra es capaz de hidrolizar el biotin-ácido - aminobenzoico (BPABA) en condiciones óptimas de p. H y temperatura, liberando el ácido - aminobenzoico (PABA). Este último, en medio ácido, junto con el nitrito de sodio y sulfamato de amonio forman un complejo coloreado con la vitamina la intensidad del color obtenido es proporcional a la actividad de la enzima biotinidasa presente en la muestra. TIPO DE MUESTRA: Sangre del talón tomada al 5 to. día de nacido, recolectadas sobre papel de filtro S&S 903.

PROCEDIMIENTO TÉCNICO: Corte un disco de 3 mm de diámetro en la mancha de sangre del control R. Deposítelo en placa elusión y añádale 40 de solución R 1. Corte un disco de 3 mm de diámetro en la mancha de sangre del control 1. Deposítelo en placa elusión en la posición indicada para el control 1 y añada 40 µl de solución de trabajo R 3. Corte un disco de 3 mm de diámetro en la mancha de sangre del control 2. Deposítelo en placa elusión en la posición indicada para el control 2 y añada 40 µl de solución de trabajo R 4. Corte un disco de 3 mm de diámetro de las muestras deposítelo en la placa de elusión en las posiciones indicadas y añadir 40 µl de la solución de trabajo R 2. Transfiera 10 µl de los controles y las muestras en la placa de reacción (F 42), añada 10 µl de la solución TCA a 30% y deje reposar durante 10 minutos añada 10 µl de la solución de trabajo R 5 en cada pocillo de la placa de reacción. Esperar 3 min. Añadir 10 µ de la solución de trabajo R 6 en cada pocillo de la placa de reacción. Añada 10 µl de la solución de trabajo R 7 en cada pocillo. Incubar a temperatura ambiente (20 -25 °C) en cámara húmeda. Esperar 10 minutos para realizar la interpretación de resultados.
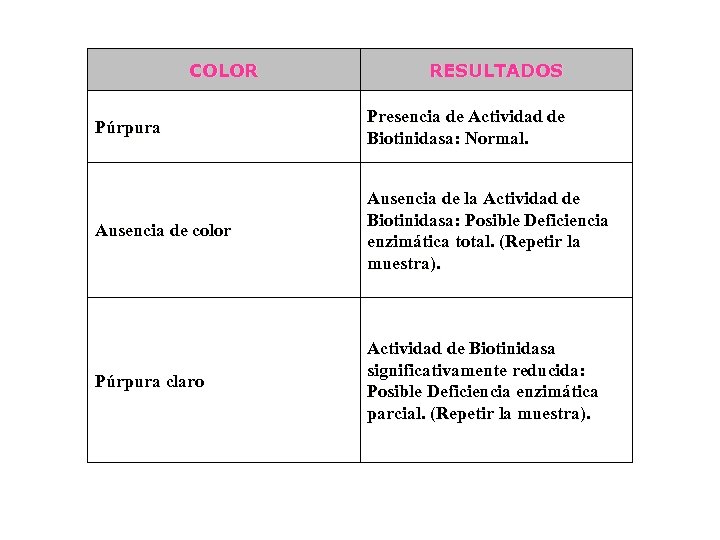
COLOR RESULTADOS Púrpura Presencia de Actividad de Biotinidasa: Normal. Ausencia de color Ausencia de la Actividad de Biotinidasa: Posible Deficiencia enzimática total. (Repetir la muestra). Púrpura claro Actividad de Biotinidasa significativamente reducida: Posible Deficiencia enzimática parcial. (Repetir la muestra).

Kit autorizado por ANMAT Disposición 6279 del 15 de octubre de 2010

¿Cuál es el tratamiento de la deficiencia de biotinidasa? No hay cura para la biotinidasa. Sin embargo, existe un tratamiento que puede ayudar con los síntomas. Los niños que tienen deficiencia de biotinidasa necesitarán tomar biotina adicional por el resto de sus vidas. Con un diagnóstico y tratamiento tempranos, la mayoría de los niños con deficiencia de biotinidasa tendrán pocos síntomas y una expectativa de vida normal.

Centros de referencia y especialistas: Unidad de Errores congénitos del Metabolismo Hospital Garrahan Pichincha Nº 1890 (CPA: C 1249 ABP) Ciudad Autónoma de Buenos Aires - República Argentina Teléfono: (54 - 11) 4308 - 4300 Dra. Luisa Bay Jefa de la Unidad de Errores Congénitos del Metabolismo del Hospital Garrahan lbay@garrahan. gov. ar TE: 49431702

Fundación de Endocrinología Infantil http: //www. fei. org. ar Unica sede: Gral. Lucio N. Mansilla 2771 (1425) Buenos Aires. Horario: Lunes a viernes de 8: 00 a 16: 00 hs. Tel: (011) 4964 -2008 Fax: (011) 4961 -7704 e-mail: fei@fei. com. ar Fundación para el estudio de las Enfermedades Neunormetabolicas Uriarte 2383 Buenos Aires Argentina Tel/Fax: 54 114 774 -305878615 info@fesen. org Directora Medica: Dra. Marina Szlago Marina. szlago@fesen. org Directora Científica: Dra. Andrea B. Schenone Andrea. schenone@fesen. org Web: www. fesen. org

Muchas gracias por su atención
60bb2bb04752c91fb96553bc0daa93bb.ppt