дефекты курс.pptx
- Количество слайдов: 45
 Дефекты и нестехиометрия в твердых телах Тема 1 Элементы геометрической кристаллографии Элементы симметрии. Описание кристаллов законами симметрии. Классы симметрии, точечные группы, сингонии, решетки Бравэ, элементарная ячейка Неотъемлемым признаком кристаллического строения минералов, можно сказать, его сущностью являются симметрия структуры и симметрия внешнего облика кристаллов. Симметрия—это закономерная повторяемость в расположении предметов или их частей на плоскости или в пространстве. Посредством некоторых простейших геометрических преобразований (вращение, отражение в зеркальной плоскости и т. п. ) отдельные части симметричной фигуры, пространственной решетки кристалла могут быть совмещены друг с другом. Пример: вращением граненого питьевого стакана вокруг его вертикальной оси можно совместить любую точку и часть стакана с другой, отражением в вертикальной срединной плоскости, как в зеркале, можно совместить разные половинки стакана. Симметричность строения фигур мы выявляем и описываем при помощи вспомогательных геометрических образов, которые мы называем элементами симметрии. Симметрия кристаллов соответствует симметрии их пространственных решеток. Существуют следующие элементы симметрии кристаллов: плоскости, оси и центр.
Дефекты и нестехиометрия в твердых телах Тема 1 Элементы геометрической кристаллографии Элементы симметрии. Описание кристаллов законами симметрии. Классы симметрии, точечные группы, сингонии, решетки Бравэ, элементарная ячейка Неотъемлемым признаком кристаллического строения минералов, можно сказать, его сущностью являются симметрия структуры и симметрия внешнего облика кристаллов. Симметрия—это закономерная повторяемость в расположении предметов или их частей на плоскости или в пространстве. Посредством некоторых простейших геометрических преобразований (вращение, отражение в зеркальной плоскости и т. п. ) отдельные части симметричной фигуры, пространственной решетки кристалла могут быть совмещены друг с другом. Пример: вращением граненого питьевого стакана вокруг его вертикальной оси можно совместить любую точку и часть стакана с другой, отражением в вертикальной срединной плоскости, как в зеркале, можно совместить разные половинки стакана. Симметричность строения фигур мы выявляем и описываем при помощи вспомогательных геометрических образов, которые мы называем элементами симметрии. Симметрия кристаллов соответствует симметрии их пространственных решеток. Существуют следующие элементы симметрии кристаллов: плоскости, оси и центр.
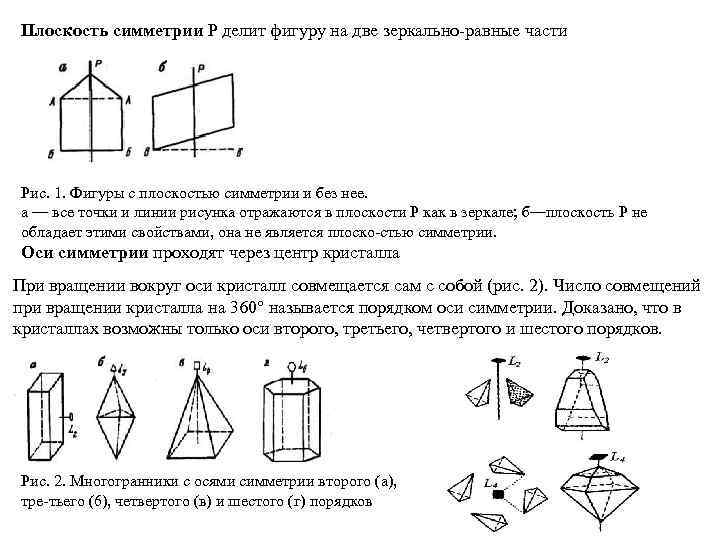 Плоскость симметрии Р делит фигуру на две зеркально равные части Рис. 1. Фигуры с плоскостью симметрии и без нее. а — все точки и линии рисунка отражаются в плоскости Р как в зеркале; б—плоскость Р не обладает этими свойствами, она не является плоско стью симметрии. Оси симметрии проходят через центр кристалла При вращении вокруг оси кристалл совмещается сам с собой (рис. 2). Число совмещений при вращении кристалла на 360° называется порядком оси симметрии. Доказано, что в кристаллах возможны только оси второго, третьего, четвертого и шестого порядков. Рис. 2. Многогранники с осями симметрии второго (а), тре тьего (6), четвертого (в) и шестого (г) порядков
Плоскость симметрии Р делит фигуру на две зеркально равные части Рис. 1. Фигуры с плоскостью симметрии и без нее. а — все точки и линии рисунка отражаются в плоскости Р как в зеркале; б—плоскость Р не обладает этими свойствами, она не является плоско стью симметрии. Оси симметрии проходят через центр кристалла При вращении вокруг оси кристалл совмещается сам с собой (рис. 2). Число совмещений при вращении кристалла на 360° называется порядком оси симметрии. Доказано, что в кристаллах возможны только оси второго, третьего, четвертого и шестого порядков. Рис. 2. Многогранники с осями симметрии второго (а), тре тьего (6), четвертого (в) и шестого (г) порядков
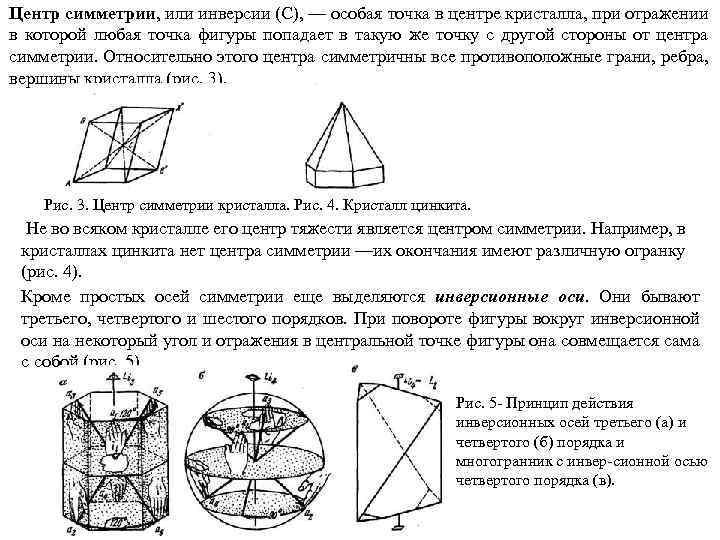 Центр симметрии, или инверсии (С), — особая точка в центре кристалла, при отражении в которой любая точка фигуры попадает в такую же точку с другой стороны от центра симметрии. Относительно этого центра симметричны все противоположные грани, ребра, вершины кристалла (рис. 3). Рис. 3. Центр симметрии кристалла. Рис. 4. Кристалл цинкита. Не во всяком кристалле его центр тяжести является центром симметрии. Например, в кристаллах цинкита нет центра симметрии —их окончания имеют различную огранку (рис. 4). Кроме простых осей симметрии еще выделяются инверсионные оси. Они бывают третьего, четвертого и шестого порядков. При повороте фигуры вокруг инверсионной оси на некоторый угол и отражения в центральной точке фигуры она совмещается сама с собой (рис. 5). Рис. 5 Принцип действия инверсионных осей третьего (а) и четвертого (б) порядка и многогранник с инвер сионной осью четвертого порядка (в).
Центр симметрии, или инверсии (С), — особая точка в центре кристалла, при отражении в которой любая точка фигуры попадает в такую же точку с другой стороны от центра симметрии. Относительно этого центра симметричны все противоположные грани, ребра, вершины кристалла (рис. 3). Рис. 3. Центр симметрии кристалла. Рис. 4. Кристалл цинкита. Не во всяком кристалле его центр тяжести является центром симметрии. Например, в кристаллах цинкита нет центра симметрии —их окончания имеют различную огранку (рис. 4). Кроме простых осей симметрии еще выделяются инверсионные оси. Они бывают третьего, четвертого и шестого порядков. При повороте фигуры вокруг инверсионной оси на некоторый угол и отражения в центральной точке фигуры она совмещается сама с собой (рис. 5). Рис. 5 Принцип действия инверсионных осей третьего (а) и четвертого (б) порядка и многогранник с инвер сионной осью четвертого порядка (в).
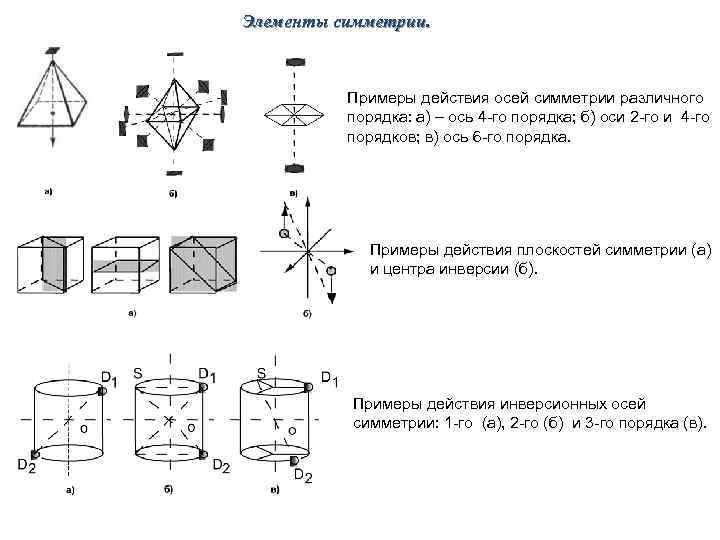 Элементы симметрии. Примеры действия осей симметрии различного порядка: а) – ось 4 -го порядка; б) оси 2 -го и 4 -го порядков; в) ось 6 -го порядка. Примеры действия плоскостей симметрии (а) и центра инверсии (б). Примеры действия инверсионных осей симметрии: 1 -го (а), 2 -го (б) и 3 -го порядка (в).
Элементы симметрии. Примеры действия осей симметрии различного порядка: а) – ось 4 -го порядка; б) оси 2 -го и 4 -го порядков; в) ось 6 -го порядка. Примеры действия плоскостей симметрии (а) и центра инверсии (б). Примеры действия инверсионных осей симметрии: 1 -го (а), 2 -го (б) и 3 -го порядка (в).
 Вращение вокруг оси симметрии, отражение в плоскости симметрии и перенос (инверсия) через центр симметрии — фактически отражение в зеркальной точке, расположенной в центре кристалла, — все такие действия называются операциями симметрии, или симметричными (симметрическими) преобразованиями. Это простые операции симметрии; кроме них в кристалле возможны и более сложные — комбинированные, или составные симметричные преобразования: одновременный поворот вокруг оси и отражение либо в плоскости симметрии (операция с так называемой зеркальной, или зеркально поворотной осью), либо в центре инверсии (операция с инверсионной осью). Всего, с учетом подобных операций, в кристаллах возможно 10 основных симметричных преобразований; однако в большинстве случаев такие дополнительные элементы симметрии как зеркальные и инверсионные оси могут быть заменены комбинациями основных элементов симметрии — поворотных осей с зеркальными плоскостями или центром инверсии.
Вращение вокруг оси симметрии, отражение в плоскости симметрии и перенос (инверсия) через центр симметрии — фактически отражение в зеркальной точке, расположенной в центре кристалла, — все такие действия называются операциями симметрии, или симметричными (симметрическими) преобразованиями. Это простые операции симметрии; кроме них в кристалле возможны и более сложные — комбинированные, или составные симметричные преобразования: одновременный поворот вокруг оси и отражение либо в плоскости симметрии (операция с так называемой зеркальной, или зеркально поворотной осью), либо в центре инверсии (операция с инверсионной осью). Всего, с учетом подобных операций, в кристаллах возможно 10 основных симметричных преобразований; однако в большинстве случаев такие дополнительные элементы симметрии как зеркальные и инверсионные оси могут быть заменены комбинациями основных элементов симметрии — поворотных осей с зеркальными плоскостями или центром инверсии.
 Понятие симметрии включает в себя составные части – элементы симметрии. Сюда относятся плоскость симметрии, ось симметрии, центр симметрии, или центр инверсии. Плоскость симметрии делит кристалл на две зеркально равные части. Обозначается она буквой Р. Части, на которые плоскость симметрии рассекает многогранник, относятся одна к другой, как предмет к своему изображению в зеркале разные кристаллы имеют различное количество плоскостей симметрии, которое ставится перед буквой Р. Наибольшее количество таких плоскостей у природных кристаллов – девять 9 Р. В кристалле серы насчитывается 3 Р, а у гипса только одна. Значит, в одном кристалле может быть несколько плоскостей симметрии. В некоторых кристаллах плоскость симметрии отсутствует. Плоскость симметрии может занимать следующее положение: • проходит через ребра; • лежать перпендикулярно к ребрам в их серединах; • проходить через грань перпендикулярно к ней; • пересекать гранные углы в их вершинах. В кристаллах возможны следующие количества плоскостей симметрии: 9 Р, 7 Р, 6 Р, 5 Р, 4 Р, 3 Р, 2 Р, Р, отсутствие плоскости симметрии. Ось симметрии – воображаемая ось, при повороте вокруг которой на некоторый угол фигура совмещается сама с собой в пространстве. Она обозначается буквой L. У кристаллов при вращении вокруг оси симметрии на полный оборот одинаковые элементы ограничения (грани, ребра, углы) могут повторяться только 2, 3, 4, 6 раз. Соответственно этому оси будут называться осями симметрии второго, третьего, четвертого и шестого порядка и обозначаться: L 2, L 3, L 4 и L 6. Порядок оси определяется числом совмещений при повороте на 360⁰С. Ось симметрии первого порядка не принимается во внимание, так как ею обладают вообще не фигуры, в том числе и несимметричные. Количество осей одного и того же порядка пишут перед буквой L: 6 L 6, 3 L 4 и т. п.
Понятие симметрии включает в себя составные части – элементы симметрии. Сюда относятся плоскость симметрии, ось симметрии, центр симметрии, или центр инверсии. Плоскость симметрии делит кристалл на две зеркально равные части. Обозначается она буквой Р. Части, на которые плоскость симметрии рассекает многогранник, относятся одна к другой, как предмет к своему изображению в зеркале разные кристаллы имеют различное количество плоскостей симметрии, которое ставится перед буквой Р. Наибольшее количество таких плоскостей у природных кристаллов – девять 9 Р. В кристалле серы насчитывается 3 Р, а у гипса только одна. Значит, в одном кристалле может быть несколько плоскостей симметрии. В некоторых кристаллах плоскость симметрии отсутствует. Плоскость симметрии может занимать следующее положение: • проходит через ребра; • лежать перпендикулярно к ребрам в их серединах; • проходить через грань перпендикулярно к ней; • пересекать гранные углы в их вершинах. В кристаллах возможны следующие количества плоскостей симметрии: 9 Р, 7 Р, 6 Р, 5 Р, 4 Р, 3 Р, 2 Р, Р, отсутствие плоскости симметрии. Ось симметрии – воображаемая ось, при повороте вокруг которой на некоторый угол фигура совмещается сама с собой в пространстве. Она обозначается буквой L. У кристаллов при вращении вокруг оси симметрии на полный оборот одинаковые элементы ограничения (грани, ребра, углы) могут повторяться только 2, 3, 4, 6 раз. Соответственно этому оси будут называться осями симметрии второго, третьего, четвертого и шестого порядка и обозначаться: L 2, L 3, L 4 и L 6. Порядок оси определяется числом совмещений при повороте на 360⁰С. Ось симметрии первого порядка не принимается во внимание, так как ею обладают вообще не фигуры, в том числе и несимметричные. Количество осей одного и того же порядка пишут перед буквой L: 6 L 6, 3 L 4 и т. п.
 Центр симметрии – это точка внутри кристалла, в которой пересекаются и делятся пополам линии, соединяющие одинаковые элементы ограничения кристалла (грани, ребра, углы). Обозначается она буквой С. Практически присутствие центра симметрии будет сказываться в том, что каждое ребро многогранника имеет параллельное себе ребро, каждая грань – такую же параллельную себе зеркально обратную грань. Если же в многограннике присутствуют грани, не имеющие себе параллельных, то такой многогранник не обладает центром симметрии. Достаточно поставить многогранник гранью на стол, чтобы заметить, имеется ли сверху такая же параллельная ей зеркально обратная грань. Конечно, на параллельность нужно проверить все типы граней. Существует ряд простых закономерностей, по которым сочетаются друг с другом элементы симметрии. Значение этих правил облегчает их нахождение. • Линия пересечения двух или нескольких плоскостей является осью симметрии. Порядок такой оси равен числу пересекающихся в ней плоскостей. • L 6 может присутствовать в кристалле только в единственном числе. • С L 6 не могут комбинироваться ни L 4, ни L 3, но может сочетаться L 2 причем L 6 и L 2 должны быть перпендикулярны; в таком случае присутствует 6 L 2. • L 4 может встречаться в единственном числе или трех взаимно перпендикулярных осей. • L 3 может встречаться в единственном числе или с 4 L 3.
Центр симметрии – это точка внутри кристалла, в которой пересекаются и делятся пополам линии, соединяющие одинаковые элементы ограничения кристалла (грани, ребра, углы). Обозначается она буквой С. Практически присутствие центра симметрии будет сказываться в том, что каждое ребро многогранника имеет параллельное себе ребро, каждая грань – такую же параллельную себе зеркально обратную грань. Если же в многограннике присутствуют грани, не имеющие себе параллельных, то такой многогранник не обладает центром симметрии. Достаточно поставить многогранник гранью на стол, чтобы заметить, имеется ли сверху такая же параллельная ей зеркально обратная грань. Конечно, на параллельность нужно проверить все типы граней. Существует ряд простых закономерностей, по которым сочетаются друг с другом элементы симметрии. Значение этих правил облегчает их нахождение. • Линия пересечения двух или нескольких плоскостей является осью симметрии. Порядок такой оси равен числу пересекающихся в ней плоскостей. • L 6 может присутствовать в кристалле только в единственном числе. • С L 6 не могут комбинироваться ни L 4, ни L 3, но может сочетаться L 2 причем L 6 и L 2 должны быть перпендикулярны; в таком случае присутствует 6 L 2. • L 4 может встречаться в единственном числе или трех взаимно перпендикулярных осей. • L 3 может встречаться в единственном числе или с 4 L 3.
 Степень симметрии Степенью симметрии называется совокупность всех элементов симметрии, которыми обладает данный кристалл. Кристалл, имеющий форму куба, обладает высокой степенью симметрии. В нем присутствуют три оси симметрии четвертого порядка (3 L 4), проходящие через середины граней куба, четыре оси симметрии третьего порядка (4 L 3), проходящие через вершины трехгранных углов, и шесть осей второго порядка (6 L 2), проходящих через середины ребер. В точке пересечения осей симметрии располагается центр симметрии куба (С). Кроме того, в кубе можно провести девять плоскостей симметрии (9 Р). Элементы симметрии кристалла можно изобразить кристаллографической формулой. Для куба формула имеет вид: 3 L 44 L 36 L 29 PC (по символике Браве). Для обозначения операций и элементов симметрии используется несколько видов символик: графическая; символика Браве (учебная); символика Шёнфлиса; символы Германа Могена (они же международные). Кроме того, в кристаллографической практике находит своё применение метод проекции кристаллов – сферической и стереографической – когда графические символы элементов симметрии наносятся на поверхность сферы, описывающей кристалл.
Степень симметрии Степенью симметрии называется совокупность всех элементов симметрии, которыми обладает данный кристалл. Кристалл, имеющий форму куба, обладает высокой степенью симметрии. В нем присутствуют три оси симметрии четвертого порядка (3 L 4), проходящие через середины граней куба, четыре оси симметрии третьего порядка (4 L 3), проходящие через вершины трехгранных углов, и шесть осей второго порядка (6 L 2), проходящих через середины ребер. В точке пересечения осей симметрии располагается центр симметрии куба (С). Кроме того, в кубе можно провести девять плоскостей симметрии (9 Р). Элементы симметрии кристалла можно изобразить кристаллографической формулой. Для куба формула имеет вид: 3 L 44 L 36 L 29 PC (по символике Браве). Для обозначения операций и элементов симметрии используется несколько видов символик: графическая; символика Браве (учебная); символика Шёнфлиса; символы Германа Могена (они же международные). Кроме того, в кристаллографической практике находит своё применение метод проекции кристаллов – сферической и стереографической – когда графические символы элементов симметрии наносятся на поверхность сферы, описывающей кристалл.
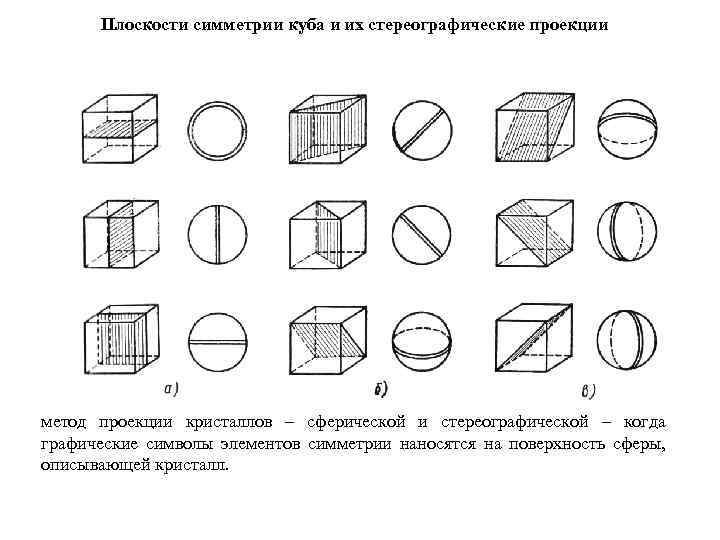 Плоскости симметрии куба и их стереографические проекции метод проекции кристаллов – сферической и стереографической – когда графические символы элементов симметрии наносятся на поверхность сферы, описывающей кристалл.
Плоскости симметрии куба и их стереографические проекции метод проекции кристаллов – сферической и стереографической – когда графические символы элементов симметрии наносятся на поверхность сферы, описывающей кристалл.
 Оси симметрии куба и их стереографические проекции
Оси симметрии куба и их стереографические проекции
 В зависимости от правил, принятых для каждой символики, элементам симметрии присваивают определённые обозначения (цифробуквенные или графические) и группируют их в виде формулы. • в графической символике используются элементы графики – фигурки многоугольников и различные линии; • в символике Браве буквы L, P, C с цифровыми индексами; • в символике Шёнфлиса – буквы C, D, S с цифровыми и буквенными индексами; • в международной символике (Германа Могена) – цифры и латинская буква m с индексами. Часто для обозначения дополнительных характеристик кристаллов вводятся дополнительные элементы или буквы. Символы Германа Могена могут приводиться в полном и сокращённом (когда некоторые составные части символа отсутствуют) вариантах. Следует отметить, что обозначения в разных видах символик не соответствуют другу, т. е. , если по Браве принято обозначать только оси, плоскости и точки, то по Герману Могену – только оси и плоскости. Наличие нескольких видов символик, видимо, связано с эволюцией представлений о симметрии и стремлением сделать записи более компактными и удобными для восприятия.
В зависимости от правил, принятых для каждой символики, элементам симметрии присваивают определённые обозначения (цифробуквенные или графические) и группируют их в виде формулы. • в графической символике используются элементы графики – фигурки многоугольников и различные линии; • в символике Браве буквы L, P, C с цифровыми индексами; • в символике Шёнфлиса – буквы C, D, S с цифровыми и буквенными индексами; • в международной символике (Германа Могена) – цифры и латинская буква m с индексами. Часто для обозначения дополнительных характеристик кристаллов вводятся дополнительные элементы или буквы. Символы Германа Могена могут приводиться в полном и сокращённом (когда некоторые составные части символа отсутствуют) вариантах. Следует отметить, что обозначения в разных видах символик не соответствуют другу, т. е. , если по Браве принято обозначать только оси, плоскости и точки, то по Герману Могену – только оси и плоскости. Наличие нескольких видов символик, видимо, связано с эволюцией представлений о симметрии и стремлением сделать записи более компактными и удобными для восприятия.
 Сочетание, или, как говорят кристаллографы, "сложение" элементов симметрии в кристаллах не произвольно, а подчиняется определенным правилам, ограничивающим число возможных комбинаций (в противном случае, при наличии в кристаллах семи независимых элементов симметрии, оно было бы огромным). Суть этих ограничений, налагаемых правилами сложения элементов симметрии, заключается в том, что, • во первых, некоторые операции симметрии оказываются равнозначными, • во вторых, симметричные преобразования действуют и на сами элементы симметрии. Последнее обстоятельство приводит к тому, что одни элементы симметрии порождают другие. Всего таких правил шесть. Благодаря им число возможных видов, или классов, симметрии кристаллов, т. е. простых комбинаций элементов симметрии, выражаемых различными формулами симметрии, резко сокращается. Существует строгий вывод этих классов симметрии, но здесь достаточно сказать, что их насчитывается для кристаллов 32. в основу вывода 32 х классов симметрии кристаллов и соответствующих им 47 простых форм легло представление о пяти ступенях (типах) симметрии кристаллов. Основные ступени симметрии
Сочетание, или, как говорят кристаллографы, "сложение" элементов симметрии в кристаллах не произвольно, а подчиняется определенным правилам, ограничивающим число возможных комбинаций (в противном случае, при наличии в кристаллах семи независимых элементов симметрии, оно было бы огромным). Суть этих ограничений, налагаемых правилами сложения элементов симметрии, заключается в том, что, • во первых, некоторые операции симметрии оказываются равнозначными, • во вторых, симметричные преобразования действуют и на сами элементы симметрии. Последнее обстоятельство приводит к тому, что одни элементы симметрии порождают другие. Всего таких правил шесть. Благодаря им число возможных видов, или классов, симметрии кристаллов, т. е. простых комбинаций элементов симметрии, выражаемых различными формулами симметрии, резко сокращается. Существует строгий вывод этих классов симметрии, но здесь достаточно сказать, что их насчитывается для кристаллов 32. в основу вывода 32 х классов симметрии кристаллов и соответствующих им 47 простых форм легло представление о пяти ступенях (типах) симметрии кристаллов. Основные ступени симметрии
 Основные ступени симметрии 1 я ступень. Примитивная (полярная) симметрия: элементы симметрии (кроме осей идентичности) отсутствуют. Все грани — самостоятельные простые формы — моноэдры (педионы), и ни одна из них не повторяется. 2 я ступень. Центральная симметрия: единственный элемент симметрии — центр инверсии. Противолежащие грани попарно равны и антипараллельны (т. е. повернуты в противоположные стороны); такая простая форма называется пинакоидом. 3 я ступень. Аксиальная (осевая) симметрия: присутствует одна полярная ось 2 го порядка. Любые две грани совмещаются путем поворота вокруг этой оси на 180°, образуя клиновидную простую форму — сфеноид (осевой диэдр). 4 я ступень. Планальная симметрия: имеется зеркальная плоскость, делящая пополам телесный угол между двумя гранями, которые располагаются в виде двускатной крыши и совмещаются между собой путем отражения в плоскости симметрии. Название такой простой формы — дома (безосный, или плоскостной диэдр) 5 я ступень. Планаксиальная симметрия: сочетание двух (точнее трех) предыдущих ступеней. Двойная ось становится биполярной (присутствует центр инверсии); зеркальная плоскость перпендикулярна ей. Характерная простая форма — четырехгранная призма.
Основные ступени симметрии 1 я ступень. Примитивная (полярная) симметрия: элементы симметрии (кроме осей идентичности) отсутствуют. Все грани — самостоятельные простые формы — моноэдры (педионы), и ни одна из них не повторяется. 2 я ступень. Центральная симметрия: единственный элемент симметрии — центр инверсии. Противолежащие грани попарно равны и антипараллельны (т. е. повернуты в противоположные стороны); такая простая форма называется пинакоидом. 3 я ступень. Аксиальная (осевая) симметрия: присутствует одна полярная ось 2 го порядка. Любые две грани совмещаются путем поворота вокруг этой оси на 180°, образуя клиновидную простую форму — сфеноид (осевой диэдр). 4 я ступень. Планальная симметрия: имеется зеркальная плоскость, делящая пополам телесный угол между двумя гранями, которые располагаются в виде двускатной крыши и совмещаются между собой путем отражения в плоскости симметрии. Название такой простой формы — дома (безосный, или плоскостной диэдр) 5 я ступень. Планаксиальная симметрия: сочетание двух (точнее трех) предыдущих ступеней. Двойная ось становится биполярной (присутствует центр инверсии); зеркальная плоскость перпендикулярна ей. Характерная простая форма — четырехгранная призма.
 В дальнейшем, зная, какие в кристаллах возможны оси симметрии, их последовательно сочетают с каждой из перечисленных выше ступеней симметрии и таким путем приходят к 32 точечным группам, соответствующим отдельным видам (классам) симметрии, т. е. всем возможным комбинациям элементов симметрии в кристаллах. В основе введенного Гесселем термина "точечные группы" лежит то обстоятельство, что в конечных кристаллических многогранниках все элементы симметрии проходят через одну неподвижную (фиксированную) точку — точку пересечения кристаллографических осей (т. е. через начало координат). Ныне пользуются преимущественно терминами "вид симметрии" (в. с. ) — ему отдается предпочтение в русской минералого кристаллографической литературе — или "класс симметрии", который более употребителен за рубежом. Заметим, что в кристаллах 32 вида симметрии естественным образом подразделяются по уровню симметрии на 3 категории: низшая (наименее симметричная) — без главной оси высокого (выше 2 го) порядка; могут присутствовать от одной до трех двойных осей; включает 8 в. с; средняя (более симметричная) — с одной главной осью 3 го, 4 го или 6 го порядка, ориентированной вертикально, т. е. вдоль кристаллографической оси с, включает 19 в. с. высшая (самая высокосимметричная) — с тремя главными осями 4 го порядка (простыми или инверсионными) либо с тремя взаимноперпендикулярными осями 2 го порядка, но в любом случае обязательно с четырьмя осями 3 го порядка; включает 5 в. с.
В дальнейшем, зная, какие в кристаллах возможны оси симметрии, их последовательно сочетают с каждой из перечисленных выше ступеней симметрии и таким путем приходят к 32 точечным группам, соответствующим отдельным видам (классам) симметрии, т. е. всем возможным комбинациям элементов симметрии в кристаллах. В основе введенного Гесселем термина "точечные группы" лежит то обстоятельство, что в конечных кристаллических многогранниках все элементы симметрии проходят через одну неподвижную (фиксированную) точку — точку пересечения кристаллографических осей (т. е. через начало координат). Ныне пользуются преимущественно терминами "вид симметрии" (в. с. ) — ему отдается предпочтение в русской минералого кристаллографической литературе — или "класс симметрии", который более употребителен за рубежом. Заметим, что в кристаллах 32 вида симметрии естественным образом подразделяются по уровню симметрии на 3 категории: низшая (наименее симметричная) — без главной оси высокого (выше 2 го) порядка; могут присутствовать от одной до трех двойных осей; включает 8 в. с; средняя (более симметричная) — с одной главной осью 3 го, 4 го или 6 го порядка, ориентированной вертикально, т. е. вдоль кристаллографической оси с, включает 19 в. с. высшая (самая высокосимметричная) — с тремя главными осями 4 го порядка (простыми или инверсионными) либо с тремя взаимноперпендикулярными осями 2 го порядка, но в любом случае обязательно с четырьмя осями 3 го порядка; включает 5 в. с.
 Сингония — одно из подразделений кристаллов, хар ся по признаку формы их элементарной ячейки. Сингония включает группу классов симметрии, обладающих одним общим или характерным элементом симметрии при одинаковом числе единичных направлений. Различают семь сингоний: кубическую, тетрагональную (квадратную), тригональную, гексагональную, ромбическую, моноклинную, триклиную. категории Таблица 1 — Классификация кристаллов по степени симметрии Сингонии и характерные для них элементы симметрии Константы параллеле-пипеда Число единичных направлений Высшая. Несколько осей высшего порядка. Единичные направ- ления отсутствуют Кубическая 4 L 3 a = b = cα = β = γ = 90 Нет Средняя. Одна ось высшего порядка. Единичное направление одно, совпадающее с единственной осью высшего порядка. Тетрагональная (квадратная)L 4 a = b ≠ cα = β = γ = 90 Одно с L 4 6. L 4; 4 L 2; 5 P; C 7. L 4; 4 L 28. L 4; P; C 9. L 4; 4 P 10. L 4 11. Li 4; 2 L 2; 2 P 12. Li 4 Тригональная. L 4 a = b = cα = β = 90γ = 120 Одно с L 3 13. L 3; 3 L 2; 4 P; C 14. L 3; 3 L 215. L 3; 3 P 16. L 3, C 17. L 3 Гексагональная. L 6 a = b = cα = β = 90γ = 120 Одно с L 6 18. L 6; 6 L 2; 7 P; C 19. L 6; 6 L 220. L 6; P; C 21. L 6; 6 P 22. L 6 23. Li 6; 3 L 2; 3 P 24. Li 6; P a ≠ b ≠ cα = β = γ = 90 Три 25. 3 L 2; 3 P; C 26. 3 L 227. L 2; 2 P a ≠ b ≠ cα = γ = 90β ≠ 90 P˄90 Множество Низшая. Нет осей Ромбическая 3 L 2 или порядка выше 2. L 2, 2 P Несколько единичных Моноклиническая направлений. L 2 или P Триклиническая C a ≠ b ≠ cα ≠ β ≠ γ ≠ или отсутствие 90 элементов симметрии Все Классы 1. 3 L 4; 4 L 3; 6 L 2; 9 P; C 2. 4 L 3; 3 L 4; 6 L 23. 4 L 3; 3 L 2; 3 P; C 4. 4 L 3; 3 L 2; 6 P 5. 4 L 3; 3 L 4 28. L 2; P; C 29. L 230. P 31. C 32. -
Сингония — одно из подразделений кристаллов, хар ся по признаку формы их элементарной ячейки. Сингония включает группу классов симметрии, обладающих одним общим или характерным элементом симметрии при одинаковом числе единичных направлений. Различают семь сингоний: кубическую, тетрагональную (квадратную), тригональную, гексагональную, ромбическую, моноклинную, триклиную. категории Таблица 1 — Классификация кристаллов по степени симметрии Сингонии и характерные для них элементы симметрии Константы параллеле-пипеда Число единичных направлений Высшая. Несколько осей высшего порядка. Единичные направ- ления отсутствуют Кубическая 4 L 3 a = b = cα = β = γ = 90 Нет Средняя. Одна ось высшего порядка. Единичное направление одно, совпадающее с единственной осью высшего порядка. Тетрагональная (квадратная)L 4 a = b ≠ cα = β = γ = 90 Одно с L 4 6. L 4; 4 L 2; 5 P; C 7. L 4; 4 L 28. L 4; P; C 9. L 4; 4 P 10. L 4 11. Li 4; 2 L 2; 2 P 12. Li 4 Тригональная. L 4 a = b = cα = β = 90γ = 120 Одно с L 3 13. L 3; 3 L 2; 4 P; C 14. L 3; 3 L 215. L 3; 3 P 16. L 3, C 17. L 3 Гексагональная. L 6 a = b = cα = β = 90γ = 120 Одно с L 6 18. L 6; 6 L 2; 7 P; C 19. L 6; 6 L 220. L 6; P; C 21. L 6; 6 P 22. L 6 23. Li 6; 3 L 2; 3 P 24. Li 6; P a ≠ b ≠ cα = β = γ = 90 Три 25. 3 L 2; 3 P; C 26. 3 L 227. L 2; 2 P a ≠ b ≠ cα = γ = 90β ≠ 90 P˄90 Множество Низшая. Нет осей Ромбическая 3 L 2 или порядка выше 2. L 2, 2 P Несколько единичных Моноклиническая направлений. L 2 или P Триклиническая C a ≠ b ≠ cα ≠ β ≠ γ ≠ или отсутствие 90 элементов симметрии Все Классы 1. 3 L 4; 4 L 3; 6 L 2; 9 P; C 2. 4 L 3; 3 L 4; 6 L 23. 4 L 3; 3 L 2; 3 P; C 4. 4 L 3; 3 L 2; 6 P 5. 4 L 3; 3 L 4 28. L 2; P; C 29. L 230. P 31. C 32. -

 Кубическая сингония отличается наибольшей степенью симметрии. Общим элементом является 4 L 3. Единичные направления отсутствуют, все направления симметрично равные. Кристаллы равномерно развиты по всем направлениям, фигуру можно вписать в шар. Такая форма называется изометричной. В тетрагональной (квадратной) сингонии общим элементом симметрии является L 4. Обычно у кристаллов этой сингонии есть квадратное поперечное сечение и одно единичное направление, совпадающее с L 4. В гексагональной и тригональной сингониях единичное направление совпадает с L 6 (у гексагональной сингонии) или с L 3 (у тригональной системы). Общим элементом симметрии для кристаллов гексагональной сингонии является ось L 6, а для кристаллов тригональной сингонии – L 3. Кристаллы гексагональной сингонии в сечении имеют шестиугольник, а кристаллы тригональной сингонии – треугольник. В ромбической сингонии отсутствуют оси симметрии выше второго порядка. Общим элементом симметрии является 3 L 2 или L 2, 2 Р. Единичных направлений три. Кристаллы в сечении имеют ромб. В моноклинальной сингонии каждый элемент симметрии присутствует в кристалле в единственном числе. Единичных направлений много. Общим элементом симметрии является L 2 или Р. В триклинической сингонии из всех элементов симметрии может присутствовать только центр С. Все направления в кристалле единичные.
Кубическая сингония отличается наибольшей степенью симметрии. Общим элементом является 4 L 3. Единичные направления отсутствуют, все направления симметрично равные. Кристаллы равномерно развиты по всем направлениям, фигуру можно вписать в шар. Такая форма называется изометричной. В тетрагональной (квадратной) сингонии общим элементом симметрии является L 4. Обычно у кристаллов этой сингонии есть квадратное поперечное сечение и одно единичное направление, совпадающее с L 4. В гексагональной и тригональной сингониях единичное направление совпадает с L 6 (у гексагональной сингонии) или с L 3 (у тригональной системы). Общим элементом симметрии для кристаллов гексагональной сингонии является ось L 6, а для кристаллов тригональной сингонии – L 3. Кристаллы гексагональной сингонии в сечении имеют шестиугольник, а кристаллы тригональной сингонии – треугольник. В ромбической сингонии отсутствуют оси симметрии выше второго порядка. Общим элементом симметрии является 3 L 2 или L 2, 2 Р. Единичных направлений три. Кристаллы в сечении имеют ромб. В моноклинальной сингонии каждый элемент симметрии присутствует в кристалле в единственном числе. Единичных направлений много. Общим элементом симметрии является L 2 или Р. В триклинической сингонии из всех элементов симметрии может присутствовать только центр С. Все направления в кристалле единичные.
 Сингонии группируются в три категории: Высшая – единичные направления отсутствуют, всегда имеется несколько осей порядка выше двух; сюда относится кубическая сингония. Средняя – имеется одно единичное направление, совпадающее с единственной осью порядка выше двух (с осями L 3, L 4, L 6). К этой категории относятся тетрагональная, тригональная и гексагональная сингонии. Низшая – имеется несколько единичных направлений, отсутствуют оси симметрии выше двух; сюда относятся триклиническая, моноклинальная и ромбическая сингонии. В настоящее время при описании минерала, даже самом кратком, наряду с химической формулой обязательно указывается и сингония, к которой принадлежат кристаллы минерала; часто приводится также класс (вид) симметрии. Это связано, в частности, с тем, что в качестве самостоятельных минеральных видов выделяются полиморфные модификации, т. е. минералы, имеющие одинаковый химический состав, но разную структуру и, следовательно, симметрию.
Сингонии группируются в три категории: Высшая – единичные направления отсутствуют, всегда имеется несколько осей порядка выше двух; сюда относится кубическая сингония. Средняя – имеется одно единичное направление, совпадающее с единственной осью порядка выше двух (с осями L 3, L 4, L 6). К этой категории относятся тетрагональная, тригональная и гексагональная сингонии. Низшая – имеется несколько единичных направлений, отсутствуют оси симметрии выше двух; сюда относятся триклиническая, моноклинальная и ромбическая сингонии. В настоящее время при описании минерала, даже самом кратком, наряду с химической формулой обязательно указывается и сингония, к которой принадлежат кристаллы минерала; часто приводится также класс (вид) симметрии. Это связано, в частности, с тем, что в качестве самостоятельных минеральных видов выделяются полиморфные модификации, т. е. минералы, имеющие одинаковый химический состав, но разную структуру и, следовательно, симметрию.
 1) Триклинная сингония (включает 2 вида симметрии). Синоним — агарная (безосная). Элементы симметрии либо отсутствуют (не считая бесчисленных одинарных осей Lx), либо представлены только центром инверсии. Все кристаллографические (координатные) оси наклонны; параметры по всем трем осям различны. Морфология кристаллов характеризуется отношением параметров а: b: с (причем принимается b=1) и значениями углов α, β, γ. Единственно возможные простые формы — моноэдры (педионы) и пинакоиды. 2) Моноклинная сингония (3 в. с). Синоним — моногарная (одноосная). Имеется одна двойная ось и/или плоскость симметрии. При их совместном присутствии они взаимноперпендикулярны, что порождает также центр инверсии. Двойная ось обычно ориентируется вдоль кристаллографической оси b, а плоскость симметрии — по нормали к ней (так называемая моноклинная установка). Два из трех углов между координатными осями — прямые; третий (обычно угол р) условно выбирается тупым. Параметры по всем трем осям различны (a # b # c; α = γ = 90°; β >90°). Морфологические характеристики кристаллов — a: b: c (b принимается за 1) и величина тупого угла β. Типичные простые формы (помимо педионов и пинакоидов) — диэдры (сфеноид, дома) и (ромбическая) призма (геометрически это — прямоугольный параллелепипед).
1) Триклинная сингония (включает 2 вида симметрии). Синоним — агарная (безосная). Элементы симметрии либо отсутствуют (не считая бесчисленных одинарных осей Lx), либо представлены только центром инверсии. Все кристаллографические (координатные) оси наклонны; параметры по всем трем осям различны. Морфология кристаллов характеризуется отношением параметров а: b: с (причем принимается b=1) и значениями углов α, β, γ. Единственно возможные простые формы — моноэдры (педионы) и пинакоиды. 2) Моноклинная сингония (3 в. с). Синоним — моногарная (одноосная). Имеется одна двойная ось и/или плоскость симметрии. При их совместном присутствии они взаимноперпендикулярны, что порождает также центр инверсии. Двойная ось обычно ориентируется вдоль кристаллографической оси b, а плоскость симметрии — по нормали к ней (так называемая моноклинная установка). Два из трех углов между координатными осями — прямые; третий (обычно угол р) условно выбирается тупым. Параметры по всем трем осям различны (a # b # c; α = γ = 90°; β >90°). Морфологические характеристики кристаллов — a: b: c (b принимается за 1) и величина тупого угла β. Типичные простые формы (помимо педионов и пинакоидов) — диэдры (сфеноид, дома) и (ромбическая) призма (геометрически это — прямоугольный параллелепипед).
 3) Ромбическая сингония (3 в. с). Синоним — дигирная (с двойными осями). В наиболее симметричных кристаллах (планаксиального типа симметрии) представлены три взаимноперпендикулярных двойных оси и три плоскости симметрии, нормальные к ним, а также центр инверсии. В менее симметричных кристаллах могут присутствовать только три двойных оси (аксиальный тип симметрии) либо одна полярная двойная ось и две проходящие через нее взаимно перпендикулярные плоскости (планальный тип симметрии). Все три угла между кристаллографическими осями — прямые, но сами оси по прежнему неравнозначны (a # b # c; α = β = γ = 90°). Морфологической характеристикой кристаллов служит только осевое отношение a: b: c, где b приравнивается к 1. Типичные простые формы (помимо педионов и пинакоидов) — ромбические призмы, пирамиды и бипирамиды, а также ромбический тетраэдр (бисфеноид). Триклинная, моноклинная и ромбическая сингонии составляют группу низших сингонии; они охватывают 8 классов симметрии, относящихся к низшей категории по уровню симметрии. В этой группе отсутствуют оси более высокого порядка, нежели двойные. Следующие три сингонии — тетра , три и гексагональная — входят в группу средних сингонии; к ним принадлежат 10 классов симметрии, относящихся к средней категории по уровню симметрии и характеризующихся наличием одной оси высокого порядка — 3 го, 4 го или 6 го (включая инверсионные). Причем, поскольку простые формы в гексагональной и тригональной сингониях (и только в них) в значительной мере перекрываются, обе они нередко (особенно за рубежом) объединяются в одну гексагональную, а тригональная рассматривается как подсистема гексагональной. Этим обусловлено расхождение в общем числе сингонии: 6 или 7.
3) Ромбическая сингония (3 в. с). Синоним — дигирная (с двойными осями). В наиболее симметричных кристаллах (планаксиального типа симметрии) представлены три взаимноперпендикулярных двойных оси и три плоскости симметрии, нормальные к ним, а также центр инверсии. В менее симметричных кристаллах могут присутствовать только три двойных оси (аксиальный тип симметрии) либо одна полярная двойная ось и две проходящие через нее взаимно перпендикулярные плоскости (планальный тип симметрии). Все три угла между кристаллографическими осями — прямые, но сами оси по прежнему неравнозначны (a # b # c; α = β = γ = 90°). Морфологической характеристикой кристаллов служит только осевое отношение a: b: c, где b приравнивается к 1. Типичные простые формы (помимо педионов и пинакоидов) — ромбические призмы, пирамиды и бипирамиды, а также ромбический тетраэдр (бисфеноид). Триклинная, моноклинная и ромбическая сингонии составляют группу низших сингонии; они охватывают 8 классов симметрии, относящихся к низшей категории по уровню симметрии. В этой группе отсутствуют оси более высокого порядка, нежели двойные. Следующие три сингонии — тетра , три и гексагональная — входят в группу средних сингонии; к ним принадлежат 10 классов симметрии, относящихся к средней категории по уровню симметрии и характеризующихся наличием одной оси высокого порядка — 3 го, 4 го или 6 го (включая инверсионные). Причем, поскольку простые формы в гексагональной и тригональной сингониях (и только в них) в значительной мере перекрываются, обе они нередко (особенно за рубежом) объединяются в одну гексагональную, а тригональная рассматривается как подсистема гексагональной. Этим обусловлено расхождение в общем числе сингонии: 6 или 7.
 4) Тетрагональная (квадратная, тетраэдр) сингония (7 в. с). Имеется одна ось симметрии 4 го порядка (простая или инверсионная), ориентированная вертикально — вдоль кристаллографической оси с. В наиболее высокосимметричном классе (планаксиальный тип симметрии) наряду с четверной присутствуют 4 двойных оси, перпендикулярные ей, 5 плоскостей симметрии, перпендикулярных пяти осям, и центр инверсии (но не в кристаллах с осью L 4 i). В тетрагональной сингонии a = b # c, α = β = γ = 90°). Типичные простые формы — тетрагональные (четырехгранные, с квадратным поперечным сечением) и дитетрагональные (восьмигранные, с поперечным сечением в виде правильного восьмиугольника) призмы, бипирамиды и пирамиды, а также тетрагональный тетраэдр (бисфеноид), тетрагональный трапецоэдр и тетрагональный скаленоэдр. Всего в тетрагональной сингонии известно 9 простых форм. 5) Тригональная (тригирная) сингония (5 или 7 классов симметрии). Два класса симметрии, в которых присутствует инверсионная ось 6 порядка, относят то к тригональной, то к гексагональной сингонии, что подчеркивает известную условность их разделения и отсутствие между ними четко выраженной границы. Кроме нее могут присутствовать двойные оси (до трех), зеркальные плоскости (до 3 х или — в кристаллах с шестерной инверсионной осью — 4 х) и иногда центр инверсии. Тройная ось может быть полярной или биполярной Простые формы тригональной сингонии: тригональные (трехгранные) и дитригональные (шестигранные) призмы, бипирамиды и пирамиды, ромбоэдры, тригональный трапецоэдр и тригональный (дитригональный) скаленоэдр; возможны также педион и пинакоид.
4) Тетрагональная (квадратная, тетраэдр) сингония (7 в. с). Имеется одна ось симметрии 4 го порядка (простая или инверсионная), ориентированная вертикально — вдоль кристаллографической оси с. В наиболее высокосимметричном классе (планаксиальный тип симметрии) наряду с четверной присутствуют 4 двойных оси, перпендикулярные ей, 5 плоскостей симметрии, перпендикулярных пяти осям, и центр инверсии (но не в кристаллах с осью L 4 i). В тетрагональной сингонии a = b # c, α = β = γ = 90°). Типичные простые формы — тетрагональные (четырехгранные, с квадратным поперечным сечением) и дитетрагональные (восьмигранные, с поперечным сечением в виде правильного восьмиугольника) призмы, бипирамиды и пирамиды, а также тетрагональный тетраэдр (бисфеноид), тетрагональный трапецоэдр и тетрагональный скаленоэдр. Всего в тетрагональной сингонии известно 9 простых форм. 5) Тригональная (тригирная) сингония (5 или 7 классов симметрии). Два класса симметрии, в которых присутствует инверсионная ось 6 порядка, относят то к тригональной, то к гексагональной сингонии, что подчеркивает известную условность их разделения и отсутствие между ними четко выраженной границы. Кроме нее могут присутствовать двойные оси (до трех), зеркальные плоскости (до 3 х или — в кристаллах с шестерной инверсионной осью — 4 х) и иногда центр инверсии. Тройная ось может быть полярной или биполярной Простые формы тригональной сингонии: тригональные (трехгранные) и дитригональные (шестигранные) призмы, бипирамиды и пирамиды, ромбоэдры, тригональный трапецоэдр и тригональный (дитригональный) скаленоэдр; возможны также педион и пинакоид.
 6) Гексагональная (гексагарная) сингония (7 или 5 классов симметрии). Отличительная особенность кристаллов — присутствие одной вертикальной оси 6 го порядка (совмещенной с координатной осью с). Помимо шестерной оси могут присутствовать двойные оси (до 6), зеркальные плоскости (тоже до 6) и иногда центр инверсии (только не в кристаллах с осью L 6 i). Простые формы: гексагональные (6 гранные) и дигексагональные (12 гранные) призмы, бипирамиды, а также гексагональный трапецоэдр (с 12 ю гранями — по 6 сверху и снизу). Всего в гексагональной и тригональной сингониях в сумме насчитывается 16 простых форм. 7) Кубическая (изометрическая, правильная) сингония (5 классов симметрии) — самая высокосимметричная, единственная, относящаяся к высшей категории по уровню симметрии. Для принадлежащих к ней кристаллов обязательно наличие четырех взаимноперпендикулярных осей 3 го порядка. Наряду с имеются три четверных оси. Обычно присутствуют 3 или 6 двойных осей. В трех классах из пяти есть плоскости симметрии (3, 6 или 9) и в двух из них — центр инверсии. Кристаллы кубической сингонии лишены какой либо специфической морфологической характеристики; их принято характеризовать величиной параметра кубической элементарной ячейки (т. е. длиной ребра элементарного куба) а 0, очень легко и просто определяемого непосредственно по рентгенограмме порошка минерала. Всего в этой сингонии 15 простых форм: тетраэдр; куб или гексаэдр; октаэдр; пять 12 гранников — ромбододекаэдр, пентагон додекаэдр, тригонтритетраэдр, тетрагон тритетраэдр, пентагон тритетраэдр; шесть 24 гранников — тригон триоктаэдр, тетрагон триоктаэдр, пентагон триоктаэдр, тетрагексаэдр, гексатетраэдр, дидодекаэдр; и единственный 48 гранник — гексоктаэдр.
6) Гексагональная (гексагарная) сингония (7 или 5 классов симметрии). Отличительная особенность кристаллов — присутствие одной вертикальной оси 6 го порядка (совмещенной с координатной осью с). Помимо шестерной оси могут присутствовать двойные оси (до 6), зеркальные плоскости (тоже до 6) и иногда центр инверсии (только не в кристаллах с осью L 6 i). Простые формы: гексагональные (6 гранные) и дигексагональные (12 гранные) призмы, бипирамиды, а также гексагональный трапецоэдр (с 12 ю гранями — по 6 сверху и снизу). Всего в гексагональной и тригональной сингониях в сумме насчитывается 16 простых форм. 7) Кубическая (изометрическая, правильная) сингония (5 классов симметрии) — самая высокосимметричная, единственная, относящаяся к высшей категории по уровню симметрии. Для принадлежащих к ней кристаллов обязательно наличие четырех взаимноперпендикулярных осей 3 го порядка. Наряду с имеются три четверных оси. Обычно присутствуют 3 или 6 двойных осей. В трех классах из пяти есть плоскости симметрии (3, 6 или 9) и в двух из них — центр инверсии. Кристаллы кубической сингонии лишены какой либо специфической морфологической характеристики; их принято характеризовать величиной параметра кубической элементарной ячейки (т. е. длиной ребра элементарного куба) а 0, очень легко и просто определяемого непосредственно по рентгенограмме порошка минерала. Всего в этой сингонии 15 простых форм: тетраэдр; куб или гексаэдр; октаэдр; пять 12 гранников — ромбододекаэдр, пентагон додекаэдр, тригонтритетраэдр, тетрагон тритетраэдр, пентагон тритетраэдр; шесть 24 гранников — тригон триоктаэдр, тетрагон триоктаэдр, пентагон триоктаэдр, тетрагексаэдр, гексатетраэдр, дидодекаэдр; и единственный 48 гранник — гексоктаэдр.
 Простые формы низших сингоний: 1 — моноэдр; 2 — пинакоид; 3 — диэдр; 4 — ромбическая призма; 5 — ромбический тетраэдр; 6 — ромбическая пирамида; 7 — ромбическая бипирамида;
Простые формы низших сингоний: 1 — моноэдр; 2 — пинакоид; 3 — диэдр; 4 — ромбическая призма; 5 — ромбический тетраэдр; 6 — ромбическая пирамида; 7 — ромбическая бипирамида;
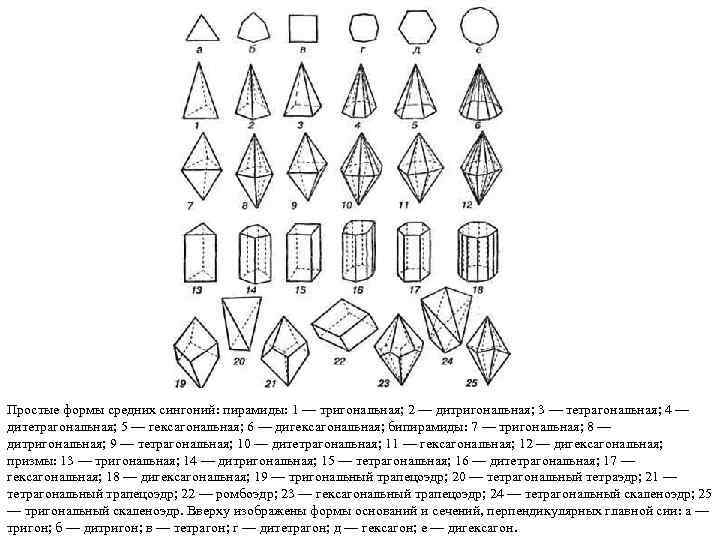 Простые формы средних сингоний: пирамиды: 1 — тригональная; 2 — дитригональная; 3 — тетрагональная; 4 — дитетрагональная; 5 — гексагональная; 6 — дигексагональная; бипирамиды: 7 — тригональная; 8 — дитригональная; 9 — тетрагональная; 10 — дитетрагональная; 11 — гексагональная; 12 — дигексагональная; призмы: 13 — тригональная; 14 — дитригональная; 15 — тетрагональная; 16 — дитетрагональная; 17 — гексагональная; 18 — дигексагональная; 19 — тригональный трапецоэдр; 20 — тетрагональный тетраэдр; 21 — тетрагональный трапецоэдр; 22 — ромбоэдр; 23 — гексагональный трапецоэдр; 24 — тетрагональный скаленоэдр; 25 — тригональный скаленоэдр. Вверху изображены формы оснований и сечений, перпендикулярных главной сии: а — тригон; б — дитригон; в — тетрагон; г — дитетрагон; д — гексагон; е — дигексагон.
Простые формы средних сингоний: пирамиды: 1 — тригональная; 2 — дитригональная; 3 — тетрагональная; 4 — дитетрагональная; 5 — гексагональная; 6 — дигексагональная; бипирамиды: 7 — тригональная; 8 — дитригональная; 9 — тетрагональная; 10 — дитетрагональная; 11 — гексагональная; 12 — дигексагональная; призмы: 13 — тригональная; 14 — дитригональная; 15 — тетрагональная; 16 — дитетрагональная; 17 — гексагональная; 18 — дигексагональная; 19 — тригональный трапецоэдр; 20 — тетрагональный тетраэдр; 21 — тетрагональный трапецоэдр; 22 — ромбоэдр; 23 — гексагональный трапецоэдр; 24 — тетрагональный скаленоэдр; 25 — тригональный скаленоэдр. Вверху изображены формы оснований и сечений, перпендикулярных главной сии: а — тригон; б — дитригон; в — тетрагон; г — дитетрагон; д — гексагон; е — дигексагон.
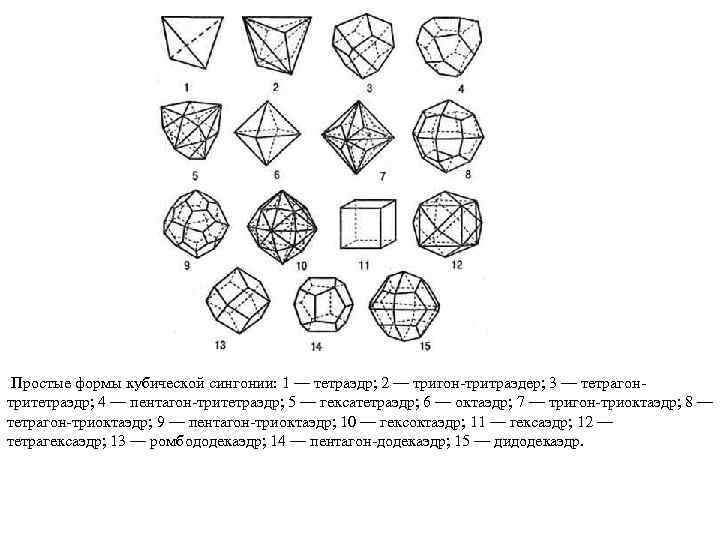 Простые формы кубической сингонии: 1 — тетраэдр; 2 — тригон тритраэдер; 3 — тетрагон тритетраэдр; 4 — пентагон тритетраэдр; 5 — гексатетраэдр; 6 — октаэдр; 7 — тригон триоктаэдр; 8 — тетрагон триоктаэдр; 9 — пентагон триоктаэдр; 10 — гексоктаэдр; 11 — гексаэдр; 12 — тетрагексаэдр; 13 — ромбододекаэдр; 14 — пентагон додекаэдр; 15 — дидодекаэдр.
Простые формы кубической сингонии: 1 — тетраэдр; 2 — тригон тритраэдер; 3 — тетрагон тритетраэдр; 4 — пентагон тритетраэдр; 5 — гексатетраэдр; 6 — октаэдр; 7 — тригон триоктаэдр; 8 — тетрагон триоктаэдр; 9 — пентагон триоктаэдр; 10 — гексоктаэдр; 11 — гексаэдр; 12 — тетрагексаэдр; 13 — ромбододекаэдр; 14 — пентагон додекаэдр; 15 — дидодекаэдр.
 Написать формулы симметрии
Написать формулы симметрии
 Формула симметрии тетраэдра по Браве: 4 L 33 L 26 P Характер симметрии тетраэдра также иллюстрирует нижеследующий рисунок. Тетраэдр имеет четыре поворотные оси 3 го порядка и три поворотные оси 2 го порядка. Каждая ось 3 го порядка проходит через вершину тетраэдра и центр противолежащей грани (например, ось АЕ на рисунке). Каждая ось 2 го порядка проходит через середины противолежащих ребер тетраэдра (например, ось FG на рисунке). Через каждую поворотную ось 2 го порядка проходят две плоскости симметрии (плоскость симметрии проводится через ось и одно из ребер тетраэдра, которые пересекаются данной осью); на рисунке показаны плоскости AGC и DFB, проходящие через ось FG. Таким образом, у тетраэдра имеются шесть плоскостей симметрии. Наконец, тетраэдр обладает также зеркально поворотной симметрией: каждая поворотная ось 2 го порядка является в то же время зеркально поворотной осью 4 го порядка.
Формула симметрии тетраэдра по Браве: 4 L 33 L 26 P Характер симметрии тетраэдра также иллюстрирует нижеследующий рисунок. Тетраэдр имеет четыре поворотные оси 3 го порядка и три поворотные оси 2 го порядка. Каждая ось 3 го порядка проходит через вершину тетраэдра и центр противолежащей грани (например, ось АЕ на рисунке). Каждая ось 2 го порядка проходит через середины противолежащих ребер тетраэдра (например, ось FG на рисунке). Через каждую поворотную ось 2 го порядка проходят две плоскости симметрии (плоскость симметрии проводится через ось и одно из ребер тетраэдра, которые пересекаются данной осью); на рисунке показаны плоскости AGC и DFB, проходящие через ось FG. Таким образом, у тетраэдра имеются шесть плоскостей симметрии. Наконец, тетраэдр обладает также зеркально поворотной симметрией: каждая поворотная ось 2 го порядка является в то же время зеркально поворотной осью 4 го порядка.
 Формула симметрии октаэдра по Браве: 3 L 44 L 36 L 29 РС Октаэдр имеет три поворотные оси 4 го порядка (они проходят через противолежащие вершины, как, например, ось АВ), четыре оси 3 го порядка (проходят через центры противолежащих граней, как, например, ось CD) и шесть осей 2 го порядка (проходят через середины противоположных взаимно параллельных ребер, как, например, ось EF). Как куб, так и октаэдр имеют девять плоскостей симметрии. Наконец, каждая поворотная ось 3 го порядка в кубе и октаэдре является в то же время зеркальной осью 6 го порядка.
Формула симметрии октаэдра по Браве: 3 L 44 L 36 L 29 РС Октаэдр имеет три поворотные оси 4 го порядка (они проходят через противолежащие вершины, как, например, ось АВ), четыре оси 3 го порядка (проходят через центры противолежащих граней, как, например, ось CD) и шесть осей 2 го порядка (проходят через середины противоположных взаимно параллельных ребер, как, например, ось EF). Как куб, так и октаэдр имеют девять плоскостей симметрии. Наконец, каждая поворотная ось 3 го порядка в кубе и октаэдре является в то же время зеркальной осью 6 го порядка.
 Формула симметрии додекаэдра по Браве: 6 L 510 L 315 L 2. Характер симметрии додекаэдра пояснен на рисунке ниже. Ось АВ, проходящая через центры противолежащих граней додекаэдра, есть одна из шести поворотных осей 5 го порядка; ось CD, проходящая через противолежащие вершины, — одна из десяти поворотных осей 3 го порядка; ось EF, проходящая через середины противоположных взаимно параллельных ребер, — одна из пятнадцати поворотных осей 2 го порядка.
Формула симметрии додекаэдра по Браве: 6 L 510 L 315 L 2. Характер симметрии додекаэдра пояснен на рисунке ниже. Ось АВ, проходящая через центры противолежащих граней додекаэдра, есть одна из шести поворотных осей 5 го порядка; ось CD, проходящая через противолежащие вершины, — одна из десяти поворотных осей 3 го порядка; ось EF, проходящая через середины противоположных взаимно параллельных ребер, — одна из пятнадцати поворотных осей 2 го порядка.
 Часто бывает полезно уметь представить периодическое расположение атомов, ионов или молекул в кристалле в виде системы точек, называемой кристаллической решеткой. Браве высказал гипотезу о том, что пространственные решётки кристаллов построены из закономерно расположенных в пространстве точек узлов (где расположены атомы), которые могут быть получены в результате повторения данной точки путём параллельных переносов ( трансляций ) ( рис. 1 ). Рис. 1. Образование трансляционных рядов (a), сеток (б) и решеток (в). Исходя из этой идеи о периодичности Бравэ в 1848 г. показал, что все многообразие кристаллических структур можно описать с помощью 14 типов решеток, отличающихся формами элементарных ячеек и симметрией и подразделяющихся на 7 кристаллографических сингоний. Эти решетки были названы решетками Бравэ. Они делятся на 4 типа (см. рис. 2): 1) примитивный узлы расположены только в вершинах параллелепипеда, 2) базоцентрированный имеется ещё по одному узлу в центрах двух противолежащих граней, 3) объёмноцентрированный к примитивному типу добавлен узел в центре ячейки, 4) гранецентрированный имеется по одному узлу в центре каждой грани. Решетки Бравэ распределяются по сингониям (системам) следующим образом: триклинная 1, моноклинных 2, тетрагональных 2, ромбических 4, тригональная (ромбоэдрическая) 1, гексагональная 1, кубических 3.
Часто бывает полезно уметь представить периодическое расположение атомов, ионов или молекул в кристалле в виде системы точек, называемой кристаллической решеткой. Браве высказал гипотезу о том, что пространственные решётки кристаллов построены из закономерно расположенных в пространстве точек узлов (где расположены атомы), которые могут быть получены в результате повторения данной точки путём параллельных переносов ( трансляций ) ( рис. 1 ). Рис. 1. Образование трансляционных рядов (a), сеток (б) и решеток (в). Исходя из этой идеи о периодичности Бравэ в 1848 г. показал, что все многообразие кристаллических структур можно описать с помощью 14 типов решеток, отличающихся формами элементарных ячеек и симметрией и подразделяющихся на 7 кристаллографических сингоний. Эти решетки были названы решетками Бравэ. Они делятся на 4 типа (см. рис. 2): 1) примитивный узлы расположены только в вершинах параллелепипеда, 2) базоцентрированный имеется ещё по одному узлу в центрах двух противолежащих граней, 3) объёмноцентрированный к примитивному типу добавлен узел в центре ячейки, 4) гранецентрированный имеется по одному узлу в центре каждой грани. Решетки Бравэ распределяются по сингониям (системам) следующим образом: триклинная 1, моноклинных 2, тетрагональных 2, ромбических 4, тригональная (ромбоэдрическая) 1, гексагональная 1, кубических 3.
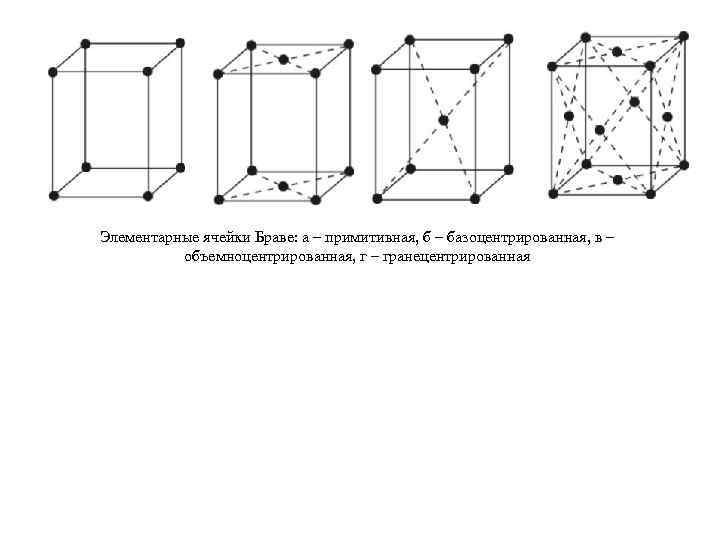 Элементарные ячейки Браве: а – примитивная, б – базоцентрированная, в – объемноцентрированная, г – гранецентрированная
Элементарные ячейки Браве: а – примитивная, б – базоцентрированная, в – объемноцентрированная, г – гранецентрированная

 Для выбора ячейки Бравэ используют три условия: 1. симметрия элементарной ячейки должна соответствовать симметрии кристалла, точнее, наиболее высокой симметрии той сингонии, к которой относится кристалл. Ребра элементарной ячейки должны быть трансляциями решетки 2. элементарная ячейки должна содержать максимально возможное число прямых углов или равных углов и равных ребер 3. элементарная ячейка должна иметь минимальный объем. z z y ' x x ' y Рис. 1. Базоцентрированная тетрагональная ячейка сводится к примитивной в 2 раза меньшей по объему. x x ' y Рис. 2. Гранецентрированная тетрагональная ячейка сводится к объемоцентрированной в 2 раза меньше по объему. Рис. 3. Произвольный выбор элементарной ячейки в объмоцентрированной решетке. Эти условия должны выполняться последовательно, т. е. при выборе ячейки первое условие важнее второго, а второе важнее третьего.
Для выбора ячейки Бравэ используют три условия: 1. симметрия элементарной ячейки должна соответствовать симметрии кристалла, точнее, наиболее высокой симметрии той сингонии, к которой относится кристалл. Ребра элементарной ячейки должны быть трансляциями решетки 2. элементарная ячейки должна содержать максимально возможное число прямых углов или равных углов и равных ребер 3. элементарная ячейка должна иметь минимальный объем. z z y ' x x ' y Рис. 1. Базоцентрированная тетрагональная ячейка сводится к примитивной в 2 раза меньшей по объему. x x ' y Рис. 2. Гранецентрированная тетрагональная ячейка сводится к объемоцентрированной в 2 раза меньше по объему. Рис. 3. Произвольный выбор элементарной ячейки в объмоцентрированной решетке. Эти условия должны выполняться последовательно, т. е. при выборе ячейки первое условие важнее второго, а второе важнее третьего.
 Типы химической связи Образование химических соединений обусловлено возникновением химической связи между атомами в молекулах и кристаллах. Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения. Появление атомной модели Бора, впервые объяснившей строение электронной оболочки, способствовало созданию представления о химической связи и её электронной природе. В соответствии с моделью Бора электроны могут занимать в атоме положения, которым отвечают определенные энергетические состояния, т. е. энергетические уровни. В 1915 г. немецкий физик Коссель дал объяснение химической связи в солях, а в 1916 году американский учёный Льюис предложил трактовку химической связи в молекулах. Они исходили из представлений о том, что атомы элементов обладают тенденцией к достижению электронной конфигурации благородных газов (полного заполнения внешнего электронного слоя). Представления Косселя и Льюиса получили названия электронной теории валентности. Валентность элементов главных подгрупп Периодической системы зависит от числа электронов, находящихся на внешнем электронном слое. Поэтому эти внешние электроны принято называть валентными. Для элементов побочных подгрупп в качестве валентных электронов могут выступать как электроны внешнего слоя, так и электроны внутренних подуровней. Различают три основных типа химической связи: ковалентную, ионную, металлическую.
Типы химической связи Образование химических соединений обусловлено возникновением химической связи между атомами в молекулах и кристаллах. Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения. Появление атомной модели Бора, впервые объяснившей строение электронной оболочки, способствовало созданию представления о химической связи и её электронной природе. В соответствии с моделью Бора электроны могут занимать в атоме положения, которым отвечают определенные энергетические состояния, т. е. энергетические уровни. В 1915 г. немецкий физик Коссель дал объяснение химической связи в солях, а в 1916 году американский учёный Льюис предложил трактовку химической связи в молекулах. Они исходили из представлений о том, что атомы элементов обладают тенденцией к достижению электронной конфигурации благородных газов (полного заполнения внешнего электронного слоя). Представления Косселя и Льюиса получили названия электронной теории валентности. Валентность элементов главных подгрупп Периодической системы зависит от числа электронов, находящихся на внешнем электронном слое. Поэтому эти внешние электроны принято называть валентными. Для элементов побочных подгрупп в качестве валентных электронов могут выступать как электроны внешнего слоя, так и электроны внутренних подуровней. Различают три основных типа химической связи: ковалентную, ионную, металлическую.
 Типы химической связи и их основные отличительные признаки. Химическая связь Связываемые атомы Характер элементов Процесс в электронной оболочке Образующиеся частицы Кристаллическая решетка Характер вещества Примеры Ионная Атом металла и атом неметалла Электроположительный и электро отрицательный Переход валентных электронов Положительные и отрицательные ионы Ионная Солеобраз ный Na. Cl Ca. O Na. OH Электроотрицательный реже электроположительный Образование общих электронных пар, заполнение молекулярных орбиталей Летучий или нелетучий Br 2 CO 2 C 6 H 6 Ковалентная Атомы неметаллов (реже-атомы металлов) Молекулы Молекулярная ----- Металличес кая Атомы металлов Электроположительный Отдача валентных электронов Атомная Алмазопод об ный Алмаз Si Si. C Положительные ионы и электронный газ Металлическая Металличе ская Металлы и сплавы
Типы химической связи и их основные отличительные признаки. Химическая связь Связываемые атомы Характер элементов Процесс в электронной оболочке Образующиеся частицы Кристаллическая решетка Характер вещества Примеры Ионная Атом металла и атом неметалла Электроположительный и электро отрицательный Переход валентных электронов Положительные и отрицательные ионы Ионная Солеобраз ный Na. Cl Ca. O Na. OH Электроотрицательный реже электроположительный Образование общих электронных пар, заполнение молекулярных орбиталей Летучий или нелетучий Br 2 CO 2 C 6 H 6 Ковалентная Атомы неметаллов (реже-атомы металлов) Молекулы Молекулярная ----- Металличес кая Атомы металлов Электроположительный Отдача валентных электронов Атомная Алмазопод об ный Алмаз Si Si. C Положительные ионы и электронный газ Металлическая Металличе ская Металлы и сплавы
 Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. Различают обменный и донорно акцепторный механизм образования ковалентной связи. 1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару 2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь Различают две разновидности ковалентной связи: неполяр ную и полярную. В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, или электронное облако свя зи, распределяется в пространстве симметрично относительно ядер обоих атомов. Примером являются двухатомные молекулы, состоя щие из атомов одного элемента: Н 2 Cl 2, О 2, N 2, F 2 и др. . в которых электронная пара в одинаковой мере принадлежит обоим атомам. В случае полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрица тельностью . Примером могут служить молекулы ле тучих неорганических соединений: НС 1, НО, H 2 S, NH 3 и др. 2 Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью. Металлическая связь Валентные электроны металлов достаточно слабо связаны со своими ядрами и могут легко отрываться от них. Поэтому металл содержит ряд положительных ионов, расположенных в определенных положениях кристаллической решетки, и большое количество электронов, свободно перемещающихся по всему кристаллу. Электроны в металле осуществляют связь между всеми атомами металла. Классификация кристаллов по типу связи В зависимости от природы частиц, образующих кристалл, и сил взаимодействия между ними, различают 4 типа кристаллов: ионные, ковалентные, металлические и молекулярные. Ионные кристаллы состоят из положительных и отрицательных ионов двух типов атомов. Они образуют кристаллическую решетку за счет электростатического (кулоновского) взаимодействия противоположно заряженных ионов. Ионная связь – сильная связь энергий от 100 до 10000 к. ДЖ/моль. Поэтому твердые тела с ионной связью имеют высокие теплоты сублимации и высокие точки плавления. Ионные кристаллы в основном диэлектрики.
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. Различают обменный и донорно акцепторный механизм образования ковалентной связи. 1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару 2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь Различают две разновидности ковалентной связи: неполяр ную и полярную. В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, или электронное облако свя зи, распределяется в пространстве симметрично относительно ядер обоих атомов. Примером являются двухатомные молекулы, состоя щие из атомов одного элемента: Н 2 Cl 2, О 2, N 2, F 2 и др. . в которых электронная пара в одинаковой мере принадлежит обоим атомам. В случае полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрица тельностью . Примером могут служить молекулы ле тучих неорганических соединений: НС 1, НО, H 2 S, NH 3 и др. 2 Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью. Металлическая связь Валентные электроны металлов достаточно слабо связаны со своими ядрами и могут легко отрываться от них. Поэтому металл содержит ряд положительных ионов, расположенных в определенных положениях кристаллической решетки, и большое количество электронов, свободно перемещающихся по всему кристаллу. Электроны в металле осуществляют связь между всеми атомами металла. Классификация кристаллов по типу связи В зависимости от природы частиц, образующих кристалл, и сил взаимодействия между ними, различают 4 типа кристаллов: ионные, ковалентные, металлические и молекулярные. Ионные кристаллы состоят из положительных и отрицательных ионов двух типов атомов. Они образуют кристаллическую решетку за счет электростатического (кулоновского) взаимодействия противоположно заряженных ионов. Ионная связь – сильная связь энергий от 100 до 10000 к. ДЖ/моль. Поэтому твердые тела с ионной связью имеют высокие теплоты сублимации и высокие точки плавления. Ионные кристаллы в основном диэлектрики.
 Химическая связь может возникнуть при электростатическом притяжении двух разноименных ионов катиона и аниона, например, K+ и I−. Перекрывание атомных орбиталей в этом случае незначительно, и электронная плотность распределена неравномерно, недостаток её будет у атома калия, а избыток у атома иода. Ионную связь (K+)−(I−) рассматривают как предельный случай ковалентной связи. Общая пара электронов в случае ионной связи практически полностью смещена к аниону. Обычно это происходит в соединениях элементов с большой разностью электроотрицательности (например, в соединениях Cs. F, Na. Br, K 2 O, Rb 2 S, Li 3 N и др. ). Все эти соединения при обычных условиях представляют собой ионные кристаллы (кристаллы, построенные из катионов и анионов), например кристаллы иодида калия или хлорида натрия. Ковалентные кристаллы. Ковалентная связь возникает между нейтральными атомами за счет перекрывания электронных облаков двух соседних атомов. Обычно она осуществляется двумя электронами с противоположными спинами, по одному от каждого атома, которые создают состояния с повышенной электронной плотностью в межъядерном пространстве. Образовавшийся таким образом отрицательный заряд между атомами стягивает их между собой, стремясь максимально приблизить друг к другу. Характерными особенностями ковалентной связи является направленность и насыщаемость. Насыщаемость состоит в том, что каждый атом способен образовывать ковалентную связь лишь с определенным кол вом соседей. Ковалентная связь образуется в том направлении, в котором расположена наибольшая часть электронного облака. Это и означает, что она носит направленный характер. Энергия ковалентной связи сравнима с энергией ионной связи. Ковалентные кристаллы – в основном полупроводники и диэлектрики.
Химическая связь может возникнуть при электростатическом притяжении двух разноименных ионов катиона и аниона, например, K+ и I−. Перекрывание атомных орбиталей в этом случае незначительно, и электронная плотность распределена неравномерно, недостаток её будет у атома калия, а избыток у атома иода. Ионную связь (K+)−(I−) рассматривают как предельный случай ковалентной связи. Общая пара электронов в случае ионной связи практически полностью смещена к аниону. Обычно это происходит в соединениях элементов с большой разностью электроотрицательности (например, в соединениях Cs. F, Na. Br, K 2 O, Rb 2 S, Li 3 N и др. ). Все эти соединения при обычных условиях представляют собой ионные кристаллы (кристаллы, построенные из катионов и анионов), например кристаллы иодида калия или хлорида натрия. Ковалентные кристаллы. Ковалентная связь возникает между нейтральными атомами за счет перекрывания электронных облаков двух соседних атомов. Обычно она осуществляется двумя электронами с противоположными спинами, по одному от каждого атома, которые создают состояния с повышенной электронной плотностью в межъядерном пространстве. Образовавшийся таким образом отрицательный заряд между атомами стягивает их между собой, стремясь максимально приблизить друг к другу. Характерными особенностями ковалентной связи является направленность и насыщаемость. Насыщаемость состоит в том, что каждый атом способен образовывать ковалентную связь лишь с определенным кол вом соседей. Ковалентная связь образуется в том направлении, в котором расположена наибольшая часть электронного облака. Это и означает, что она носит направленный характер. Энергия ковалентной связи сравнима с энергией ионной связи. Ковалентные кристаллы – в основном полупроводники и диэлектрики.
 Металлические кристаллы. Металлическая связь возникает в следствии взаимодействия положительных ионов решетки с электронным газом: электроны, находящиеся между ионами, стягивают их между собой, уравновешивая силы отталкивания. Энергия металлической связи сравнима с энергией ковалентной связи. Металлы обладают высокой электро и теплопроводностью, вызванной наличием свободных электронов. • • • В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку. Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства узлах кристаллической решётки, например, металла серебро. Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью (особенно золото, серебро, медь, алюминий). Молекулярные кристаллы. В узлах решетки находятся определенным образом ориентированные нейтральные молекулы, связанные между собой слабыми ван дер вальсовыми силами. В основном это диэлектрики. Следует отметить, что в чистом виде каждая из этих связей в реальном кристалле встречается редко. Практически всегда имеет место наложение двух и более типов связи. Одна из них, как правило, имеет превалирующее значение, определяя структуру и свойства тела. кристаллическая решетка алмаза кристаллическая решетка графита
Металлические кристаллы. Металлическая связь возникает в следствии взаимодействия положительных ионов решетки с электронным газом: электроны, находящиеся между ионами, стягивают их между собой, уравновешивая силы отталкивания. Энергия металлической связи сравнима с энергией ковалентной связи. Металлы обладают высокой электро и теплопроводностью, вызванной наличием свободных электронов. • • • В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку. Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства узлах кристаллической решётки, например, металла серебро. Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью (особенно золото, серебро, медь, алюминий). Молекулярные кристаллы. В узлах решетки находятся определенным образом ориентированные нейтральные молекулы, связанные между собой слабыми ван дер вальсовыми силами. В основном это диэлектрики. Следует отметить, что в чистом виде каждая из этих связей в реальном кристалле встречается редко. Практически всегда имеет место наложение двух и более типов связи. Одна из них, как правило, имеет превалирующее значение, определяя структуру и свойства тела. кристаллическая решетка алмаза кристаллическая решетка графита
 Размеры частиц часто определяют тип кристаллической структуры. Размер атомов, ионов и молекул определяется валентными электронами. Атом не имеет границ и его размер – величина условная. Тем не менее можно характеризовать размер свободного атома орбитальным радиусом. Но, практический интерес представляют атомы и ионы в составе вещества, а не свободные. Поскольку состояния свободного и связанного атома значительно отличаются (прежде всего их энергия), то должны отличаться и размеры. Для связанных атомов также вводят связующие их размер величины. Хотя электронные облака связанных атомов могут существенно отличаться от сферических, размеры атомов принято хар вать эффективными (кажущимеся) радиусами. Размеры атомов одного и того же элемента существенно зависят от того, с каким типом связи находится атом. Поэтому выделяют ковалентные, ионные, металлические и ван-дер-вальсовые радиусы. В концепции эффективных радиусов межатомные расстояния считают суммой радиусов двух соседних атомов, принимая атомы за несжимаемые шары. Ковалентные радиусы: Ковалентный радиус равен половине межатомного расстояния. Для всех элементов кроме водорода ковалентный радиус больше орбитального. Это связано с тем, что состояние связанных атомов в молекулах похоже на возбужденное состояние свободных атомов, где валентные электроны расположены дальше от своих ядер, чем в свободных атомов в основном состоянии. Ионные радиусы. Поскольку при нормальных условиях затруднительно наблюдать молекулы с ионными связями и в то же время известно большое кол во соединений, образующих ионные кристаллы, то когда речь идет о ионных радиусах это почти всегда радиусы ионов в кристалле. Металлические радиусы: Определить металлические радиусы не представляет никаких трудностей – достаточно измерить межъядерное расстояние в соответствующем металле и поделить пополам. Металлические радиусы в отличии от ионных и ковалентных близки к орбитальным.
Размеры частиц часто определяют тип кристаллической структуры. Размер атомов, ионов и молекул определяется валентными электронами. Атом не имеет границ и его размер – величина условная. Тем не менее можно характеризовать размер свободного атома орбитальным радиусом. Но, практический интерес представляют атомы и ионы в составе вещества, а не свободные. Поскольку состояния свободного и связанного атома значительно отличаются (прежде всего их энергия), то должны отличаться и размеры. Для связанных атомов также вводят связующие их размер величины. Хотя электронные облака связанных атомов могут существенно отличаться от сферических, размеры атомов принято хар вать эффективными (кажущимеся) радиусами. Размеры атомов одного и того же элемента существенно зависят от того, с каким типом связи находится атом. Поэтому выделяют ковалентные, ионные, металлические и ван-дер-вальсовые радиусы. В концепции эффективных радиусов межатомные расстояния считают суммой радиусов двух соседних атомов, принимая атомы за несжимаемые шары. Ковалентные радиусы: Ковалентный радиус равен половине межатомного расстояния. Для всех элементов кроме водорода ковалентный радиус больше орбитального. Это связано с тем, что состояние связанных атомов в молекулах похоже на возбужденное состояние свободных атомов, где валентные электроны расположены дальше от своих ядер, чем в свободных атомов в основном состоянии. Ионные радиусы. Поскольку при нормальных условиях затруднительно наблюдать молекулы с ионными связями и в то же время известно большое кол во соединений, образующих ионные кристаллы, то когда речь идет о ионных радиусах это почти всегда радиусы ионов в кристалле. Металлические радиусы: Определить металлические радиусы не представляет никаких трудностей – достаточно измерить межъядерное расстояние в соответствующем металле и поделить пополам. Металлические радиусы в отличии от ионных и ковалентных близки к орбитальным.
 Ван-дер-вальсовые радиусы: Ван дер вальсовые радиусы можно определить если измерить в кристалле расстояние между атомами, когда не существует никакой химической связи между ними. Иначе говоря, атомы принадлежат разным молекулам, которые связаны только вандервальсовым взаимодействием. Величины ван дер вальсовых радиусов значительно больше ковалентных, так как вносит вклад индукционное и ориентационное взаимодействие.
Ван-дер-вальсовые радиусы: Ван дер вальсовые радиусы можно определить если измерить в кристалле расстояние между атомами, когда не существует никакой химической связи между ними. Иначе говоря, атомы принадлежат разным молекулам, которые связаны только вандервальсовым взаимодействием. Величины ван дер вальсовых радиусов значительно больше ковалентных, так как вносит вклад индукционное и ориентационное взаимодействие.
 Понятие о зонной теории твердых тел. Основные положения Твердое тело – многоядерная и многоэлектронная система, в которой действуют электростатические (кулоновские) силы). Магнитное взаимодействие значительно слабее и вносит лишь небольшие поправки. Допущения: 1) адиабатическое приближение – деление системы на легкие и тяжелые частицы. Тогда скорость движения ядер << скорости движения электронов. Ядра рассматриваются как неподвижные. 2) полагают, что рассматриваемый «выделенный» электрон находится в усредненном заданном внешнем поле сферически – симметричном поле, образованным всеми другими электронами и ядром. Такое поле называют «самосогласованным» . Решение осуществляется методом Хартри Фока. Энергетический спектр электронов в твердом теле существенно отличается от энергетического спектра свободных — он состоит из отдельных разрешенных энергетических зон, разделенных зонами запрещенных энергий. Согласно квантово механическим постулатам Бора, в изолированном атоме энергия электрона может принимать строго дискретные значения (электрон находится на одной из орбиталей). В случае же системы нескольких атомов, объединенных химической связью, электронные орбитали расщепляются в количестве, пропорциональном количеству атомов, образуя так называемые молекулярные орбитали. При дальнейшем увеличении системы до макроскопического уровня, количество орбиталей становится очень велико, а разница энергий электронов, находящихся на соседних орбиталях, соответственно очень маленькой — энергетические уровни расщепляются до двух практически непрерывных дискретных наборов — энергетических зон. Наивысшая из разрешенных энергетических зон в полупроводниках и диэлектриках, в которой при температуре 0 К все энергетические состояния заняты электронами, называется валентной, следующая за ней — зоной проводимости. В проводниках зоной проводимости называется наивысшая разрешенная зона, в которой находятся электроны при температуре 0 К.
Понятие о зонной теории твердых тел. Основные положения Твердое тело – многоядерная и многоэлектронная система, в которой действуют электростатические (кулоновские) силы). Магнитное взаимодействие значительно слабее и вносит лишь небольшие поправки. Допущения: 1) адиабатическое приближение – деление системы на легкие и тяжелые частицы. Тогда скорость движения ядер << скорости движения электронов. Ядра рассматриваются как неподвижные. 2) полагают, что рассматриваемый «выделенный» электрон находится в усредненном заданном внешнем поле сферически – симметричном поле, образованным всеми другими электронами и ядром. Такое поле называют «самосогласованным» . Решение осуществляется методом Хартри Фока. Энергетический спектр электронов в твердом теле существенно отличается от энергетического спектра свободных — он состоит из отдельных разрешенных энергетических зон, разделенных зонами запрещенных энергий. Согласно квантово механическим постулатам Бора, в изолированном атоме энергия электрона может принимать строго дискретные значения (электрон находится на одной из орбиталей). В случае же системы нескольких атомов, объединенных химической связью, электронные орбитали расщепляются в количестве, пропорциональном количеству атомов, образуя так называемые молекулярные орбитали. При дальнейшем увеличении системы до макроскопического уровня, количество орбиталей становится очень велико, а разница энергий электронов, находящихся на соседних орбиталях, соответственно очень маленькой — энергетические уровни расщепляются до двух практически непрерывных дискретных наборов — энергетических зон. Наивысшая из разрешенных энергетических зон в полупроводниках и диэлектриках, в которой при температуре 0 К все энергетические состояния заняты электронами, называется валентной, следующая за ней — зоной проводимости. В проводниках зоной проводимости называется наивысшая разрешенная зона, в которой находятся электроны при температуре 0 К.
 1. 2. 3. 4. 5. Особенности зонной схемы Зоны энергетических уровней образуются как уровнями, занятыми электронами, так и свободными уровнями. В изолированном атоме дискретные уровни энергии разделены областями недозволенных значений энергии. Разрешенные энергетические зоны разделены зонами запрещенных значений энергии (запрещенными зонами). Ширина запрещенных зон соизмерима с шириной разрешенных зон. С увеличением энергии ширина разрешенных зон увеличивается, а ширина запрещенных зон уменьшается. В изолированном атоме дозволенные энергетические уровни могут быть заняты электронами или свободны. В кристалле может быть различное заполнение зон. В отдельных случаях они могут быть целиком свободны или целиком заняты. В изолированном атоме электроны могут переходить с одного уровня на другой. В кристалле электроны могут переходить из одной разрешенной зоны в другую, а также совершать переходы внутри одной и той же зоны. Особенно сильно расщепляются вышележащие энергетические уровни, и особенно, уровни с внешним валентным электроном. Эта зона называется валентной. Зона, лежащая над валентной называется свободной.
1. 2. 3. 4. 5. Особенности зонной схемы Зоны энергетических уровней образуются как уровнями, занятыми электронами, так и свободными уровнями. В изолированном атоме дискретные уровни энергии разделены областями недозволенных значений энергии. Разрешенные энергетические зоны разделены зонами запрещенных значений энергии (запрещенными зонами). Ширина запрещенных зон соизмерима с шириной разрешенных зон. С увеличением энергии ширина разрешенных зон увеличивается, а ширина запрещенных зон уменьшается. В изолированном атоме дозволенные энергетические уровни могут быть заняты электронами или свободны. В кристалле может быть различное заполнение зон. В отдельных случаях они могут быть целиком свободны или целиком заняты. В изолированном атоме электроны могут переходить с одного уровня на другой. В кристалле электроны могут переходить из одной разрешенной зоны в другую, а также совершать переходы внутри одной и той же зоны. Особенно сильно расщепляются вышележащие энергетические уровни, и особенно, уровни с внешним валентным электроном. Эта зона называется валентной. Зона, лежащая над валентной называется свободной.
 Деление твердых тел на проводники, полупроводники и диэлектрики С позиций зонной теории различие в электрических свойствах твердых тел объясняется: а) шириной запрещенных зон; б) различным заполнением электронов разрешенных энергетических зон, а именно валентной зоны. Необходимое условие проводимости ─ наличие свободных электронов в валентной зоне. В зависимости от степени заполнения валентной зоны электронами и ширины запрещенной зоны кристаллы подразделяются на металлы, полупроводники и диэлектрики.
Деление твердых тел на проводники, полупроводники и диэлектрики С позиций зонной теории различие в электрических свойствах твердых тел объясняется: а) шириной запрещенных зон; б) различным заполнением электронов разрешенных энергетических зон, а именно валентной зоны. Необходимое условие проводимости ─ наличие свободных электронов в валентной зоне. В зависимости от степени заполнения валентной зоны электронами и ширины запрещенной зоны кристаллы подразделяются на металлы, полупроводники и диэлектрики.
 Зонная схема металлов, полупроводников и диэлектриков Проводники (металлы) — материалы, у которых зона проводимости и валентная зона перекрываются (нет энергетического зазора), образуя одну зону, называемую зоной проводимости (таким образом, электрон может свободно перемещаться между ними, получив любую допустимо малую энергию). Электроны заполняют валентную зону частично. При этом в зоне остаются свободные квантовые состояния не занятые электронами. Даже незначительное нагревание приводит к тепловому движение. Энергии тепловых движений достаточно для того, чтобы перевести некоторые электроны на уровни с большей энергией. Электроны переходят в свободное состояние. При наложении электрического поля такие электроны изменяют свое квантовое состояние и совершают упорядоченное пространственное движение против поля. Возникает электрический ток.
Зонная схема металлов, полупроводников и диэлектриков Проводники (металлы) — материалы, у которых зона проводимости и валентная зона перекрываются (нет энергетического зазора), образуя одну зону, называемую зоной проводимости (таким образом, электрон может свободно перемещаться между ними, получив любую допустимо малую энергию). Электроны заполняют валентную зону частично. При этом в зоне остаются свободные квантовые состояния не занятые электронами. Даже незначительное нагревание приводит к тепловому движение. Энергии тепловых движений достаточно для того, чтобы перевести некоторые электроны на уровни с большей энергией. Электроны переходят в свободное состояние. При наложении электрического поля такие электроны изменяют свое квантовое состояние и совершают упорядоченное пространственное движение против поля. Возникает электрический ток.
 диэлектрики — материалы, у которых зоны не перекрываются и расстояние между ними составляет более 5 э. В (для того, чтобы перевести электрон из валентной зоны в зону проводимости требуется значительная энергия, поэтому диэлектрики ток практически не проводят); полупроводники — материалы, у которых зоны не перекрываются и расстояние между ними (ширина запрещенной зоны) лежит в интервале 0, 1– 3 э. В (для того, чтобы перевести электрон из валентной зоны в зону проводимости требуется энергия меньшая, чем для диэлектрика, поэтому чистые полупроводники слабо пропускают ток). При 0 К принципиально полупроводники не отличаются от диэлектриков. Элеткроны заполняют валентную зону полностью, но ширина запрещенной зоны не так велика как в диэлетктриках. Поэтому энергии тепловых движений или внешнего излучения хватает для перехода электронов из валентной зоны в зону проводимости. Чем выше температура, тем выше концентрация электронов в зоне проводимости, тем лучше кристалл проводит электрический ток. Зонная теория является основой современной теории твердых тел. Она позволила понять природу и объяснить важнейшие свойства металлов, полупроводников и диэлектриков. Величина запрещенной зоны (энергетическая щель между зонами валентности и проводимости) является ключевой величиной в зонной теории и определяет оптические и электрические свойства материала. Например, в полупроводниках проводимость можно увеличить, создав разрешенный энергетический уровень в запрещенной зоне путем легирования — добавления в состав исходного основного материала примесей для изменения его физических и химических свойств. В этом случае говорят, что полупроводник примесный.
диэлектрики — материалы, у которых зоны не перекрываются и расстояние между ними составляет более 5 э. В (для того, чтобы перевести электрон из валентной зоны в зону проводимости требуется значительная энергия, поэтому диэлектрики ток практически не проводят); полупроводники — материалы, у которых зоны не перекрываются и расстояние между ними (ширина запрещенной зоны) лежит в интервале 0, 1– 3 э. В (для того, чтобы перевести электрон из валентной зоны в зону проводимости требуется энергия меньшая, чем для диэлектрика, поэтому чистые полупроводники слабо пропускают ток). При 0 К принципиально полупроводники не отличаются от диэлектриков. Элеткроны заполняют валентную зону полностью, но ширина запрещенной зоны не так велика как в диэлетктриках. Поэтому энергии тепловых движений или внешнего излучения хватает для перехода электронов из валентной зоны в зону проводимости. Чем выше температура, тем выше концентрация электронов в зоне проводимости, тем лучше кристалл проводит электрический ток. Зонная теория является основой современной теории твердых тел. Она позволила понять природу и объяснить важнейшие свойства металлов, полупроводников и диэлектриков. Величина запрещенной зоны (энергетическая щель между зонами валентности и проводимости) является ключевой величиной в зонной теории и определяет оптические и электрические свойства материала. Например, в полупроводниках проводимость можно увеличить, создав разрешенный энергетический уровень в запрещенной зоне путем легирования — добавления в состав исходного основного материала примесей для изменения его физических и химических свойств. В этом случае говорят, что полупроводник примесный.


