Lektsia_7V_OP_OKh_Ob_ch_3.pptx
- Количество слайдов: 14


ДЕ 7: • • Буферные системы Комплексные соединения ПР ОВР

ДЕ 8 Дисперсная система – это система, состоящая из дисперсной фазы (ДФ) дисперсионной среды (ДС): • ДФ: Размер частиц: • Истинные растворы НМС (М<5000 г/моль): 10 -10 – 1012 м; • ВМС(М>5000 г/моль): 10 -7 – 10 -9 м • ГДС: >10 -7 м, • КДС: 10 -7 – 10 -9 м ДФ + ДС(Н 2 О) ДФ+ДС: Характер взаимодействия: • Лиофильные (греч. «филио» -люблю) - сильное взаимодействие, образуются самопроизвольно, термодинамически устойчивы, стабилизатор не требуется (растворы белков, полинуклеиновых кислот) • Лиофобные (греч. «лиос» -жидкость, «фобио» -ненавижу)- слабое взаимодействие (термодинамически неустойчивы, требуется стабилизатор),

Физическая химия: поверхностные явления адсорбция на границе Т-Г, Т-Ж Поверхность раздела фаз Подвижная Ж -Г Ж -Ж Неподвижная Т -Г Т -Ж Т -Т

Адсорбция на границе раздела Ж-Г Адсорбция – изменение концентрации вещества на границе раздела фаз Уравнение Гиббса поверхностная активность Г – количество адсорбированного вещества, моль/м 2 С – концентрация, моль/дм 3 σр-ра < σo ПАВ: Δσ < 0 Г>0 (положительная адсорбция) ПИАВ: σр-ра > σo Δσ > 0 Г<0 (отрицательная адсорбция) Изотерма адсорбции – зависимость адсорбции от равновесной концентрации растворенного вещества при постоянной температуре

ПАВ: правило Дюкло-Траубе поверхностная активность Поверхностная активность вещества одного и того же гомологического ряда возрастает примерно в 3 раза при увеличении углеводородной цепи на группу - СН 2
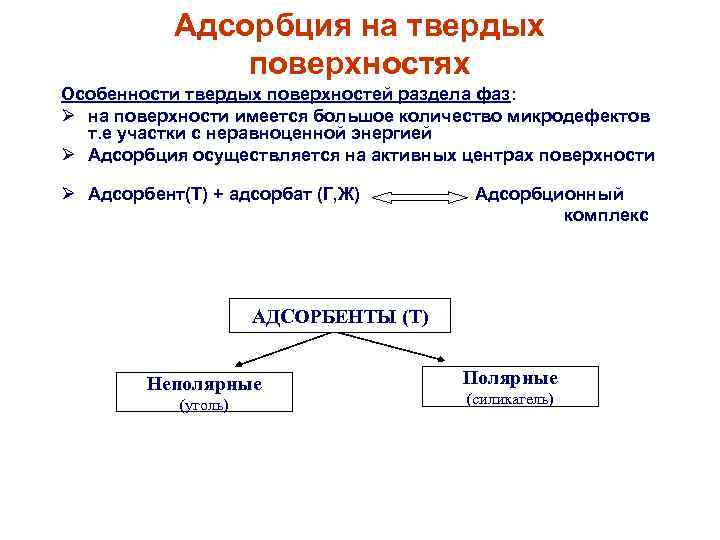
Адсорбция на твердых поверхностях Особенности твердых поверхностей раздела фаз: на поверхности имеется большое количество микродефектов т. е участки с неравноценной энергией Адсорбция осуществляется на активных центрах поверхности Адсорбент(Т) + адсорбат (Г, Ж) Адсорбционный комплекс АДСОРБЕНТЫ (Т) Неполярные (уголь) Полярные (силикагель)

Механизмы адсорбции из водных растворов АДСОРБЦИЯ Молекулярная Избирательная Ионная Обменная

Ионная адсорбция – это процесс поглощения ионов электролитов на полярных адсорбентах. Избирательная - характерна для сильных электролитов и наблюдается тогда, когда адсорбция какого-либо вещества значительно превосходит адсорбцию других данным сорбентом. Избирательная адсорбция подчиняется правилу Панета-Фаянса: • на поверхности твердого полярного сорбента преимущественно адсорбируются те ионы, которые входят в состав кристаллической решетки адсорбента или близкие к ним по природе и свойствам; • на заряженной поверхности сорбента могут дополнительно поглощаться противоположные по знаку ионы. Схема адсорбции:
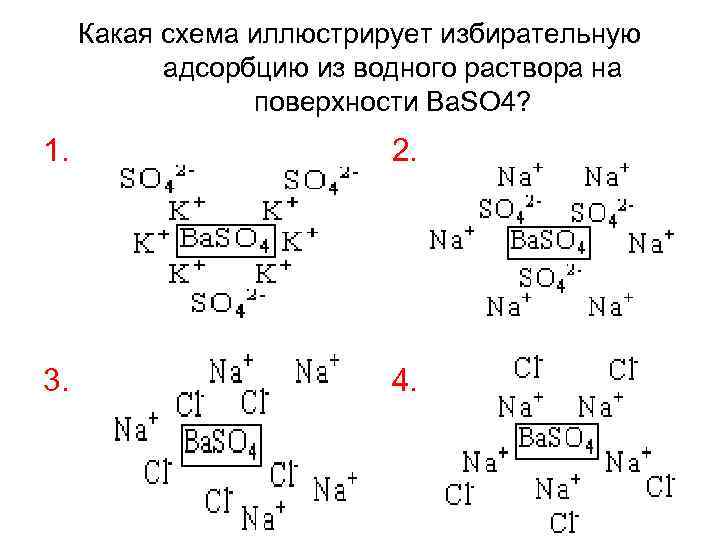
Какая схема иллюстрирует избирательную адсорбцию из водного раствора на поверхности Ba. SO 4? 1. 2. 3. 4.

Формирование твёрдой фазы оксалата кальция : Ca. СI 2 + Na 2 C 2 O 4 = 2 Na. СI + Ca C 2 O 4 Ca 2+ + (C 2 O 4)2 - = Ca C 2 O 4
![Полученные коллоидные системы: 1. С отрицательно заряженной гранулой: {[m. Ca. C 2 O 4]n. Полученные коллоидные системы: 1. С отрицательно заряженной гранулой: {[m. Ca. C 2 O 4]n.](https://present5.com/presentation/10409068_143272815/image-12.jpg)
Полученные коллоидные системы: 1. С отрицательно заряженной гранулой: {[m. Ca. C 2 O 4]n. C 2 O 42 - 2(n-x)Na+}2 х- 2 x. Na+ y. H 2 О 2. С положительно заряженной гранулой: {[m. Ca. C 2 O 4]n. Ca 2+ 2(n-x)Cl-}2 x+ 2 x. Cl- y. H 2 O

Получение КДС: диспергационные методы - путем дробления (механического , УЗ, электрического, химического) более крупных частиц конденсационные методы : химические реакции, в которых образуются труднорастворимые соединения) Условия получения КДС химическим конденсационным методом: -использование достаточно разбавленных растворов, -небольшой избыток одного из реагирующих веществ Истиный раствор d< 10 -9 м конденсирование Коллоидный раствор (КДС) -9<d< 10 -6 м 10 диспергирование Структурная единица КДС – мицелла – (лат. «micella» -крошка, крупинка) нейтральная частица ГДС d > 10 -6 м

ДЕ 8: Физико-химические свойства дисперсных систем Дисперсные системы: ДФ+ ДС КДС: ГДС: неустойчивы, требуется стабилизатор üСуспензии üЭмульсии ü Аэрозоли üПены Устойчивость (седиментационная, агрегативная), классификация агрегативная устойчивость обусловлена зарядом гранулы Методы получения КДС : диспергация, конденсация, Строение КДЧ(ДФ): мицелла
Lektsia_7V_OP_OKh_Ob_ch_3.pptx