Взаимное влияние атомов в молекулах.ppt
- Количество слайдов: 26

д. х. н. , проф. СПб. ГУ Карцова Анна Алексеевна 2010
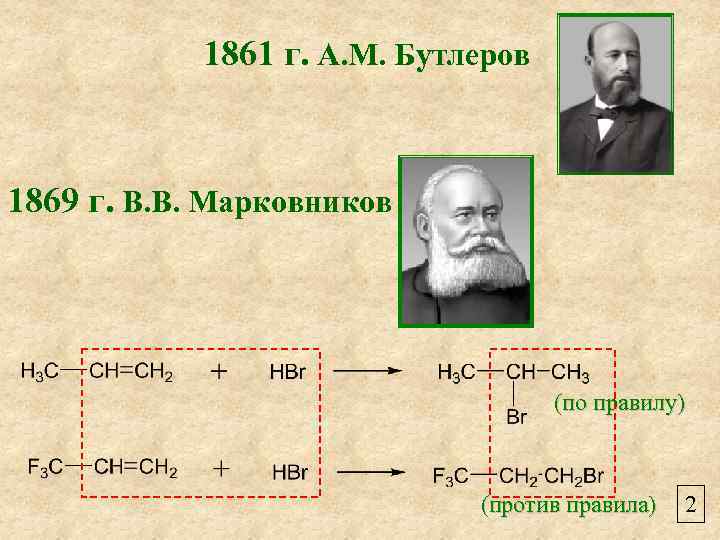
1861 г. А. М. Бутлеров 1869 г. В. В. Марковников (по правилу) (против правила) 2
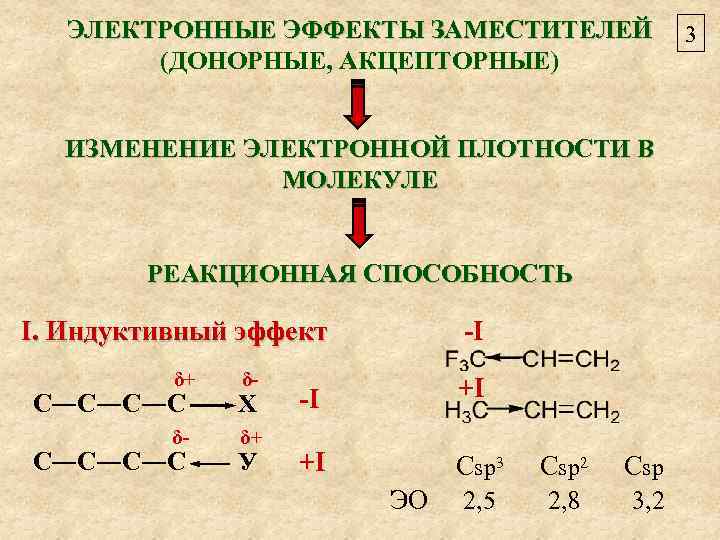
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ (ДОНОРНЫЕ, АКЦЕПТОРНЫЕ) ИЗМЕНЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В МОЛЕКУЛЕ РЕАКЦИОННАЯ СПОСОБНОСТЬ I. Индуктивный эффект δ+ δ- С―С―С―С Х δ- δ+ С―С―С―С У -I -I +I +I Сsp 3 Csp 2, 5 2, 8 3, 2 ЭО 3
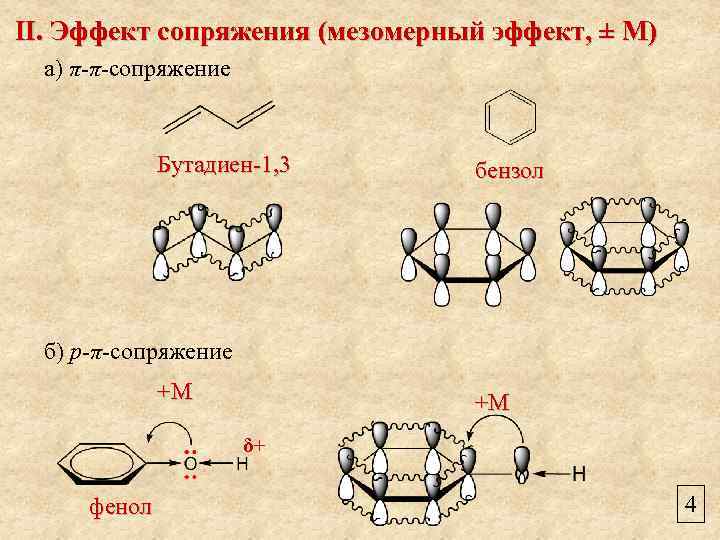
II. Эффект сопряжения (мезомерный эффект, ± М) а) π-π-сопряжение Бутадиен-1, 3 бензол б) р-π-сопряжение +М +М δ+ фенол 4
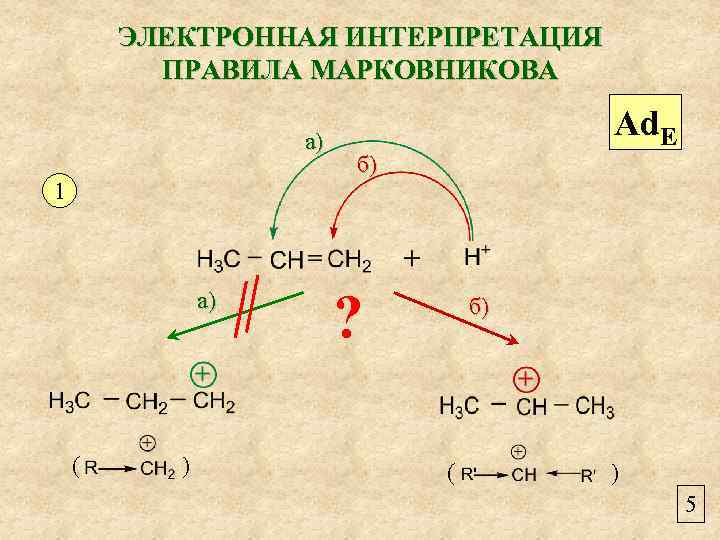
ЭЛЕКТРОННАЯ ИНТЕРПРЕТАЦИЯ ПРАВИЛА МАРКОВНИКОВА а) 1 а) ( ) Ad. E б) ? б) ( ) 5
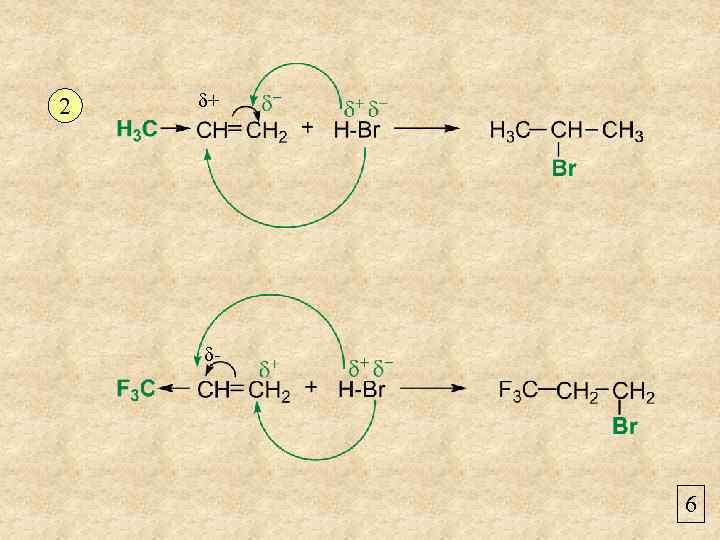
2 δ+ δ- 6
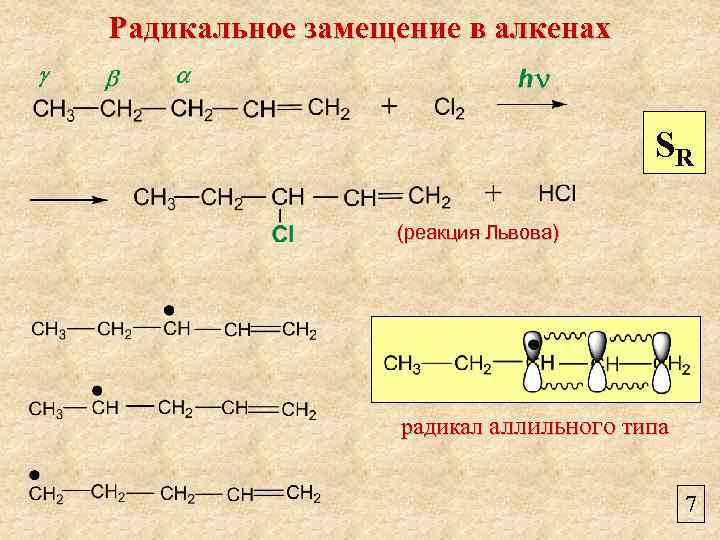
Радикальное замещение в алкенах SR (реакция Львова) радикал аллильного типа 7
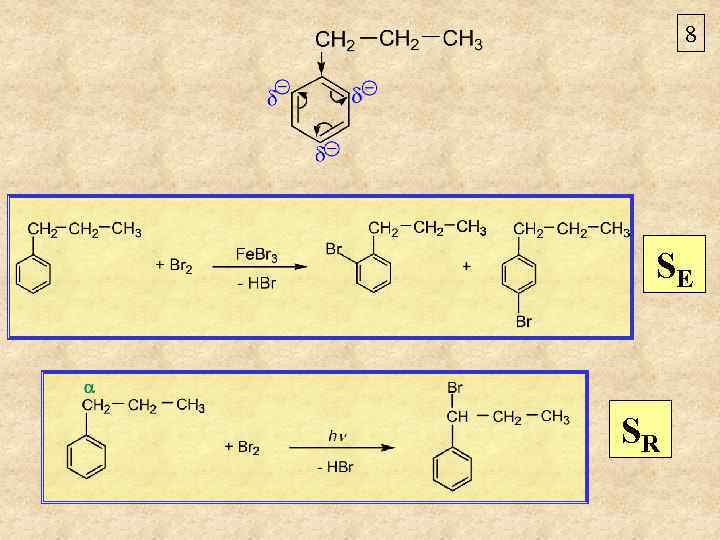
8 SE SR
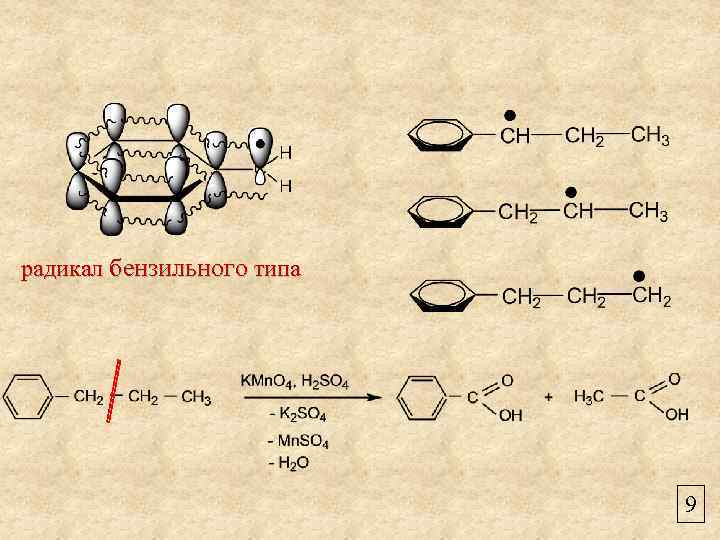
радикал бензильного типа 9
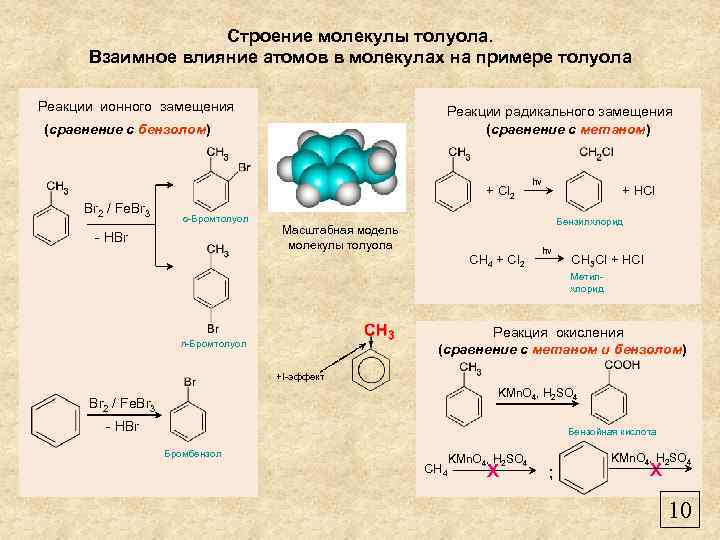
Строение молекулы толуола. Взаимное влияние атомов в молекулах на примере толуола Реакции ионного замещения Реакции радикального замещения (сравнение с метаном) (сравнение с бензолом) + Cl 2 Br 2 / Fe. Br 3 о-Бромтолуол - HBr hν + HCl Бензилхлорид Масштабная модель молекулы толуола CH 4 + Cl 2 hν CH 3 Cl + HCl Метилхлорид Реакция окисления (сравнение с метаном и бензолом) п-Бромтолуол +I-эффект KMn. O 4, H 2 SO 4 Br 2 / Fe. Br 3 - HBr Бензойная кислота Бромбензол CH 4 KMn. O 4, H 2 SO 4 X ; KMn. O 4, H 2 SO 4 X 10
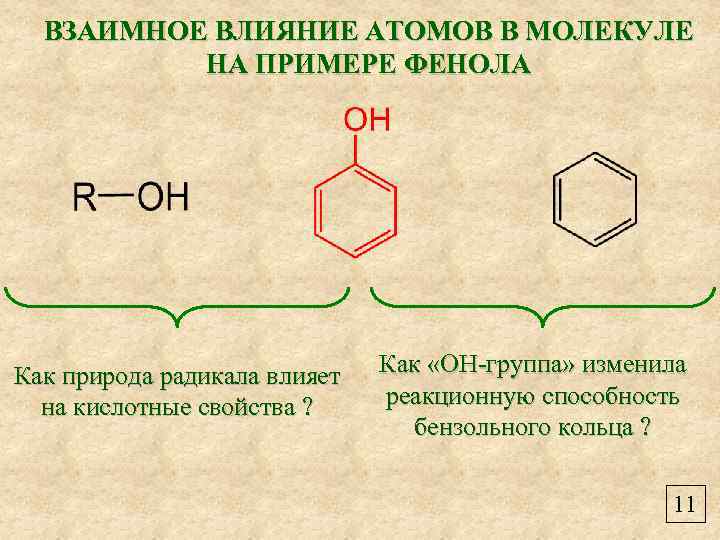
ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛЕ НА ПРИМЕРЕ ФЕНОЛА Как природа радикала влияет на кислотные свойства ? Как «ОН-группа» изменила реакционную способность бензольного кольца ? 11
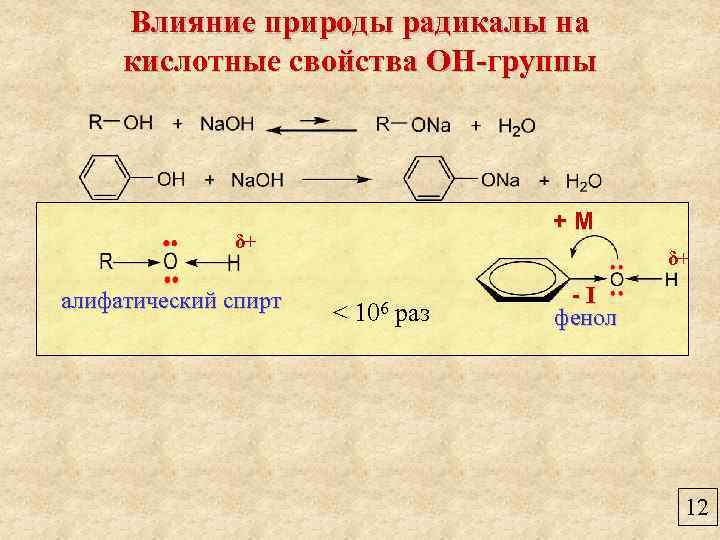
Влияние природы радикалы на кислотные свойства ОН-группы +М δ+ алифатический спирт δ+ < 106 раз -I фенол 12
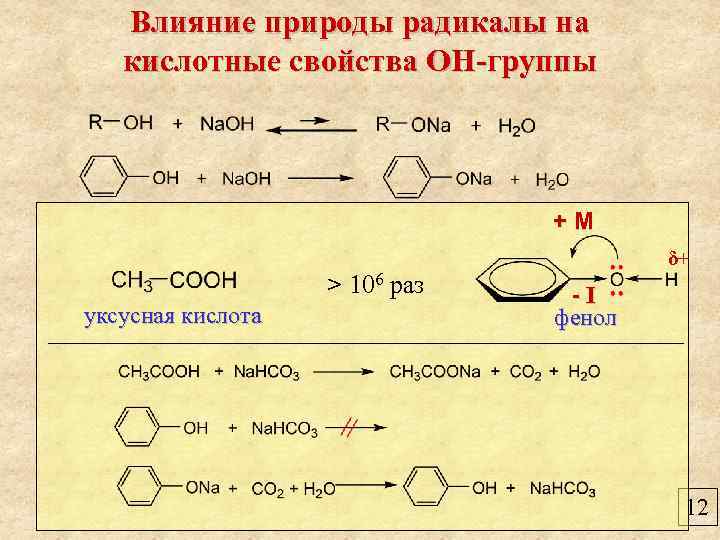
Влияние природы радикалы на кислотные свойства ОН-группы +М δ+ > 106 раз уксусная кислота -I фенол 12
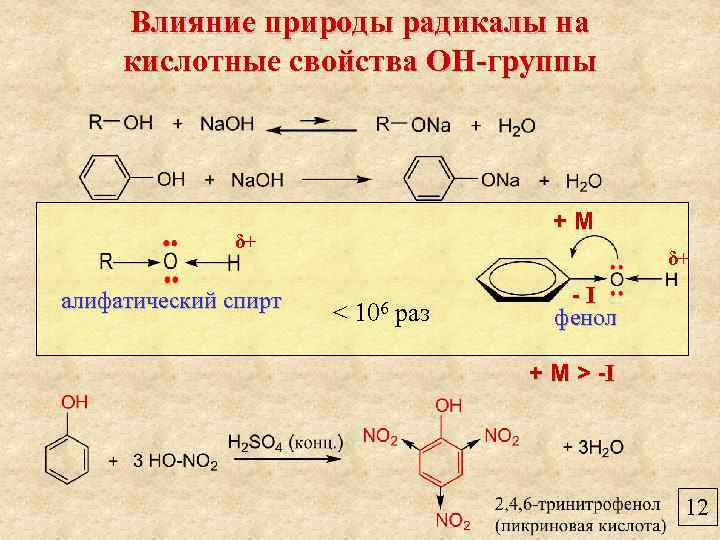
Влияние природы радикалы на кислотные свойства ОН-группы +М δ+ алифатический спирт δ+ < 106 раз -I фенол + М > -I 12
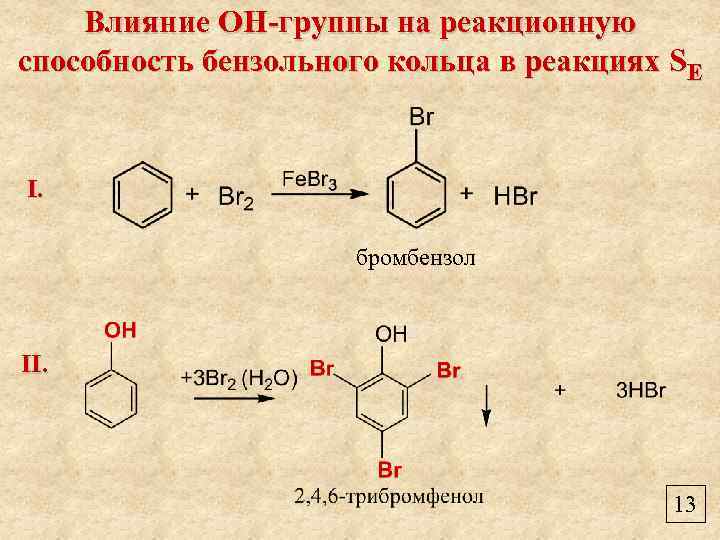
Влияние ОН-группы на реакционную способность бензольного кольца в реакциях SE I. бромбензол II. 13
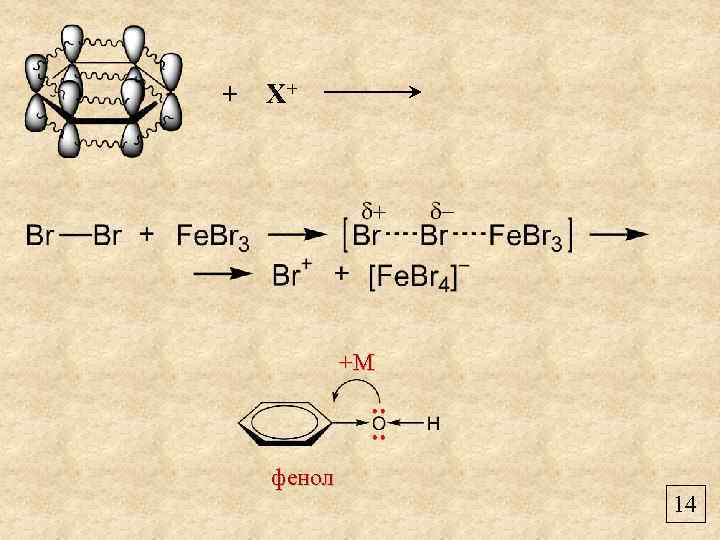
+ Х+ +М фенол 14
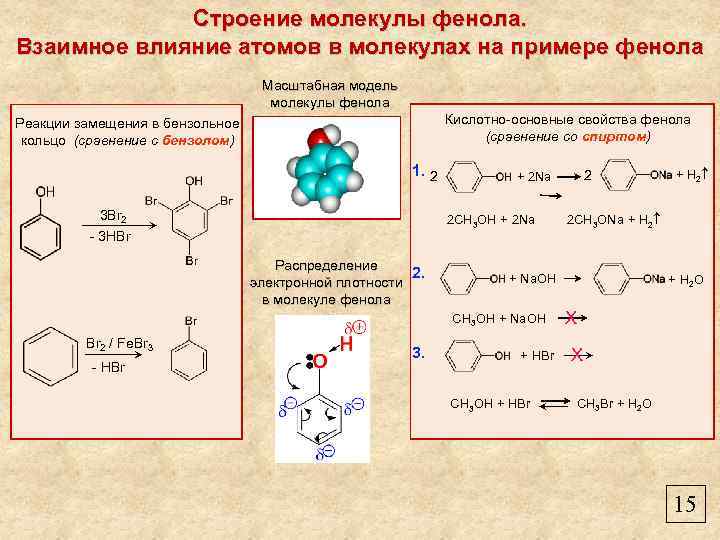
Строение молекулы фенола. Взаимное влияние атомов в молекулах на примере фенола Масштабная модель молекулы фенола Кислотно-основные свойства фенола (сравнение со спиртом) Реакции замещения в бензольное кольцо (сравнение с бензолом) 1. 2 3 Br 2 2 CH 3 OH + 2 Na - 3 HBr Распределение 2. электронной плотности в молекуле фенола - HBr 3. + HBr CH 3 OH + HBr + H 2 2 CH 3 ONa + H 2 + Na. OH CH 3 OH + Na. OH Br 2 / Fe. Br 3 2 + 2 Na + H 2 O X X CH 3 Br + H 2 O 15
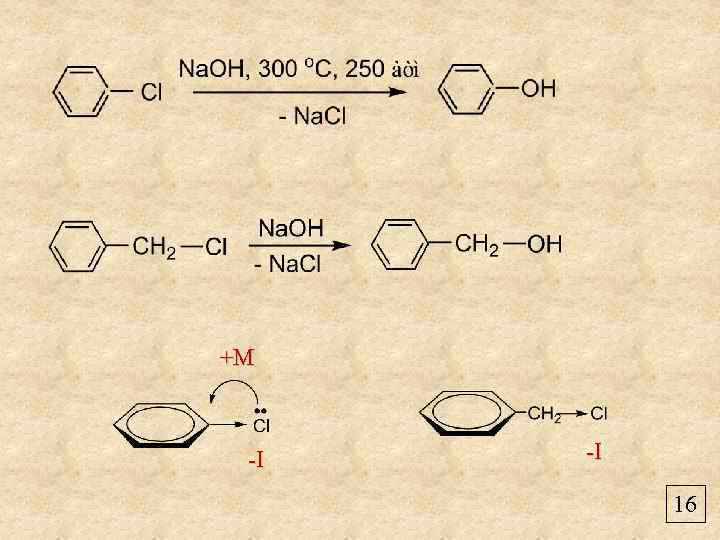
+М -I -I 16
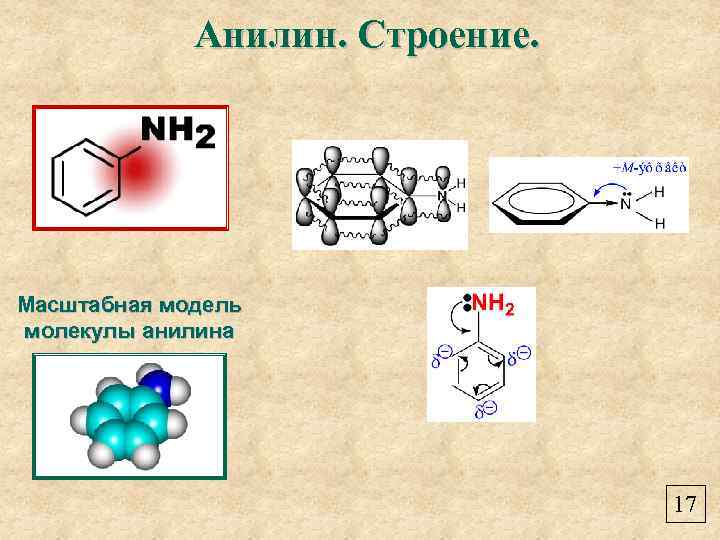
Анилин. Строение. Масштабная модель молекулы анилина 17
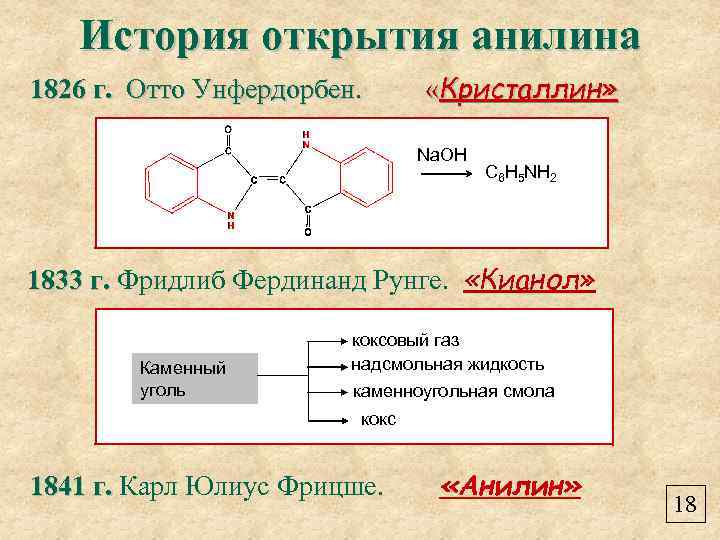
История открытия анилина 1826 г. Отто Унфердорбен. «Кристаллин» Na. OH C 6 H 5 NH 2 1833 г. Фридлиб Фердинанд Рунге. «Кианол» Каменный уголь коксовый газ надсмольная жидкость каменноугольная смола кокс 1841 г. Карл Юлиус Фрицше. «Анилин» 18
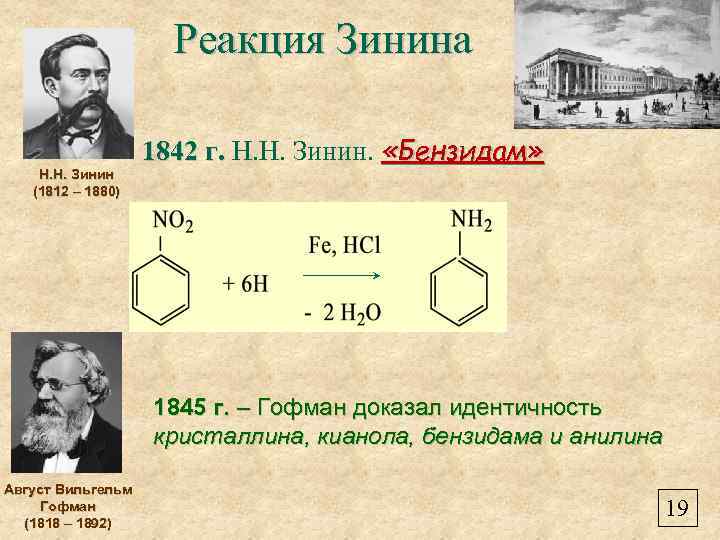
Реакция Зинина Н. Н. Зинин (1812 – 1880) 1842 г. Н. Н. Зинин. «Бензидам» 1845 г. – Гофман доказал идентичность кристаллина, кианола, бензидама и анилина Август Вильгельм Гофман (1818 – 1892) 19
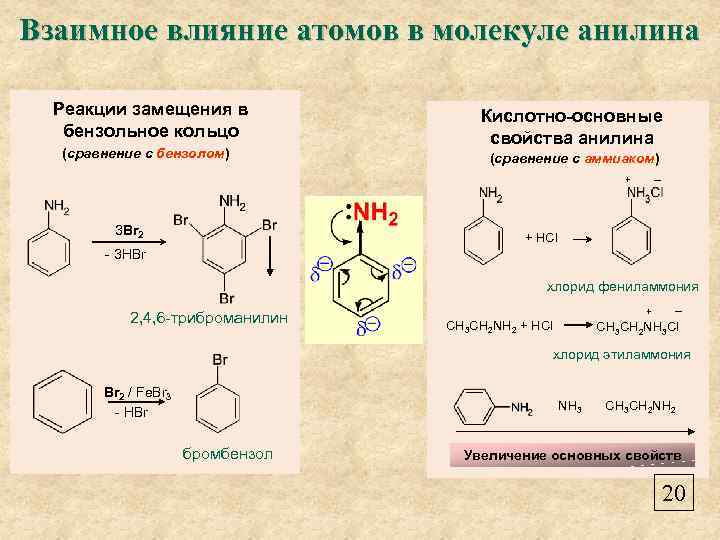
Взаимное влияние атомов в молекуле анилина Реакции замещения в бензольное кольцо (сравнение с бензолом) Кислотно-основные свойства анилина (сравнение с аммиаком) + 3 Br 2 ─ + HCl - 3 HBr хлорид фениламмония 2, 4, 6 -триброманилин + CH 3 CH 2 NH 2 + HCl ─ CH 3 CH 2 NH 3 Cl хлорид этиламмония Br 2 / Fe. Br 3 - HBr NH 3 бромбензол CH 3 CH 2 NH 2 Увеличение основных свойств 20
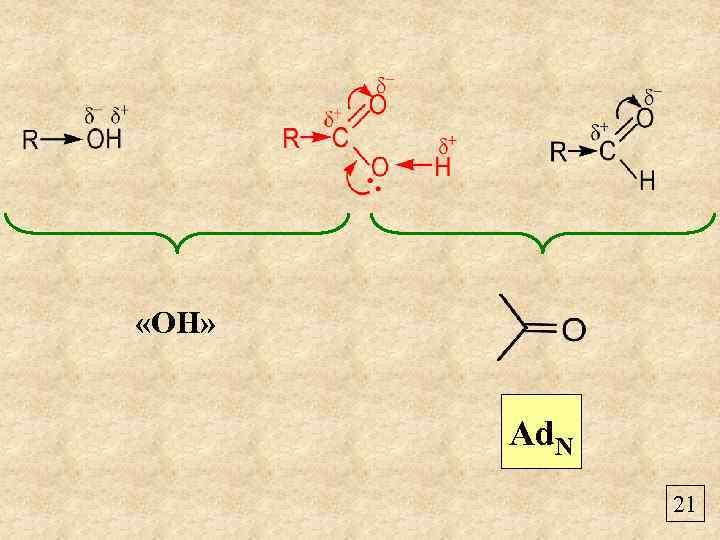
«OH» Ad. N 21
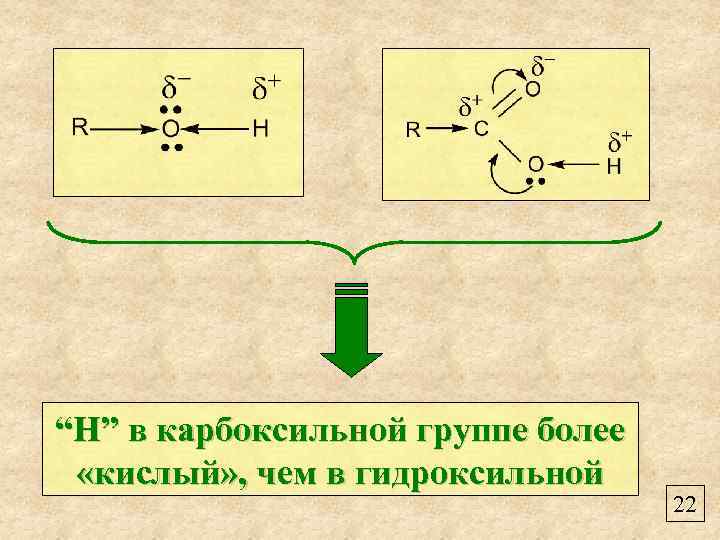
“Н” в карбоксильной группе более «кислый» , чем в гидроксильной 22
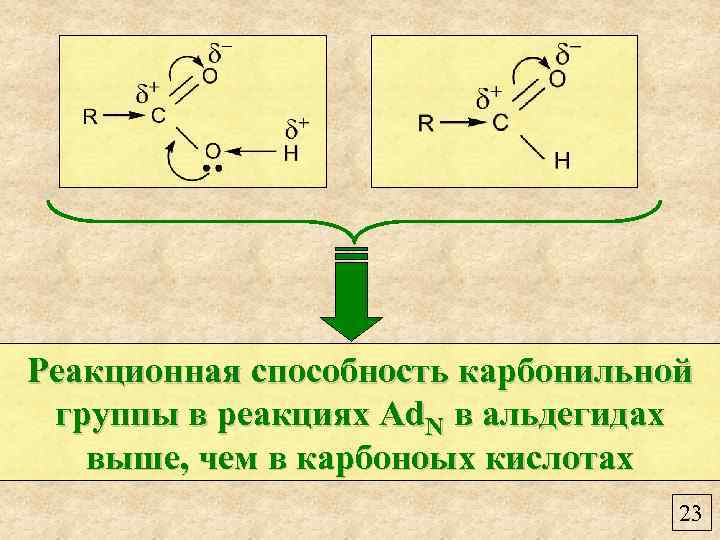
Реакционная способность карбонильной группы в реакциях Ad. N в альдегидах выше, чем в карбоноых кислотах 23

Взаимное влияние атомов в молекулах.ppt