Lektsia_12_Kolloidtyk_zh_1199_yeler.ppt
- Количество слайдов: 30

ДӘРІС № 12 КОЛЛОИДТЫҚ ЖҮЙЕЛЕР (ЗОЛЬДЕР)

КОЛЛОИДТЫҚ ЖҮЙЕЛЕР – бұл фазалар арасындағы беттің ауданы жақсы дамыған жоғары дисперсті микрогетерогенді жүйелер. Бұл жүйелер дисперсті жүйелерге жатады.

Ағылшын ғалымы Грэм (1861 ж. ) кристаллоид деген түсінік енгізді бірінішісі «кристалл» , ал екіншісін – коллоид (гректін «колла» клей) деген сөздерінен шыққан. Оның айтуынша негіздер, тұздар, қышқылдарды кристаллоидтарға, ал шайыр және клей тәрізді заттарды коллоидтарға жатқызды. Кейін орыс ғалымы И. Г. Борщев (1869 ж. ) заттардың кристалды және коллоидты күйі деп бөліп, түзету енгізді

• Дисперстік фаза мен дисперстік ортаның агрегаттық күйіне қарай төмендегідей жіктеледі: 1. Дисперстік ортасы сұйық , ал дисперстік фаза: • газ – көбіктер (сыра, өрт сөндіретін) • сұйық – эмульсия (ыстық сүт, маргарин, мұнай мен су, крем, мазь) • қатты – суспензия (суық сүт, металлдардың коллоидты ерітінділері)

2. Дисперстік орта – газ, дисперстік фаза: • сұйық - аэрозольдер (тұман, бұлт, орг. лак ) • қатты- темекі түтіні, цемент шаңы, кант ұны. 3. Дисперстік орта – қатты, дисперстік фаза: • газ – қатты көбіктер, пеноплас, пемза, активтелген көмір

• сұйық – табиғи минералдар (маржан тас, опал) • қатты – металдың балқымалары, түсті шынылар, бағалы тастар т, б. Дисперстік ортасы сұйық болып келетін крллоидты ерітінділер зольдер (латын тілінен solutus – еріген ) деп аталады.

Дисперсті фаза бөлшектерінің өзара әрекеттесуіне бйланысты: 1. Еркін дисперсті жүйелер – дисперсті фаза бөлшектері өзара байланыспаған, өзара тәуелсіз қозғалады (лиозольдер, аэрозольдер, суспензиялар, эмульсиялар). 2. Байланысқан дисперсті жүйелер - фазалардың біреуі құрылымды байланған еркін қозғалмайды (гельдер, көбіктер).

ДИСПЕРСТІК ЖҮЙЕЛЕРДІ АЛУ ЖОЛДАРЫ: Дисперстілеу – ірі бөлшектерді коллоидты-дисперстілік дәрежесіне дейін әртүрлі жолдармен ұнтақтау. Конденсация – атомдар, молекулалар, иондарды коллоидтыдисперстілік дәрежесіне дейін химиялық жолдармен ірілету, біріктіру. 8

ДИСПЕРСТІЛЕУ ӘДІСТЕРІ: • Механикалық ұнтақтау – диірмендер көмегімен • Электрлік ұнтақтау – жоғарғы вольттік доғамен • Ультрадыбыспен ұнтақтау • Пептизация әдісі 9

ПЕПТИЗАЦИЯ ӘДІСІ Іс жүзінде суда ерімейтін көптеген тұнбалар кейбір заттар әсерінен коллоидты ерітіндіге айналады. Пептизация тұнбаны шаю кезінде немесе арнайы заттар – пептизаторлар қосу кезінде жүреді. Бұл кезде тұнбадан коагуляциялаушы иондар кетіріледі немесе иондар тұнбаның коллоидты бөлшектерінің бетіне адсорбцияланады. Бұл қос электр қабатының түзілуіне немесе коллоидты бөлшектердің айналасында сольватты қабаттың пайда болуына әкеледі. Түзілген қабат бөлшектер арасындағы жабысу күшін әлсіретеді. Осылайша босаған бөлшектер жылулық қозғалыс есебінен сұйықтық көлеміне еркін таралады. Яғни, пептизация коагуляция (ұю) процесіне кері процесс деп айтуға да болады. 10

КОНДЕНСАЦИЯ САТЫЛАРЫ: 1. Коллоидтық бөлшектің түзілуі – қанық ерітіндіде кристалдану орталығының пайда болуы; бөгде бөлшектер көп болған сайын, коллоидты түзілуі де тез болады. 2. Коллоидтық бөлшектің өсуі 3. Стабилизатор қабатының түзілуі (ДЭҚ). 11

КОНДЕНСАЦИЯЛЫҚ ӘДІС • Шынайы ерітіндіден молекулаларды агрегатқа ассоциациялауға негізделген; Ірі дисперсті жүйелерді алуда қолданылады; Сыртқы жұмысты қажет етпейді; Жаңа фазаның пайда болуы аса қанық ортада жүреді. 12 • • •

ФИЗИКАЛЫҚ КОНДЕНСАЦИЯ ӘДІСІ 1. Будан конденсациялау әдісі – төмен температурада газды ортада тұманның, бұлттың пайда болуы. 2. Еріткішті ауыстыру әдісі – заттың ерітіндісін осы зат мүлдем ерімейтін сұйықтыққа құяды. Мысалы, Күкірт, холестерин гидрозольдерін алу. 13

ХИМИЯЛЫҚ КОНДЕНСАЦИЯЛЫҚ ӘДІСТЕР Химиялық реакция нәтижесінде коллоидтық жүйелерді алуға негізделген: 1. Тотықсыздану реакциясы (металдардың Au, Ag, Pt гидрозолдерін алу). Натрий ауратының формальдегидпен тотықсыздануы. 2 Na. Au. O 2 + 3 HCOH + Na 2 CO 3 = 2 Au + 3 HCOONa +Na. HCO 3 + H 2 O Мицелланың құрылысы: 14

2. Алмасу реакциясы. Күміс иодидінің золін алу: Ag. NO 3 + KJ(арт. ) = Ag. J↓ + KNO 3 Мицелланың құрылысы: 15

3. Тотығу реакциясы Күкірт золін алу 2 H 2 Sер-ді + O 2 = 2 S ↓+ 2 H 2 O Мицелланың құрылысы: 16

4. Гидролиз реакциясы Темір гидроксидінің гидрозолін алу: Fe. Cl 3 + 3 H 2 O = Fe(OH)3 ↓ + 3 HCl Мицелланың құрылысы: 17
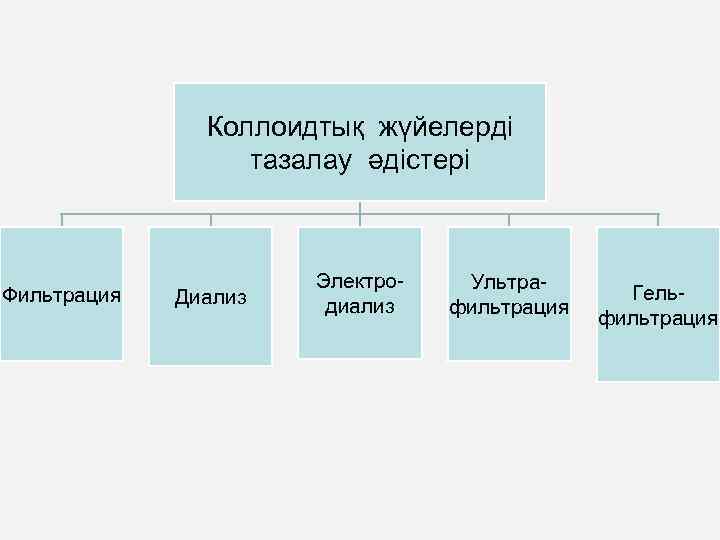
Коллоидтық жүйелерді тазалау әдістері Фильтрация Диализ Электродиализ Ультрафильтрация Гельфильтрация
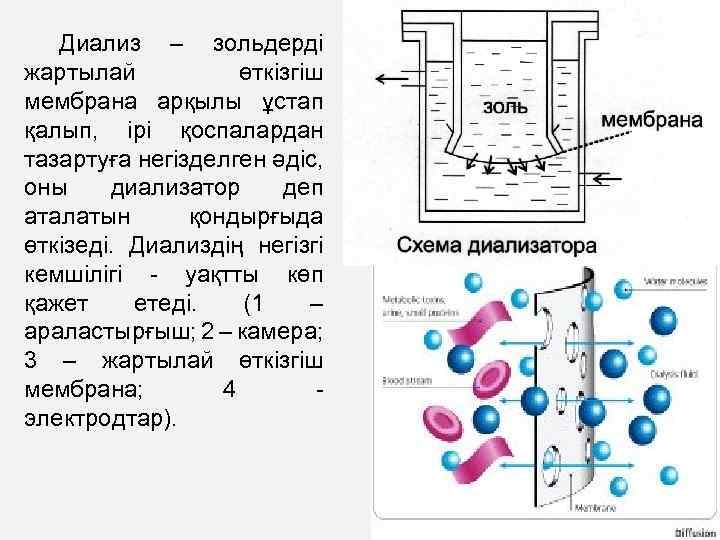
Диализ – зольдерді жартылай өткізгіш мембрана арқылы ұстап қалып, ірі қоспалардан тазартуға негізделген әдіс, оны диализатор деп аталатын қондырғыда өткізеді. Диализдің негізгі кемшілігі - уақтты көп қажет етеді. (1 – араластырғыш; 2 – камера; 3 – жартылай өткізгіш мембрана; 4 - электродтар).
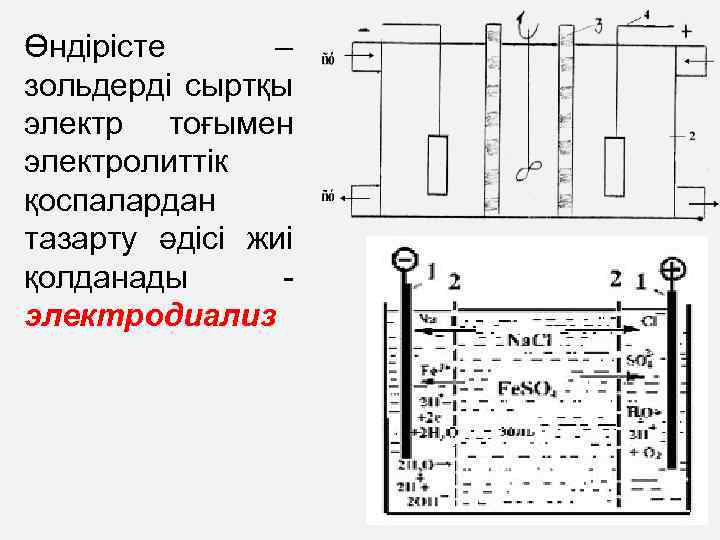
Өндірісте – зольдерді сыртқы электр тоғымен электролиттік қоспалардан тазарту әдісі жиі қолданады - электродиализ
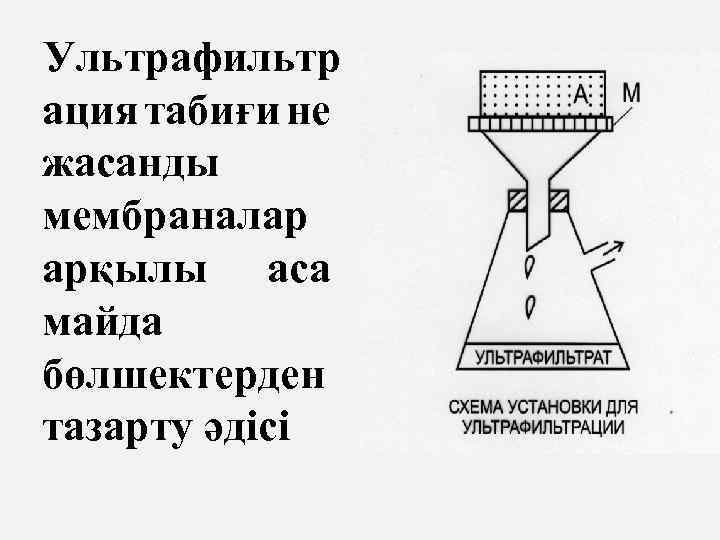
Ультрафильтр ация табиғи не жасанды мембраналар арқылы аса майда бөлшектерден тазарту әдісі

ЗОЛЬДЕРДІҢ ОПТИКАЛЫҚ ҚАСИЕТТЕРІ Жарықтың шашырауын жүйелі түрде зерттеу XIX ғасырдың ортасында басталды (1852 ж. Брюкке; 1857 ж. Фарадей; 1869 ж. Тиндаль). Әсіресе, жарық шашырауын Тиндаль өте тиянақты және нақтылы зерттеді, ол сондай-ақ, жарық шашырауын байқаудың бірден-бір жеңіл де қарапайым әдісін ұсынды. Тиндаль әдісі бойынша коллоидты ерітіндіні қараңғы жерге орналастырып, оның бүйір жағынан жарық сәулесін түсіреді. Осындағы бүйір жағынан көрінетін сәуле “Тиндаль конусы не эффектісі “ деп аталды
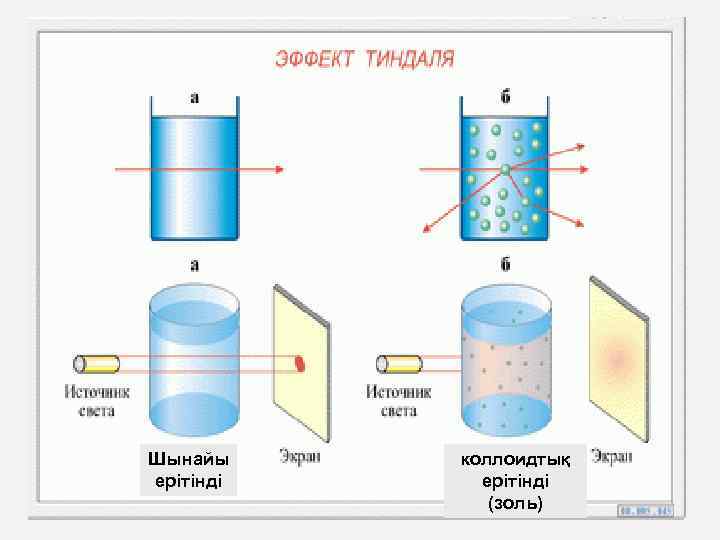
Шынайы ерітінді коллоидтық ерітінді (золь)

Коллоидтық бөлшектердің құрылысының мицеллярлық теориясы МИЦЕЛЛА (лат. мica – крошка, қоқым, майда бөлшек) – ортасы сұйық болып келетін коллоидты ерітіндінің дисперстік фазасының жеке қарапайым бөлшегі

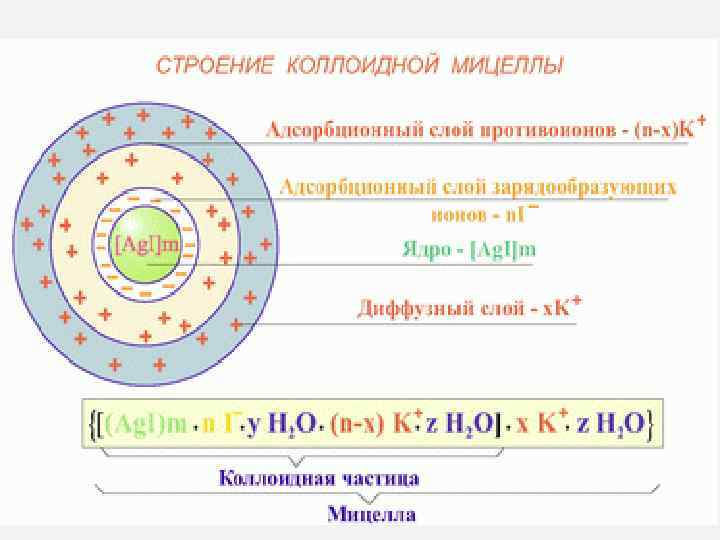
Коллоидтық бөлшектің құрылысы Агрегат ПАИ-мен бірге мицелла ядросын құрады. Мицелланың зарядталған ядросы ерітіндіден өзіне қарсы ионды тартады. ҚИ-дың бір бөлігі адсорбциялық қабат құрайды. Агрегат ПАИ-мен бірге гранула немесе коллоидтық бөлшек түзеді. Коллоидтық бөлшектің зарядын ПАИ заряды арқылы анықтайды. Коллоидтық бөлшекті диффузиялық қабаттың броундық қозғалысына ұшыраған және ядромен берік байланыспаған ҚИ қоршап тұрады. Нәтижесінде электробейтарап бөлшек - мицелла түзіледі. 25
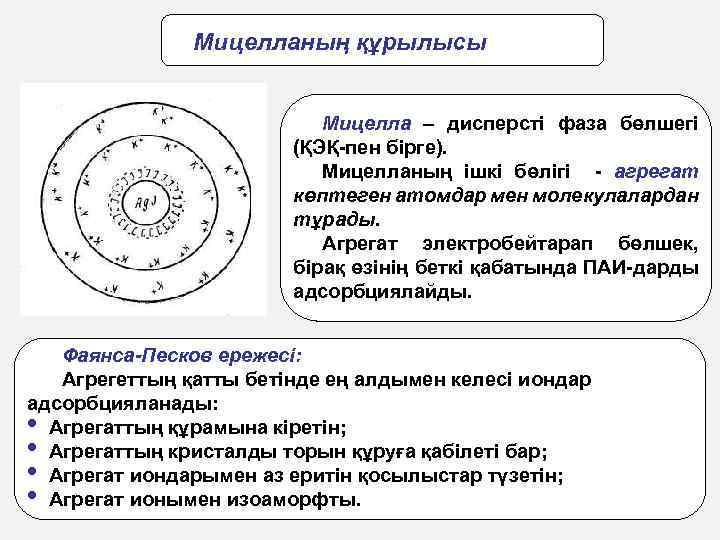
Мицелланың құрылысы Мицелла – дисперсті фаза бөлшегі (ҚЭҚ-пен бірге). Мицелланың ішкі бөлігі - агрегат көптеген атомдар мен молекулалардан тұрады. Агрегат электробейтарап бөлшек, бірақ өзінің беткі қабатында ПАИ-дарды адсорбциялайды. Фаянса-Песков ережесі: Агрегеттың қатты бетінде ең алдымен келесі иондар адсорбцияланады: • Агрегаттың құрамына кіретін; • Агрегаттың кристалды торын құруға қабілеті бар; • Агрегат иондарымен аз еритін қосылыстар түзетін; • Агрегат ионымен изоаморфты. 26

Мысал: Ag. NO 3 – электролит-стабилизатор Ag+ – ПАИ – Қарсы иондар 27

Коллоидтық жүйелердің қолданылуы мен маңызы Бұлттар, тұман С/Г типті коллоидты жүйелер, ал жаңбыр, найзағай және басқа да метеорологиялық құбылыстар коллоидтық құбылыстармен байланысты құбылыстар деп қарастырылуы керек. Керамикалық өндіріс коллоидтық химиямен тығыз байланысты. Себебі саз (керамиканың негізгі шикізаты) –гидратталған алюминий силикатының концентрлі суспензиясы болып табылады. Минералдық шикізат негізінде жаңа құрылыстық материалдар (композициялық материалдар) жасауда колоидтық химияның маңызы өте зор.

Қағаз жасауда өсімдік талшығы жоғары дисперстік күйге дейін ұнтақталады. Бояу технологиясында; Фармацевтикада; Су тазартуда; Тамақ өнеркәсібінде қамыр дайындауда ісіну процесі, маргарин, майонез, соустар жасауда эмульгациялау процесі, сыр дайындау коагуляция процесі, ет қайнатуда коагуляция немесе ақуыздар денатурациясы болып табылады.
Lektsia_12_Kolloidtyk_zh_1199_yeler.ppt