18-Медьсодержащие белки (30).ppt
- Количество слайдов: 48
 Cu Медьсодержащие протеины Типы медьсодержащих центров:
Cu Медьсодержащие протеины Типы медьсодержащих центров:
 Тип I (синие медные протеины) • Донорный узел: 1 Cu, N 2 S экваториальная координация (2 His, 1 Cys) + аксиальная S (Met) или O (Gln) • Координационный полиэдр – искаженный тетраэдр или тригональная бипирамида • Функция – обратимый электронный перенос Cu. II + e Cu. I R = S (Met) (азурин, пластоцианин, лакказа) R = O (Glu) (фитоцианины) R = H 2 O (церулоплазмин)
Тип I (синие медные протеины) • Донорный узел: 1 Cu, N 2 S экваториальная координация (2 His, 1 Cys) + аксиальная S (Met) или O (Gln) • Координационный полиэдр – искаженный тетраэдр или тригональная бипирамида • Функция – обратимый электронный перенос Cu. II + e Cu. I R = S (Met) (азурин, пластоцианин, лакказа) R = O (Glu) (фитоцианины) R = H 2 O (церулоплазмин)
 Тип I (синие медные протеины) Примеры: а) Малые синие протеины: азурин семейство пластоцианинов семейство фитоцианинов растицианин аурацианин б) Синие оксидазы: аскорбат оксидаза лакказа церулоплазмин в) Нитрит редуктаза
Тип I (синие медные протеины) Примеры: а) Малые синие протеины: азурин семейство пластоцианинов семейство фитоцианинов растицианин аурацианин б) Синие оксидазы: аскорбат оксидаза лакказа церулоплазмин в) Нитрит редуктаза
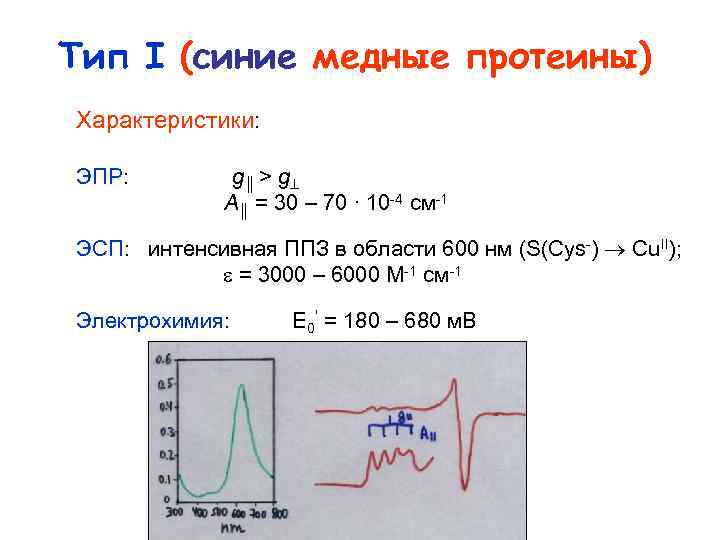 Тип I (синие медные протеины) Характеристики: ЭПР: g║ > g A║ = 30 – 70 ∙ 10 4 см 1 ЭСП: интенсивная ППЗ в области 600 нм (S(Cys ) Cu. II); = 3000 – 6000 M 1 см 1 Электрохимия: E 0’ = 180 – 680 м. В
Тип I (синие медные протеины) Характеристики: ЭПР: g║ > g A║ = 30 – 70 ∙ 10 4 см 1 ЭСП: интенсивная ППЗ в области 600 нм (S(Cys ) Cu. II); = 3000 – 6000 M 1 см 1 Электрохимия: E 0’ = 180 – 680 м. В
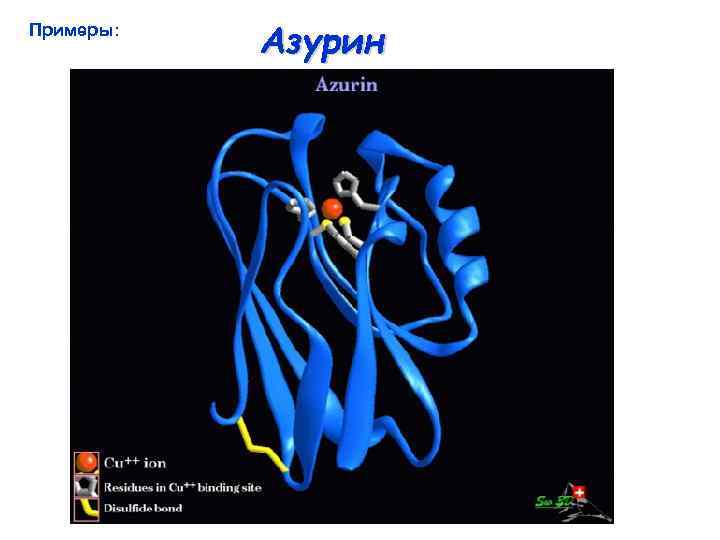 Примеры: Азурин
Примеры: Азурин
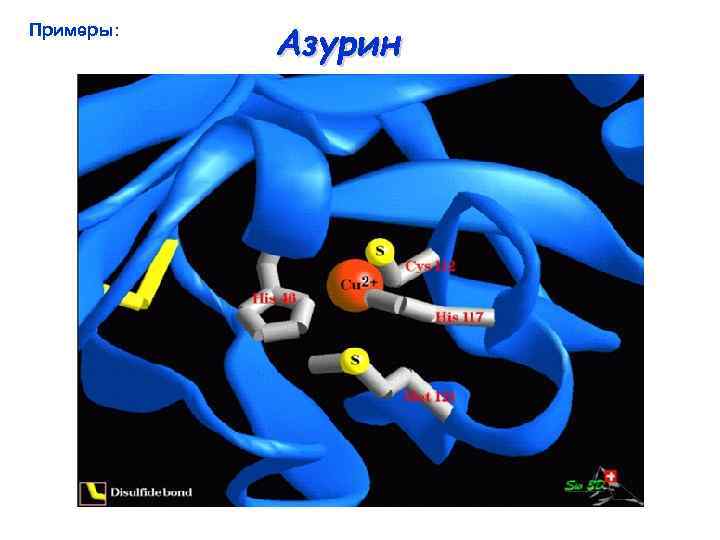 Примеры: Азурин
Примеры: Азурин
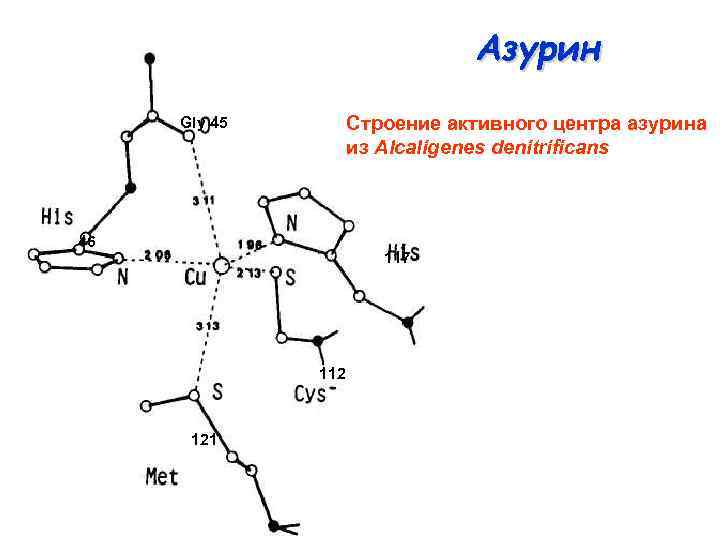 Азурин Строение активного центра азурина из Alcaligenes denitrificans Gly 45 46 117 112 121
Азурин Строение активного центра азурина из Alcaligenes denitrificans Gly 45 46 117 112 121
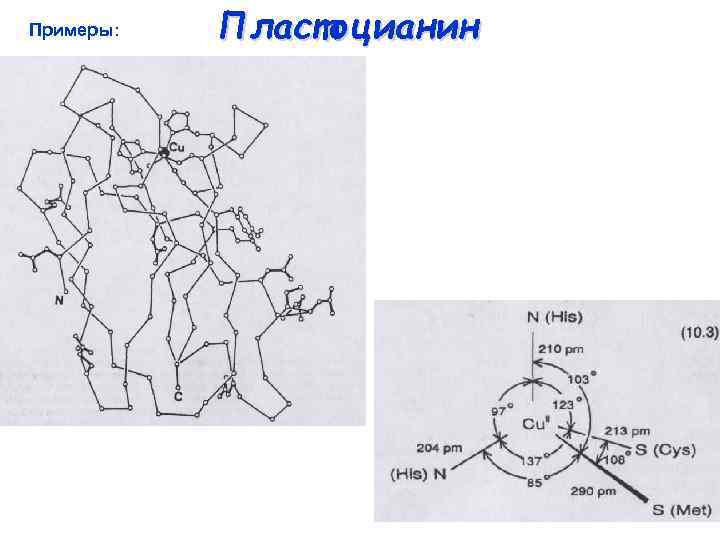 Примеры: Пластоцианин
Примеры: Пластоцианин
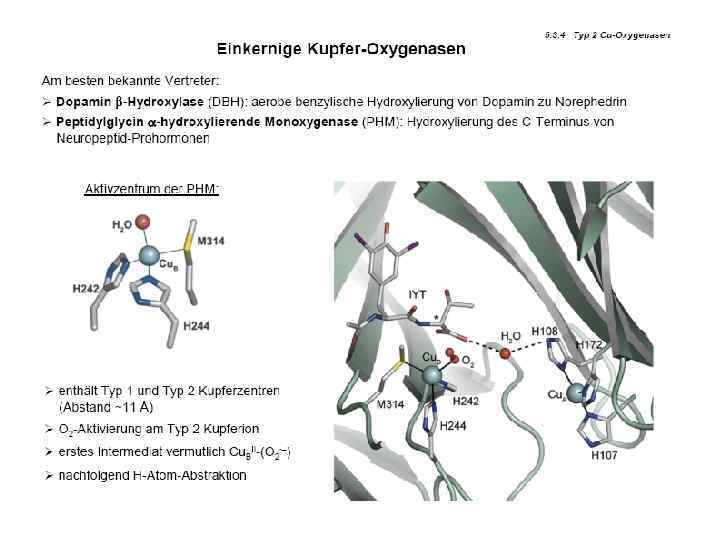
![Тип II Cu[(N)His]m. Rn • L = N, O или S доноры; R = Тип II Cu[(N)His]m. Rn • L = N, O или S доноры; R =](https://present5.com/presentation/3397782_226162431/image-10.jpg) Тип II Cu[(N)His]m. Rn • L = N, O или S доноры; R = O или S доноры m = 1 до 4; n = 0 до 3; m+n (КЧ) = 4 или 5 • Полиэдр – плоский квадрат или квадратная пирамида • Функции – катализ (нередко с другими кофакторами), связанный с активацией молекулярного кислорода Примеры: • Cu, Zn упероксид дисмутаза с • Диоксигеназы • Монооксигеназы • Дофамин ß идроксилаза г • Метан монооксигеназа • Нитрит редуктаза • “Несиние оксидазы” • Аминоксидаза • Галактозоксидаза
Тип II Cu[(N)His]m. Rn • L = N, O или S доноры; R = O или S доноры m = 1 до 4; n = 0 до 3; m+n (КЧ) = 4 или 5 • Полиэдр – плоский квадрат или квадратная пирамида • Функции – катализ (нередко с другими кофакторами), связанный с активацией молекулярного кислорода Примеры: • Cu, Zn упероксид дисмутаза с • Диоксигеназы • Монооксигеназы • Дофамин ß идроксилаза г • Метан монооксигеназа • Нитрит редуктаза • “Несиние оксидазы” • Аминоксидаза • Галактозоксидаза
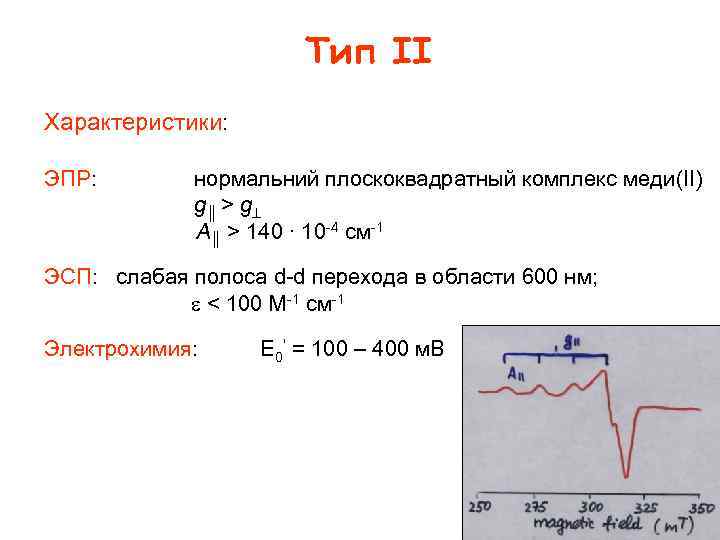 Тип II Характеристики: ЭПР: нормальний плоскоквадратный комплекс меди(II) g ║ > g A║ > 140 ∙ 10 4 см 1 ЭСП: слабая полоса d d перехода в области 600 нм; < 100 M 1 см 1 Электрохимия: E 0’ = 100 – 400 м. В
Тип II Характеристики: ЭПР: нормальний плоскоквадратный комплекс меди(II) g ║ > g A║ > 140 ∙ 10 4 см 1 ЭСП: слабая полоса d d перехода в области 600 нм; < 100 M 1 см 1 Электрохимия: E 0’ = 100 – 400 м. В
 Примеры: Супероксид-дисмутаза 2 O 2 + O 22
Примеры: Супероксид-дисмутаза 2 O 2 + O 22
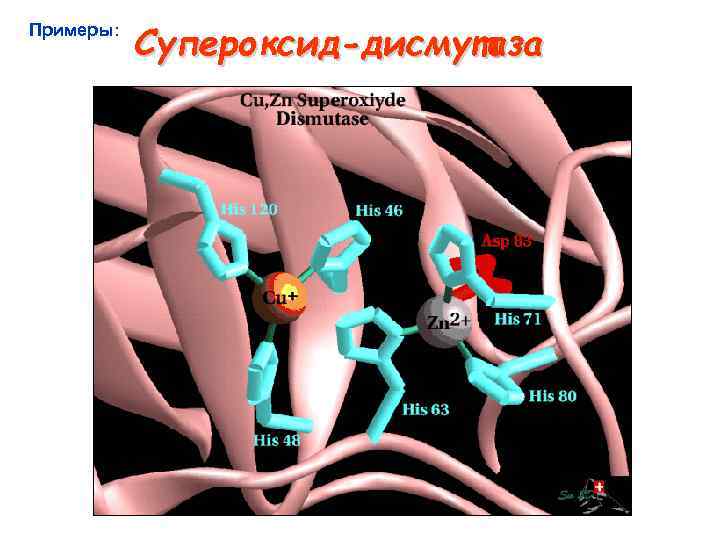 Примеры: Супероксид-дисмутаза
Примеры: Супероксид-дисмутаза
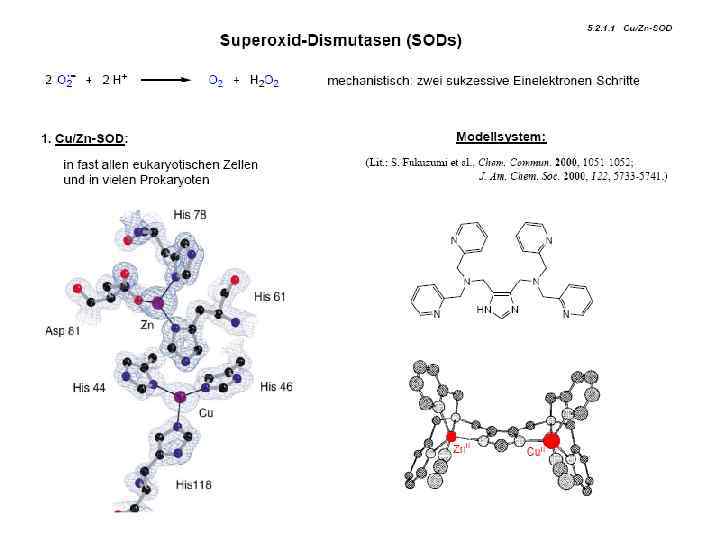
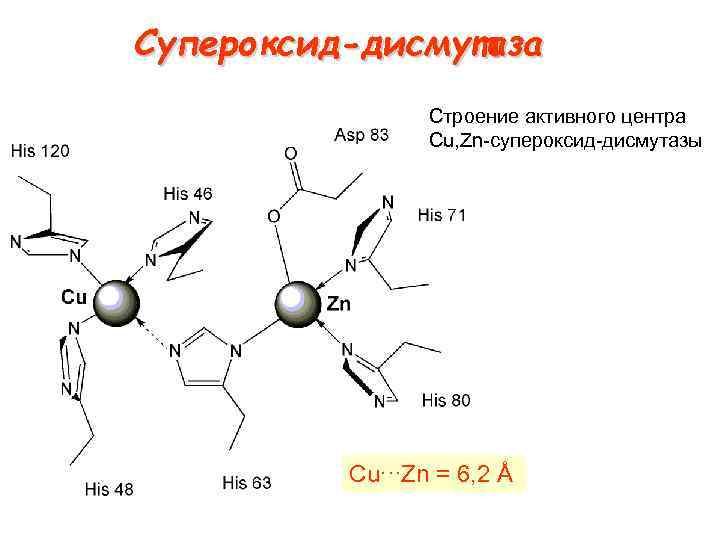 Супероксид-дисмутаза Строение активного центра Cu, Zn супероксид дисмутазы Cu∙·∙Zn = 6, 2 Å
Супероксид-дисмутаза Строение активного центра Cu, Zn супероксид дисмутазы Cu∙·∙Zn = 6, 2 Å
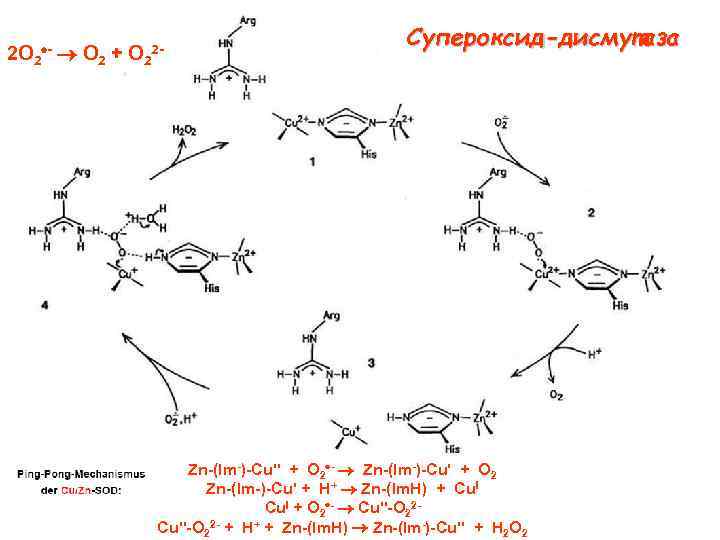 2 O 2 + O 2 2 Супероксид-дисмутаза Zn (lm ) Cu" + O 2 Zn (lm ) Cu' + O 2 Zn (Im ) Cu' + H+ Zn (lm. H) + Cu. I + O 2 Cu" O 22 + H+ + Zn (lm. H) Zn (lm ) Cu" + H 2 O 2
2 O 2 + O 2 2 Супероксид-дисмутаза Zn (lm ) Cu" + O 2 Zn (lm ) Cu' + O 2 Zn (Im ) Cu' + H+ Zn (lm. H) + Cu. I + O 2 Cu" O 22 + H+ + Zn (lm. H) Zn (lm ) Cu" + H 2 O 2
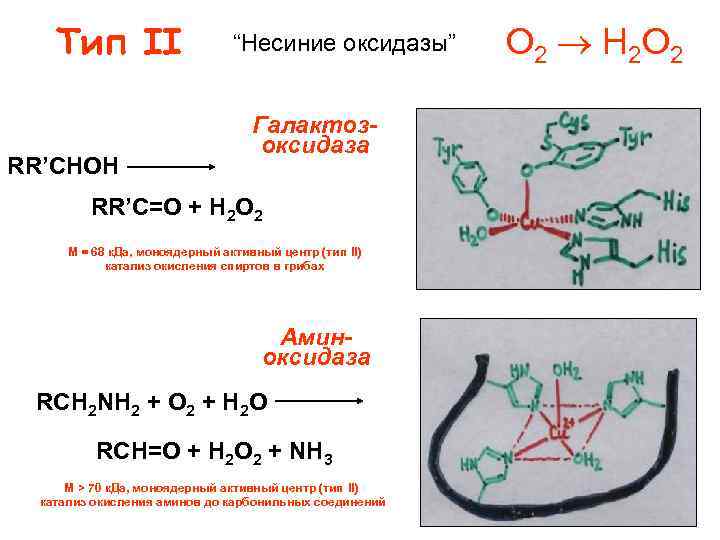 Тип II RR’CHOH “Несиние оксидазы” Галактозоксидаза RR’C=O + H 2 O 2 M = 68 к. Да, моноядерный активный центр (тип II) катализ окисления спиртов в грибах Аминоксидаза RCH 2 NH 2 + O 2 + H 2 O RCH=O + H 2 O 2 + NH 3 M > 70 к. Да, моноядерный активный центр (тип II) катализ окисления аминов до карбонильных соединений O 2 H 2 O 2
Тип II RR’CHOH “Несиние оксидазы” Галактозоксидаза RR’C=O + H 2 O 2 M = 68 к. Да, моноядерный активный центр (тип II) катализ окисления спиртов в грибах Аминоксидаза RCH 2 NH 2 + O 2 + H 2 O RCH=O + H 2 O 2 + NH 3 M > 70 к. Да, моноядерный активный центр (тип II) катализ окисления аминов до карбонильных соединений O 2 H 2 O 2
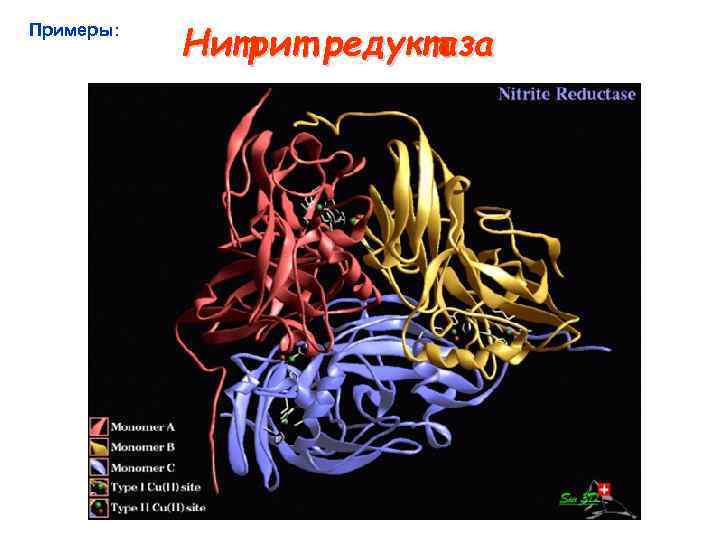 Примеры: Нитрит редуктаза
Примеры: Нитрит редуктаза
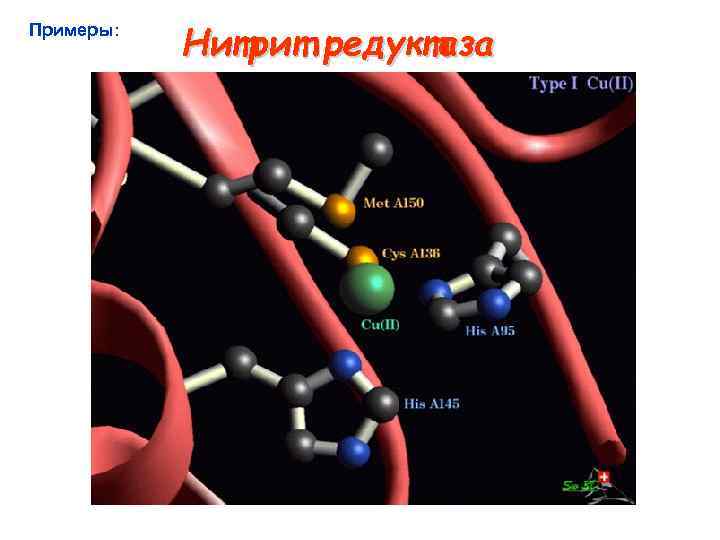 Примеры: Нитрит редуктаза
Примеры: Нитрит редуктаза
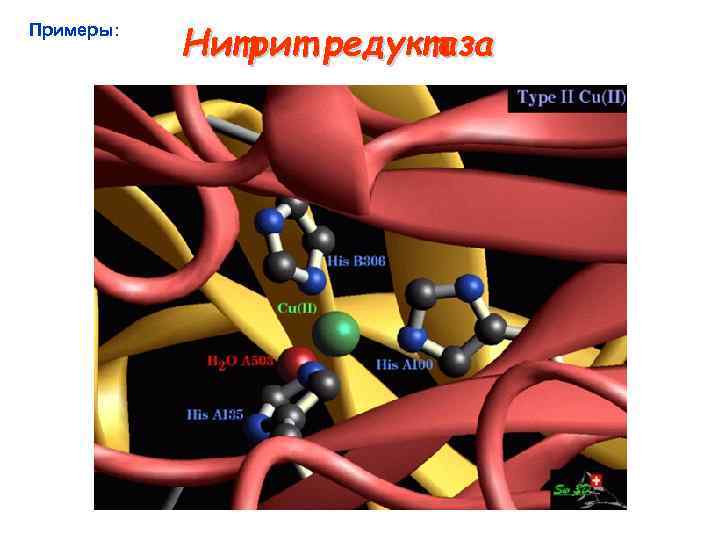 Примеры: Нитрит редуктаза
Примеры: Нитрит редуктаза
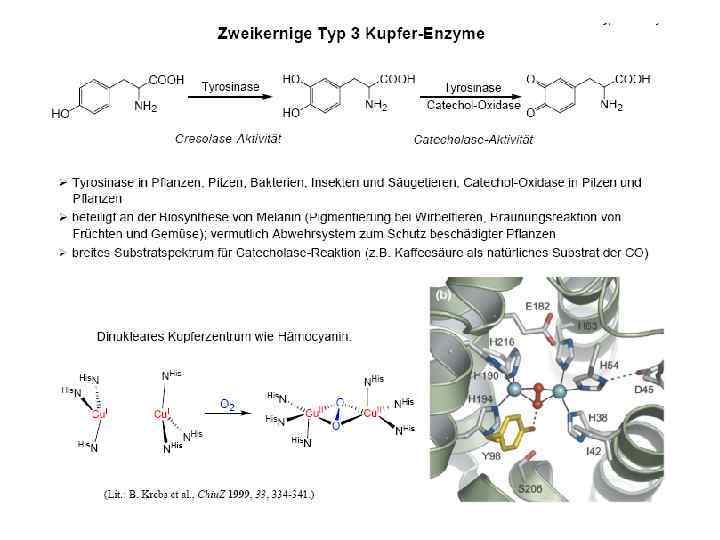
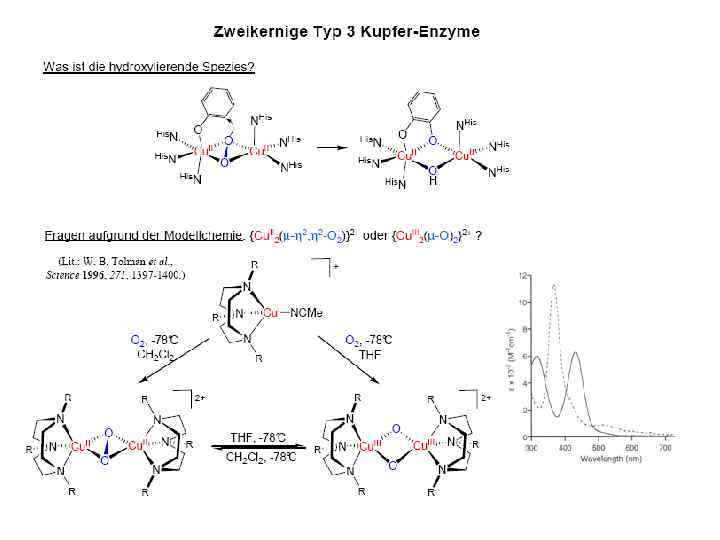
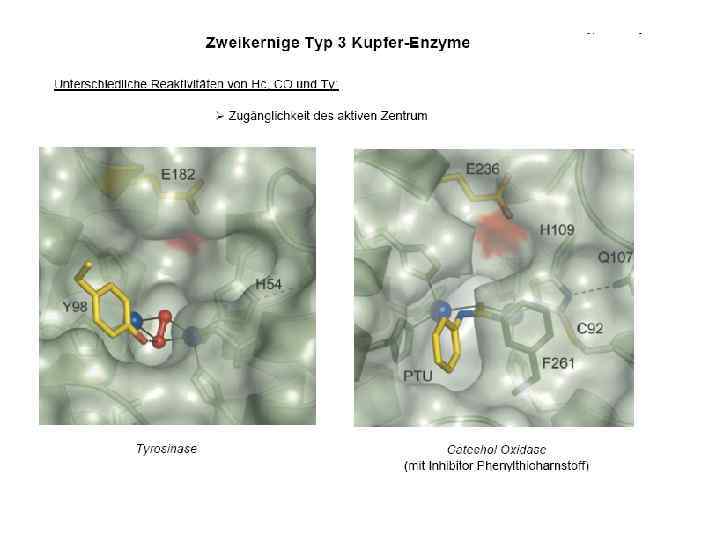
![Тип III µ O[Cu(NHis)3]2 2 • Cu 2 димер; N 3···N 3 донорный узел Тип III µ O[Cu(NHis)3]2 2 • Cu 2 димер; N 3···N 3 донорный узел](https://present5.com/presentation/3397782_226162431/image-22.jpg) Тип III µ O[Cu(NHis)3]2 2 • Cu 2 димер; N 3···N 3 донорный узел • Полиэдр – тригональная антипризма • Функции – катализ реакций оксигенирования окисления, транспорт кислорода Примеры: Катехолоксидаза Гемоцианины Тирозиназа
Тип III µ O[Cu(NHis)3]2 2 • Cu 2 димер; N 3···N 3 донорный узел • Полиэдр – тригональная антипризма • Функции – катализ реакций оксигенирования окисления, транспорт кислорода Примеры: Катехолоксидаза Гемоцианины Тирозиназа
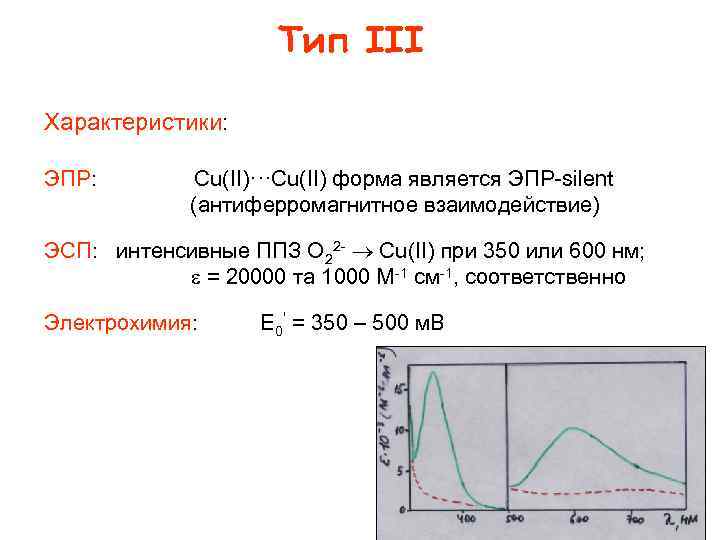 Тип III Характеристики: ЭПР: Cu(II)···Cu(II) форма является ЭПР silent (антиферромагнитное взаимодействие) ЭСП: интенсивные ППЗ O 22 Cu(II) при 350 или 600 нм; = 20000 та 1000 M 1 см 1, соответственно Электрохимия: E 0’ = 350 – 500 м. В
Тип III Характеристики: ЭПР: Cu(II)···Cu(II) форма является ЭПР silent (антиферромагнитное взаимодействие) ЭСП: интенсивные ППЗ O 22 Cu(II) при 350 или 600 нм; = 20000 та 1000 M 1 см 1, соответственно Электрохимия: E 0’ = 350 – 500 м. В
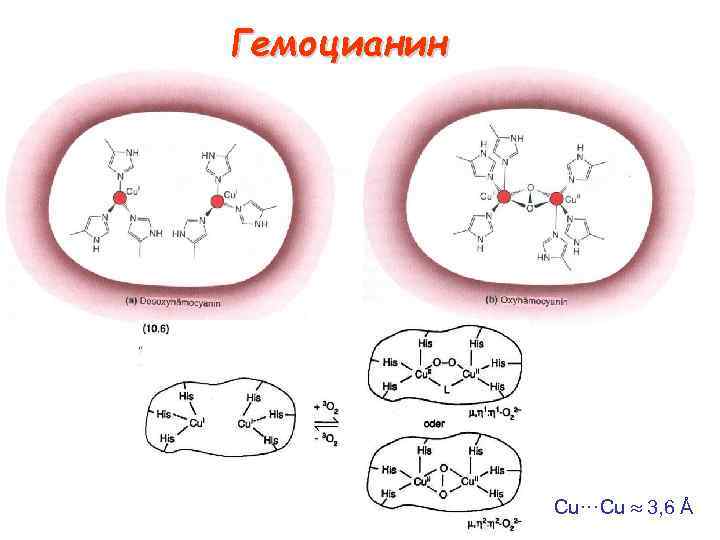 Гемоцианин Cu···Cu 3, 6 Å
Гемоцианин Cu···Cu 3, 6 Å
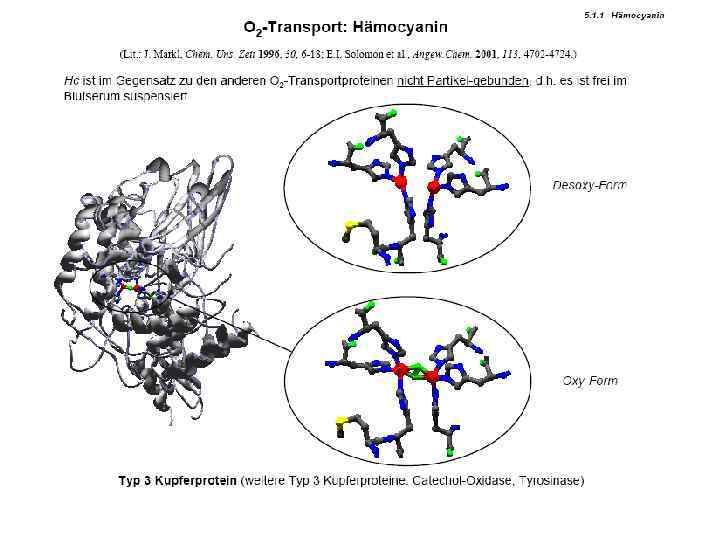
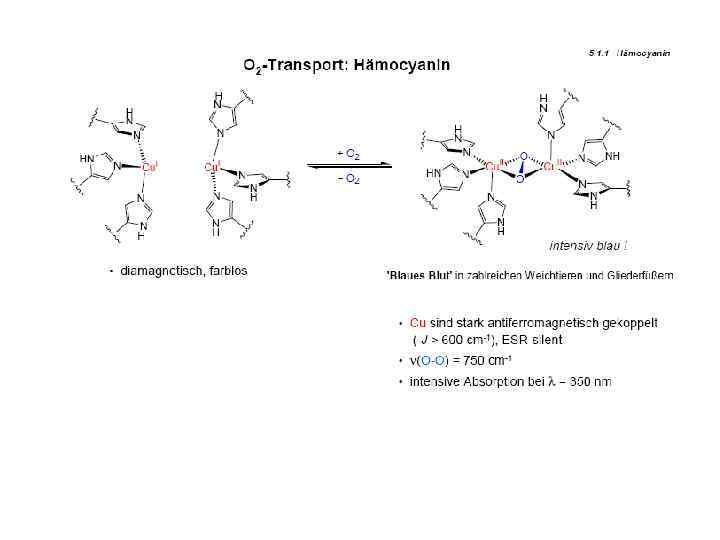
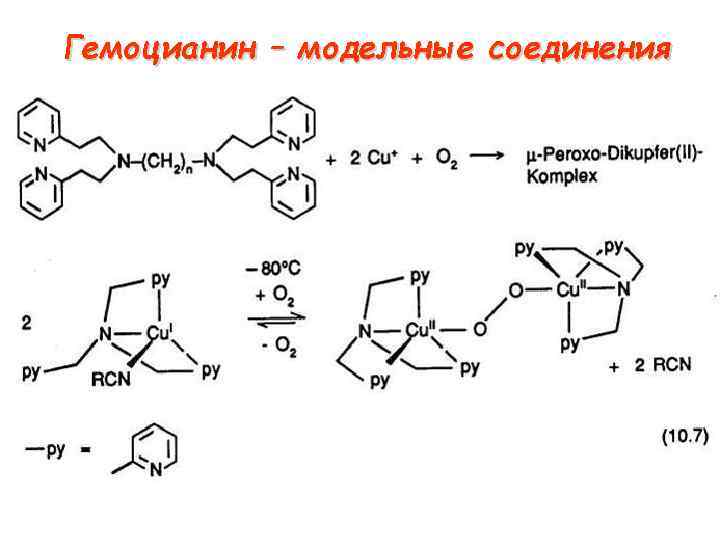 Гемоцианин – модельные соединения
Гемоцианин – модельные соединения
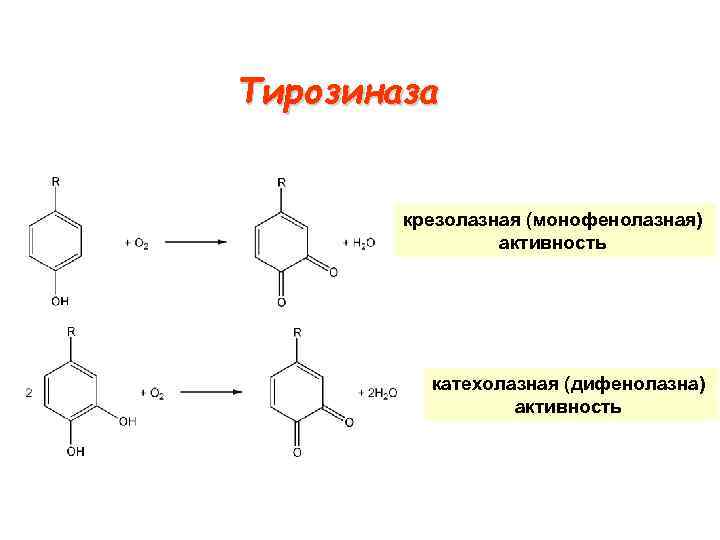 Тирозиназа крезолазная (монофенолазная) активность катехолазная (дифенолазна) активность
Тирозиназа крезолазная (монофенолазная) активность катехолазная (дифенолазна) активность
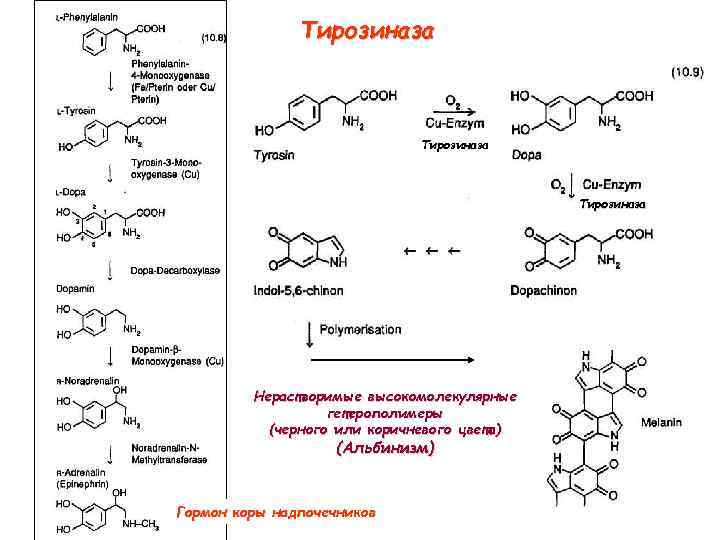 Тирозиназа Нерастворимые высокомолекулярные гетерополимеры (черного или коричневого цвета) (Альбинизм) Гормон коры надпочечников
Тирозиназа Нерастворимые высокомолекулярные гетерополимеры (черного или коричневого цвета) (Альбинизм) Гормон коры надпочечников
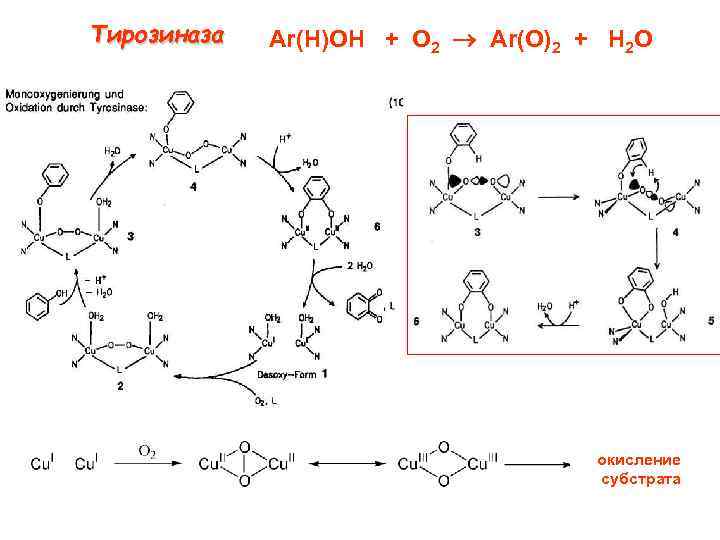 Тирозиназа Ar(H)OH + O 2 Ar(O)2 + H 2 O окисление субстрата
Тирозиназа Ar(H)OH + O 2 Ar(O)2 + H 2 O окисление субстрата
![Триядерный центр (Тип II + Тип III) Cu(NHis)2 OH·µ OH[Cu(N )3]2 His • Cu Триядерный центр (Тип II + Тип III) Cu(NHis)2 OH·µ OH[Cu(N )3]2 His • Cu](https://present5.com/presentation/3397782_226162431/image-37.jpg) Триядерный центр (Тип II + Тип III) Cu(NHis)2 OH·µ OH[Cu(N )3]2 His • Cu 3 тример; N 3···N 2 O донорный узел • Функции – катализ переноса электронов на О 2 как терминальный акцептор Характеристики: • объединяет свойства типов II и III • вместе с центром типа I может осуществлять функцию первичного акцептора электронов Примеры: Синие оксидазы: Аскорбат оксидаза Лакказа Церулоплазмин
Триядерный центр (Тип II + Тип III) Cu(NHis)2 OH·µ OH[Cu(N )3]2 His • Cu 3 тример; N 3···N 2 O донорный узел • Функции – катализ переноса электронов на О 2 как терминальный акцептор Характеристики: • объединяет свойства типов II и III • вместе с центром типа I может осуществлять функцию первичного акцептора электронов Примеры: Синие оксидазы: Аскорбат оксидаза Лакказа Церулоплазмин
 “Синие оксидазы” O 2 H 2 O Аскорбат оксидаза Лакказа М = 2 х 75 к. Да 1 центр типа I (E 0’ = 0, 4 В) Окисление аскорбата до дегидроаскорбата в растениях М = 60 – 130 к. Да 1 центр типа I (E 0’ = 0, 4 – 0, 8 В) Окисление полифенолов и полиаминов в растениях Церулоплазмин М = 130 к. Да 2 центра типа I (E 0’ = 0, 4 В) Транспорт и сохранение меди, мобилизация железа, антиоксидантные функции в плазме млекопитающих
“Синие оксидазы” O 2 H 2 O Аскорбат оксидаза Лакказа М = 2 х 75 к. Да 1 центр типа I (E 0’ = 0, 4 В) Окисление аскорбата до дегидроаскорбата в растениях М = 60 – 130 к. Да 1 центр типа I (E 0’ = 0, 4 – 0, 8 В) Окисление полифенолов и полиаминов в растениях Церулоплазмин М = 130 к. Да 2 центра типа I (E 0’ = 0, 4 В) Транспорт и сохранение меди, мобилизация железа, антиоксидантные функции в плазме млекопитающих
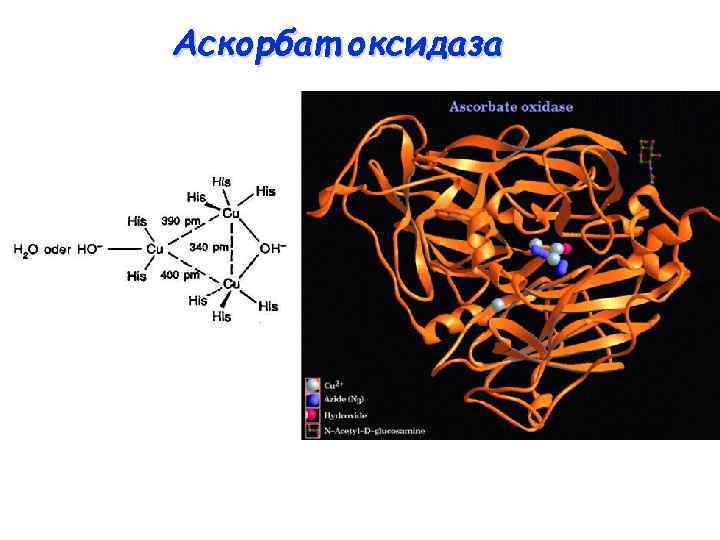 Аскорбат оксидаза
Аскорбат оксидаза
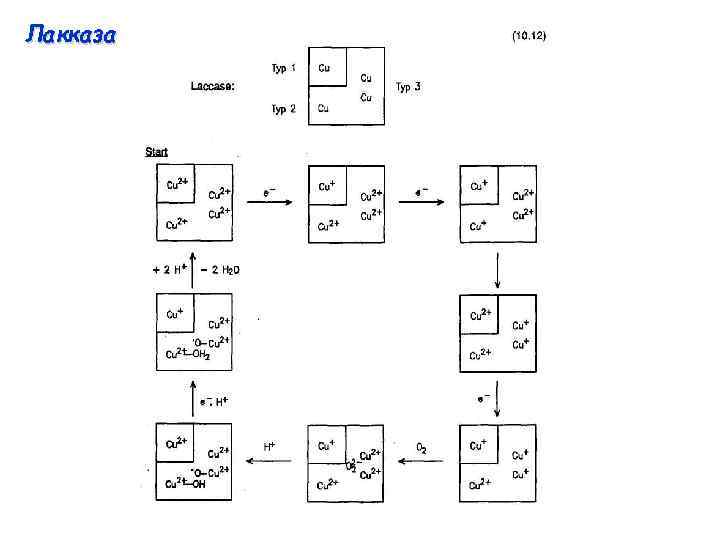 Лакказа
Лакказа
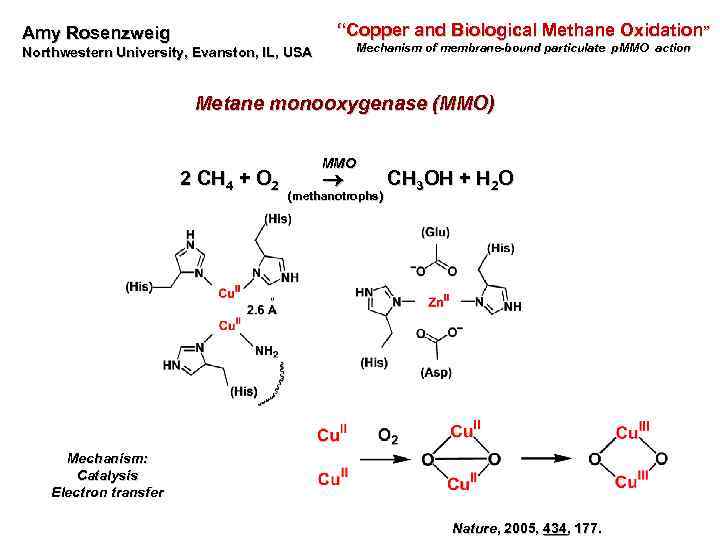 “Copper and Biological Methane Oxidation” Amy Rosenzweig Northwestern University, Evanston, IL, USA Mechanism of membrane-bound particulate p. MMO action p. MMO Metane monooxygenase (MMO) MMO 2 CH 4 + O 2 CH 3 OH + H 2 O (methanotrophs) Mechanism: Catalysis Electron transfer Nature, 2005, 434, 177.
“Copper and Biological Methane Oxidation” Amy Rosenzweig Northwestern University, Evanston, IL, USA Mechanism of membrane-bound particulate p. MMO action p. MMO Metane monooxygenase (MMO) MMO 2 CH 4 + O 2 CH 3 OH + H 2 O (methanotrophs) Mechanism: Catalysis Electron transfer Nature, 2005, 434, 177.

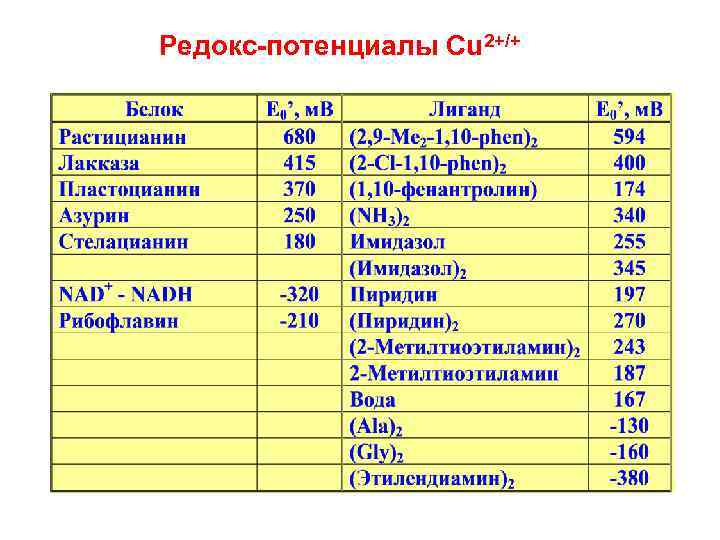 Редокс потенциалы Cu 2+/+
Редокс потенциалы Cu 2+/+
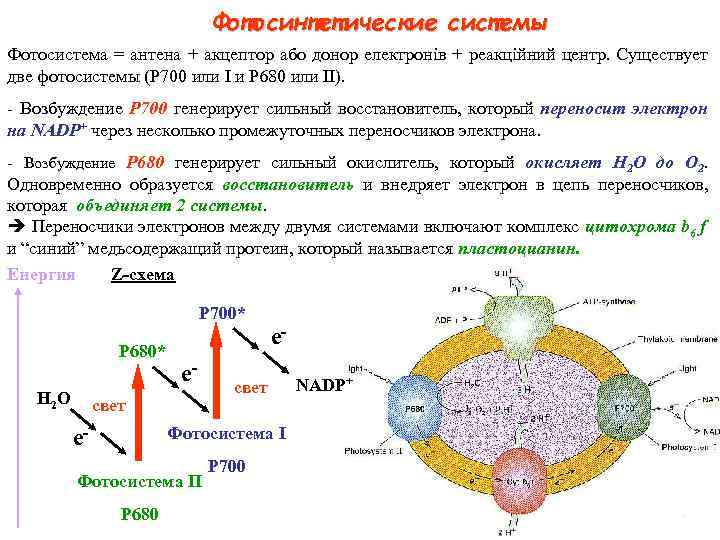 Фотосинтетические системы Фотосистема = антена + акцептор або донор електронів + реакційний центр. Существует две фотосистемы (Р 700 или I и Р 680 или II). - Возбуждение P 700 генерирует сильный восстановитель, который переносит электрон на NADP+ через несколько промежуточных переносчиков электрона. - Возбуждение P 680 генерирует сильный окислитель, который окисляет H 2 O до O 2. Одновременно образуется восстановитель и внедряет электрон в цепь переносчиков, которая объединяет 2 системы. Переносчики электронов между двумя системами включают комплекс цитохрома b 6 f и “синий” медьсодержащий протеин, который называется пластоцианин. Енергия Z схема P 700* P 680* H 2 O e свет Фотосистема I e Фотосистема II P 680 P 700 NADP+
Фотосинтетические системы Фотосистема = антена + акцептор або донор електронів + реакційний центр. Существует две фотосистемы (Р 700 или I и Р 680 или II). - Возбуждение P 700 генерирует сильный восстановитель, который переносит электрон на NADP+ через несколько промежуточных переносчиков электрона. - Возбуждение P 680 генерирует сильный окислитель, который окисляет H 2 O до O 2. Одновременно образуется восстановитель и внедряет электрон в цепь переносчиков, которая объединяет 2 системы. Переносчики электронов между двумя системами включают комплекс цитохрома b 6 f и “синий” медьсодержащий протеин, который называется пластоцианин. Енергия Z схема P 700* P 680* H 2 O e свет Фотосистема I e Фотосистема II P 680 P 700 NADP+
 Окисление H 2 O в O 2 требует удаления 4 электронов с каждой молекулы O 2 2 H 2 O = O 2 + 4 H+ + 4 e. В соответствии с Z-схемой, каждый электрон участвует в фотохимической реакции как Р 680, так и Р 700: минимально 2 фотона необходимо для переноса каждого электрона. Таким образом, 2 х 4 = 8 фотонов необходимо для образования одной молекулы O 2.
Окисление H 2 O в O 2 требует удаления 4 электронов с каждой молекулы O 2 2 H 2 O = O 2 + 4 H+ + 4 e. В соответствии с Z-схемой, каждый электрон участвует в фотохимической реакции как Р 680, так и Р 700: минимально 2 фотона необходимо для переноса каждого электрона. Таким образом, 2 х 4 = 8 фотонов необходимо для образования одной молекулы O 2.
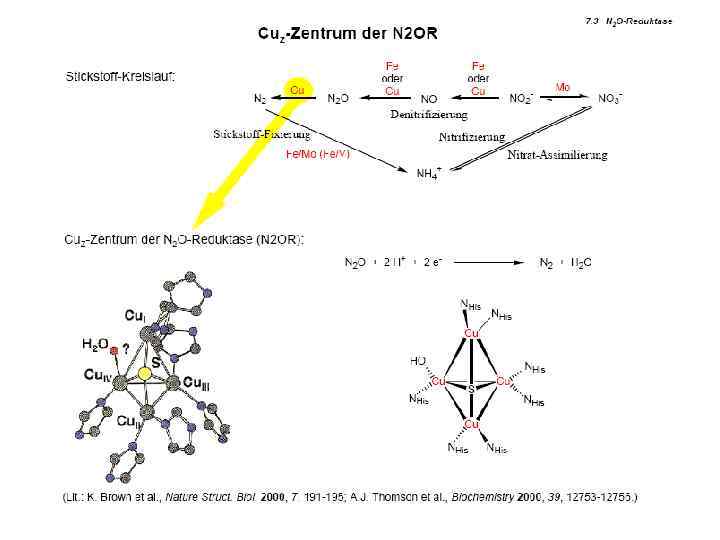
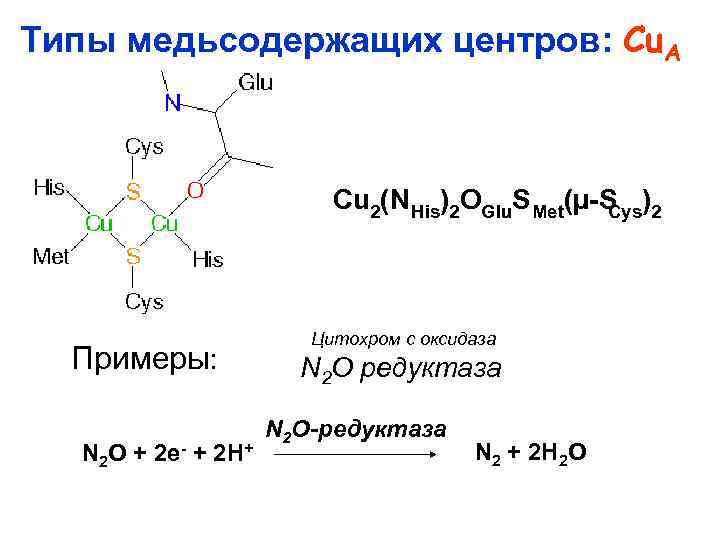 Типы медьсодержащих центров: Cu. A Cu 2(N His)2 OGlu. S Met(µ S )2 Cys Примеры: N 2 O + 2 e + 2 H+ Цитохром c оксидаза N 2 O редуктаза N 2 O-редуктаза N 2 + 2 H 2 O
Типы медьсодержащих центров: Cu. A Cu 2(N His)2 OGlu. S Met(µ S )2 Cys Примеры: N 2 O + 2 e + 2 H+ Цитохром c оксидаза N 2 O редуктаза N 2 O-редуктаза N 2 + 2 H 2 O
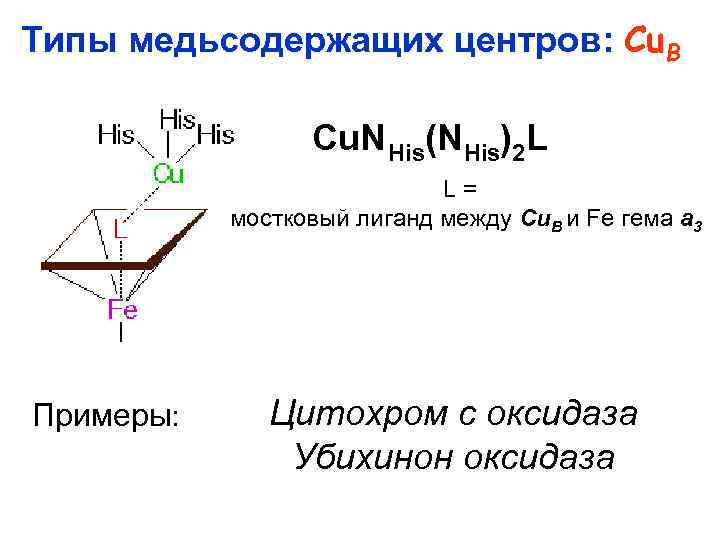 Типы медьсодержащих центров: Cu. В Cu. N His(NHis)2 L L= мостковый лиганд между Cu. B и Fe гема a 3 Примеры: Цитохром c оксидаза Убихинон оксидаза
Типы медьсодержащих центров: Cu. В Cu. N His(NHis)2 L L= мостковый лиганд между Cu. B и Fe гема a 3 Примеры: Цитохром c оксидаза Убихинон оксидаза


