bc077086e0da49a812ef928fbcb3a92b.ppt
- Количество слайдов: 43

CONTRÔLE DE QUALITE DES MEDICAMENTS Direction des laboratoires et des Contrôles Pr. Pierre-Antoine BONNET Directeur scientifique Site Montpellier-Vendargues

ACTIVITES DE CONTRÔLE DE L’AFSSAPS
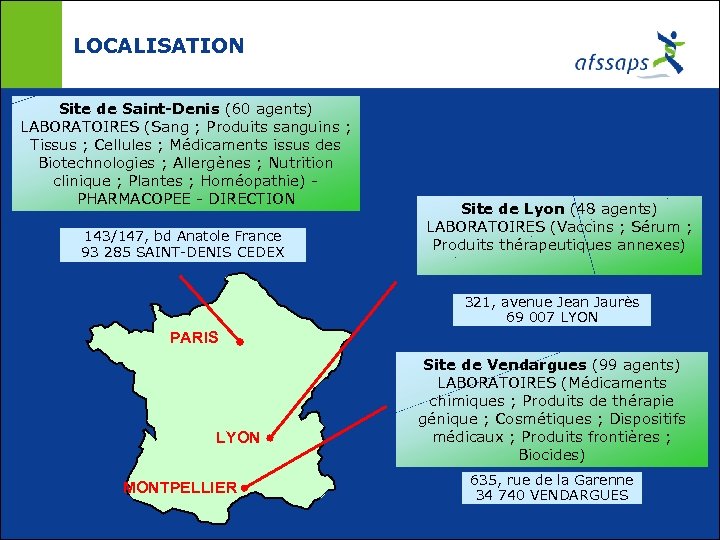
LOCALISATION Site de Saint-Denis (60 agents) LABORATOIRES (Sang ; Produits sanguins ; Tissus ; Cellules ; Médicaments issus des Biotechnologies ; Allergènes ; Nutrition clinique ; Plantes ; Homéopathie) - PHARMACOPEE - DIRECTION 143/147, bd Anatole France 93 285 SAINT-DENIS CEDEX Site de Lyon (48 agents) LABORATOIRES (Vaccins ; Sérum ; Produits thérapeutiques annexes) 321, avenue Jean Jaurès 69 007 LYON PARIS LYON MONTPELLIER Site de Vendargues (99 agents) LABORATOIRES (Médicaments chimiques ; Produits de thérapie génique ; Cosmétiques ; Dispositifs médicaux ; Produits frontières ; Biocides) 635, rue de la Garenne 34 740 VENDARGUES
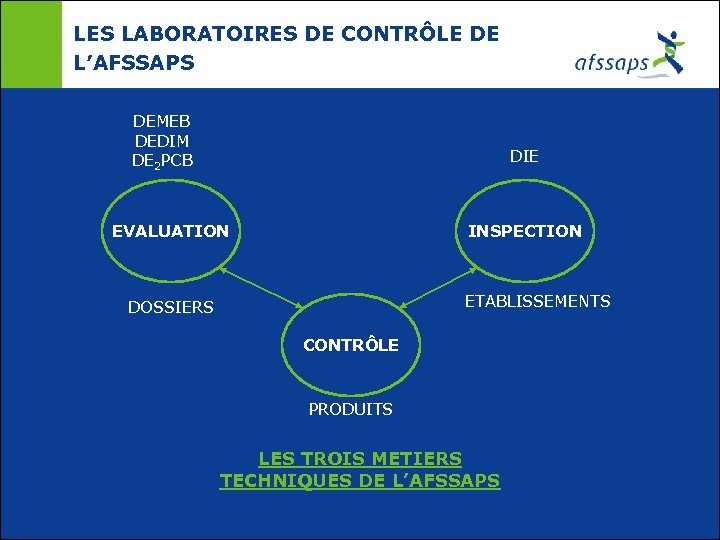
LES LABORATOIRES DE CONTRÔLE DE L’AFSSAPS DEMEB DEDIM DE 2 PCB DIE EVALUATION INSPECTION ETABLISSEMENTS DOSSIERS CONTRÔLE PRODUITS LES TROIS METIERS TECHNIQUES DE L’AFSSAPS

LE CONTRÔLE DE QUALITE DES MEDICAMENTS PAR LES LABORATOIRES NATIONAUX DE CONTRÔLE LA QUALITE PHARMACEUTIQUE EST JUGEE PAR : - L’EVALUATION DU DOSSIER PHARMACEUTIQUE DU PRODUIT Faite par les Autorités d’Enregistrement (en France : Afssaps) - L’INSPECTION DES SITES DE FABRICATION Faite par les Autorités d’Inspection (en France : Afssaps) - LE CONTRÔLE EN LABORATOIRE Fait : - par les Autorités de Contrôle (en France : Afssaps) - dans les Laboratoires Nationaux de Contrôle indépendants du fabricant

OBJECTIFS DES CONTROLES EN LABORATOIRE EXPERTISE TECHNIQUE INDEPENDANTE DU FABRICANT VISANT A VERIFIER LA QUALITE PHARMACEUTIQUE DU PRODUIT è COMPOSITION QUALITATIVE è COMPOSITION QUANTITATIVE è CARACTERISTIQUES ORGANOLEPTIQUES è ESSAIS è PURETE è STABILITE è PROPRETE MICROBIOLOGIQUE è ACTIVITE BIOLOGIQUE (IN VIVO ET IN VITRO)

LES REFERENTIELS DES CONTROLES â DOCUMENTS DECRIVANT LES PARAMETRES DE QUALITE PHARMACEUTIQUE DES PRODUITS ET LES TECHNIQUES DE CONTROLE : - VALIDES - â CONSENSUELS (Fabricants – Experts – Autorités) OPPOSABLES PARTIE PHARMACEUTIQUE DU DOSSIER D’AMM PHARMACOPEE (EN FRANCE LA PHARMACOPEE EUROPEENNE PRIME) GUIDELINES SPECIFIQUES

LES CONTROLES DE QUALITE DES MEDICAMENTS PAR LES LABORATOIRES NATIONAUX DE CONTROLE LES BESOINS DES LABORATOIRES NATIONAUX DE CONTROLE ¢ LES ECHANTILLONS DE PRODUITS Règles d’échantillonnage Conditions d’envoi ¢ LA PARTIE PHARMACEUTIQUE DU DOSSIER D’AMM ¢ LA PHARMACOPEE ¢ EQUIPEMENTS PERMETTANT DE REALISER LES CONTROLES ADAPTES ¢ PERSONNEL QUALIFIE

LE CONTRÔLE DE QUALITE DES MEDICAMENTS PAR LES LABORATOIRES NATIONAUX DE CONTRÔLE LES QUESTIONS POSEES ¢ LA CONFORMITE AUX REFERENTIELS DE QUALITE - - PHARMACOPEE (Nationale – Européenne) PARTIE PHARMACEUTIQUE DU DOSSIER D’AMM ¢ LES PARAMETRES CONTROLES DEPENDENT DE LA NATURE DU PRODUIT ET DE LA FORME PHARMACEUTIQUE Identification du principe actif Dosage du principe actif Nature et taux d’impuretés Masse, sécabilité, p. H Propreté microbiologique Stérilité Activité biologique (in vivo chez le rongeur ou in vitro) Toxicité anormale Tolérance locale

PHARMACOPEE EUROPEENNE 35 États membres (inclus 26 pays de l’Union européenne) : Allemagne Autriche Belgique Bosnie et Herzegovine Bulgarie Chypre Croatie Danemark Espagne Estonie Finlande France Grèce Hongrie Irlande Islande Italie Lettonie Lituanie Luxembourg Malte Norvège Pays-bas Portugal République Tchèque Roumanie ex-République yougoslave de Macédoine (FYROM) Royaume-Uni Serbie et Monténégro Slovaquie Slovénie Suède Suisse Turquie Commission des Communautés européennes 14 Observateurs : • Pays européens : Albanie Georgie Pologne Ukraine • Pays non - européens Algérie Australie Canada Chine Malaisie Maroc Sénégal Syrie Tunisie • OMS

FARMACOPEA EUROPEA Edicion española

LE RESEAU EUROPEEN DES LABORATOIRES DE CONTRÔLE DES MEDICAMENTS
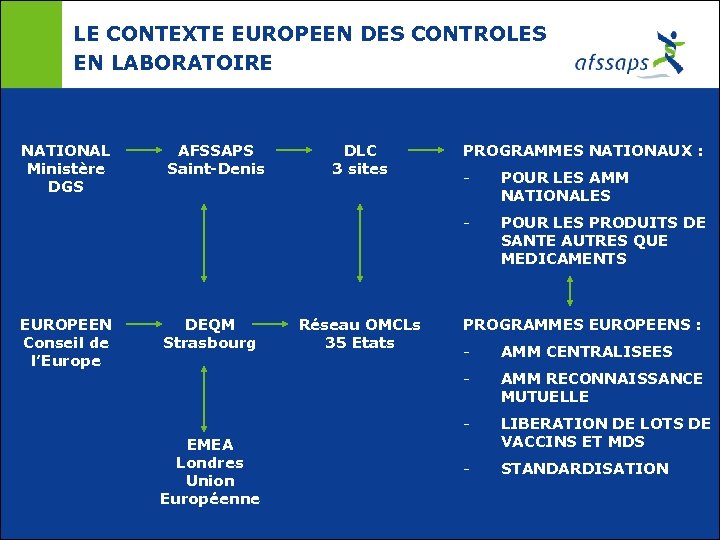
LE CONTEXTE EUROPEEN DES CONTROLES EN LABORATOIRE NATIONAL Ministère DGS AFSSAPS Saint-Denis DLC 3 sites PROGRAMMES NATIONAUX : DEQM Strasbourg Réseau OMCLs 35 Etats POUR LES AMM NATIONALES - EUROPEEN Conseil de l’Europe - POUR LES PRODUITS DE SANTE AUTRES QUE MEDICAMENTS PROGRAMMES EUROPEENS : AMM CENTRALISEES - AMM RECONNAISSANCE MUTUELLE - EMEA Londres Union Européenne - LIBERATION DE LOTS DE VACCINS ET MDS - STANDARDISATION

LES CONTROLES DE QUALITE DES MEDICAMENTS PAR LES LABORATOIRES NATIONAUX DE CONTROLE ¢ Pour les MEDICAMENTS BIOLOGIQUES (vaccins et Médicaments dérivés du sang) LIBERATION DE LOTS EXIGEE PAR LES DIRECTIVES EUROPEENNES ¢ Pour les autres MEDICAMENTS SURVEILLANCE DU MARCHE -Programme annuel de contrôle systématique ou analyse de risque -Contrôle suite à des urgences (Pharmacovigilance…. ) -Contrôle partagé entre différents OMCLs selon compétences LOTS PRIS AU HASARD PARMI LES LOTS DISPONIBLES SUR LE MARCHE

LES PROCEDURES DE SURVEILLANCE DU MARCHE

LA SURVEILLANCE DU MARCHE PAR LES CONTROLES EN LABORATOIRE ¢ AU NIVEAU NATIONAL : TOUS LES PRODUITS DE SANTE MEDICAMENTS AYANT UNE AMM NATIONALE PRODUITS DE SANTE CIRCULANT SUR LE MARCHE FRANÇAIS : PRODUITS SANGUINS – COSMETIQUES – DISPOSITIFS MEDICAUX – PLANTES MEDICINALES… SUIVANT DES PROGRAMMES ANNUELS ETABLIS PAR L’AFSSAPS ET EN REPONSE A DES DEMANDES PONCTUELLES EN CAS D’INCIDENT OU D’ACCIDENT ¢ AU NIVEAU EUROPEEN : LES MEDICAMENTS CHIMIQUES ET CEUX ISSUS DES BIOTECHNOLOGIES AYANT UNE AMM EUROPEENNE CENTRALISEE SUIVANT DES PROGRAMMES ANNUELS COORDONNES PAR LA DIRECTION EUROPEENNE DE LA QUALITE DU MEDICAMENT AGISSANT PAR CONTRAT AVEC L’AGENCE EUROPEENNE DU MEDICAMENT

LA SURVEILLANCE DU MARCHE PROCEDURE SELECTION DE PRODUITS SELECTION DE LOTS AU HASARD DEMANDE DES LOTS AUX FABRICANTS OU PRELEVEMENTS DES LOTS PAR L’INSPECTION RECEPTION DES ECHANTILLONS A LA DLC REALISATION DES CONTROLES BULLETINS D’ANALYSE DIE DEMEB DLC Fabricant
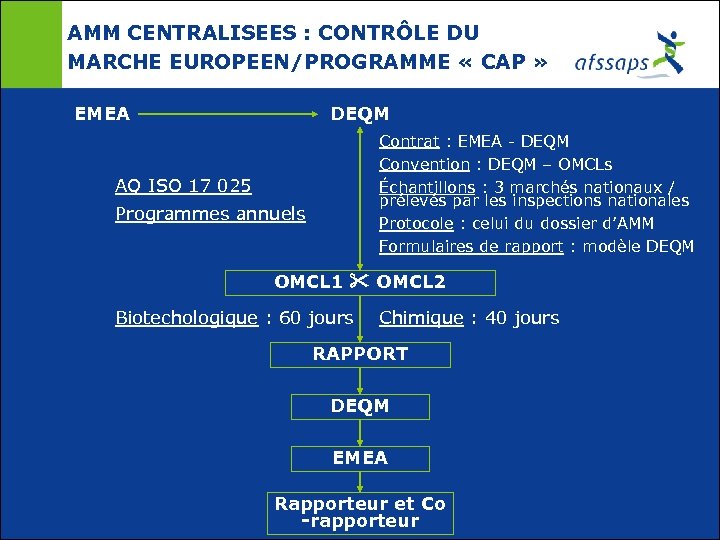
AMM CENTRALISEES : CONTRÔLE DU MARCHE EUROPEEN/PROGRAMME « CAP » EMEA DEQM Contrat : EMEA - DEQM Convention : DEQM – OMCLs Échantillons : 3 marchés nationaux / prélevés par les inspections nationales Protocole : celui du dossier d’AMM Formulaires de rapport : modèle DEQM AQ ISO 17 025 Programmes annuels OMCL 1 OMCL 2 Biotechologique : 60 jours Chimique : 40 jours RAPPORT DEQM EMEA Rapporteur et Co -rapporteur

LES CONTROLES DES GENERIQUES PAR LES LABORATOIRES DE L’AFSSAPS

DLC : COMPLEMENTARITE : EVALUATION – INSPECTION – CONTROLE : EXEMPLE DES GENERIQUES ¢ EVALUATION ETABLISSEMENT DES REPERTOIRES DES GENERIQUES ¢ INSPECTION CONTRÔLES B. P. F. DES GENERIQUES ¢ CONTRÔLE GENERIQUES INSCRITS AUX REPERTOIRES - IDENTIFICATION / DOSAGE DU PRINCIPE ACTIF - QUALITE MICROBIOLOGIQUE - TESTS PHYSICO-CHIMIQUES ET BIOLOGIQUES EN FONCTION DE LA FORME PHARMACEUTIQUE

LES GENERIQUES LES CONTROLES EN LABORATOIRE ¢ ¢ ¢ ¢ 1 GROUPE GENERIQUE LA REFERENCE ET SES GENERIQUES LES PRODUITS FINIS LE DOSSIER « LE PLUS ACTUALISE » - - UNE SERIE D’ANALYSES AU MEME MOMENT – PAR LES MEMES AGENTS – AVEC LES MEMES EQUIPEMENTS – SUR LES MEMES PARAMETRES - - VISION GLOBALE SUR LA QUALITE DES PRODUITS ET LES DIFFERENCES ENTRE LES PRODUITS - - 2 QUESTIONS : CONFORME OU NON CONFORME ? MEME QUALITE OU PAS ?

BILAN DES CONTRÔLES DES GÉNÉRIQUES PAR L’AFSSAPS (1999 – 2006) 1845 produits (2157 lots) REFERENCES Nombre de Nombre NC spécialités Contrôles systématiques (1999 -2006) Enquête Dissolution (2001 -2003) Contrôles motivés (2000 -2006) 314 17 62 (% NC) 19 (6, 05 %) 0 15 (24, 19 %) GENERIQUES Nombre de spécialités 1136 30 286 Nombre NC Test (% NC) statistique 102 (8, 98 %) 3 (10 %) 44 (15, 38 %) NS NS NS
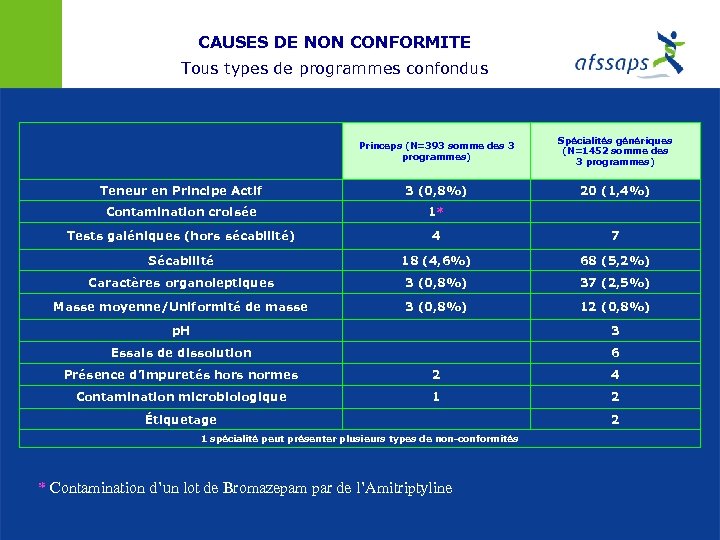
CAUSES DE NON CONFORMITE Tous types de programmes confondus Princeps (N=393 somme des 3 programmes) Spécialités génériques (N=1452 somme des 3 programmes) Teneur en Principe Actif 3 (0, 8%) 20 (1, 4%) Contamination croisée 1* Tests galéniques (hors sécabilité) 4 7 Sécabilité 18 (4, 6%) 68 (5, 2%) Caractères organoleptiques 3 (0, 8%) 37 (2, 5%) Masse moyenne/Uniformité de masse 3 (0, 8%) 12 (0, 8%) p. H 3 Essais de dissolution 6 Présence d’impuretés hors normes 2 4 Contamination microbiologique 1 2 Étiquetage 2 1 spécialité peut présenter plusieurs types de non-conformités * Contamination d’un lot de Bromazepam par de l’Amitriptyline

ACTIONS ENTREPRISES PAR L’ Afssaps Suivi des réunions non-conformités inter-directions Inspections 20 Retraits de lots 11 Modifications de méthode /dossier/fabrication 78 Re-contrôles, contrôles d’autres lots/spécialités 29 Modifications de conditionnement 4 Modifications de formule 2 Arrêts de fabrication 3 Informations Inspection Etrangère 3 En cours 17 167 Actions menées pour un total de 1845 spécialités analysées, soit en moyenne 1 action pour 11 produits contrôlés

LES MEDICAMENTS ANTIRETROVIRAUX

Contrôle des ARV en France et en Europe: ¢ ARV: Médicaments en procédure européenne (CAP): ¢Evaluation centralisée par l’EMEA ¢Inspections coordonnées par l’EMEA ¢Contrôles en laboratoire coordonnés par l’EDQM CONTROLES EN LABORATOIRE - prélèvements dans différents pays européens (3/4 lots) - répartis entre laboratoires compétents du réseau - sur la base des dossiers d’AMM et monogr. PE - suivi coordonné par l’EDQM / EMEA 1999 -2006: 22 ARV contrôlés dont 6 par l’AFSSAPS

ARV principes actifs: Monographies de référence ¢ PHARMACOPEE EUROPEENNE: Monographies principes actifs: Didanosine (CRS + Imp. identif) Indinavir (CRS + Imp. identif) Lamivudine (CRS + Imp. identif) Névirapine (CRS + Imp. identif)) Ritonavir (CRS + Imp. identif) Stavudine (CRS + Imp. identif) Zidovudine (CRS + Imp. identif) Saquinavir (en cours)
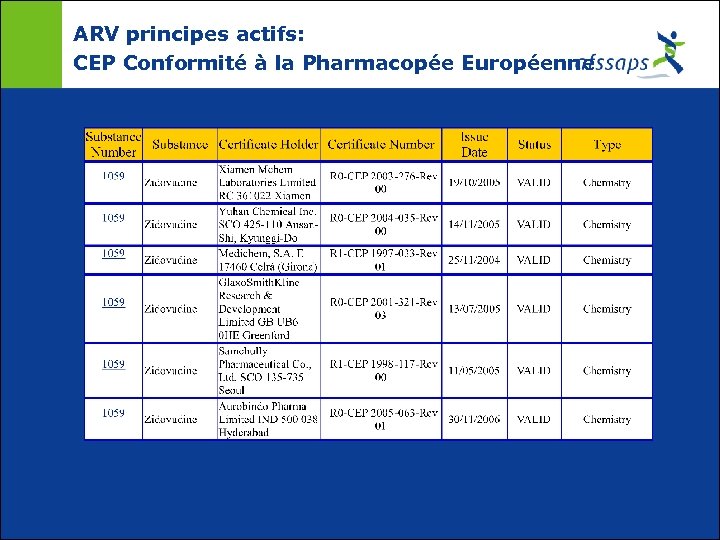
ARV principes actifs: CEP Conformité à la Pharmacopée Européenne

Médicaments ARV : Monographies de référence ¢ Pharmacopée Internationale http: //www. who. int/medicines/publications/pharmacopoeia Abacavir tablets Didanosine oral powder, liquid for oral use, tablets Lamivudine tablets Stavudine capsules Zidovudine capsules, IV infusion, Zidovudine & Lamivudine tablets Zidovudine, Lamivudine & Abacavir tablets

Médicaments ARV : Pré-qualification OMS ¢ Programme de préqualification OMS http: //www. who. int/prequal - Evaluation des dossiers - Inspections des sites de production (rapports publics) - Contrôles de qualité en laboratoire à la demande de l’OMS Préqualification des produits: médicaments / producteur Sept. 2007: 43 médicaments préqualifiés

Médicaments ARV : Qualification et dosage des PA - Contrefaçons ¢ Expertise spécifique de la DLC - Bibliothèque de principes actifs: 22 ARV - Développement et validation de 2 méthodes complémentaires d’identification et de dosage des ARV (HPLC UV) - Contrôle de 111 médicaments ARV (origine Asie et Afrique) en collaboration avec l’OMS - Possibilité d’identification de produits inconnus par HPLC/MS/MS

Médicaments ARV : Qualification et dosage des PA - Contrefaçons ¢ Bibliothèque de principes actifs: 22 ARV Abacavir, amdoxovir, amprenavir, atazanavir, didanosine, efavirenz, emfuvirtide, emtricitabine, fosamprenavir, indinavir, lamivudine, lopinavir, nelfinavir, nevirapine anhydrous, nevirapine hemihydrate, ritonavir, saquinavir, stavudine, tenofovir, tripanavir, zalcitabine, zidovudine

Médicaments ARV : Qualification et dosage des PA - Contrefaçons ¢ Méthode de contrôle Contrefaçons Mise au point par les laboratoires de l’AFSSAPS Deux méthodes complémentaires permettant: - l’identification des principes actifs ARV - le dosage des ARV dans le produit fini - Applicable pour la détermination et le dosage de 19 ARV: - 8 nucléosides inhibiteurs de la réverse transcriptase - 11 non-nucléosides IRT ou inhibiteurs de protéase - Appliquée au contrôle de 111 produits différents (coll. OMS)

Les médicaments anti-rétroviraux H. Rebiere et al, J. Chromatog. B, 850 (2007) 376 -383.
Les médicaments anti-rétroviraux
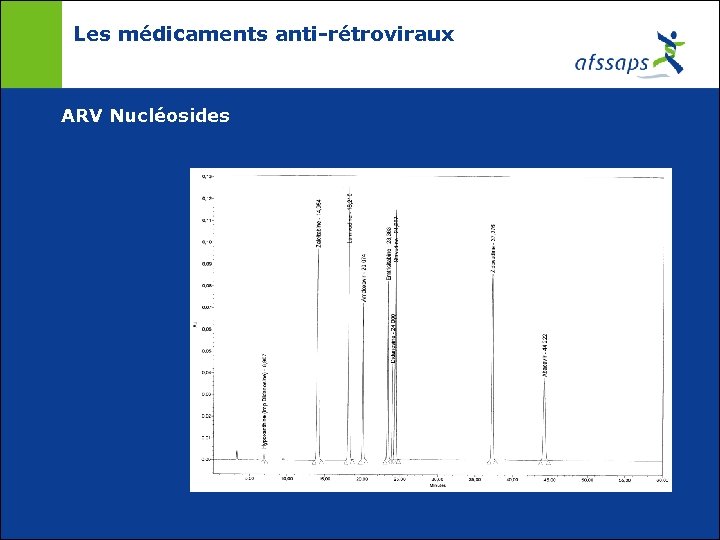
Les médicaments anti-rétroviraux ARV Nucléosides
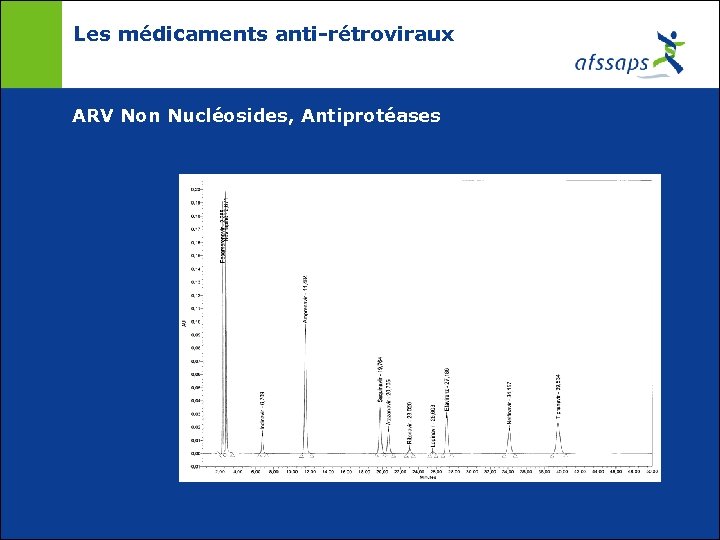
Les médicaments anti-rétroviraux ARV Non Nucléosides, Antiprotéases

Exemple: Ginovir GINOVIR : (Echantillon pris sur le marché africain) Producteur : SELCHI Pharmaceuticals, Namibie Formule : Zidovudine 200 mg Lamivudine 150 mg Indinavir 40 mg Contrôles AFSSAPS: Zidovudine 201 mg Stavudine 40 mg

Retrait international des lots de VIRACEPT ¢ VIRACEPT: Nelfinavir mésilate Comprimés 250 mg, poudre orale P. E. : Monographie sur les mésilates: La méthode de production doit être évaluée de façon à déterminer le potentiel de formation de mésilates d’alkyles… Si nécessaire, la méthode de production est validée pour démontrer que les mésylates d’alkyles ne sont pas détectables dans le produit final. ►PRODUCCIÓN Se debe evaluar el método de producción para determinar la posibilidad de formación de mesilatos de alquilo, que es particularmente probable cuando el medio de reacción contiene alcoholes inferiores. Si es necesario, el método de producción se valida para demostrar que los mesilatos de alquilo no son detectables en el producto final.

Retrait international des lots de VIRACEPT ¢ VIRACEPT: Nelfinavir mésilate ¢ Problème: détermination dans le produit fini des taux d’EMS et MMS (méthane sulfonates) Juin 2007: Mise au point et validation d’une méthode de dosage indépendamment par Lab. ROCHE et par DLC/AFSSAPS DLC: Méthode sur la base d’une méthode mise au point sur différentes matières premières. Difficulté d’adaptation au PF (pb d’extraction et de spécificité) - Extraction liquide (Acétate d’éthyle) + filtration - Analyse par GC/MS: validation entre 5 et 1500 ppm Présence dans plusieurs lots d’EMS à taux entre 10 et 1000 ppm

Médicaments Anticancéreux: Grande diversité des médicaments de cette classe thérapeutique ATC code LO…. Médicaments chimiques et/ou biologiques Alkylants, antimétabolites, agents du fuseau, inhibiteurs des topoisomérases, hormones, anti-hormones, Anticorps monoclonaux, cytokines… - Procédures nationales, MRP, CAP - Princeps et Génériques - Pas de préqualification OMS

Médicaments Anticancéreux: Enquête spécifique menée par les laboratoires de contrôle de l’AFSSAPS dans le cadre du plan CANCER Contrôle de 42 spécialités issues de 9 groupes différents: Carboplatine, Cisplatine, Oxaliplatine, Doxorubicine, Pinarubicine, Daunorubicine, Gemcitabine, Etoposide… - Contrôles spécifiques (dosages, impuretés. . ) - Médicaments toxiques CMR: - Conditions spécifiques de manipulation et de traitement…

Merci de votre attention !
bc077086e0da49a812ef928fbcb3a92b.ppt