 Cоциальная роль водородных связей Выполнила Ярмощук Женя 11 Г
Cоциальная роль водородных связей Выполнила Ярмощук Женя 11 Г
 Водородная связь форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. водородная связь рассматривает роль водорода, водородных связей и их нелокальности в решении (в контексте модели горячей Земли) таких задач как: физика землетрясений и вулканизма, физика образования месторождений алмазов и углеводородов.
Водородная связь форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. водородная связь рассматривает роль водорода, водородных связей и их нелокальности в решении (в контексте модели горячей Земли) таких задач как: физика землетрясений и вулканизма, физика образования месторождений алмазов и углеводородов.
 История В книге The Nature of Chemical Bond and the Structure of Molecules and Crystals Лайнуса Полинга, впервые изданной в 1939 году, первое упоминание водородной связи приписывается Муру и Винмиллу
История В книге The Nature of Chemical Bond and the Structure of Molecules and Crystals Лайнуса Полинга, впервые изданной в 1939 году, первое упоминание водородной связи приписывается Муру и Винмиллу
 Свойства Энергия водородной связи значительно меньше энергии обычной ковалентной связи Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак. Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях
Свойства Энергия водородной связи значительно меньше энергии обычной ковалентной связи Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак. Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях
 Свойства Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры). Прочность водородной связи (энтальпияобразование комплекса) зависит от полярности комплекса и колеблется от ~ 6 к. Дж/моль для комплексов молекул галогеноводородов с инертными газами до 160 к. Дж/моль для ион-молекулярных комплексов (AHB)±; так, для комплекса (H 2 O • H • OH 2)+ образованного H 2 O и H 3 O+ — 132 к. Дж/моль в газовой фазе.
Свойства Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры). Прочность водородной связи (энтальпияобразование комплекса) зависит от полярности комплекса и колеблется от ~ 6 к. Дж/моль для комплексов молекул галогеноводородов с инертными газами до 160 к. Дж/моль для ион-молекулярных комплексов (AHB)±; так, для комплекса (H 2 O • H • OH 2)+ образованного H 2 O и H 3 O+ — 132 к. Дж/моль в газовой фазе.
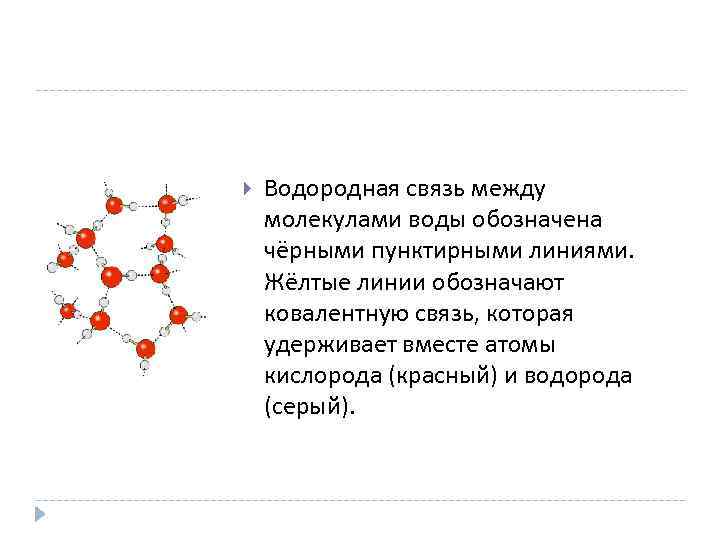 Водородная связь между молекулами воды обозначена чёрными пунктирными линиями. Жёлтые линии обозначают ковалентную связь, которая удерживает вместе атомы кислорода (красный) и водорода (серый).
Водородная связь между молекулами воды обозначена чёрными пунктирными линиями. Жёлтые линии обозначают ковалентную связь, которая удерживает вместе атомы кислорода (красный) и водорода (серый).
 Механизм Гротгуса Аномально высокая теплоёмкость воды, а также теплопроводность многоатомных спиртов обеспечивается многочисленными водородными связями. Одна молекула воды может образовать до четырёх классических водородных связей с соседями (с учётом бифуркатных H-связей до 5— 6). Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Водородные связи ответственны за многие другие уникальные свойства воды
Механизм Гротгуса Аномально высокая теплоёмкость воды, а также теплопроводность многоатомных спиртов обеспечивается многочисленными водородными связями. Одна молекула воды может образовать до четырёх классических водородных связей с соседями (с учётом бифуркатных H-связей до 5— 6). Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Водородные связи ответственны за многие другие уникальные свойства воды