ПрезентацияСравнительная характеристика веществ.ppt
- Количество слайдов: 22
 Cl 2 NO 2 СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ВЕЩЕСТВ
Cl 2 NO 2 СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ВЕЩЕСТВ
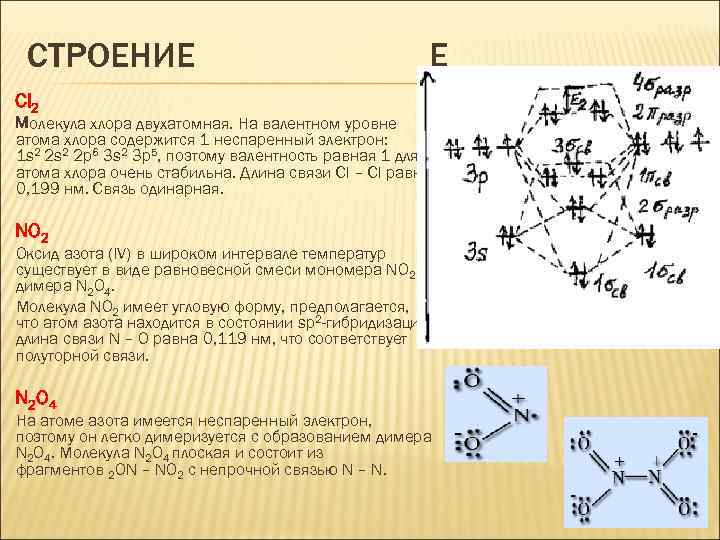 СТРОЕНИЕ E Cl 2 Молекула хлора двухатомная. На валентном уровне атома хлора содержится 1 неспаренный электрон: 1 s 2 2 p 6 3 s 2 3 p 5, поэтому валентность равная 1 для атома хлора очень стабильна. Длина связи Cl – Cl равна 0, 199 нм. Связь одинарная. NO 2 Оксид азота (IV) в широком интервале температур существует в виде равновесной смеси мономера NO 2 и димера N 2 O 4. Молекула NO 2 имеет угловую форму, предполагается, что атом азота находится в состоянии sp 2 -гибридизации, длина связи N – O равна 0, 119 нм, что соответствует полуторной связи. N 2 O 4 На атоме азота имеется неспаренный электрон, поэтому он легко димеризуется с образованием димера N 2 O 4. Молекула N 2 O 4 плоская и состоит из фрагментов 2 ON – NO 2 c непрочной связью N – N.
СТРОЕНИЕ E Cl 2 Молекула хлора двухатомная. На валентном уровне атома хлора содержится 1 неспаренный электрон: 1 s 2 2 p 6 3 s 2 3 p 5, поэтому валентность равная 1 для атома хлора очень стабильна. Длина связи Cl – Cl равна 0, 199 нм. Связь одинарная. NO 2 Оксид азота (IV) в широком интервале температур существует в виде равновесной смеси мономера NO 2 и димера N 2 O 4. Молекула NO 2 имеет угловую форму, предполагается, что атом азота находится в состоянии sp 2 -гибридизации, длина связи N – O равна 0, 119 нм, что соответствует полуторной связи. N 2 O 4 На атоме азота имеется неспаренный электрон, поэтому он легко димеризуется с образованием димера N 2 O 4. Молекула N 2 O 4 плоская и состоит из фрагментов 2 ON – NO 2 c непрочной связью N – N.
 СПОСОБЫ ПОЛУЧЕНИЯ ПРОМЫШЛЕННЫЙ СПОСОБ Cl 2 Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой: Mn. O 2 + 4 HCl → Mn. Cl 2 + Cl 2↑ + 2 H 2 O В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. 4 HCl + O 2 → 2 H 2 O + 2 Cl 2
СПОСОБЫ ПОЛУЧЕНИЯ ПРОМЫШЛЕННЫЙ СПОСОБ Cl 2 Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой: Mn. O 2 + 4 HCl → Mn. Cl 2 + Cl 2↑ + 2 H 2 O В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. 4 HCl + O 2 → 2 H 2 O + 2 Cl 2
 СПОСОБЫ ПОЛУЧЕНИЯ Особо чистый хлор получают нагреванием хлорида золота Реакция термического разложения хлорида золота(III): 2 Au. Cl 3 0 t C 2 Au + 3 Cl 2 CL 2
СПОСОБЫ ПОЛУЧЕНИЯ Особо чистый хлор получают нагреванием хлорида золота Реакция термического разложения хлорида золота(III): 2 Au. Cl 3 0 t C 2 Au + 3 Cl 2 CL 2
 СПОСОБЫ ПОЛУЧЕНИЯ CL 2 Применяется три варианта электрохимического метода получения хлора. Два из них электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути. Диафрагменный метод с твёрдым катодом Полость электролизера разделена пористой асбестовой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом. В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита (раствора Na. Cl). В результате электрохимического процесса на аноде за счёт разложения галита выделяется хлор, а на катоде за счёт разложения воды — водород. При этом прикатодная зона обогащается гидроксидом натрия. Мембранный метод с твёрдым катодом Мембранный метод по сути, аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной полимерной мембраной. Мембранный метод производства эффективнее, чем диафрагменный, но сложнее в применении. Ртутный метод с жидким катодом Процесс проводят в электролитической ванне, которая состоит из электролизера, разлагателя и ртутного насоса, объединённых между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизёра служит поток ртути. Аноды — графитовые или малоизнашивающиеся. Вместе с ртутью через электролизёр непрерывно течет поток анолита — раствора хлорида натрия. В результате электрохимического разложения хлорида на аноде образуются молекулы хлора, а на катоде выделившийся натрий растворяется в ртути образуя амальгаму.
СПОСОБЫ ПОЛУЧЕНИЯ CL 2 Применяется три варианта электрохимического метода получения хлора. Два из них электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути. Диафрагменный метод с твёрдым катодом Полость электролизера разделена пористой асбестовой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом. В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита (раствора Na. Cl). В результате электрохимического процесса на аноде за счёт разложения галита выделяется хлор, а на катоде за счёт разложения воды — водород. При этом прикатодная зона обогащается гидроксидом натрия. Мембранный метод с твёрдым катодом Мембранный метод по сути, аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной полимерной мембраной. Мембранный метод производства эффективнее, чем диафрагменный, но сложнее в применении. Ртутный метод с жидким катодом Процесс проводят в электролитической ванне, которая состоит из электролизера, разлагателя и ртутного насоса, объединённых между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизёра служит поток ртути. Аноды — графитовые или малоизнашивающиеся. Вместе с ртутью через электролизёр непрерывно течет поток анолита — раствора хлорида натрия. В результате электрохимического разложения хлорида на аноде образуются молекулы хлора, а на катоде выделившийся натрий растворяется в ртути образуя амальгаму.
 СПОСОБЫ ПОЛУЧЕНИЯ ПРОМЫШЛЕННЫЙ СПОСОБ Cl 2 Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли: 2 Na. Cl + 2 H 2 О → H 2↑ + Cl 2↑ + 2 Na. OH Анод: 2 Cl− — 2 е− → Cl 20↑ Катод: 2 H 2 O + 2 e− → H 2↑ + 2 OH− Так как параллельно электролизу хлорида натрия проходит процесс электролиз воды, то суммарное уравнение можно выразить следующим образом: 1, 80 Na. Cl + 0, 50 H 2 O → 1, 00 Cl 2↑ + 1, 10 Na. OH + 0, 03 H 2↑ NO 2 В промышленности окисление оксида азота (II) кислородом: 2 NO + O 2 = 2 NO 2, реакция является обратимой.
СПОСОБЫ ПОЛУЧЕНИЯ ПРОМЫШЛЕННЫЙ СПОСОБ Cl 2 Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли: 2 Na. Cl + 2 H 2 О → H 2↑ + Cl 2↑ + 2 Na. OH Анод: 2 Cl− — 2 е− → Cl 20↑ Катод: 2 H 2 O + 2 e− → H 2↑ + 2 OH− Так как параллельно электролизу хлорида натрия проходит процесс электролиз воды, то суммарное уравнение можно выразить следующим образом: 1, 80 Na. Cl + 0, 50 H 2 O → 1, 00 Cl 2↑ + 1, 10 Na. OH + 0, 03 H 2↑ NO 2 В промышленности окисление оксида азота (II) кислородом: 2 NO + O 2 = 2 NO 2, реакция является обратимой.
 СПОСОБЫ ПОЛУЧЕНИЯ ЛАБОРАТОРНЫЕ МЕТОДЫ Cl 2 Для получения хлора в небольших количествах обычно используются процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия, диоксидом свинца, бертолетовой солью и т. п. ), обычно используется диоксид марганца или перманганат калия NO 2 2 KMn. O 4 + 16 HCl → 2 KCl + 2 Mn. Cl 2 + 5 Cl 2↑ +8 H 2 O Mn. O 2 + 4 HCl → Mn. Cl 2 + Cl 2↑ +2 H 2 O K 2 Cr 2 O 7 + 14 HCl → 3 Cl 2 + 2 KCl + 2 Cr. Cl 3 + 7 H 2 O В лаборатории образуется при взаимодействии меди с горячей концентрированной азотной кислотой: Cu + 4 HNO 3 = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O; Также его можно получить термическим разложением нитрата свинца, однако при проведении реакции следует соблюдать осторожностьтермическом разложении высушенных нитратов тяжелых металлов: 2 Pb(NO 3)2 = 2 Pb. O + 4 NO 2 + O 2
СПОСОБЫ ПОЛУЧЕНИЯ ЛАБОРАТОРНЫЕ МЕТОДЫ Cl 2 Для получения хлора в небольших количествах обычно используются процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия, диоксидом свинца, бертолетовой солью и т. п. ), обычно используется диоксид марганца или перманганат калия NO 2 2 KMn. O 4 + 16 HCl → 2 KCl + 2 Mn. Cl 2 + 5 Cl 2↑ +8 H 2 O Mn. O 2 + 4 HCl → Mn. Cl 2 + Cl 2↑ +2 H 2 O K 2 Cr 2 O 7 + 14 HCl → 3 Cl 2 + 2 KCl + 2 Cr. Cl 3 + 7 H 2 O В лаборатории образуется при взаимодействии меди с горячей концентрированной азотной кислотой: Cu + 4 HNO 3 = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O; Также его можно получить термическим разложением нитрата свинца, однако при проведении реакции следует соблюдать осторожностьтермическом разложении высушенных нитратов тяжелых металлов: 2 Pb(NO 3)2 = 2 Pb. O + 4 NO 2 + O 2
 ФИЗИЧЕСКИЕ СВОЙСТВА ПРИ 25 °С Хлор Cl 2 ядовитый газ желтовато-зелёного цвета, с резким запахом. Оксид азота (IV) NO 2 бурый газ, с резким удушливым запахом, ядовит, N 2 O 4 – бесцветен. В обычном состоянии NO 2 существует в равновесии со своим димером N 2 O 4. Склонность к его образованию объясняется наличием в молекуле NO 2 неспаренного электрона.
ФИЗИЧЕСКИЕ СВОЙСТВА ПРИ 25 °С Хлор Cl 2 ядовитый газ желтовато-зелёного цвета, с резким запахом. Оксид азота (IV) NO 2 бурый газ, с резким удушливым запахом, ядовит, N 2 O 4 – бесцветен. В обычном состоянии NO 2 существует в равновесии со своим димером N 2 O 4. Склонность к его образованию объясняется наличием в молекуле NO 2 неспаренного электрона.
 ФИЗИЧЕСКИЕ СВОЙСТВА Cl 2 Газообразный хлор - жёлто-зелёный. Сжижается под давлением около 6 атм. Жидкий хлор кипит при — 34°С и затвердевает при— 101° С, имеет темно-желтый (жёлтозелёный) цвет. Интенсивность окраски падает с понижением температуры. По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хуже серебра NO 2 Твердый оксид азота (IV) бесцветен и состоит только из молекул N 2 O 4. Газообразный оксид азота (IV) (диоксид азота) NO 2 имеет красно-бурый цвет, в жидкий состоянии – желтоватого цвета. При температуре 140°C диоксид азота состоит только из молекул NO 2, он очень тёмного, почти чёрного цвета. В точке кипения NO 2 представляет собой желтоватую жидкость, содержащую около 0, 1 % NO 2. При температуре ниже 21°С — это бесцветная жидкость (или желтоватая из-за примеси мономера). При температуре ниже − 12 °C белые кристаллы состоят только из молекул N 2 O 4. При нагревании до температуры плавления -12, 8 °С появляется бурая окраска, которая усиливается при повышении температуры и увеличения доли мономера в смеси.
ФИЗИЧЕСКИЕ СВОЙСТВА Cl 2 Газообразный хлор - жёлто-зелёный. Сжижается под давлением около 6 атм. Жидкий хлор кипит при — 34°С и затвердевает при— 101° С, имеет темно-желтый (жёлтозелёный) цвет. Интенсивность окраски падает с понижением температуры. По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хуже серебра NO 2 Твердый оксид азота (IV) бесцветен и состоит только из молекул N 2 O 4. Газообразный оксид азота (IV) (диоксид азота) NO 2 имеет красно-бурый цвет, в жидкий состоянии – желтоватого цвета. При температуре 140°C диоксид азота состоит только из молекул NO 2, он очень тёмного, почти чёрного цвета. В точке кипения NO 2 представляет собой желтоватую жидкость, содержащую около 0, 1 % NO 2. При температуре ниже 21°С — это бесцветная жидкость (или желтоватая из-за примеси мономера). При температуре ниже − 12 °C белые кристаллы состоят только из молекул N 2 O 4. При нагревании до температуры плавления -12, 8 °С появляется бурая окраска, которая усиливается при повышении температуры и увеличения доли мономера в смеси.
 ОБМЕННЫЕ РЕАКЦИИ С ВОДОЙ Cl 2 растворим преимущественно в неполярных растворителях, No 2 - в полярных Растворитель Растворимость Cl 2 г/100 г Бензол Растворим Вода (25 °C) 0, 65 Тетрахлорметан (19 °C) 17, 61 Хлороформ Хорошо растворим Cl 2 и No 2 взаимодействуют с водой:
ОБМЕННЫЕ РЕАКЦИИ С ВОДОЙ Cl 2 растворим преимущественно в неполярных растворителях, No 2 - в полярных Растворитель Растворимость Cl 2 г/100 г Бензол Растворим Вода (25 °C) 0, 65 Тетрахлорметан (19 °C) 17, 61 Хлороформ Хорошо растворим Cl 2 и No 2 взаимодействуют с водой:
 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Термический распад Cl 2 Степень диссоциации молекулы хлора Cl 2 → 2 Cl при 1000 К равна 2, 07· 10− 4%, а при 2500 К — 0, 909 %. NO 2
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Термический распад Cl 2 Степень диссоциации молекулы хлора Cl 2 → 2 Cl при 1000 К равна 2, 07· 10− 4%, а при 2500 К — 0, 909 %. NO 2
 ХИМИЧЕСКИЕ СВОЙСТВА ОБМЕННЫЕ РЕАКЦИИ Взаимодействие с растворами и расплавами щелочей Взаимодействие с растворами и расплавами солей
ХИМИЧЕСКИЕ СВОЙСТВА ОБМЕННЫЕ РЕАКЦИИ Взаимодействие с растворами и расплавами щелочей Взаимодействие с растворами и расплавами солей
 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Диспропорционирование Cl 2 NO 2
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Диспропорционирование Cl 2 NO 2
 ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА НЕМЕТАЛЛЫ Взаимодействие с простыми веществами Cl 2 NO 2
ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА НЕМЕТАЛЛЫ Взаимодействие с простыми веществами Cl 2 NO 2
 ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА Взаимодействие с простыми веществами Cl 2 NO 2 МЕТАЛЛЫ
ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА Взаимодействие с простыми веществами Cl 2 NO 2 МЕТАЛЛЫ
 ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА Взаимодействие со сложными веществами Cl 2 NO 2
ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА Взаимодействие со сложными веществами Cl 2 NO 2
 ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА Взаимодействие с простыми и сложными веществами. - единственная реакция Cl 2 с простым окислителем 2 NO 2+ Cl 2=2 NO 2 Cl не уверен
ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА Взаимодействие с простыми и сложными веществами. - единственная реакция Cl 2 с простым окислителем 2 NO 2+ Cl 2=2 NO 2 Cl не уверен
 ТЕХНИКА РАБОТЫ И УСЛОВИЯ ОБРАЩЕНИЯ С ВЕЩЕСТВОМ Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0, 006 мг/л (т. е. в два раза выше порога восприятия запаха хлора). При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором Na 2 SO 3 или Na 2 S 2 O 3. В качестве первой помощи при острых отравлениях хлором применяется вдыхание паров спирта с эфиром или нашатырного спирта. Признаки отравления хлором: резкая боль в груди, сухой кашель, рвота, резь в глазах, слезотечение, нарушение координации движений. Средства индивидуальной защиты: противогазы всех типов, марлевая повязка, смоченная водой или 2% раствором соды (1 чайная ложка на стакан воды). Антихлор: Na 2 S 2 O 3
ТЕХНИКА РАБОТЫ И УСЛОВИЯ ОБРАЩЕНИЯ С ВЕЩЕСТВОМ Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0, 006 мг/л (т. е. в два раза выше порога восприятия запаха хлора). При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором Na 2 SO 3 или Na 2 S 2 O 3. В качестве первой помощи при острых отравлениях хлором применяется вдыхание паров спирта с эфиром или нашатырного спирта. Признаки отравления хлором: резкая боль в груди, сухой кашель, рвота, резь в глазах, слезотечение, нарушение координации движений. Средства индивидуальной защиты: противогазы всех типов, марлевая повязка, смоченная водой или 2% раствором соды (1 чайная ложка на стакан воды). Антихлор: Na 2 S 2 O 3
 ТЕХНИКА РАБОТЫ И УСЛОВИЯ ОБРАЩЕНИЯ С ВЕЩЕСТВОМ Оксиды азота, улетучивающиеся в атмосферу, представляют серьёзную опасность для экологической ситуации, так как способны вызывать кислотные дожди, разрушают озоновый слой, а также сами по себе являются токсичными веществами, вызывающими раздражение слизистых оболочек. Двуокись азота воздействует в основном на дыхательные пути и легкие, а также вызывает изменения состава крови, в частности, уменьшает содержание в крови гемоглобина. Воздействие на организм человека диоксида азота снижает сопротивляемость к заболеваниям, вызывает кислородное голодание тканей, особенно у детей. Усиливает действие канцерогенных веществ, способствуя возникновению злокачественных новообразований. Образующаяся в результате взаимодействия диоксида азота с водой азотная кислота является сильным коррозионным агентом. мономерной формы.
ТЕХНИКА РАБОТЫ И УСЛОВИЯ ОБРАЩЕНИЯ С ВЕЩЕСТВОМ Оксиды азота, улетучивающиеся в атмосферу, представляют серьёзную опасность для экологической ситуации, так как способны вызывать кислотные дожди, разрушают озоновый слой, а также сами по себе являются токсичными веществами, вызывающими раздражение слизистых оболочек. Двуокись азота воздействует в основном на дыхательные пути и легкие, а также вызывает изменения состава крови, в частности, уменьшает содержание в крови гемоглобина. Воздействие на организм человека диоксида азота снижает сопротивляемость к заболеваниям, вызывает кислородное голодание тканей, особенно у детей. Усиливает действие канцерогенных веществ, способствуя возникновению злокачественных новообразований. Образующаяся в результате взаимодействия диоксида азота с водой азотная кислота является сильным коррозионным агентом. мономерной формы.
 УСЛОВИЯ ХРАНЕНИЯ И ТРАНСПОРТИРОВКИ ВЕЩЕСТВА Производимый хлор хранится в специальных «танках» или закачивается в стальные баллоны высокого давления. Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота. Образующаяся в результате взаимодействия диоксида азота с водой азотная кислота является сильным коррозионным агентом. Железо и алюминий пассивируют концентрированную азотную кислоту, следовательно, ее можно хранить и перевозить в цистернах и других емкостях из этих металлов.
УСЛОВИЯ ХРАНЕНИЯ И ТРАНСПОРТИРОВКИ ВЕЩЕСТВА Производимый хлор хранится в специальных «танках» или закачивается в стальные баллоны высокого давления. Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота. Образующаяся в результате взаимодействия диоксида азота с водой азотная кислота является сильным коррозионным агентом. Железо и алюминий пассивируют концентрированную азотную кислоту, следовательно, ее можно хранить и перевозить в цистернах и других емкостях из этих металлов.
 ПРИМЕНЕНИЕ CI 2 Хлор применяют во многих отраслях промышленности, науки и бытовых нужд: В производстве поливинилхлорида, пластиков, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы. Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1, 2 -дихлорэтан. Отбеливающие свойства хлора известны с давних времен. Этот способ отбеливания тканей, бумаги, картона используется уже несколько веков. Производство хлорорганических инсектицидов. На получение средств защиты растений расходуется значительная часть производимого хлора. Один из самых важных инсектицидов — гексахлорциклогексан (часто называемый гексахлораном). Использовался как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт, фосген.
ПРИМЕНЕНИЕ CI 2 Хлор применяют во многих отраслях промышленности, науки и бытовых нужд: В производстве поливинилхлорида, пластиков, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы. Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1, 2 -дихлорэтан. Отбеливающие свойства хлора известны с давних времен. Этот способ отбеливания тканей, бумаги, картона используется уже несколько веков. Производство хлорорганических инсектицидов. На получение средств защиты растений расходуется значительная часть производимого хлора. Один из самых важных инсектицидов — гексахлорциклогексан (часто называемый гексахлораном). Использовался как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт, фосген.
 ПРИМЕНЕНИЕ NO 2 Хлор также применяется для обеззараживания воды — «хлорирования» . Наиболее распространённый способ обеззараживания питьевой воды; основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов катализирующие окислительновосстановительные процессы. Для обеззараживания питьевой воды применяют: хлор, двуокись хлора, хлорамин и хлорную известь. В пищевой промышленности зарегистрирован в качестве пищевой добавки E 925. В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений. В металлургии для производства чистых металлов: титана, олова, тантала, ниобия. Как индикатор солнечных нейтрино в хлор-аргонных детекторах. NO 2 применяется в производстве серной и азотной кислот, в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах.
ПРИМЕНЕНИЕ NO 2 Хлор также применяется для обеззараживания воды — «хлорирования» . Наиболее распространённый способ обеззараживания питьевой воды; основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов катализирующие окислительновосстановительные процессы. Для обеззараживания питьевой воды применяют: хлор, двуокись хлора, хлорамин и хлорную известь. В пищевой промышленности зарегистрирован в качестве пищевой добавки E 925. В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений. В металлургии для производства чистых металлов: титана, олова, тантала, ниобия. Как индикатор солнечных нейтрино в хлор-аргонных детекторах. NO 2 применяется в производстве серной и азотной кислот, в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах.


