17-Цитохром с оксидаза (19).ppt
- Количество слайдов: 30
 Цитохром с оксидаза Fe и Cu
Цитохром с оксидаза Fe и Cu
 Сукцинат дегидрогеназа Комплекс II FAD 2 Fe=2 S 4 Fe=2 S O 2 Холин NADH FMN 2 Fe=2 S 4 Fe=4 S NADHдегидрогеназа Комплекс I FAD Fe=S Холин дегидрогеназа Комплекс II Убихинон Цит а 3 2 Cu 10 Цитохром соксидаза Комплекс IV Цитохром с Цит в 566 Цит в 561 2 Fe=2 S Цит с1 Участки синтеза АТФ Цитохром средуктаза Комплекс III Схема электронтраспортной цепи
Сукцинат дегидрогеназа Комплекс II FAD 2 Fe=2 S 4 Fe=2 S O 2 Холин NADH FMN 2 Fe=2 S 4 Fe=4 S NADHдегидрогеназа Комплекс I FAD Fe=S Холин дегидрогеназа Комплекс II Убихинон Цит а 3 2 Cu 10 Цитохром соксидаза Комплекс IV Цитохром с Цит в 566 Цит в 561 2 Fe=2 S Цит с1 Участки синтеза АТФ Цитохром средуктаза Комплекс III Схема электронтраспортной цепи

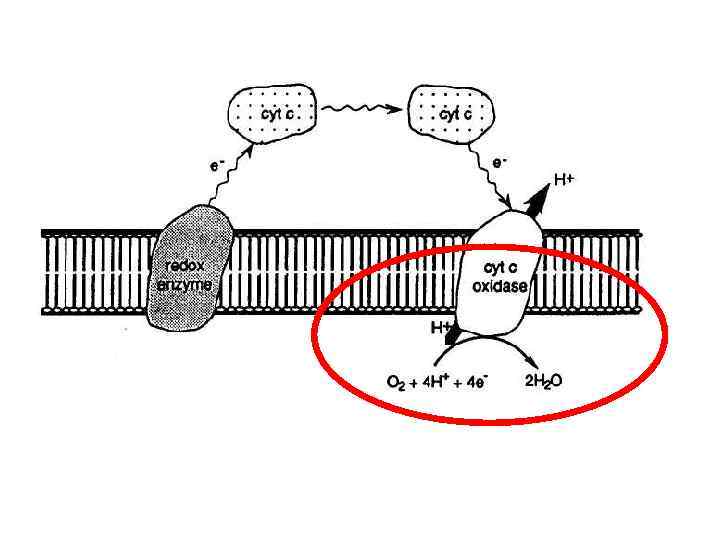
 Цитохром с оксидаза
Цитохром с оксидаза
 Цитохром с оксидаза
Цитохром с оксидаза
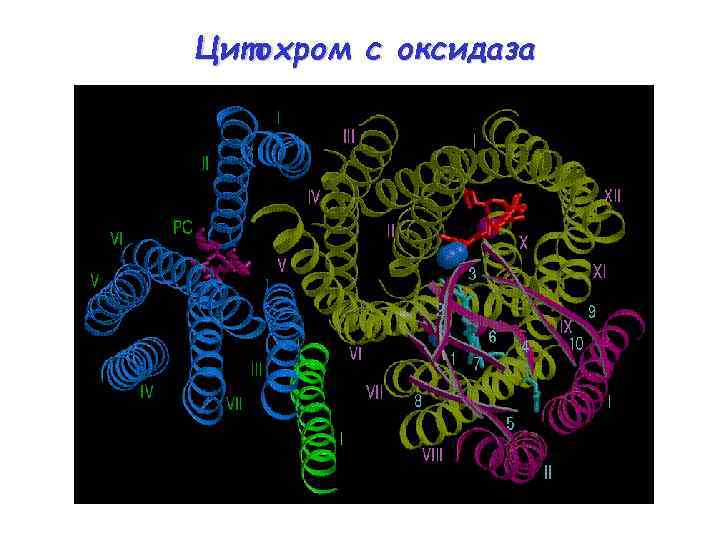
 4 Dred + O 2 + 8 H+in 4 Dox + 2 H 2 O + 4 H+out Содержит от 4 (в бактериях) до 13 (в организме человека) субъединиц Субъединица I содержит низкоспиновый цитохром a и центр, связывающий кислород, который состоит из высокоспинового цитохрома a 3 и центра Cu. B Субъединица II содержит биядерный центр Cu. A, который получает электроны от цитохрома с и передает их на цитохром a и далее на центр, связывающий кислород Субъединица III не содержит металлов, но вместе с субъединицами I и II, образует каталитически активное ядро
4 Dred + O 2 + 8 H+in 4 Dox + 2 H 2 O + 4 H+out Содержит от 4 (в бактериях) до 13 (в организме человека) субъединиц Субъединица I содержит низкоспиновый цитохром a и центр, связывающий кислород, который состоит из высокоспинового цитохрома a 3 и центра Cu. B Субъединица II содержит биядерный центр Cu. A, который получает электроны от цитохрома с и передает их на цитохром a и далее на центр, связывающий кислород Субъединица III не содержит металлов, но вместе с субъединицами I и II, образует каталитически активное ядро
 Субъединица 1 Субъединица I содержит низкоспиновый цитохром a и кислород связывающий центр, который состоит из высокоспинового цитохрома a 3 и центра Cu. B
Субъединица 1 Субъединица I содержит низкоспиновый цитохром a и кислород связывающий центр, который состоит из высокоспинового цитохрома a 3 и центра Cu. B
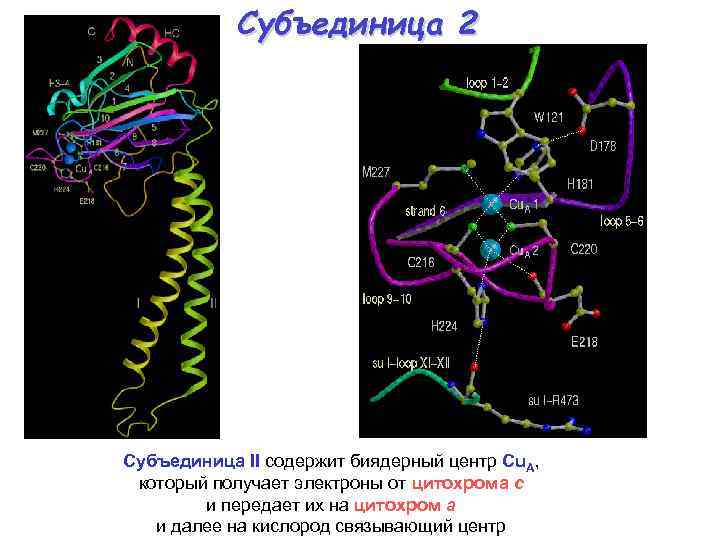 Субъединица 2 Субъединица II содержит биядерный центр Cu. A, который получает электроны от цитохрома с и передает их на цитохром a и далее на кислород связывающий центр
Субъединица 2 Субъединица II содержит биядерный центр Cu. A, который получает электроны от цитохрома с и передает их на цитохром a и далее на кислород связывающий центр
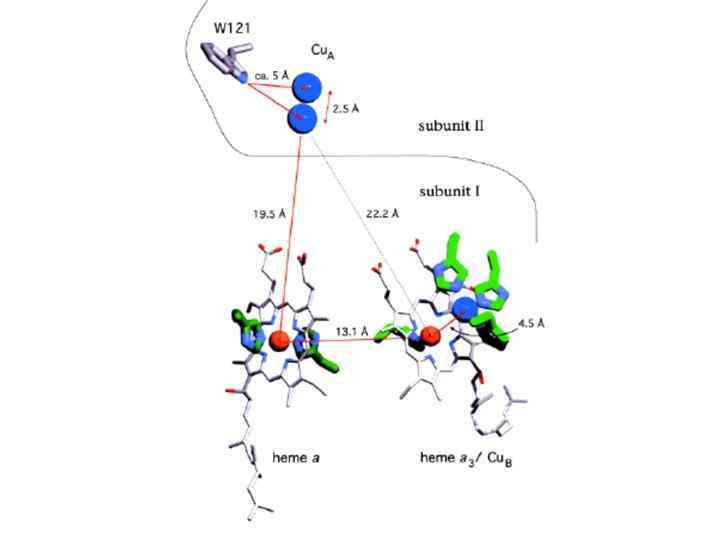
 Центр Cu. А • биядерный • координация: 2 N(His), 1 S(Met), O(амид)(Glu), 2 -S(Cys) Центр Cu. В • координация: 3 N(His) Mg-связывающий центр • роль неясна • координация: N(His), СОО-(Asp), СОО-(Glu), H 2 O Совместный с центром Cu. A
Центр Cu. А • биядерный • координация: 2 N(His), 1 S(Met), O(амид)(Glu), 2 -S(Cys) Центр Cu. В • координация: 3 N(His) Mg-связывающий центр • роль неясна • координация: N(His), СОО-(Asp), СОО-(Glu), H 2 O Совместный с центром Cu. A
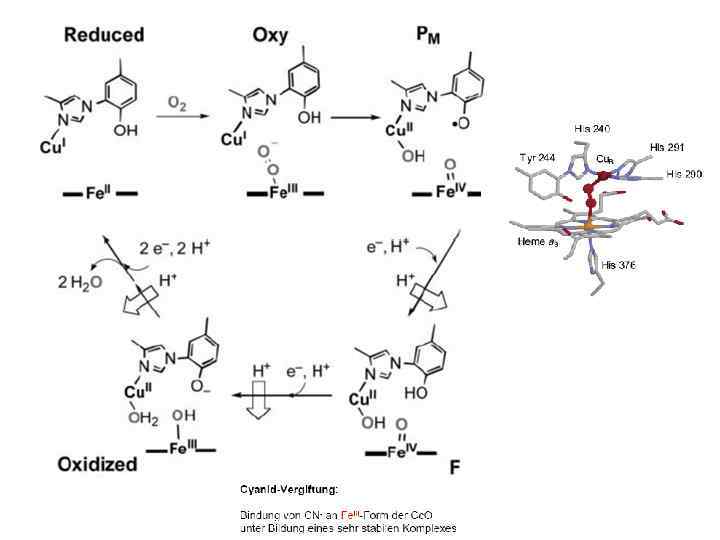
 Низкоспиновый цитохром a: в аксиальной координации 2 N(His) Высокоспиновый цитохром a 3: в аксиальной координации N(His) Цитохром а 3 - Cu. В центр: • как а 3, так и Cu. В имеют вакантные координационные положения для связывания субстрата • Высокоспиновый гем a 3 III (S = 5/2) антиферромагнитно спарен с Cu. BII (S = 1/2), в результате сумарный спин S = 2 • не имеет сигнала ЭПР как в окисленной, так и в восстановленной формах • возможно, что в окисленной форме координированный субстрат принимает участие в передаче обменного взаимодействия между а 3 и Cu. B
Низкоспиновый цитохром a: в аксиальной координации 2 N(His) Высокоспиновый цитохром a 3: в аксиальной координации N(His) Цитохром а 3 - Cu. В центр: • как а 3, так и Cu. В имеют вакантные координационные положения для связывания субстрата • Высокоспиновый гем a 3 III (S = 5/2) антиферромагнитно спарен с Cu. BII (S = 1/2), в результате сумарный спин S = 2 • не имеет сигнала ЭПР как в окисленной, так и в восстановленной формах • возможно, что в окисленной форме координированный субстрат принимает участие в передаче обменного взаимодействия между а 3 и Cu. B
 Центр Cu. A
Центр Cu. A
 Cu. A центр
Cu. A центр
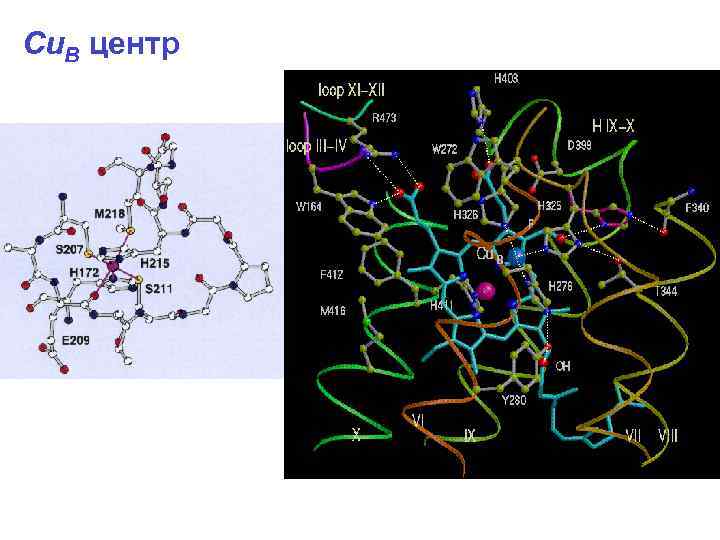 Cu. B центр
Cu. B центр

 Полностью окисленная форма: Cu. AII cyt a. III cyt a 3 III Cu. BII Полностью восстановленная форма: Cu. AI cyt a. II cyt a 3 II Cu. BI 4 Dred + O 2 + 8 H+in 4 Dox + 2 H 2 O + 4 H+out
Полностью окисленная форма: Cu. AII cyt a. III cyt a 3 III Cu. BII Полностью восстановленная форма: Cu. AI cyt a. II cyt a 3 II Cu. BI 4 Dred + O 2 + 8 H+in 4 Dox + 2 H 2 O + 4 H+out
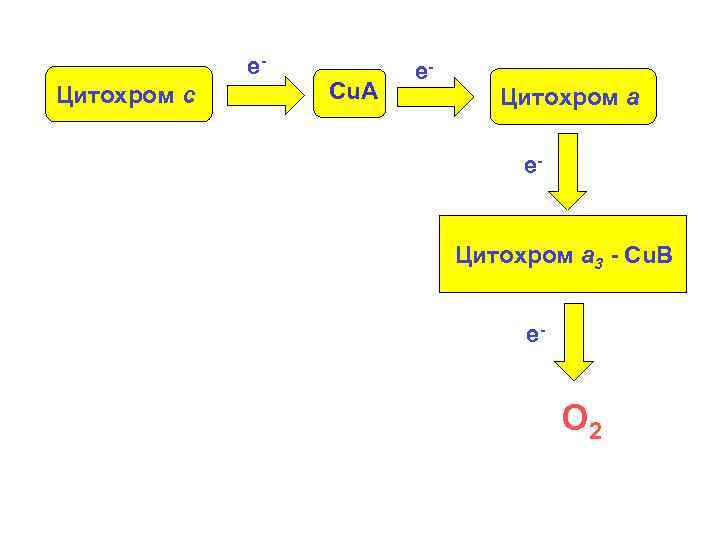 е. Цитохром с Cu. A е- Цитохром а 3 - Cu. B е- O 2
е. Цитохром с Cu. A е- Цитохром а 3 - Cu. B е- O 2



 Каталитический цикл 580 нм 607 нм
Каталитический цикл 580 нм 607 нм
 Hartmut Michel (Nobel Price, 1988) Max-Planck Institute of Biophysics, Frankfurt am Main, Germany “Cytochrome с Oxidase, Structure Known, Mechanism Elusive”
Hartmut Michel (Nobel Price, 1988) Max-Planck Institute of Biophysics, Frankfurt am Main, Germany “Cytochrome с Oxidase, Structure Known, Mechanism Elusive”
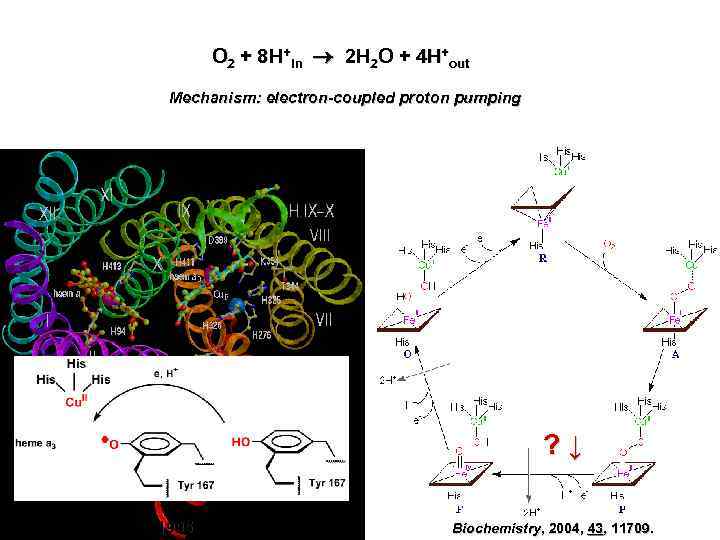 O 2 + 8 H+in 2 H 2 O + 4 H+out Mechanism: electron-coupled proton pumping ? ↓ 1995 Biochemistry, 2004, 43, 11709.
O 2 + 8 H+in 2 H 2 O + 4 H+out Mechanism: electron-coupled proton pumping ? ↓ 1995 Biochemistry, 2004, 43, 11709.




 Hartmut Michel is a German biochemist and Nobel Laureate Hartmut Michel received Nobel Prize in Chemistry jointly with Johann Deisenhofer and Robert Huber in 1988. Together with Michel and Huber, Deisenhofer determined the three-dimensional structure of a protein complex found in certain photosynthetic bacteria. This membrane protein complex, called a photosynthetic reaction center, was known to play a crucial role in initiating a simple type of photosynthesis. Between 1982 and 1985, the three scientists used X-ray crystallography to determine the exact arrangement of the more than 10, 000 atoms that make up the protein complex. Their research increased the general understanding of the mechanisms of photosynthesis and revealed similarities between the photosynthetic processes of plants and bacteria.
Hartmut Michel is a German biochemist and Nobel Laureate Hartmut Michel received Nobel Prize in Chemistry jointly with Johann Deisenhofer and Robert Huber in 1988. Together with Michel and Huber, Deisenhofer determined the three-dimensional structure of a protein complex found in certain photosynthetic bacteria. This membrane protein complex, called a photosynthetic reaction center, was known to play a crucial role in initiating a simple type of photosynthesis. Between 1982 and 1985, the three scientists used X-ray crystallography to determine the exact arrangement of the more than 10, 000 atoms that make up the protein complex. Their research increased the general understanding of the mechanisms of photosynthesis and revealed similarities between the photosynthetic processes of plants and bacteria.


