цитокин-зависимая иммунопатология.pptx
- Количество слайдов: 18

ЦИТОКИН-ЗАВИСИМЫЕ ИММУНОПАТОЛОГИИ

ЦИТОКИН-ЗАВИСИМАЯ ИММУНОПАЛОГИЯ: НАРУШЕНИЕ ВЫРАБОТКИ Дефицит выработки цитокинов. У новорожденных детей, чаще всего недоношенных, снижена выработка ИНФү, что приводит к возникновению вирусных инфекций. Снижение синтеза ИНФү наблюдается у детей и взрослых страдающих рецидивирующими вирусными и бактериальными инфекциями. Снижение активности цитокинов наблюдается под действием ингибиторов цитокинов, ингибиторов рецепторов, циркулирующих рецепторов, аутоантител к цитокинам. У новорожденных снижение ИЛ-1 и ФНО коррелирует с увеличением ИЛ-1 Ра и р55 рецептора ФНО в сыворотке. Избыточность выработки цитокинов наблюдается при длительном и интенсивном воспалительном процессе. В крови накапливаются провоспалительные цитокины. Повышенный уровень ИЛ-1 и ФНОα играет важную роль в патогенезе целого ряда заболеваний: септического шока, ревматоидного артрита, острого миелолейкоза, туберкулеза.

АУТОВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ Гетерогенная группа редких генетически детерминированных состояний, характеризующихся непровоцируемыми приступами воспаления и манифестирующиеся лихорадкой и клинической симптоматикой, напоминающей ревматическую при отсутствии аутоиммунных или инфекционных причин.
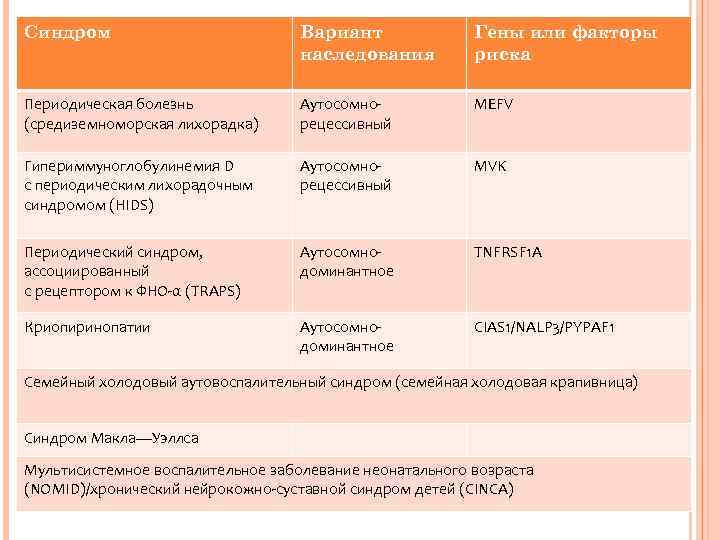
Синдром Вариант наследования Гены или факторы риска Периодическая болезнь (средиземноморская лихорадка) Аутосомнорецессивный MEFV Гипериммуноглобулинемия D с периодическим лихорадочным синдромом (HIDS) Аутосомнорецессивный MVK Периодический синдром, ассоциированный с рецептором к ФНО-α (TRAPS) Аутосомнодоминантное TNFRSF 1 A Криопиринопатии Аутосомнодоминантное CIAS 1/NALP 3/PYPAF 1 Семейный холодовый аутовоспалительный синдром (семейная холодовая крапивница) Синдром Макла—Уэллса Мультисистемное воспалительное заболевание неонатального возраста (NOMID)/хронический нейрокожно-суставной синдром детей (CINCA)

ПЕРИОДИЧЕСКАЯ БОЛЕЗНЬ Болезнь возникает преимущественно в детском или юношеском возрасте, чаще у лиц мужского пола, отмечается хроническое течение с обострениями и ремиссиями, возникающими через различные сроки. Характерными чертами ПБ являются ее этническая ассоциированность (болезнь поражает преимущественно евреевсефардов, армян, ассирийцев, реже — арабов и представителей других народов Средиземноморья) и аутосомно-рецессивный тип наследования. В 1997 г. был обнаружен ген ПБ MEFV, локализованный в 16 хромосоме. ген MEFV экспрессируется в гранулоцитах, моноцитах, дендритных клетках, а также фибробластах кожи, брюшины и синовиальной оболочки, в результате чего образуется белок пирин (или маренострин — от лат. Mare Nostrum — Средиземное море), состоящий из 781 аминокислотного остатка.
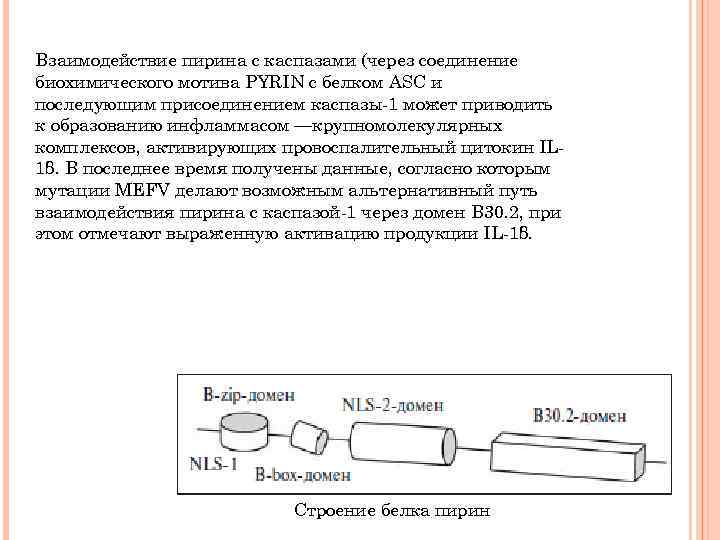
Взаимодействие пирина с каспазами (через соединение биохимического мотива PYRIN с белком ASC и последующим присоединением каспазы-1 может приводить к образованию инфламмасом —крупномолекулярных комплексов, активирующих провоспалительный цитокин IL 1β. В последнее время получены данные, согласно которым мутации MEFV делают возможным альтернативный путь взаимодействия пирина с каспазой-1 через домен В 30. 2, при этом отмечают выраженную активацию продукции IL-1β. Строение белка пирин

КРИОПИРИНОПАТИИ Ген криопирина локализован в 1 хромосоме. Мутации данного гена ассоциированы с возникновением нескольких вариантов СПЛ: синдрома Макла—Уэллса и семейной холодовой крапивницы. Несколько позднее была выявлена взаимосвязь этого гена еще с одной нозологической формой — мультисистемным воспалительным заболеванием неонатального возраста (Neonatal Onset Multisystemic Inflammatory Disease, NOMID), иначе называемым хроническим нейрокожно-суставным синдромом детей (Chronic Infantile Neurological Cutaneous and Articular syndrome, CINCA). Характерное проявление криопиринопатий —сыпь, напоминающая крапивницу. Гистологически обнаруживают инфильтрацию кожи лимфоцитами и нейтрофилами, при этом содержание тучных клеток в инфильтрате незначительно, что отличает сыпь при криопиринопатиях от истинной крапивницы.
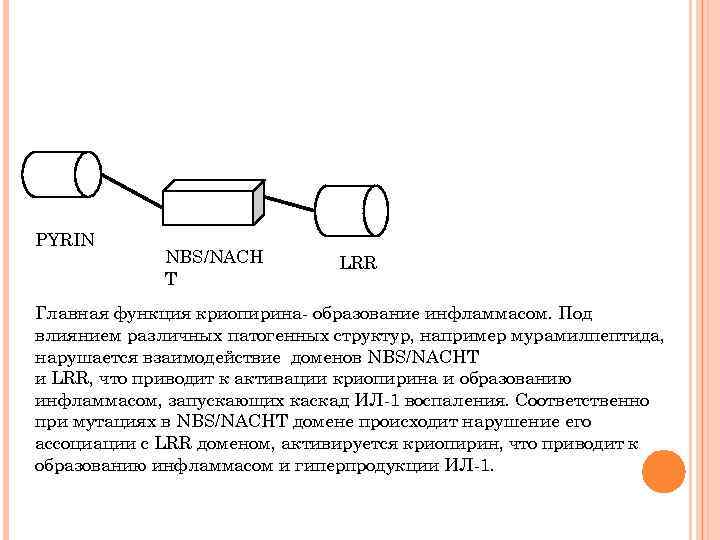
PYRIN NBS/NACH T LRR Главная функция криопирина- образование инфламмасом. Под влиянием различных патогенных структур, например мурамилпептида, нарушается взаимодействие доменов NBS/NACHT и LRR, что приводит к активации криопирина и образованию инфламмасом, запускающих каскад ИЛ-1 воспаления. Соответственно при мутациях в NBS/NACHT домене происходит нарушение его ассоциации с LRR доменом, активируется криопирин, что приводит к образованию инфламмасом и гиперпродукции ИЛ-1.
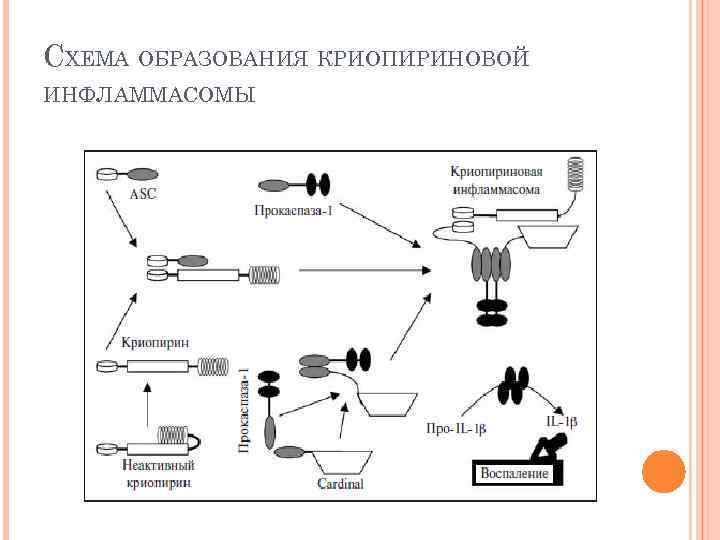
СХЕМА ОБРАЗОВАНИЯ КРИОПИРИНОВОЙ ИНФЛАММАСОМЫ
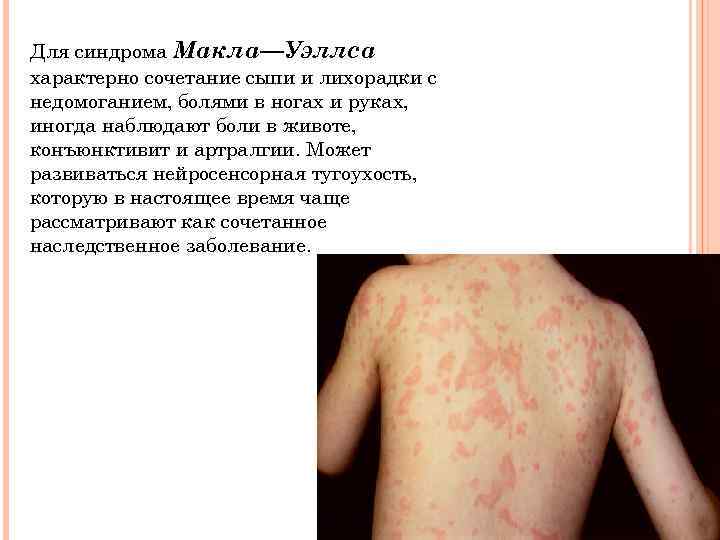
Для синдрома Макла—Уэллса характерно сочетание сыпи и лихорадки с недомоганием, болями в ногах и руках, иногда наблюдают боли в животе, конъюнктивит и артралгии. Может развиваться нейросенсорная тугоухость, которую в настоящее время чаще рассматривают как сочетанное наследственное заболевание.
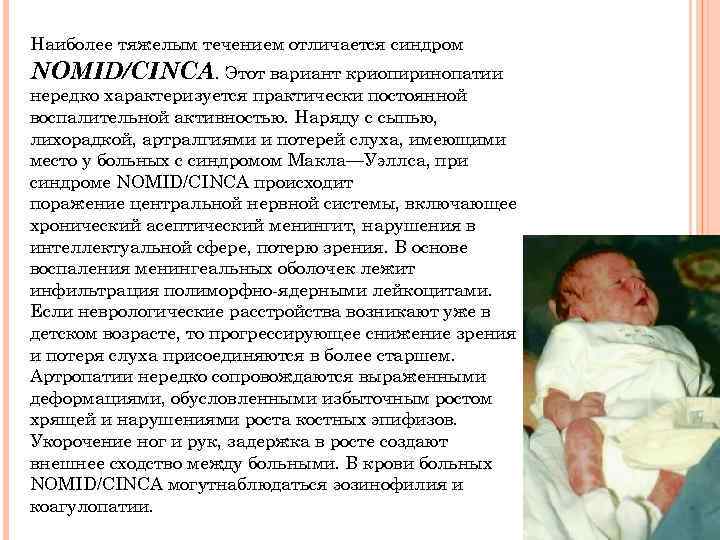
Наиболее тяжелым течением отличается синдром NOMID/CINCA. Этот вариант криопиринопатии нередко характеризуется практически постоянной воспалительной активностью. Наряду с сыпью, лихорадкой, артралгиями и потерей слуха, имеющими место у больных с синдромом Макла—Уэллса, при синдроме NOMID/CINCA происходит поражение центральной нервной системы, включающее хронический асептический менингит, нарушения в интеллектуальной сфере, потерю зрения. В основе воспаления менингеальных оболочек лежит инфильтрация полиморфно-ядерными лейкоцитами. Если неврологические расстройства возникают уже в детском возрасте, то прогрессирующее снижение зрения и потеря слуха присоединяются в более старшем. Артропатии нередко сопровождаются выраженными деформациями, обусловленными избыточным ростом хрящей и нарушениями роста костных эпифизов. Укорочение ног и рук, задержка в росте создают внешнее сходство между больными. В крови больных NOMID/CINCA могутнаблюдаться эозинофилия и коагулопатии.

TRAPS (TNF receptor associated periodic syndrom)— это доминантно наследуемое заболевание, обусловленное нарушением структуры растворимой субъединицы р55 рецептора к ФНОα. Эта субъединица кодируется геном TNFRSF 1 A, расположенном на хромосоме 12. Приступы лихорадки при этом заболевании длятся от 5 дней до 3 недель. У 3 из 4 больных обнаруживают разнообразные кожные проявления: от псевдокрапивницы до эритематозных пятен неправильной формы и бляшек. Наиболее характерны бляшки разного размера, горячие на ощупь и чувствительные при пальпации, локализующиеся преимущественно на ногах и руках и распространяющиеся от дистальных участков к проксимальным. При гистологическом исследовании кожи выявляли периваскулярную и интерстициальную инфильтрацию лимфоцитами и моноцитами. Частыми симптомами, сопровождающими атаки болезни, являются также сухой плеврит, артрит, конъюнктивит и периорбитальный отек. Во время атак обычно выявляют лейкоцитоз и повышение в крови реактантов острой фазы воспаления. Подавление проявлений болезни обычно достигается назначением больших доз кортикостероидов.
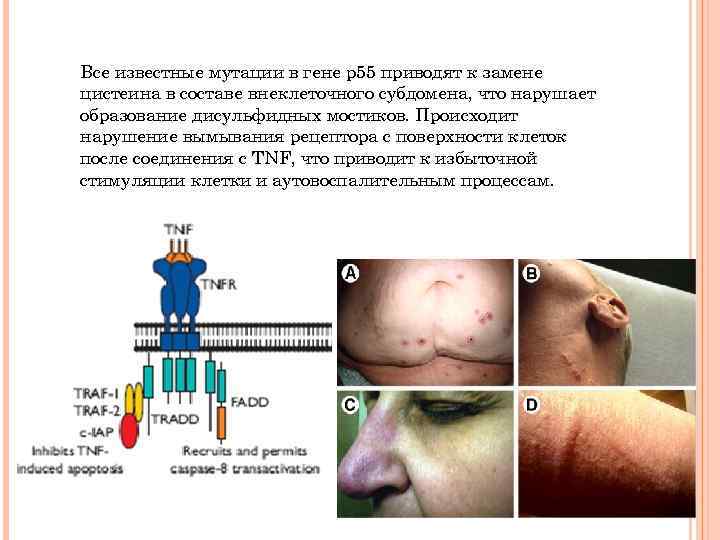
Все известные мутации в гене р55 приводят к замене цистеина в составе внеклеточного субдомена, что нарушает образование дисульфидных мостиков. Происходит нарушение вымывания рецептора с поверхности клеток после соединения с TNF, что приводит к избыточной стимуляции клетки и аутовоспалительным процессам.

При HIDS (гипериммуноглобулинемия D с периодическим лихорадочным синдромом) причина атак аутовоспаления пока остается малопонятной. Исследования, проведенные в 1999 г. сразу двумя коллективами ученых позволили обнаружить ассоциацию этого синдрома с гомозиготным носительством мутантных аллелей гена мевалонаткиназы (MVK), расположенного в хромосоме 12. В норме мевалонаткиназа катализирует превращение мевалоновой кислоты в 5 фосфомевалонат, эта реакция участвует в синтезе ряда биологически важных веществ: холестерина, витамина D, желчных кислот, стероидов и нестероидных изопреноидов. Обнаружено свыше 35 мутаций MVK, ассоциированных с HIDS. Все они приводят к изменению структуры активного центра и снижению каталитической активности фермента. Вследствие этого в организме происходит избыточное накопление мевалоновой кислоты, что, в частности, проявляется мевалоновой ацидурией. При полном выпадении функции фермента мевалонаткиназы наблюдают также периодическую лихорадку, задержку роста и дефицит психических функций.

ЦИТОКИН-ЗАВИСИМАЯ ИММУНОПАЛОГИЯ: ДЕФЕКТ РЕЦЕПТОРОВ Рецепторы для ИЛ-2, 4, 7, 9, 13 и 15 имеют общую ү-цепь. Дефект генов (делеция аминокислотных остатков 62 и 81), кодирующих синтез этой цепи приводит развитию Х- сцепленного тяжелого комбинированного иммунодефицита (ТКИД) известен так же под названием «мальчик в пузыре» , так как больные очень уязвимы и должны находиться в стерильной среде. Для данного заболевания характерно отсутствие или значительное падение содержания Т-лимфоцитов, В-лимфоциты не функционируют и резко снижены показатели гуморального и клеточного иммунного ответа. Дефицит альфа - субъединицы рецептора ИЛ-7 приводит к снижению количества Т-лимфоцитов, но при этом NK и Влимфоциты остаются в норме.

ЦИТОКИН-ЗАВИСИМАЯ ИММУНОПАЛОГИЯ: ДИСБАЛАНС TH 1/ H 2 T Показано, что в развитии аллергических заболеваний большую роль играют Th 1. Некоторые аутоиммунные заболевания характеризуются повышением активности Th 1, которые избыточно активируют воспалительный и клеточный иммунитет. Наиболее яркий пример участия цитокинов в развитии аутоиммуного процесса - ревматоидный артрит.

РЕВМАТОИДНЫЙ Аутоиммунное заболевание, которое характеризуется поражением синовиальной оболочки, хряща и костной ткани сустава. В синовиальной оболочке обнаруживаются плазмоцитоидные и миелоидные ДК, синовиальные макрофаги, которые синтезируют широкий спектр цитокинов, способных направлять дифференцировку наивных Тлимфоцитов в любом направлении: ИЛ-12, 18 Th 1, ИЛ-4 – Th 2, ИЛ-1, 6, 23 – Th 17. В синовиальной жидкости отмечается повышенный уровень TNFα, при этом наблюдается снижение продукции антивоспалительных и регуляторных цитокинов. Диагностический маркер ИЛ-1. АРТРИТ

цитокин-зависимая иммунопатология.pptx