Цитогенетика 22-24.ppt
- Количество слайдов: 50

Цитогенетика НГУ 2011 Рубцов Николай Борисович, д. б. н. , зав. лабораторией, ИЦи. Г СО РАН.

Консервативные районы и «горячие точки» перестроек в Х-хромосомах исследованных видов полевок Схема консервативных районов Х-хромосомы гипотетического предка полевок группы «arvalis» Локализация консервативных районов в Х-хромосомах полевок Короткими стрелками слева обозначены точки разрывов-воссоединений гипотетических инверсий, разделивших Х-хромосому на консервативные районы (цветные сегменты). Длинными стрелками указаны границы, по которым разрывы проходили более одного раза. Цифрами указано число инверсионных событий, в которых участвовали пограничные районы консервативных сегментов. Цветными кругами показаны районы локализации кластеров ПП-ДНК, выявляемые ДНК-пробой 8 RC (зеленый) и районоспецифичными ДНК-пробами, как дополнительные сигналы (красный).
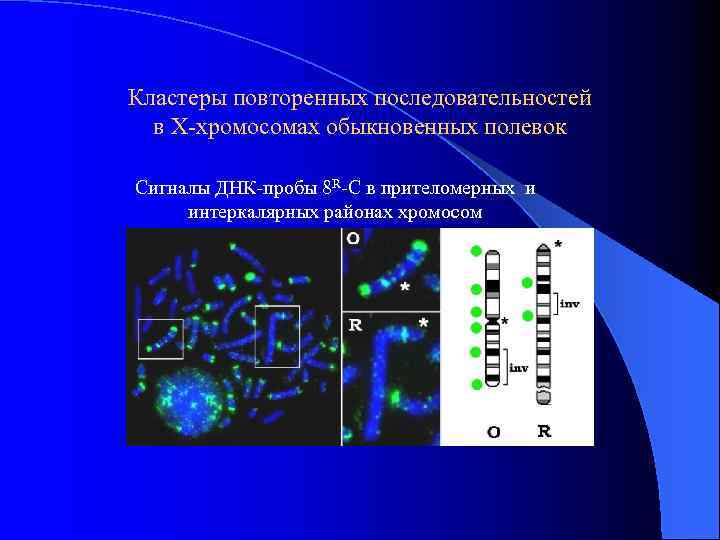
Кластеры повторенных последовательностей в Х-хромосомах обыкновенных полевок Сигналы ДНК-пробы 8 R-С в прителомерных и интеркалярных районах хромосом

Кластеры дуплицированных последовательностей в хромосомах человека Hum Mol Genet. 2001 Oct 1; 10(20): 2215 -23 Lessons from the human genome: transitions between euchromatin and heterochromatin. Horvath JR et al.
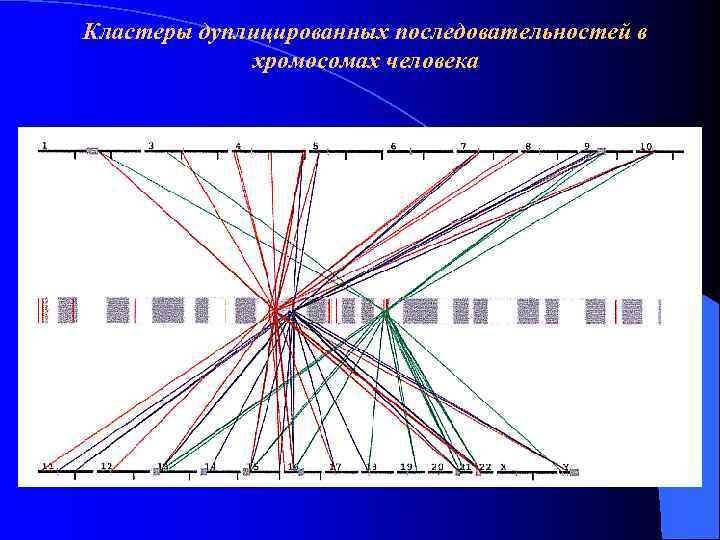
Кластеры дуплицированных последовательностей в хромосомах человека
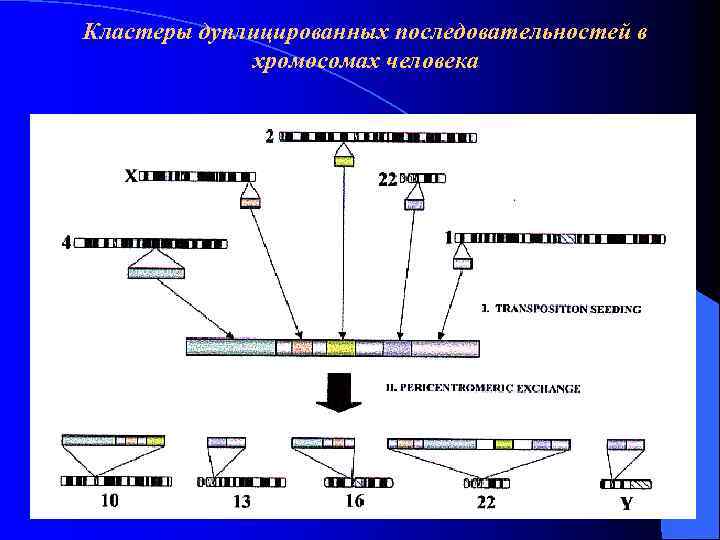
Кластеры дуплицированных последовательностей в хромосомах человека

В-хромосомы

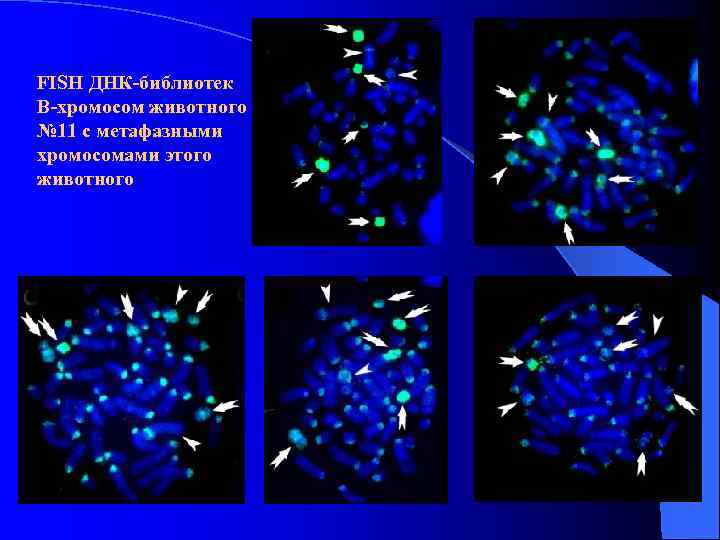
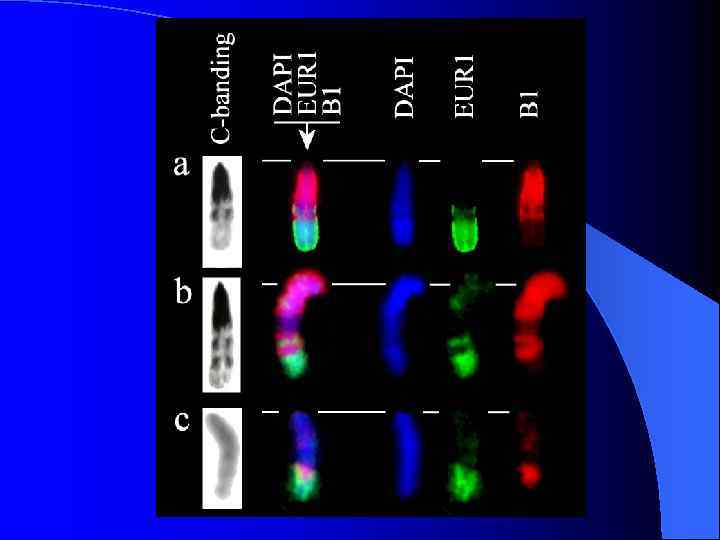
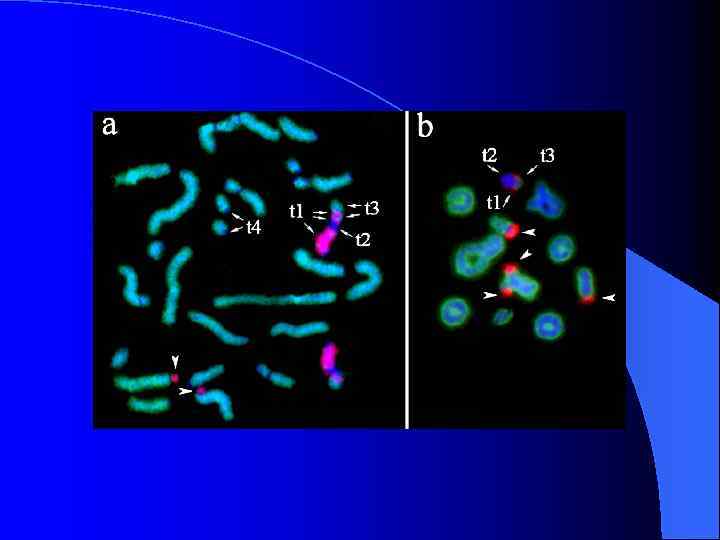
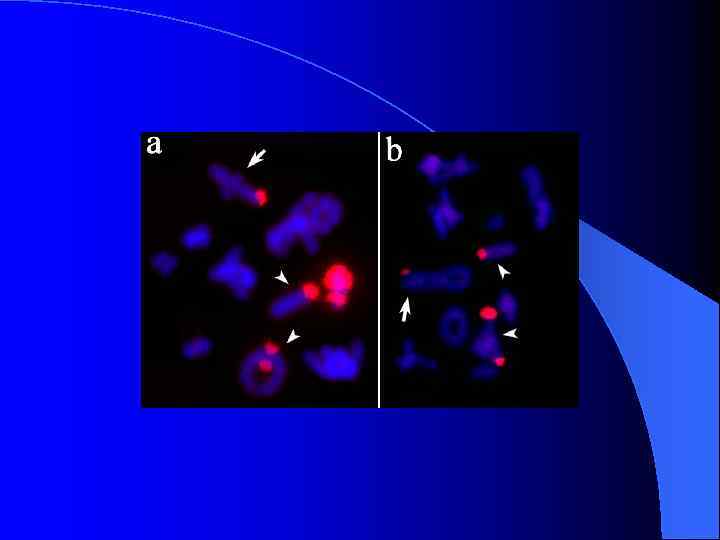
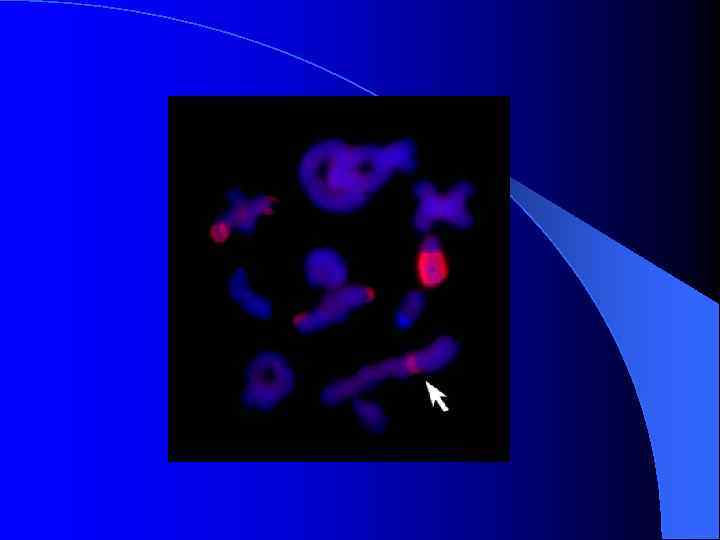
FISH ДНК-библиотек В-хромосом животного № 11 с метафазными хромосомами этого животного
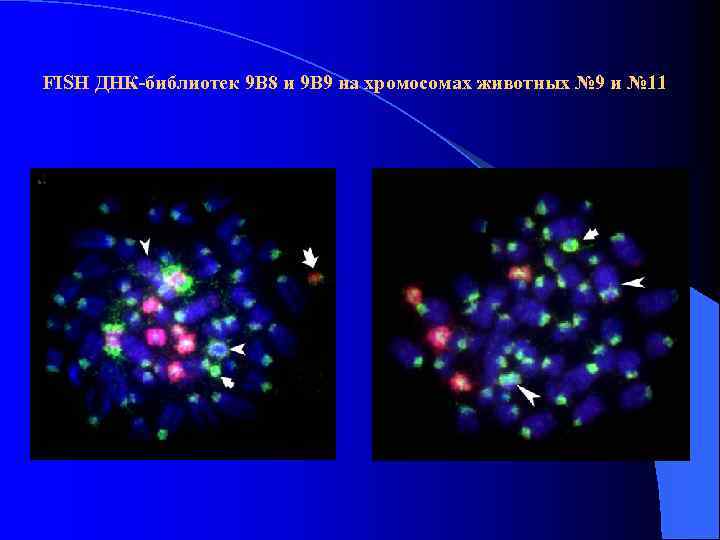
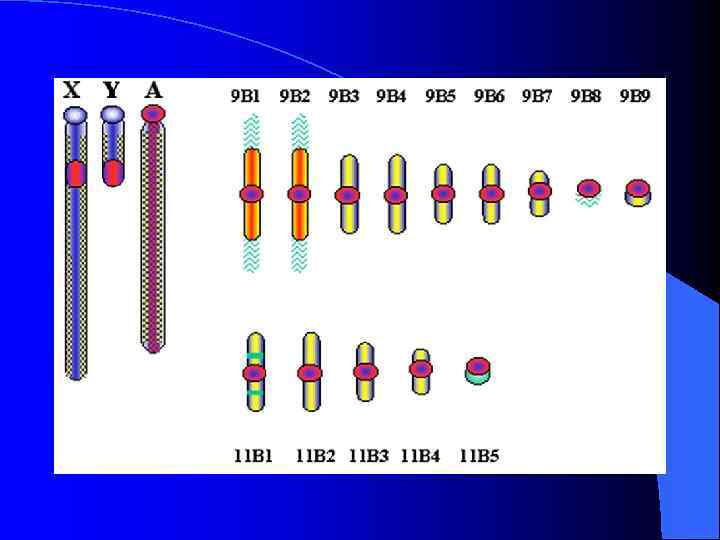
FISH ДНК-библиотек 9 В 8 и 9 В 9 на хромосомах животных № 9 и № 11

FISH ДНК-библиотек Аро. С и 11 В 2 pq на хромосомах животного № 11
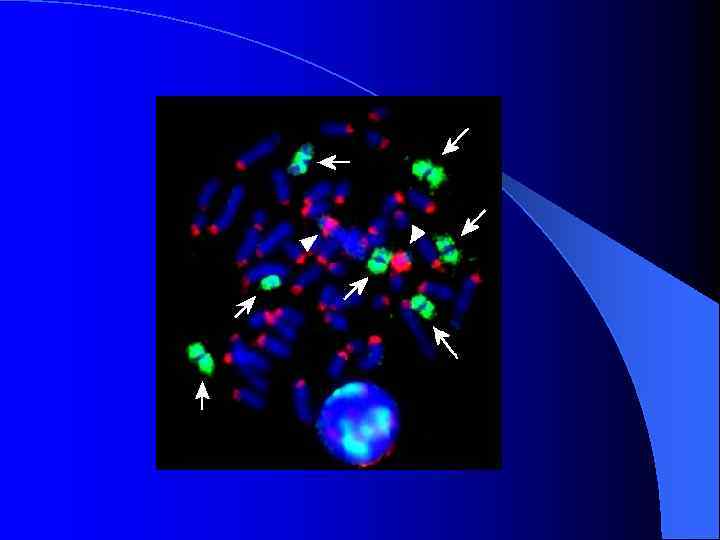
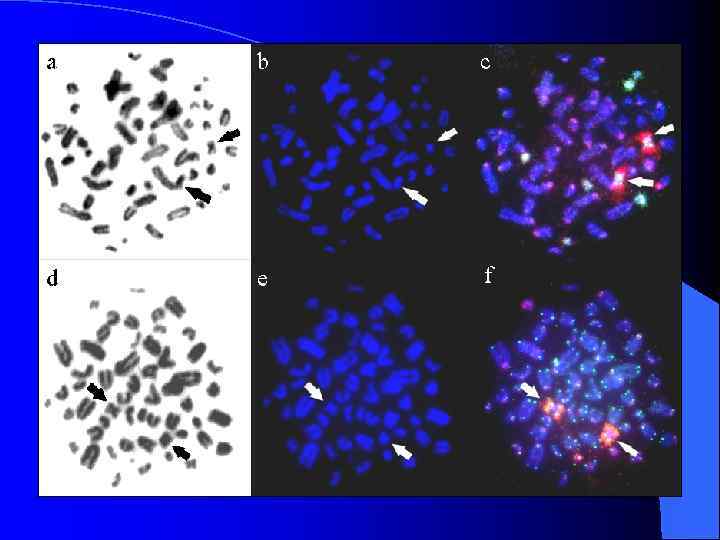
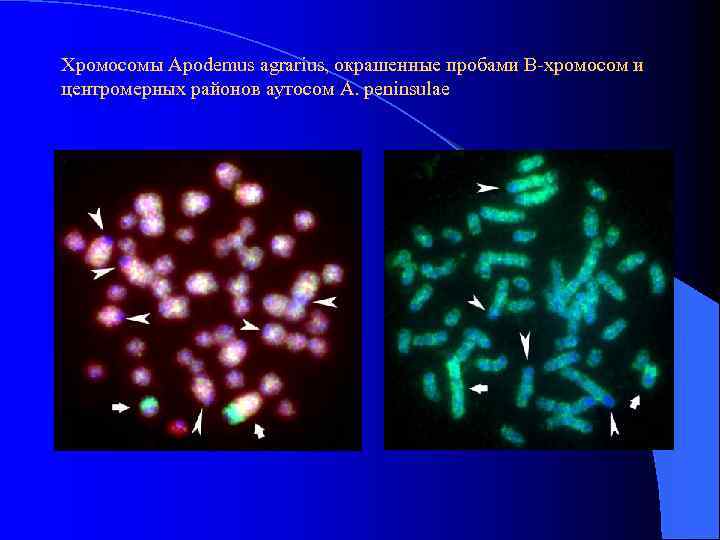
Хромосомы Apodemus agrarius, окрашенные пробами В-хромосом и центромерных районов аутосом A. peninsulae
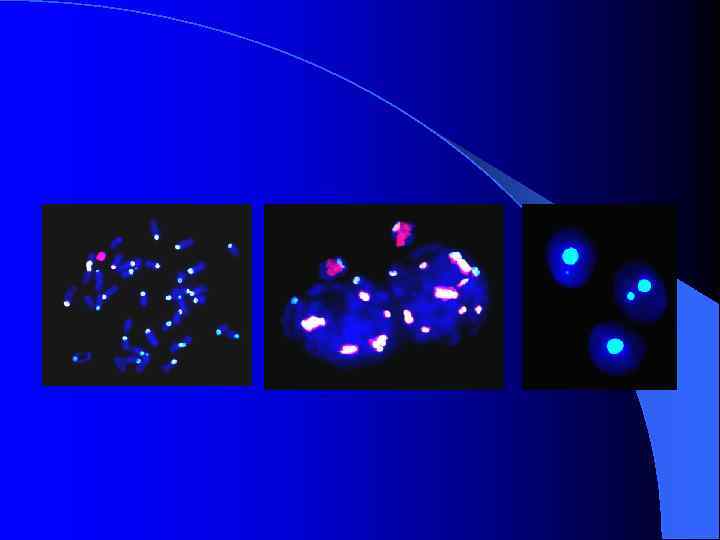
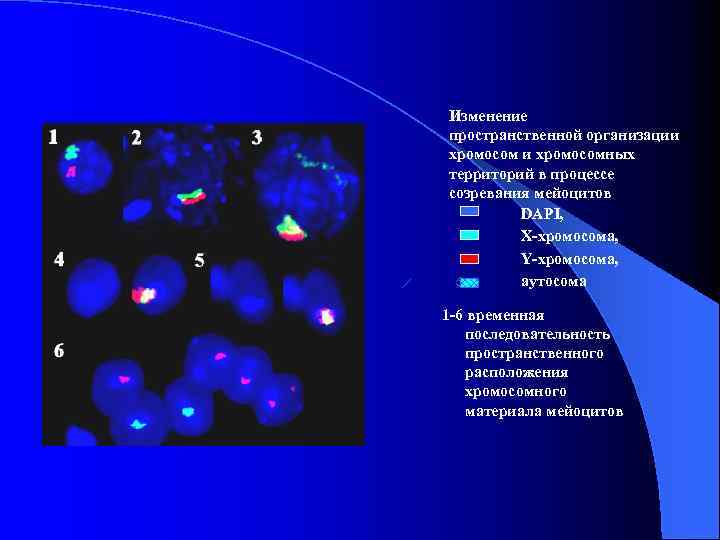
Изменение пространственной организации хромосомных территорий в процессе созревания мейоцитов DAPI, Х-хромосома, Y-хромосома, аутосома 1 -6 временная последовательность пространственного расположения хромосомного материала мейоцитов


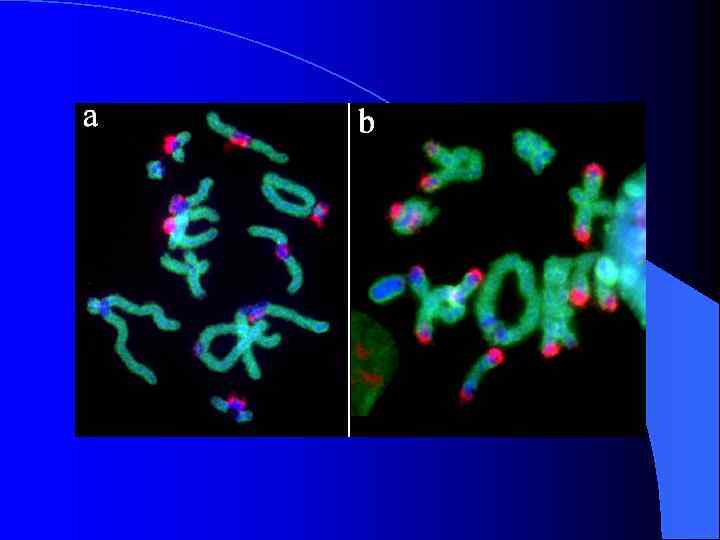
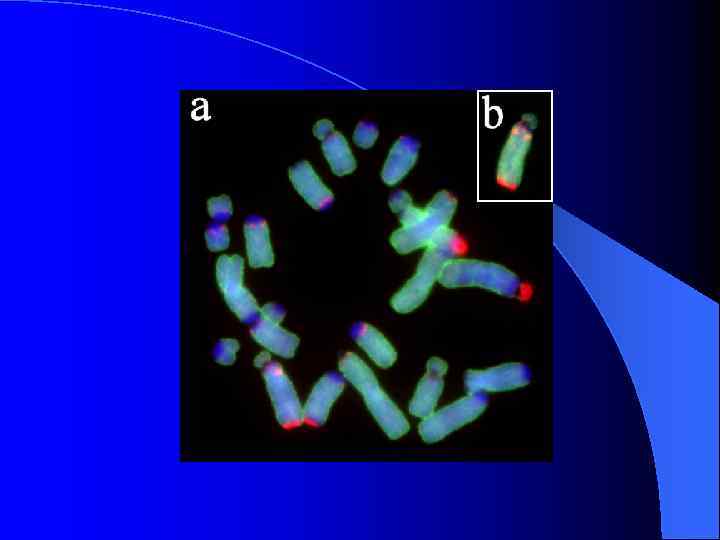
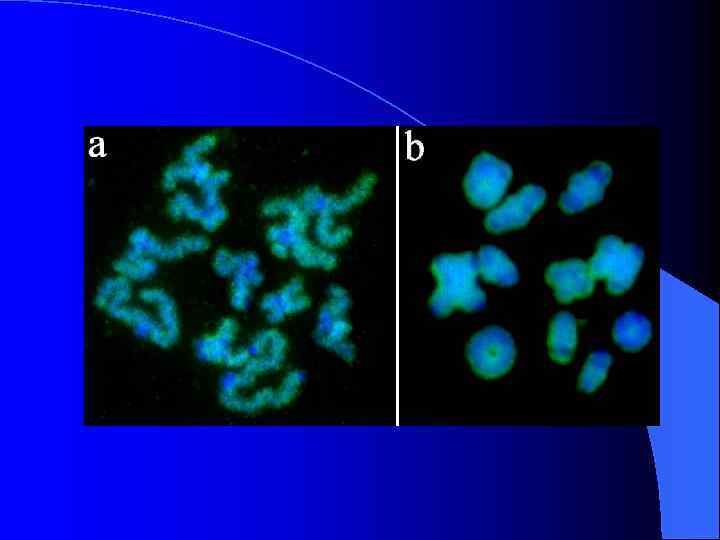
Морфологические типы В-хромосом Podisma sapporensis
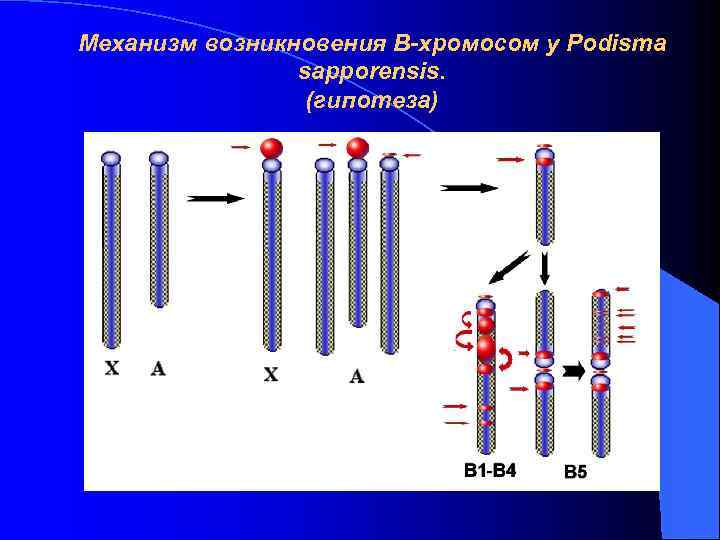
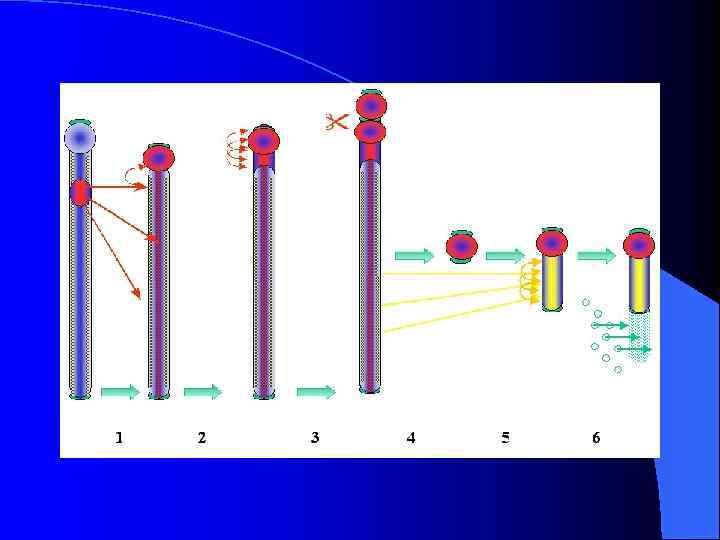
Механизм возникновения В-хромосом у Podisma sapporensis. (гипотеза)

Цитогенетика растений
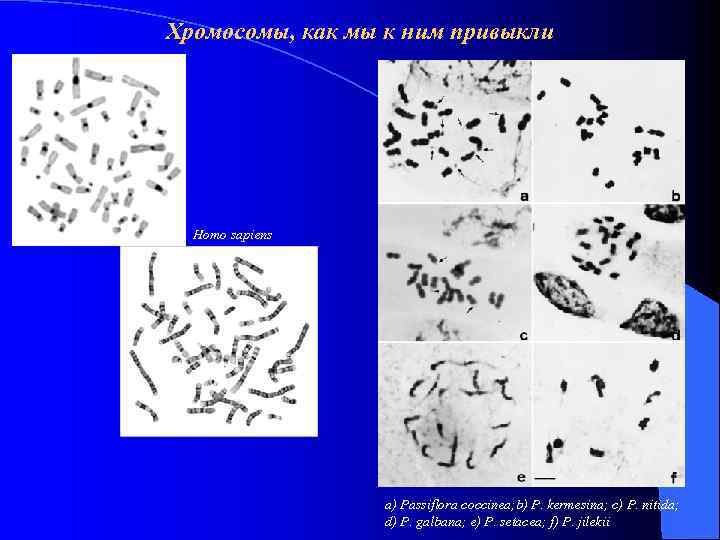
Хромосомы, как мы к ним привыкли Homo sapiens a) Passiflora coccinea; b) P. kermesina; c) P. nitida; d) P. galbana; e) P. setacea; f) P. jilekii
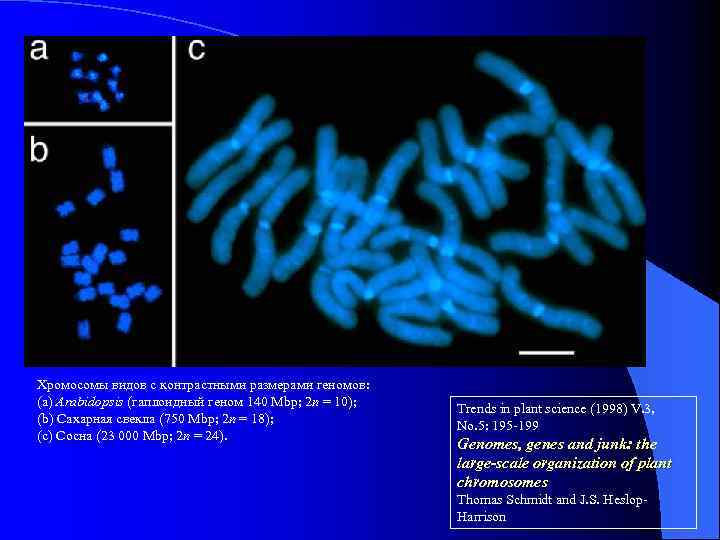
Хромосомы видов с контрастными размерами геномов: (a) Arabidopsis (гаплоидный геном 140 Mbp; 2 n = 10); (b) Сахарная свекла (750 Mbp; 2 n = 18); (c) Сосна (23 000 Mbp; 2 n = 24). Trends in plant science (1998) V. 3, No. 5: 195 -199 Genomes, genes and junk: the large-scale organization of plant chromosomes Thomas Schmidt and J. S. Heslop. Harrison
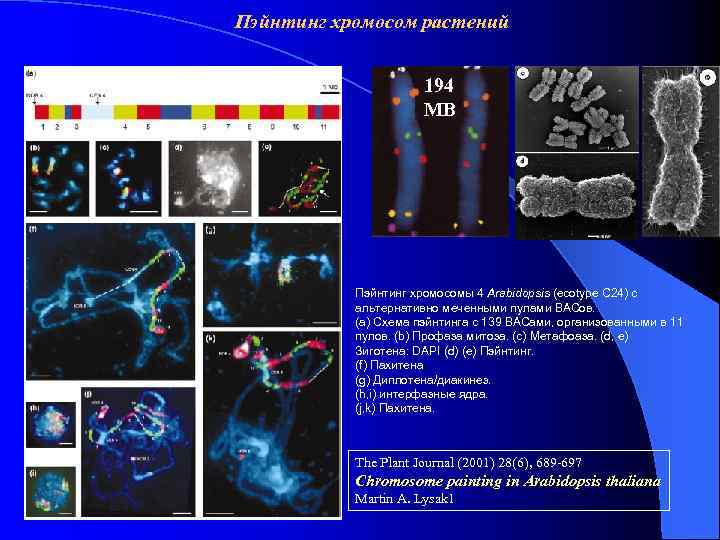
Пэйнтинг хромосом растений 194 MB Пэйнтинг хромосомы 4 Arabidopsis (ecotype C 24) с альтернативно меченными пулами BACов. (a) Схема пэйнтинга с 139 BACами, организованными в 11 пулов. (b) Профаза митоза. (c) Метафоаза. (d, e) Зиготена: DAPI (d) (e) Пэйнтинг. (f) Пахитена (g) Диплотена/диакинез. (h, i) интерфазные ядра. (j, k) Пахитена. The Plant Journal (2001) 28(6), 689 -697 Chromosome painting in Arabidopsis thaliana Martin A. Lysak 1
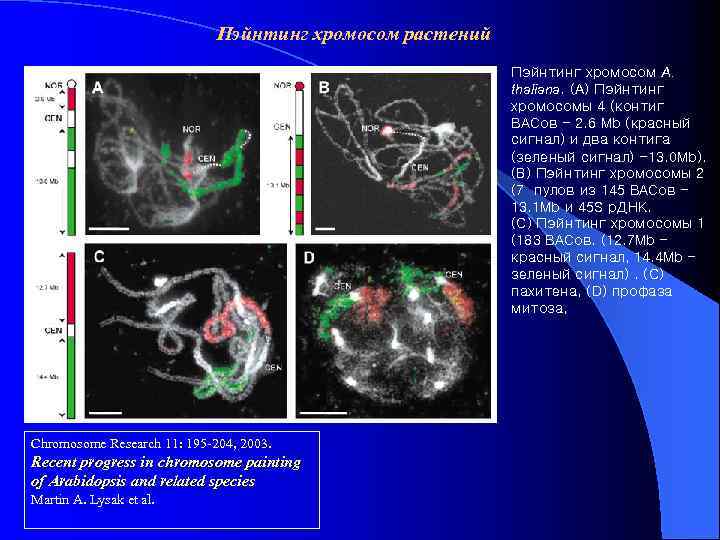
Пэйнтинг хромосом растений Пэйнтинг хромосом A. thaliana. (A) Пэйнтинг хромосомы 4 (контиг BACов - 2. 6 Mb (красный сигнал) и два контига (зеленый сигнал) -13. 0 Mb). (B) Пэйнтинг хромосомы 2 (7 пулов из 145 BACов 13. 1 Mb и 45 S р. ДНК. (C) Пэйнтинг хромосомы 1 (183 BACов. (12. 7 Mb красный сигнал, 14. 4 Mb зеленый сигнал). (C) пахитена, (D) профаза митоза, Chromosome Research 11: 195 -204, 2003. Recent progress in chromosome painting of Arabidopsis and related species Martin A. Lysak et al.
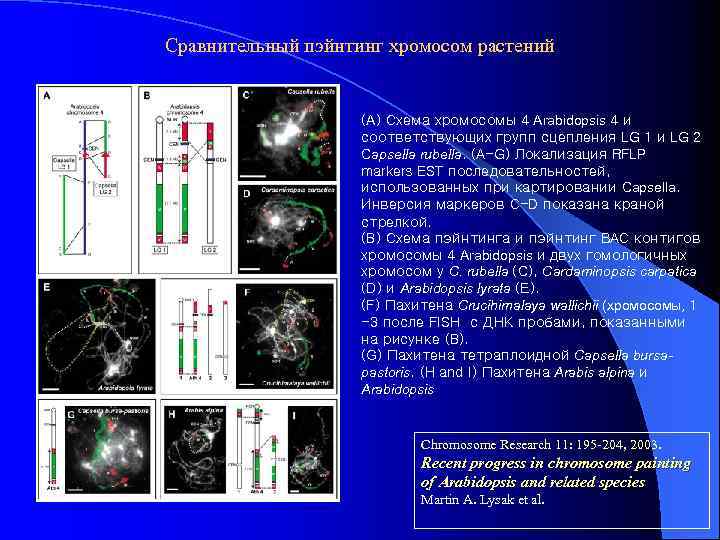
Сравнительный пэйнтинг хромосом растений (A) Схема хромосомы 4 Arabidopsis 4 и соответствующих групп сцепления LG 1 и LG 2 Capsella rubella. (A-G) Локализация RFLP markers EST последовательностей, использованных при картировании Capsella. Инверсия маркеров C-D показана краной стрелкой. (B) Схема пэйнтинга и пэйнтинг BAC контигов хромосомы 4 Arabidopsis и двух гомологичных хромосом у C. rubella (C), Cardaminopsis carpatica (D) и Arabidopsis lyrata (E). (F) Пахитена Crucihimalaya wallichii (хромосомы, 1 -3 после FISH с ДНК пробами, показанными на рисунке (B). (G) Пахитена тетраплоидной Capsella bursapastoris. (H and I) Пахитена Arabis alpina и Arabidopsis Chromosome Research 11: 195 -204, 2003. Recent progress in chromosome painting of Arabidopsis and related species Martin A. Lysak et al.
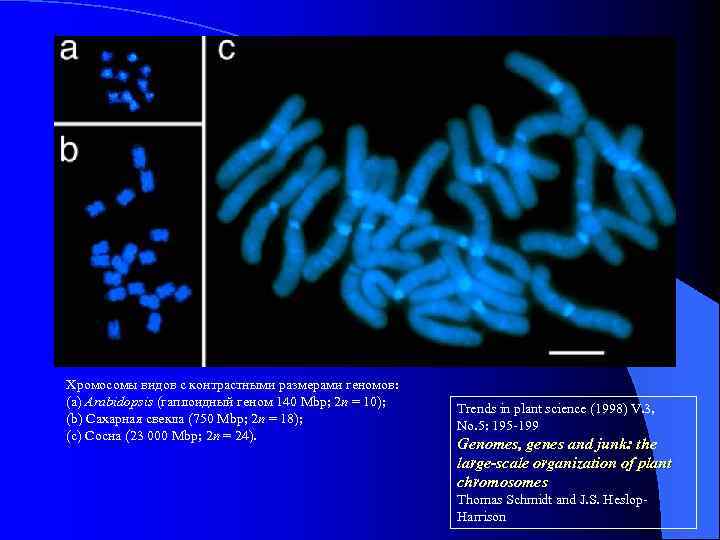
Хромосомы видов с контрастными размерами геномов: (a) Arabidopsis (гаплоидный геном 140 Mbp; 2 n = 10); (b) Сахарная свекла (750 Mbp; 2 n = 18); (c) Сосна (23 000 Mbp; 2 n = 24). Trends in plant science (1998) V. 3, No. 5: 195 -199 Genomes, genes and junk: the large-scale organization of plant chromosomes Thomas Schmidt and J. S. Heslop. Harrison
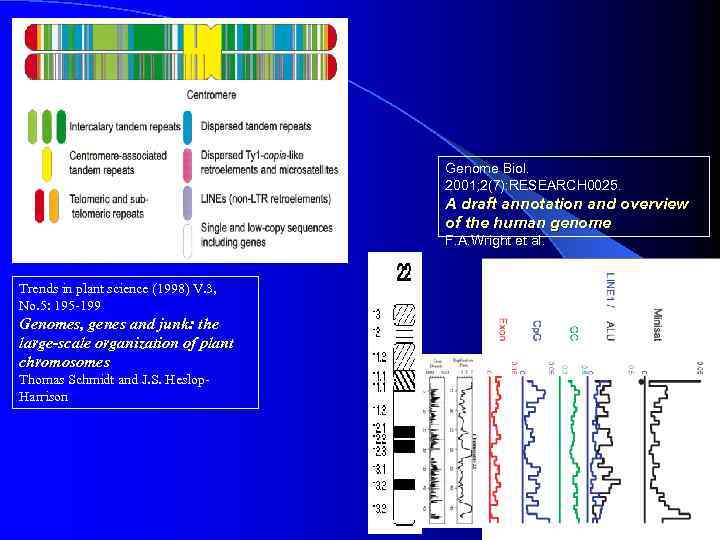
Genome Biol. 2001; 2(7): RESEARCH 0025. A draft annotation and overview of the human genome F. A. Wright et al. Trends in plant science (1998) V. 3, No. 5: 195 -199 Genomes, genes and junk: the large-scale organization of plant chromosomes Thomas Schmidt and J. S. Heslop. Harrison
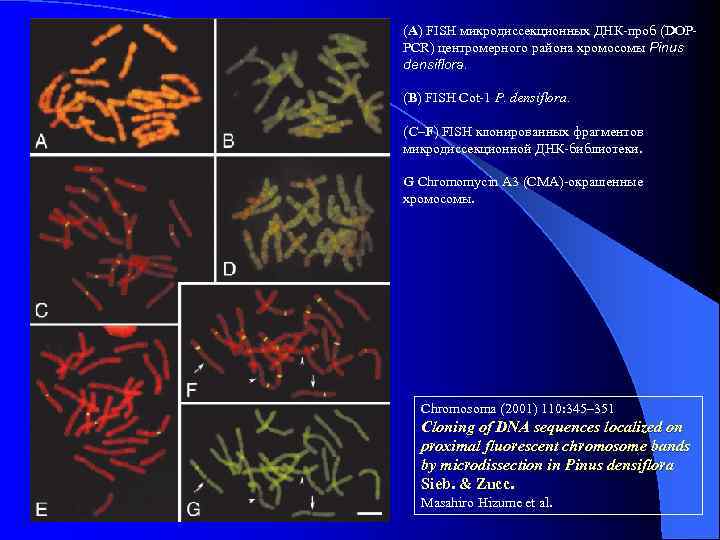
(A) FISH микродиссекционных ДНК-проб (DOPPCR) центромерного района хромосомы Pinus densiflora. (B) FISH Cot-1 P. densiflora. (C–F) FISH клонированных фрагментов микродиссекционной ДНК-библиотеки. G Chromomycin A 3 (CMA)-окрашенные хромосомы. Chromosoma (2001) 110: 345– 351 Cloning of DNA sequences localized on proximal fluorescent chromosome bands by microdissection in Pinus densiflora Sieb. & Zucc. Masahiro Hizume et al.
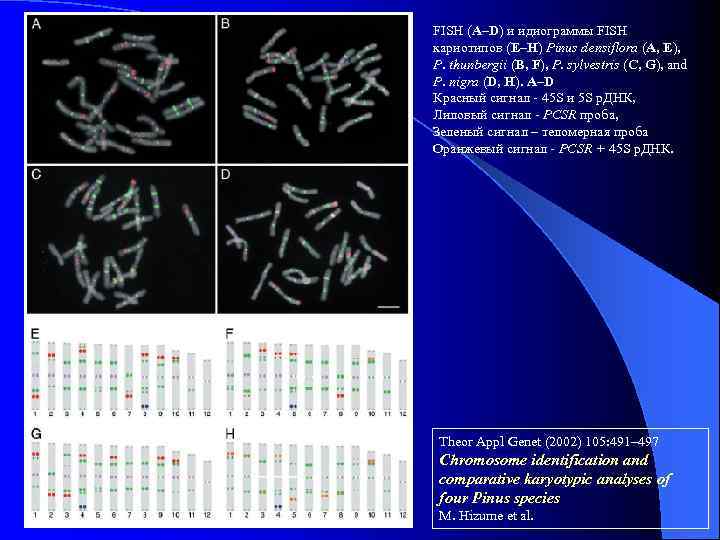
FISH (A–D) и идиограммы FISH кариотипов (E–H) Pinus densiflora (A, E), P. thunbergii (B, F), P. sylvestris (C, G), and P. nigra (D, H). A–D Красный сигнал - 45 S и 5 S р. ДНК, Лиловый сигнал - PCSR проба, Зеленый сигнал – теломерная проба Оранжевый сигнал - PCSR + 45 S р. ДНК. Theor Appl Genet (2002) 105: 491– 497 Chromosome identification and comparative karyotypic analyses of four Pinus species M. Hizume et al.
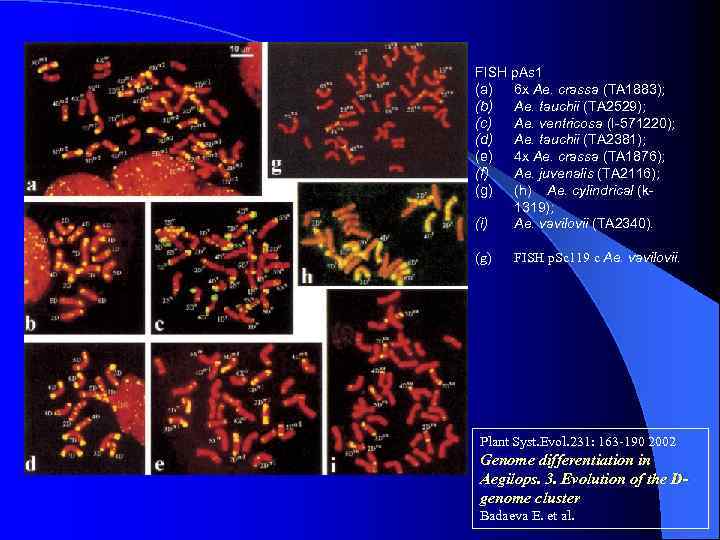
FISH p. As 1 (a) 6 x Ae. crassa (TA 1883); (b) Ae. tauchii (TA 2529); (c) Ae. ventricosa (I-571220); (d) Ae. tauchii (TA 2381); (e) 4 x Ae. crassa (TA 1876); (f) Ae. juvenalis (TA 2116); (g) (h) Ae. cylindrical (k 1319); (i) Ae. vavilovii (TA 2340). (g) FISH p. Sc 119 c Ae. vavilovii. Plant Syst. Evol. 231: 163 -190 2002 Genome differentiation in Aegilops. 3. Evolution of the Dgenome cluster Badaeva E. et al.
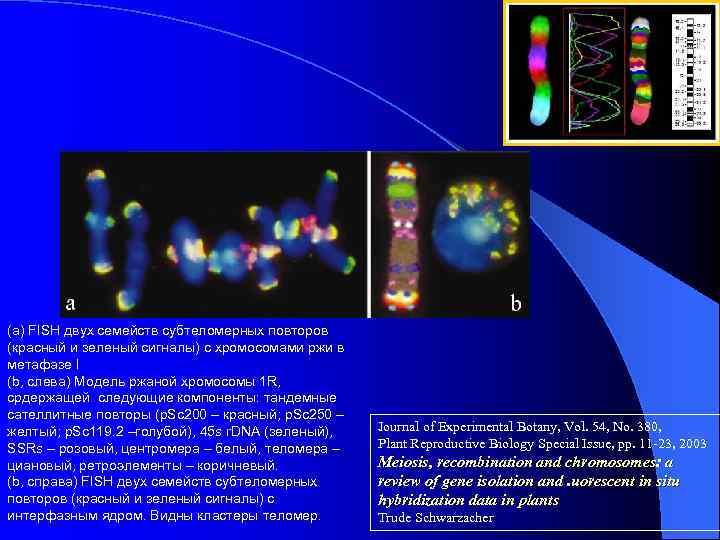
(а) FISH двух семейств субтеломерных повторов (красный и зеленый сигналы) с хромосомами ржи в метафазе I (b, слева) Модель ржаной хромосомы 1 R, срдержащей следующие компоненты: тандемные сателлитные повторы (p. Sc 200 – красный; p. Sc 250 – желтый; p. Sc 119. 2 –голубой), 45 s r. DNA (зеленый), SSRs – розовый, центромера – белый, теломера – циановый, ретроэлементы – коричневый. (b, справа) FISH двух семейств субтеломерных повторов (красный и зеленый сигналы) с интерфазным ядром. Видны кластеры теломер. Journal of Experimental Botany, Vol. 54, No. 380, Plant Reproductive Biology Special Issue, pp. 11 -23, 2003 Meiosis, recombination and chromosomes: a review of gene isolation and. uorescent in situ hybridization data in plants Trude Schwarzacher
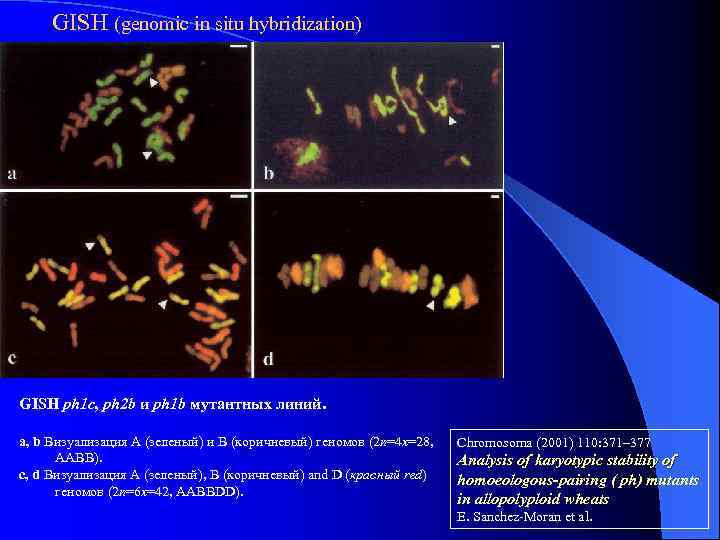
GISH (genomic in situ hybridization) GISH ph 1 c, ph 2 b и ph 1 b мутантных линий. a, b Визуализация A (зеленый) и B (коричневый) геномов (2 n=4 x=28, AABB). c, d Визуализация A (зеленый), B (коричневый) and D (красный red) геномов (2 n=6 x=42, AABBDD). Chromosoma (2001) 110: 371– 377 Analysis of karyotypic stability of homoeologous-pairing ( ph) mutants in allopolyploid wheats E. Sanchez-Moran et al.
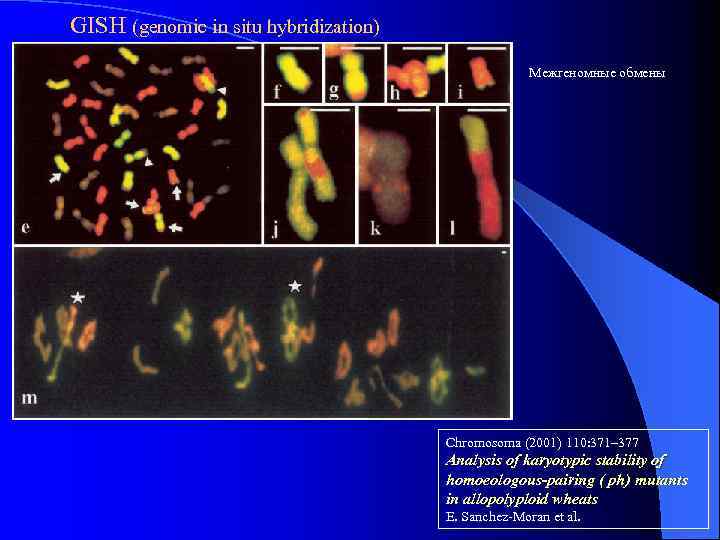
GISH (genomic in situ hybridization) Межгеномные обмены Chromosoma (2001) 110: 371– 377 Analysis of karyotypic stability of homoeologous-pairing ( ph) mutants in allopolyploid wheats E. Sanchez-Moran et al.
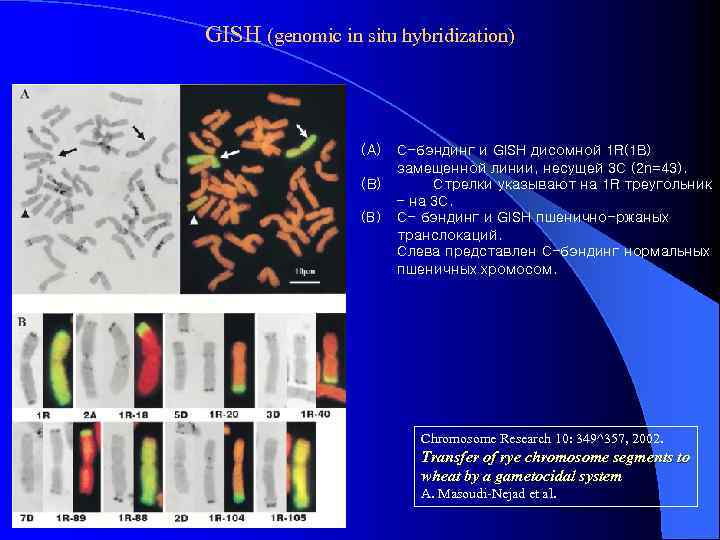
GISH (genomic in situ hybridization) (A) (B) C-бэндинг и GISH дисомной 1 R(1 B) замещенной линии, несущей 3 C (2 n=43). Стрелки указывают на 1 R треугольник – на 3 C. C- бэндинг и GISH пшенично-ржаных транслокаций. Слева представлен C-бэндинг нормальных пшеничных хромосом. Chromosome Research 10: 349^357, 2002. Transfer of rye chromosome segments to wheat by a gametocidal system A. Masoudi-Nejad et al.
FISH и распластанный хроматин/ДНК
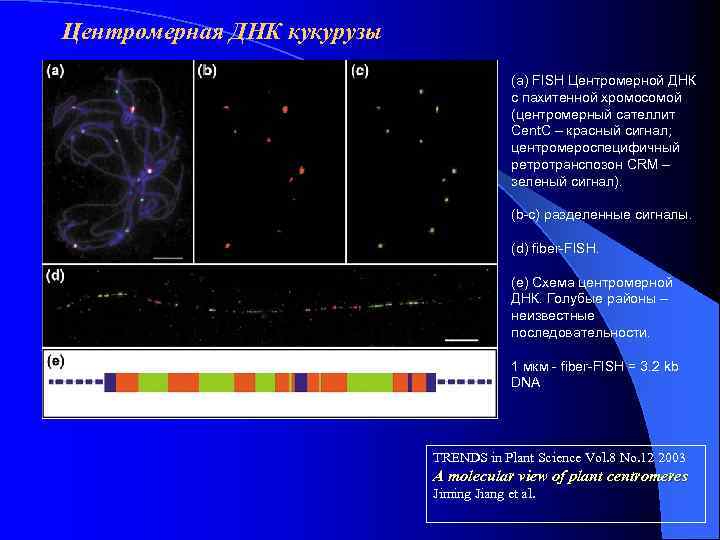
Центромерная ДНК кукурузы (a) FISH Центромерной ДНК с пахитенной хромосомой (центромерный сателлит Cent. C – красный сигнал; центромероспецифичный ретротранспозон CRM – зеленый сигнал). (b-с) разделенные сигналы. (d) fiber-FISH. (e) Схема центромерной ДНК. Голубые районы – неизвестные последовательности. 1 мкм - fiber-FISH = 3. 2 kb DNA TRENDS in Plant Science Vol. 8 No. 12 2003 A molecular view of plant centromeres Jiming Jiang et al.
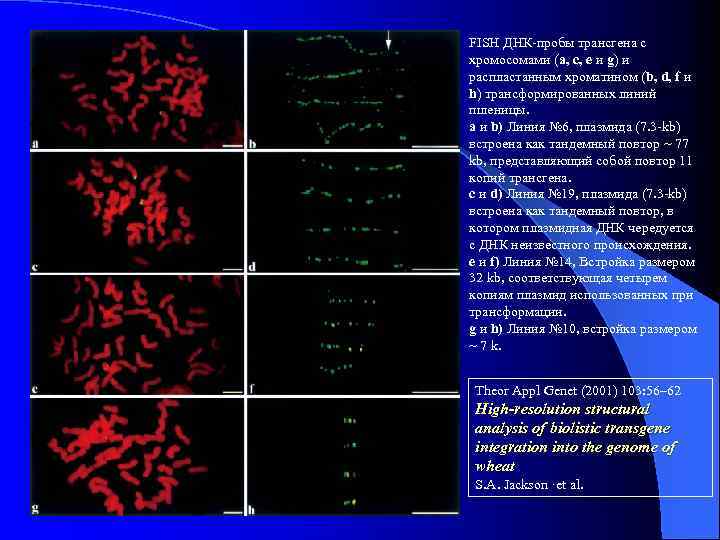
FISH ДНК-пробы трансгена с хромосомами (a, c, e и g) и распластанным хроматином (b, d, f и h) трансформированных линий пшеницы. a и b) Линия № 6, плазмида (7. 3 -kb) встроена как тандемный повтор ~ 77 kb, представляющий собой повтор 11 копий трансгена. c и d) Линия № 19, плазмида (7. 3 -kb) встроена как тандемный повтор, в котором плазмидная ДНК чередуется с ДНК неизвестного происхождения. e и f) Линия № 14, Встройка размером 32 kb, соответствующая четырем копиям плазмид использованных при трансформации. g и h) Линия № 10, встройка размером ~ 7 k. Theor Appl Genet (2001) 103: 56– 62 High-resolution structural analysis of biolistic transgene integration into the genome of wheat S. A. Jackson ·et al.
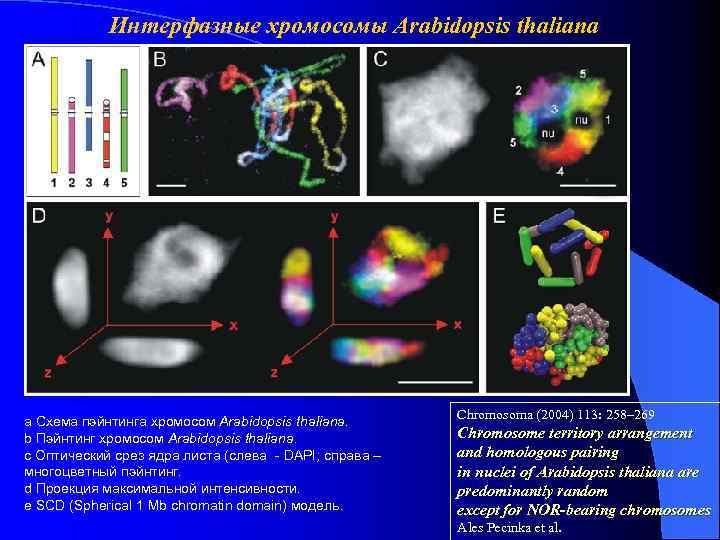
Интерфазные хромосомы Arabidopsis thaliana a Схема пэйнтинга хромосом Arabidopsis thaliana. b Пэйнтинг хромосом Arabidopsis thaliana. c Оптический срез ядра листа (слева - DAPI; справа – многоцветный пэйнтинг. d Проекция максимальной интенсивности. e SCD (Spherical 1 Mb chromatin domain) модель. Chromosoma (2004) 113: 258– 269 Chromosome territory arrangement and homologous pairing in nuclei of Arabidopsis thaliana are predominantly random except for NOR-bearing chromosomes Ales Pecinka et al.
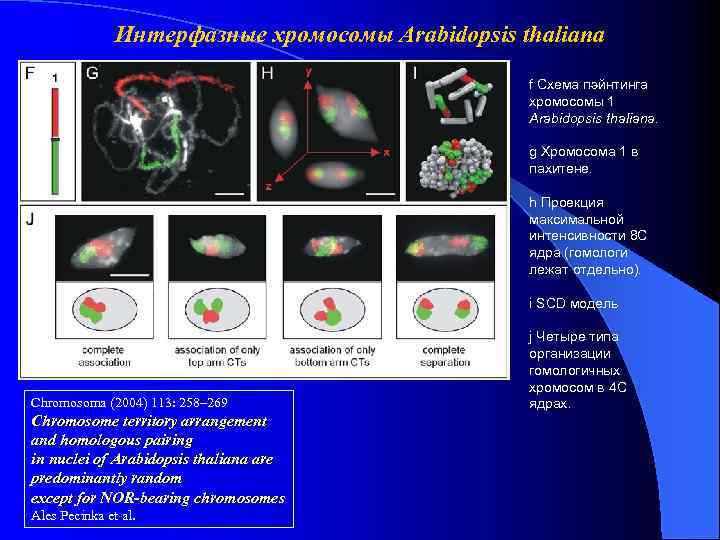
Интерфазные хромосомы Arabidopsis thaliana f Схема пэйнтинга хромосомы 1 Arabidopsis thaliana. g Хромосома 1 в пахитене. h Проекция максимальной интенсивности 8 C ядра (гомологи лежат отдельно). i SCD модель Chromosoma (2004) 113: 258– 269 Chromosome territory arrangement and homologous pairing in nuclei of Arabidopsis thaliana are predominantly random except for NOR-bearing chromosomes Ales Pecinka et al. j Четыре типа организации гомологичных хромосом в 4 C ядрах.
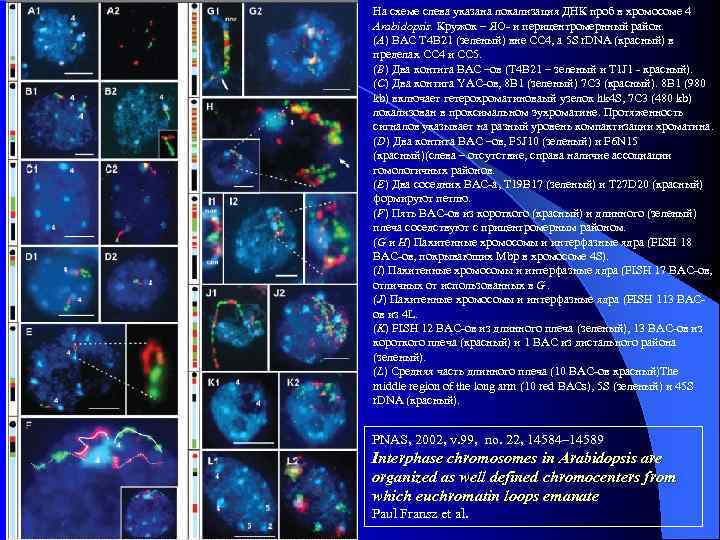
На схеме слева указана локализация ДНК проб в хромосоме 4 Arabidopsis. Кружок – ЯО- и перицентромернный район. (A) BAC T 4 B 21 (зеленый) вне CC 4, а 5 S r. DNA (красный) в пределах CC 4 и CC 5. (B) Два контига BAC –ов (T 4 B 21 – зеленый и T 1 J 1 - красный). (C) Два контига YAC-ов, 8 B 1 (зеленый) 7 C 3 (красный). 8 B 1 (980 kb) включает гетерохроматиноваый узелок hk 4 S, 7 C 3 (480 kb) локализован в проксимальном эухроматине. Протяженность сигналов указывает на разный уровень компактизации хроматина. (D) Два контига BAC –ов, F 5 J 10 (зеленый) и F 6 N 15 (красный)(слева – отсутствие, справа наличие ассоциации гомологичных районов. (E) Два соседних ВАС-а, T 19 B 17 (зеленый) и T 27 D 20 (красный) формируют петлю. (F) Пять BAC-ов из короткого (красный) и длинного (зеленый) плеча соседствуют с прицентромерным районом. (G и H) Пахитенные хромосомы и интерфазные ядра (FISH 18 BAC-ов, покрывающих Mbp в хромосоме 4 S). (I) Пахитенные хромосомы и интерфазные ядра (FISH 17 BAC-ов, отличных от использованных в G. (J) Пахитенные хромосомы и интерфазные ядра (FISH 113 BACов из 4 L. (K) FISH 12 BAC-ов из длинного плеча (зеленый), 13 BAC-ов из короткого плеча (красный) и 1 BAC из дистального района (зеленый). (L) Средняя часть длинного плеча (10 BAC-ов красный)The middle region of the long arm (10 red BACs), 5 S (зеленый) и 45 S r. DNA (красный). PNAS, 2002, v. 99, no. 22, 14584– 14589 Interphase chromosomes in Arabidopsis are organized as well defined chromocenters from which euchromatin loops emanate Paul Fransz et al.
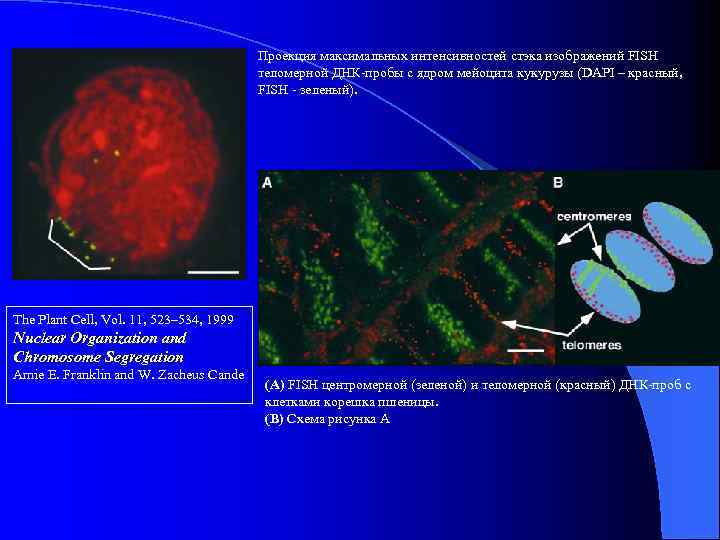
Проекция максимальных интенсивностей стэка изображений FISH теломерной ДНК-пробы с ядром мейоцита кукурузы (DAPI – красный, FISH - зеленый). The Plant Cell, Vol. 11, 523– 534, 1999 Nuclear Organization and Chromosome Segregation Amie E. Franklin and W. Zacheus Cande (A) FISH центромерной (зеленой) и теломерной (красный) ДНК-проб с клетками корешка пшеницы. (B) Схема рисунка А
Цитогенетика 22-24.ppt