 Цинк (Zn) и Кадмий (Cd) ТОМАС Ф. К МГП-10 1
Цинк (Zn) и Кадмий (Cd) ТОМАС Ф. К МГП-10 1
 Цинк и Кадмий ЦИНК КАДМИЙ 2
Цинк и Кадмий ЦИНК КАДМИЙ 2
 История открытия КАДМИЙ ЦИНК Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в. ), Китае (XI в. ). Долгое время не удавалось выделить чистый цинк. В 1746 А. С. Маргграф разработал способ получения чистого цинка путём прокаливания смеси его окиси с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. В промышленном масштабе выплавка цинка началась в XVII в. Открыт немецким профессором Ф. Штромейером в 1817. Провизоры Магдебурга при изучении оксида цинка Zn. O заподозрили в нём примесь мышьяка. Штромейер выделил из Zn. O коричнево-бурый оксид, восстановил его водородом и получил серебристо-белый металл, который получил название кадмий. 3
История открытия КАДМИЙ ЦИНК Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в. ), Китае (XI в. ). Долгое время не удавалось выделить чистый цинк. В 1746 А. С. Маргграф разработал способ получения чистого цинка путём прокаливания смеси его окиси с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. В промышленном масштабе выплавка цинка началась в XVII в. Открыт немецким профессором Ф. Штромейером в 1817. Провизоры Магдебурга при изучении оксида цинка Zn. O заподозрили в нём примесь мышьяка. Штромейер выделил из Zn. O коричнево-бурый оксид, восстановил его водородом и получил серебристо-белый металл, который получил название кадмий. 3
 каламин 4
каламин 4
 Фштромеиер 5
Фштромеиер 5
 А. Макгграф 6
А. Макгграф 6
 ПРИМИНЕНИЯ/ ОБЛАСТИ ПРИМИНЕНИЯ ЦИНК Цинкование В медицине (оксид цинка как антисептик) Производство сплавов Производство резиновых шин Масляные краски КАДМИЙ Сплавы Защитные покрытия Химические источники тока Пигменты Цена 7
ПРИМИНЕНИЯ/ ОБЛАСТИ ПРИМИНЕНИЯ ЦИНК Цинкование В медицине (оксид цинка как антисептик) Производство сплавов Производство резиновых шин Масляные краски КАДМИЙ Сплавы Защитные покрытия Химические источники тока Пигменты Цена 7
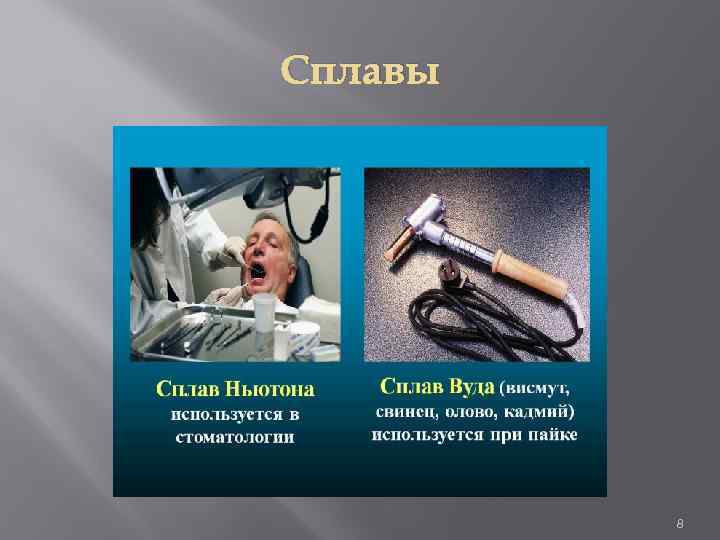 Сплавы 8
Сплавы 8
 Приминение кадмия 9
Приминение кадмия 9
 Халькофильные элементы В соответствии с классификацией норвежского геохимика В. М. Гольдшмидта, к ним относятся химические элементы сульфидных руд, то есть элементы побочных группы периодической системы химических элементов. В их число входит 19 элементов: S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sb, Te, Au, Hg, Tl, Pb, Bi, Po. Металлические халькофильные элементы обладают специфическим сродством к сере, селену и теллуру. На долю всех халькофильных элементов приходится всего 0, 046 % массы земной коры, но из-за способности накапливаться в определённых условиях они образуют рудные месторождения, среди которых доминируют гидротермальные жильные. В осадочных породах сульфиды ряда элементов (меди, свинца, цинка и частично серебра) образуют стратиформные (пластовые) рудные залежи. 10
Халькофильные элементы В соответствии с классификацией норвежского геохимика В. М. Гольдшмидта, к ним относятся химические элементы сульфидных руд, то есть элементы побочных группы периодической системы химических элементов. В их число входит 19 элементов: S, Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sb, Te, Au, Hg, Tl, Pb, Bi, Po. Металлические халькофильные элементы обладают специфическим сродством к сере, селену и теллуру. На долю всех халькофильных элементов приходится всего 0, 046 % массы земной коры, но из-за способности накапливаться в определённых условиях они образуют рудные месторождения, среди которых доминируют гидротермальные жильные. В осадочных породах сульфиды ряда элементов (меди, свинца, цинка и частично серебра) образуют стратиформные (пластовые) рудные залежи. 10
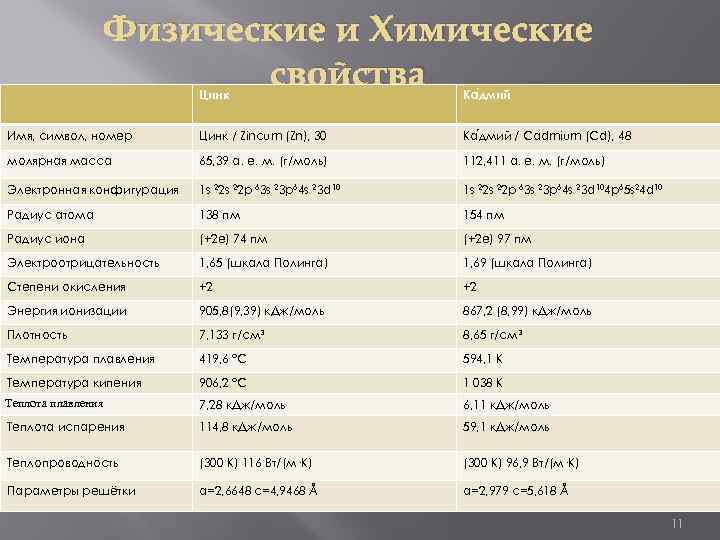 Физические и Химические свойства Цинк Ка дмий Имя, символ, номер Цинк / Zincum (Zn), 30 Ка дмий / Cadmium (Cd), 48 молярная масса 65, 39 а. е. м. (г/моль) 112, 411 а. е. м. (г/моль) Электронная конфигурация 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 10 Радиус атома 138 пм 154 пм Радиус иона (+2 e) 74 пм (+2 e) 97 пм Электроотрицательность 1, 65 (шкала Полинга) 1, 69 (шкала Полинга) Степени окисления +2 +2 Энергия ионизации 905, 8(9, 39) к. Дж/моль 867, 2 (8, 99) к. Дж/моль Плотность 7, 133 г/см³ 8, 65 г/см³ Температура плавления 419, 6 °C 594, 1 K Температура кипения 906, 2 °C 1 038 K Теплота плавления 7, 28 к. Дж/моль 6, 11 к. Дж/моль Теплота испарения 114, 8 к. Дж/моль 59, 1 к. Дж/моль Теплопроводность (300 K) 116 Вт/(м·К) (300 K) 96, 9 Вт/(м·К) Параметры решётки a=2, 6648 c=4, 9468 Å a=2, 979 c=5, 618 Å 11
Физические и Химические свойства Цинк Ка дмий Имя, символ, номер Цинк / Zincum (Zn), 30 Ка дмий / Cadmium (Cd), 48 молярная масса 65, 39 а. е. м. (г/моль) 112, 411 а. е. м. (г/моль) Электронная конфигурация 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 10 Радиус атома 138 пм 154 пм Радиус иона (+2 e) 74 пм (+2 e) 97 пм Электроотрицательность 1, 65 (шкала Полинга) 1, 69 (шкала Полинга) Степени окисления +2 +2 Энергия ионизации 905, 8(9, 39) к. Дж/моль 867, 2 (8, 99) к. Дж/моль Плотность 7, 133 г/см³ 8, 65 г/см³ Температура плавления 419, 6 °C 594, 1 K Температура кипения 906, 2 °C 1 038 K Теплота плавления 7, 28 к. Дж/моль 6, 11 к. Дж/моль Теплота испарения 114, 8 к. Дж/моль 59, 1 к. Дж/моль Теплопроводность (300 K) 116 Вт/(м·К) (300 K) 96, 9 Вт/(м·К) Параметры решётки a=2, 6648 c=4, 9468 Å a=2, 979 c=5, 618 Å 11
 Распространенность цинка и кадмия в земной коре ЦИНК Кадмий относиться к числу редких рассеяных элементов, его кларк (процентное содержание по массе) в земной коре составляет 1. 3 х10 -5%. КАДМИЙ Среднее содержание цинка в земной коре (кларк) — 8, 3× 10 -3% по массе 12
Распространенность цинка и кадмия в земной коре ЦИНК Кадмий относиться к числу редких рассеяных элементов, его кларк (процентное содержание по массе) в земной коре составляет 1. 3 х10 -5%. КАДМИЙ Среднее содержание цинка в земной коре (кларк) — 8, 3× 10 -3% по массе 12
 порядок кларков различных элементов в земной коре по В. Ф. Барабанову Более 10 000 г/т - O, Si, Al, Fe, Ca, Mg, Na, K. 1000 -10 000 - Mn, Ti. 100 -1000 - C, F, P, S, Cl, Rb, Sr, Zr, Ba. 10 -100 - Pb, Th, Y, Nb, La, Ce, Nd, Li, B, N, Sc, V, Cr, Co, Ni, Cu, Zn, Ga. 1 -10 - Eu, Dy, Ho, Er, Yb, Hf, Ta, W, Tl, U, Ge, As, Br, Mo, Sn, Sc, Pm, Sm, Be. 0, 1 -1, 0 - Cd, Bi, In, Tu, I, Sb, Lu. 0, 01 -0, 1 - Ar, Se, Ag, Hg. 0, 001 -0, 01 - Re, Os, Ir, Ru, Rh, Pd, Te, Pt, He, Au 13
порядок кларков различных элементов в земной коре по В. Ф. Барабанову Более 10 000 г/т - O, Si, Al, Fe, Ca, Mg, Na, K. 1000 -10 000 - Mn, Ti. 100 -1000 - C, F, P, S, Cl, Rb, Sr, Zr, Ba. 10 -100 - Pb, Th, Y, Nb, La, Ce, Nd, Li, B, N, Sc, V, Cr, Co, Ni, Cu, Zn, Ga. 1 -10 - Eu, Dy, Ho, Er, Yb, Hf, Ta, W, Tl, U, Ge, As, Br, Mo, Sn, Sc, Pm, Sm, Be. 0, 1 -1, 0 - Cd, Bi, In, Tu, I, Sb, Lu. 0, 01 -0, 1 - Ar, Se, Ag, Hg. 0, 001 -0, 01 - Re, Os, Ir, Ru, Rh, Pd, Te, Pt, He, Au 13
 Распространенность цинка и кадмия в магматических породах ЦИНК КАДМИЙ ультра основн ые основные породы средние кислые породы 3*10^3 1, 3*10^-2 7, 2*10^-3 6*10^-3 средн ультраос ие новные основные поро кислые породы ды породы 5*10^-6 1, 9*10^-5 0 1*10^-5 14
Распространенность цинка и кадмия в магматических породах ЦИНК КАДМИЙ ультра основн ые основные породы средние кислые породы 3*10^3 1, 3*10^-2 7, 2*10^-3 6*10^-3 средн ультраос ие новные основные поро кислые породы ды породы 5*10^-6 1, 9*10^-5 0 1*10^-5 14
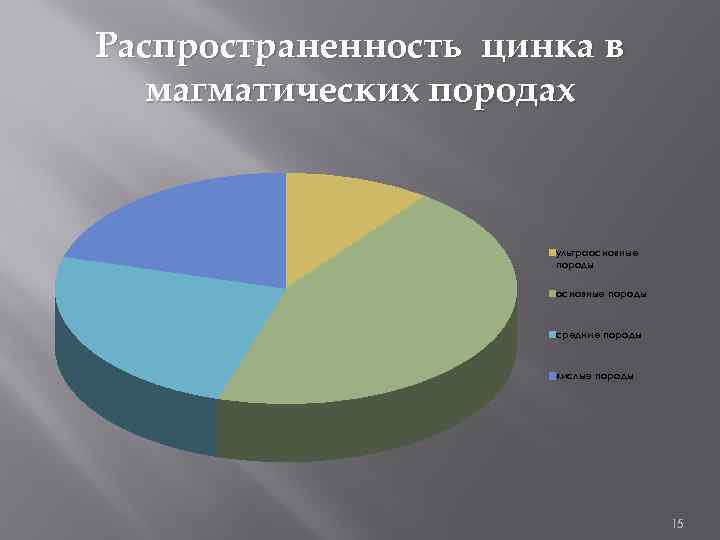 Распространенность цинка в магматических породах ультраосновные породы средние породы кислые породы 15
Распространенность цинка в магматических породах ультраосновные породы средние породы кислые породы 15
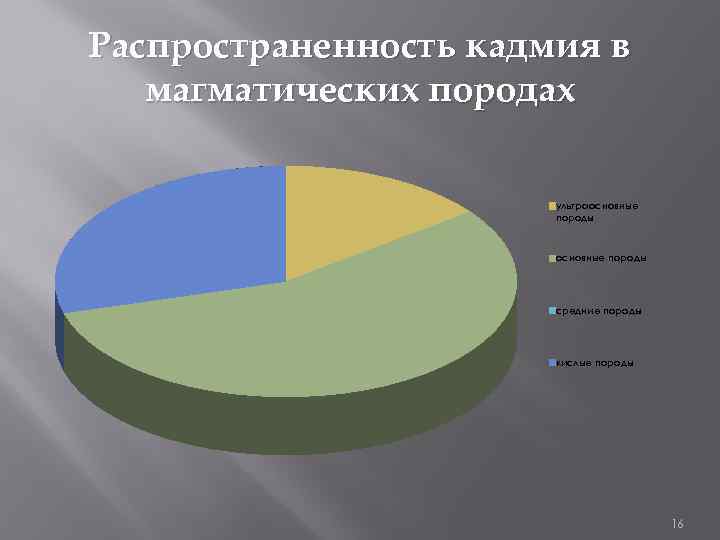 Распространенность кадмия в магматических породах ультраосновные породы средние породы кислые породы 16
Распространенность кадмия в магматических породах ультраосновные породы средние породы кислые породы 16
 Распространенность цинка и кадмия в осадочних породах ЦИНК КАДМИЙ глины и сланцы 9, 5*10^-3 глины и сланцы 3*10^-5 песчаники карбонатные породы 1, 6 *10^-3 песчаники карбонатные породы 0, n *10^-5 2, 0*10^-3 0, 4*10^-5 17
Распространенность цинка и кадмия в осадочних породах ЦИНК КАДМИЙ глины и сланцы 9, 5*10^-3 глины и сланцы 3*10^-5 песчаники карбонатные породы 1, 6 *10^-3 песчаники карбонатные породы 0, n *10^-5 2, 0*10^-3 0, 4*10^-5 17
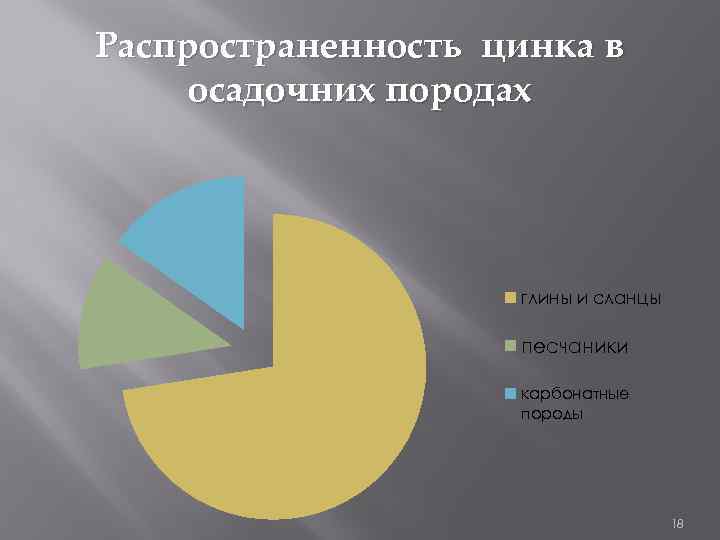 Распространенность цинка в осадочних породах глины и сланцы песчаники карбонатные породы 18
Распространенность цинка в осадочних породах глины и сланцы песчаники карбонатные породы 18
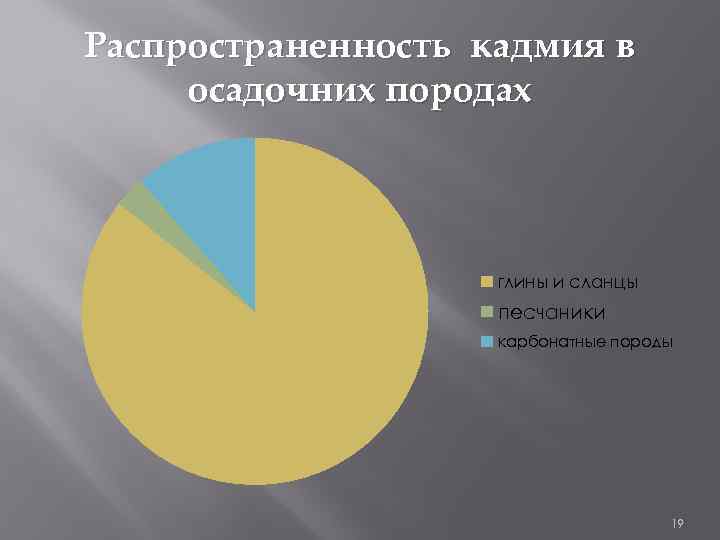 Распространенность кадмия в осадочних породах глины и сланцы песчаники карбонатные породы 19
Распространенность кадмия в осадочних породах глины и сланцы песчаники карбонатные породы 19
 распространенность Цинка и Кадмия в других природных объектах ЦИНК Содержание цинка в воде морей и океанов составляет 0, 01 мг/л. общее количество некоторых растворимых форм химических элементов, содержащихся в морской воде (в млн. т): Cl – 26 513 610 000, Na – 14 746 680 000, SO 42 - - 3 70 370 000, S – 1 216 300 000, HCO 3 - - Mg – 1 776 890 000, Ca – 558 960 000, K – 530 190 000, 195 910 000, Br – 92 201 000, Sr -11 097 000, B – 6 096 000, Si – 4 110 000, …. Mo – 13 700, 850 КАДМИЙ Zn – 6 , Fe -4658, Al – 1370, …Au – 15, 1. Цинк — важный биогенный элемент; в живом веществе содержится в среднем 5× 10 -4% цинка Присутствует кадмий, в определенных количествах и в воздухе По зарубежным данным содержание кадмия в воздухе составляет 0. 1 -5. 0 нг/м 3 в сельской местности (1 нг или 1 нанограмм = 10 -9 грамм), 2 - 15 нг/м 3 - в городах и от 15 до 150 нг/м 3 - в промышленных районах. Кадмий способен накапливаться в растениях (больше всего в грибах) и живых организмах (особенно в водных) В воде 20
распространенность Цинка и Кадмия в других природных объектах ЦИНК Содержание цинка в воде морей и океанов составляет 0, 01 мг/л. общее количество некоторых растворимых форм химических элементов, содержащихся в морской воде (в млн. т): Cl – 26 513 610 000, Na – 14 746 680 000, SO 42 - - 3 70 370 000, S – 1 216 300 000, HCO 3 - - Mg – 1 776 890 000, Ca – 558 960 000, K – 530 190 000, 195 910 000, Br – 92 201 000, Sr -11 097 000, B – 6 096 000, Si – 4 110 000, …. Mo – 13 700, 850 КАДМИЙ Zn – 6 , Fe -4658, Al – 1370, …Au – 15, 1. Цинк — важный биогенный элемент; в живом веществе содержится в среднем 5× 10 -4% цинка Присутствует кадмий, в определенных количествах и в воздухе По зарубежным данным содержание кадмия в воздухе составляет 0. 1 -5. 0 нг/м 3 в сельской местности (1 нг или 1 нанограмм = 10 -9 грамм), 2 - 15 нг/м 3 - в городах и от 15 до 150 нг/м 3 - в промышленных районах. Кадмий способен накапливаться в растениях (больше всего в грибах) и живых организмах (особенно в водных) В воде 20
 основные минералы-носители ЦИНК Zn. S – сфалерит (цинковая обманка), содержит 67, 1 % цинка, цвет – желтый, бурый, чёрный; n. Zn. S·m. Fe. S – марматит, содержит более 60 % цинка, буровато-черный цвет; Zn. O – цинкит, содержит 80, 3 % цинка, темно-красный цвет; Zn. CO 3 – смитсонит, содержит 64, 8 % Zn. O, белый, серый, зеленоватый цвет; Zn 2 Si. O 4(2 Zn. O·Si. O 2 ) – виллемит, содержит 73 % Zn. O, белый, желтый, зеленоватый цвет; H 2 Zn 2 Si. O 5(2 Zn. O·Si. O 2·H 2 O) – каламин, содержит 67, 5 % Zn. O, белый, желтый, зеленоватый цвет; Zn. SO 4 – цинкозит, содержит 50, 3 % Zn. O, в природе встречается редко; Zn. SO 4· 7 H 2 O – госларит, содержит 28, 2 % Zn. O, белый или красноватый цвет. КАДМИИ У кадмия есть собственные минералы – гринокит Cd. S, отавит Cd. CO 3, монтепонит Cd. O, кадмоселит Cd. Se, ксантохроит Cd. S(H 2 O)х и хоулиит. Единственным промышленно значимым источником кадмия являются руды цинка, где он содержится в концентрации 0, 01– 5%. Кадмий накапливается также в галените (до 0, 02%), халькопирите (до 0, 12%), пирите (до 0, 02%), станните (до 0, 2%). Общие мировые ресурсы кадмия оцениваются в 20 млн. т, промышленные – в 600 тыс. т. 21
основные минералы-носители ЦИНК Zn. S – сфалерит (цинковая обманка), содержит 67, 1 % цинка, цвет – желтый, бурый, чёрный; n. Zn. S·m. Fe. S – марматит, содержит более 60 % цинка, буровато-черный цвет; Zn. O – цинкит, содержит 80, 3 % цинка, темно-красный цвет; Zn. CO 3 – смитсонит, содержит 64, 8 % Zn. O, белый, серый, зеленоватый цвет; Zn 2 Si. O 4(2 Zn. O·Si. O 2 ) – виллемит, содержит 73 % Zn. O, белый, желтый, зеленоватый цвет; H 2 Zn 2 Si. O 5(2 Zn. O·Si. O 2·H 2 O) – каламин, содержит 67, 5 % Zn. O, белый, желтый, зеленоватый цвет; Zn. SO 4 – цинкозит, содержит 50, 3 % Zn. O, в природе встречается редко; Zn. SO 4· 7 H 2 O – госларит, содержит 28, 2 % Zn. O, белый или красноватый цвет. КАДМИИ У кадмия есть собственные минералы – гринокит Cd. S, отавит Cd. CO 3, монтепонит Cd. O, кадмоселит Cd. Se, ксантохроит Cd. S(H 2 O)х и хоулиит. Единственным промышленно значимым источником кадмия являются руды цинка, где он содержится в концентрации 0, 01– 5%. Кадмий накапливается также в галените (до 0, 02%), халькопирите (до 0, 12%), пирите (до 0, 02%), станните (до 0, 2%). Общие мировые ресурсы кадмия оцениваются в 20 млн. т, промышленные – в 600 тыс. т. 21
 Поведение в геологических процессах В изверженных породах Zn находится в виде тонкорассеянного сульфида, в виде изоморфной примеси в слюдах, амфиболах (ионной радиус Zn 2+ =0, 083 нм определяет изоморфизм с Fe 2+ и Mn 2+) Zn энергично мигрирует в гидротермах , в которых он образует различные комплексы и осаждается вместе с Pb, Ag и другими халькофилами, образуя различные сульфиды. концентрация Cd связана с гидротермальными процессами , в которых он является аналогом Zn, накапливается в сфалелите до 5%. 22
Поведение в геологических процессах В изверженных породах Zn находится в виде тонкорассеянного сульфида, в виде изоморфной примеси в слюдах, амфиболах (ионной радиус Zn 2+ =0, 083 нм определяет изоморфизм с Fe 2+ и Mn 2+) Zn энергично мигрирует в гидротермах , в которых он образует различные комплексы и осаждается вместе с Pb, Ag и другими халькофилами, образуя различные сульфиды. концентрация Cd связана с гидротермальными процессами , в которых он является аналогом Zn, накапливается в сфалелите до 5%. 22
 Геохимические барьеры цинка и кадмия Сульфидный (серододный) Щелочной Кислый Испарительный Термодинамический Сорбционный 23
Геохимические барьеры цинка и кадмия Сульфидный (серододный) Щелочной Кислый Испарительный Термодинамический Сорбционный 23
 в термрдинамических барьерах Например в термрдинамических барьерах по околобатолитовой теории крупного американского ученного В. Эммонса, который полагал , что по мере остывания гранитных батолитов из постмагматических растворов сначала осаждались Sn, Mo и другие элементы высокотемпературных месторождений потом Cu, Zn, Pb и другие элементы среднетемпературных месторождений и наконец элементы низкотемпературных месторождений Ряд эммонса: Sn, W, As, Bi, Au, Cu, Zn, Pb, Ag, Au, Sb, Hg. 24
в термрдинамических барьерах Например в термрдинамических барьерах по околобатолитовой теории крупного американского ученного В. Эммонса, который полагал , что по мере остывания гранитных батолитов из постмагматических растворов сначала осаждались Sn, Mo и другие элементы высокотемпературных месторождений потом Cu, Zn, Pb и другие элементы среднетемпературных месторождений и наконец элементы низкотемпературных месторождений Ряд эммонса: Sn, W, As, Bi, Au, Cu, Zn, Pb, Ag, Au, Sb, Hg. 24
 Формы нахождения ЦИНК Самородный цинк в природе не найден. Цинк встречается в рудах главным образом в виде соединений с серой или кислородом. КАДМИЙ Кадмий относится к редким, рассеянным элементам: он содержится в виде изоморфной примеси во многих минералах и всегда в минералах цинка. 25
Формы нахождения ЦИНК Самородный цинк в природе не найден. Цинк встречается в рудах главным образом в виде соединений с серой или кислородом. КАДМИЙ Кадмий относится к редким, рассеянным элементам: он содержится в виде изоморфной примеси во многих минералах и всегда в минералах цинка. 25
 Участие цинка и кадмия в биологическом круговороте у цинка и кадмия как другие элементы есть интенсивность биологического поглощения их в органах разных растений На пример У сосны устойчивый характер распределения элементов по всему высотно-экологическому профилю присущ для тонких веток (Cd > Cu > Zn > Pb), корней (Cu > Cd > Zn > Pb) и отчасти хвои (Cu > Zn > Cd > Pb). У березы по всему профилю не меняются особенности распределения элементов в ветках и листьях (Cd > Zn > Cu > Pb), корнях (Zn > Cu > Cd > Pb). В настоящее время из 92 встречающихся в природе элементов 81 обнаружен в организме человека. При этом 15 из них (Fe, I, Cu, Zn, Co, Cr, Mo, Ni, V, Se, Mn, As, F, Si, Li) признаны жизненно необходимыми. Однако они могут оказывать отрицательное влияние на растения, животных и человека, если концентрация их доступных форм превышает определенные пределы. Cd, Pb, Sn и Rb считаются условно необходимыми, т. к. они, по всей видимости, не очень важны для растений и животных и опасны для здоровья человека даже при относительно низких концентрациях. 26
Участие цинка и кадмия в биологическом круговороте у цинка и кадмия как другие элементы есть интенсивность биологического поглощения их в органах разных растений На пример У сосны устойчивый характер распределения элементов по всему высотно-экологическому профилю присущ для тонких веток (Cd > Cu > Zn > Pb), корней (Cu > Cd > Zn > Pb) и отчасти хвои (Cu > Zn > Cd > Pb). У березы по всему профилю не меняются особенности распределения элементов в ветках и листьях (Cd > Zn > Cu > Pb), корнях (Zn > Cu > Cd > Pb). В настоящее время из 92 встречающихся в природе элементов 81 обнаружен в организме человека. При этом 15 из них (Fe, I, Cu, Zn, Co, Cr, Mo, Ni, V, Se, Mn, As, F, Si, Li) признаны жизненно необходимыми. Однако они могут оказывать отрицательное влияние на растения, животных и человека, если концентрация их доступных форм превышает определенные пределы. Cd, Pb, Sn и Rb считаются условно необходимыми, т. к. они, по всей видимости, не очень важны для растений и животных и опасны для здоровья человека даже при относительно низких концентрациях. 26
 поведение в водной и воздушной средах ЦИНК Стандартный электродны потенциал цинка -0, 76 В. Компактный цинк тускнеет на воздухе, покрываясь тонким слоем цинка оксида, влажный воздух, особенно в присут. СО 2, постепенно разрушает цинк при комнатной т-ре. При сильном нагр. на воздухетцинк сгорает с образованием Zn. O. Пары воды при красном калении реагируют с цинком с выделением Н 2. Цинк обычной чистоты легко взаимод. с к-тами с образованием солей и с р-рами щелочей с образованием гидроцинкатов, напр. Na 2[Zn(OH)4], раств. в р-рах NH 3 и солей аммония, Fе. С 1 3, вытесняет Сu, Cd и др. более электроположит. Металлы из р-ров их солей. Цинк высокой чистоты почти не реагирует ни с ктами, ни с р-рами щелочей. Цинк не взаимод. с Н 2, но Н 2 незначительно раств. в цинке при повышенных т-рах. КАДМИЙ В сухом воздухе кадмий устойчив во влажном на его поверхности медленно образуется тонкая пленка оксида. На воздухе выше температуры плавления кадмий сгорает с образованием бурого Cd. O Пары кадмия реагируют с парами воды с выделением водорода. Медленно взаимодействует с минеральными кислотами (легче всего с HNO 3) с образованием солей. Соли кадмия бесцветны. В растворах молекулы многих солей, в частности галогенидов, сильно ассоциированы; растворы имеют слабокислую реакцию вследствие гидролиза. При действии растворов щелочей. начиная с р. Н 7 -8, осаждаются гидроксосоли. Кадмий восстанавливает NH 4 NO 3 в концентрированных растворах до NH 4 NO 2. Окисляется до Cd(II) растворами Сu. Сl 2, солей Fe(III). С растворами щелочей. в отличие от Zn, не взаимодействует. 27
поведение в водной и воздушной средах ЦИНК Стандартный электродны потенциал цинка -0, 76 В. Компактный цинк тускнеет на воздухе, покрываясь тонким слоем цинка оксида, влажный воздух, особенно в присут. СО 2, постепенно разрушает цинк при комнатной т-ре. При сильном нагр. на воздухетцинк сгорает с образованием Zn. O. Пары воды при красном калении реагируют с цинком с выделением Н 2. Цинк обычной чистоты легко взаимод. с к-тами с образованием солей и с р-рами щелочей с образованием гидроцинкатов, напр. Na 2[Zn(OH)4], раств. в р-рах NH 3 и солей аммония, Fе. С 1 3, вытесняет Сu, Cd и др. более электроположит. Металлы из р-ров их солей. Цинк высокой чистоты почти не реагирует ни с ктами, ни с р-рами щелочей. Цинк не взаимод. с Н 2, но Н 2 незначительно раств. в цинке при повышенных т-рах. КАДМИЙ В сухом воздухе кадмий устойчив во влажном на его поверхности медленно образуется тонкая пленка оксида. На воздухе выше температуры плавления кадмий сгорает с образованием бурого Cd. O Пары кадмия реагируют с парами воды с выделением водорода. Медленно взаимодействует с минеральными кислотами (легче всего с HNO 3) с образованием солей. Соли кадмия бесцветны. В растворах молекулы многих солей, в частности галогенидов, сильно ассоциированы; растворы имеют слабокислую реакцию вследствие гидролиза. При действии растворов щелочей. начиная с р. Н 7 -8, осаждаются гидроксосоли. Кадмий восстанавливает NH 4 NO 3 в концентрированных растворах до NH 4 NO 2. Окисляется до Cd(II) растворами Сu. Сl 2, солей Fe(III). С растворами щелочей. в отличие от Zn, не взаимодействует. 27
 Соединения цинка На воздухе цинк покрывается тонкой пленкой оксида Zn. O. При сильном нагревании сгорает с образованием амфотерного белого оксида Zn. O: Оксид цинка реагирует как с растворами кислот так и щелочами: Цинк обычной чистоты активно реагирует с растворами кислот 28
Соединения цинка На воздухе цинк покрывается тонкой пленкой оксида Zn. O. При сильном нагревании сгорает с образованием амфотерного белого оксида Zn. O: Оксид цинка реагирует как с растворами кислот так и щелочами: Цинк обычной чистоты активно реагирует с растворами кислот 28
 Соединения кадмия В сухой атмосфере кадмий устойчив, во влажной постепенно покрывается пленкой оксида Cd. O. Выше температуры плавления кадмий горит на воздухе с образованием оксида Cd. O бурого цвета: 2 Сd + O 2 = 2 Cd. O. Пары кадмия реагируют с парами воды с образованием водорода Cd + H 2 O = Cd. O + H 2↑. По сравнению со своим соседом по группе IIB — цинком кадмий медленнее реагирует с кислотами: Сd + 2 HCl = Cd. Cl 2 + H 2↑. Легче всего реакция протекает с азотной кислотой: 3 Cd + 8 HNO 3 = 3 Cd(NO 3)2 + 2 NO↑ + 4 H 2 O. И. т. п 29
Соединения кадмия В сухой атмосфере кадмий устойчив, во влажной постепенно покрывается пленкой оксида Cd. O. Выше температуры плавления кадмий горит на воздухе с образованием оксида Cd. O бурого цвета: 2 Сd + O 2 = 2 Cd. O. Пары кадмия реагируют с парами воды с образованием водорода Cd + H 2 O = Cd. O + H 2↑. По сравнению со своим соседом по группе IIB — цинком кадмий медленнее реагирует с кислотами: Сd + 2 HCl = Cd. Cl 2 + H 2↑. Легче всего реакция протекает с азотной кислотой: 3 Cd + 8 HNO 3 = 3 Cd(NO 3)2 + 2 NO↑ + 4 H 2 O. И. т. п 29
 Со щелочами кадмий не реагирует 30
Со щелочами кадмий не реагирует 30
 Основные типы месторождений ЦИНК Свинцово-цинковые месторождения, и их основные промышленные типы: Вулканогенно гидротермальный Скарновый Стратиформный Месторождения цинка известны в Австралии, Боливии В России крупнейшим производителем свинцовоцинковых концентратов является ОАО "ГМК Дальполиметалл КАДМИЙ Хотя известны самостоятельные минералы кадмия - гринокит (Cd. S), отавит (Cd. CO 3), монтепонит (Cd. O) и селенид (Cd. Se), своих месторождений они не образуют, а присутствуют в виде примесей в цинковых, свинцовых, медных и полиметаллических рудах, которые и являются основным источником промышленной добычи кадмия. 31
Основные типы месторождений ЦИНК Свинцово-цинковые месторождения, и их основные промышленные типы: Вулканогенно гидротермальный Скарновый Стратиформный Месторождения цинка известны в Австралии, Боливии В России крупнейшим производителем свинцовоцинковых концентратов является ОАО "ГМК Дальполиметалл КАДМИЙ Хотя известны самостоятельные минералы кадмия - гринокит (Cd. S), отавит (Cd. CO 3), монтепонит (Cd. O) и селенид (Cd. Se), своих месторождений они не образуют, а присутствуют в виде примесей в цинковых, свинцовых, медных и полиметаллических рудах, которые и являются основным источником промышленной добычи кадмия. 31


