Цинк, ртуть.ppt
- Количество слайдов: 48
 Цинк, ртуть и их соединения
Цинк, ртуть и их соединения

 Электронно-графическая формула атома цинка: Элементы d-семейства
Электронно-графическая формула атома цинка: Элементы d-семейства
 Электронно-графическая формула атома кадмия: Элементы d-семейства
Электронно-графическая формула атома кадмия: Элементы d-семейства
 Zn 0 – 2 e → Zn 2+ Степени окисления 0, +2. Валентность II Hg 0 – 1 e → Hg+ Hg 0 – 2 e → Hg 2+ Степени окисления 0, +1, +2. Валентность I, II
Zn 0 – 2 e → Zn 2+ Степени окисления 0, +2. Валентность II Hg 0 – 1 e → Hg+ Hg 0 – 2 e → Hg 2+ Степени окисления 0, +1, +2. Валентность I, II
 Физические свойства
Физические свойства


 Металл голубовато -белого цвета, на воздухе покрывается оксидной пленкой и тускнеет. Хрупкий на холоду, при нагревании – пластичен.
Металл голубовато -белого цвета, на воздухе покрывается оксидной пленкой и тускнеет. Хрупкий на холоду, при нагревании – пластичен.

 Серебристо-белый металл, жидкий при комнатной температуре (t плавления = -39ºС). Ядовит! Растворяет многие металлы, образуя амальгамы.
Серебристо-белый металл, жидкий при комнатной температуре (t плавления = -39ºС). Ядовит! Растворяет многие металлы, образуя амальгамы.
 Нахождение в природе.
Нахождение в природе.
 Сфалерит (цинковая обманка) (Zn. S)
Сфалерит (цинковая обманка) (Zn. S)
 Ганит (цинковая шпинель) Zn. O·Al 2 O 3
Ганит (цинковая шпинель) Zn. O·Al 2 O 3
 Цинкит (красная цинковая руда) (Zn. O)
Цинкит (красная цинковая руда) (Zn. O)
 Цинкит (красная цинковая руда) (Zn. O)
Цинкит (красная цинковая руда) (Zn. O)
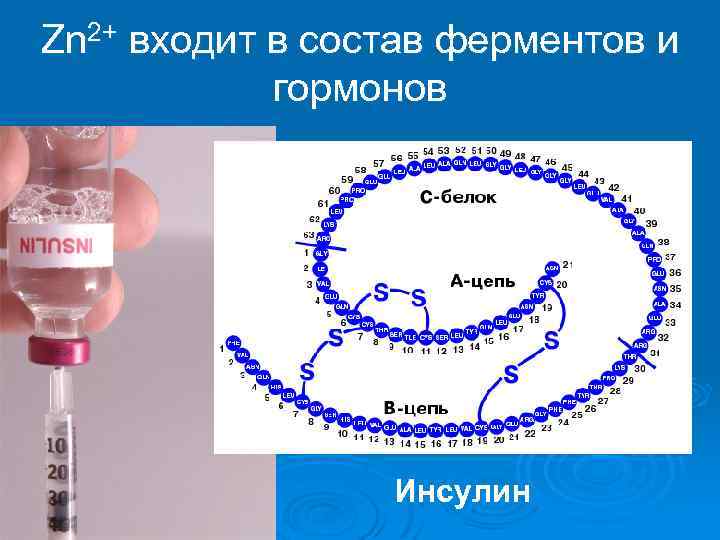 Zn 2+ входит в состав ферментов и гормонов Инсулин
Zn 2+ входит в состав ферментов и гормонов Инсулин
 Киноварь Hg. S
Киноварь Hg. S
 Киноварь Hg. S
Киноварь Hg. S
 Способы получения: 2 Zn. S + 3 O 2 → 2 Zn. O + 2 SO 2 Ø Пирометаллургический способ: Zn. O + C → Zn + CO Ø Гидрометаллургический способ: Zn. O + H 2 SO 4 → Zn. SO 4 + H 2 O с последующим электрлизом Zn. SO 4 Hg. S + O 2 → Hg + SO 2
Способы получения: 2 Zn. S + 3 O 2 → 2 Zn. O + 2 SO 2 Ø Пирометаллургический способ: Zn. O + C → Zn + CO Ø Гидрометаллургический способ: Zn. O + H 2 SO 4 → Zn. SO 4 + H 2 O с последующим электрлизом Zn. SO 4 Hg. S + O 2 → Hg + SO 2
 Химические свойства
Химические свойства
 Взаимодействие с простыми веществами: Zn + Cl 2 → 2 Zn + O 2 → Zn + S → Zn. Cl 2 2 Zn. O Zn. S 3 Zn + 2 P → Zn 3 P 2 фосфид цинка Zn + H 2 → Zn. H 2 гидрид цинка
Взаимодействие с простыми веществами: Zn + Cl 2 → 2 Zn + O 2 → Zn + S → Zn. Cl 2 2 Zn. O Zn. S 3 Zn + 2 P → Zn 3 P 2 фосфид цинка Zn + H 2 → Zn. H 2 гидрид цинка
 Взаимодействие со сложными веществами: Zn + H 2 O ≠ Zn + 2 HCl → Zn. Cl 2 + H 2 O Zn + H 2 SO 4(разб. ) → Zn. SO 4 + H 2 O 3 Zn + 4 H 2 SO 4(конц. ) → 3 Zn. SO 4 + S↓ + 4 H 2 O
Взаимодействие со сложными веществами: Zn + H 2 O ≠ Zn + 2 HCl → Zn. Cl 2 + H 2 O Zn + H 2 SO 4(разб. ) → Zn. SO 4 + H 2 O 3 Zn + 4 H 2 SO 4(конц. ) → 3 Zn. SO 4 + S↓ + 4 H 2 O
 Взаимодействие с азотной кислотой: 4 Zn + 10 HNO 3(оч. разб. )→ 4 Zn(NO 3)2 + NH 4 NO 3 + 3 H 2 O 3 Zn + 8 HNO 3(разб. ) → 3 Zn(NO 3)2 + 2 NO↑ + 4 H 2 O Zn + 4 HNO 3(конц. ) → Zn(NO 3)2 + 2 NO 2↑ + 2 H 2 O
Взаимодействие с азотной кислотой: 4 Zn + 10 HNO 3(оч. разб. )→ 4 Zn(NO 3)2 + NH 4 NO 3 + 3 H 2 O 3 Zn + 8 HNO 3(разб. ) → 3 Zn(NO 3)2 + 2 NO↑ + 4 H 2 O Zn + 4 HNO 3(конц. ) → Zn(NO 3)2 + 2 NO 2↑ + 2 H 2 O
 Взаимодействие цинка с концентрированной азотной кислотой.
Взаимодействие цинка с концентрированной азотной кислотой.
 Взаимодействие со сложными веществами: С солями: Zn + Sn. Cl 2 → Sn↓ + Zn. Cl 2 Со щелочами: Zn + 2 KOH → K 2 Zn. O 2 + H 2↑ Zn + 2 KOH + 2 H 2 O → K 2[Zn(OH)4] + H 2↑ Zn + 4 NH 4 OH → [Zn(NH 3)4](OH)2 + H 2↑ + 2 H 2 O
Взаимодействие со сложными веществами: С солями: Zn + Sn. Cl 2 → Sn↓ + Zn. Cl 2 Со щелочами: Zn + 2 KOH → K 2 Zn. O 2 + H 2↑ Zn + 2 KOH + 2 H 2 O → K 2[Zn(OH)4] + H 2↑ Zn + 4 NH 4 OH → [Zn(NH 3)4](OH)2 + H 2↑ + 2 H 2 O
 Взаимодействие с простыми веществами: Hg + Cl 2(изб. ) → Hg. Cl 2 2 Hg(изб. ) + Cl 2 → Hg 2 Cl 2 Hg + S(изб. ) → Hg. S 2 Hg(изб. ) + S → Hg 2 S 2 Hg + O 2 → 2 Hg. O (неустойчив, сразу разлагается)
Взаимодействие с простыми веществами: Hg + Cl 2(изб. ) → Hg. Cl 2 2 Hg(изб. ) + Cl 2 → Hg 2 Cl 2 Hg + S(изб. ) → Hg. S 2 Hg(изб. ) + S → Hg 2 S 2 Hg + O 2 → 2 Hg. O (неустойчив, сразу разлагается)

 Взаимодействие со сложными веществами: Hg + H 2 O ≠ Hg + HCl ≠ Hg + H 2 SO 4(разб. ) ≠ Hg + 2 H 2 SO 4(конц. ) → Hg. SO + SO ↑ 4 2 + 2 H 2 O
Взаимодействие со сложными веществами: Hg + H 2 O ≠ Hg + HCl ≠ Hg + H 2 SO 4(разб. ) ≠ Hg + 2 H 2 SO 4(конц. ) → Hg. SO + SO ↑ 4 2 + 2 H 2 O
 Взаимодействие с простыми веществами: 3 Hg + 8 HNO 3(разб. ) → 3 Hg(NO 3)2 + 2 NO↑ + 4 H 2 O Hg + 4 HNO 3(конц. ) → Hg(NO 3)2 + 2 NO 2↑ + 2 H 2 O 2 Hg(изб. ) + 4 HNO 3(конц. ) → Hg 2(NO 3)2 + 2 NO 2↑ + 2 H 2 O
Взаимодействие с простыми веществами: 3 Hg + 8 HNO 3(разб. ) → 3 Hg(NO 3)2 + 2 NO↑ + 4 H 2 O Hg + 4 HNO 3(конц. ) → Hg(NO 3)2 + 2 NO 2↑ + 2 H 2 O 2 Hg(изб. ) + 4 HNO 3(конц. ) → Hg 2(NO 3)2 + 2 NO 2↑ + 2 H 2 O
 Соединения цинка
Соединения цинка
 Оксид цинка Zn. O – порошок белого цвета
Оксид цинка Zn. O – порошок белого цвета
 Амфотерные свойства оксида цинка: С кислотой: Zn. O + H 2 SO 4 → Zn. SO 4 + H 2 O Со щелочью: Ø в расплаве Zn. O + 2 KOH → K 2 Zn. O 2 + H 2 O цинкат натрия Ø в растворе Zn. O + 2 KOH + H 2 O → K 2[Zn(OH)4] тетрагидроксоцинкат калия
Амфотерные свойства оксида цинка: С кислотой: Zn. O + H 2 SO 4 → Zn. SO 4 + H 2 O Со щелочью: Ø в расплаве Zn. O + 2 KOH → K 2 Zn. O 2 + H 2 O цинкат натрия Ø в растворе Zn. O + 2 KOH + H 2 O → K 2[Zn(OH)4] тетрагидроксоцинкат калия
 Гидроксид цинка Zn(OH)2 – твердое вещество белого цвета Zn. O + H 2 O ≠ Zn. SO 4 + 2 Na. OH → → Zn(OH)2↓ + Na 2 SO 4
Гидроксид цинка Zn(OH)2 – твердое вещество белого цвета Zn. O + H 2 O ≠ Zn. SO 4 + 2 Na. OH → → Zn(OH)2↓ + Na 2 SO 4
 Амфотерные свойства гидроксида цинка: С кислотой: Zn(OH)2 + 2 HNO 3 → Zn(NO 3)2 + 2 H 2 O Со щелочью: Ø в расплаве Zn(OH)2 + 2 Na. OH → Na 2 Zn. O 2 + 2 H 2 O цинкат натрия Ø в растворе Zn(OH)2 + 2 Na. OH → Na 2[Zn(OH)4] тетрагидроксоцинкат натрия
Амфотерные свойства гидроксида цинка: С кислотой: Zn(OH)2 + 2 HNO 3 → Zn(NO 3)2 + 2 H 2 O Со щелочью: Ø в расплаве Zn(OH)2 + 2 Na. OH → Na 2 Zn. O 2 + 2 H 2 O цинкат натрия Ø в растворе Zn(OH)2 + 2 Na. OH → Na 2[Zn(OH)4] тетрагидроксоцинкат натрия
 Гидроксид цинка растворяется в аммиаке: Zn(OH)2 + 4 NH 4 OH → → [Zn(NH 3)4](OH)2 + 4 H 2 O гидроксид тетраамминцинка
Гидроксид цинка растворяется в аммиаке: Zn(OH)2 + 4 NH 4 OH → → [Zn(NH 3)4](OH)2 + 4 H 2 O гидроксид тетраамминцинка
 Гидролиз солей цинка: Zn. SO 4 + 2 H 2 O ↔ H 2 SO 4 + Zn(OH)2↓ Zn 2+ + SO 42 - + 2 H 2 O ↔ 2 H+ + SO 42 - + Zn(OH)2↓ Zn 2+ + 2 H 2 O ↔ 2 H+ + Zn(OH)2↓ среда кислая
Гидролиз солей цинка: Zn. SO 4 + 2 H 2 O ↔ H 2 SO 4 + Zn(OH)2↓ Zn 2+ + SO 42 - + 2 H 2 O ↔ 2 H+ + SO 42 - + Zn(OH)2↓ Zn 2+ + 2 H 2 O ↔ 2 H+ + Zn(OH)2↓ среда кислая
 Качественная реакция на катионы Zn 2+: Zn. Cl 2 + Na 2 S → Zn. S↓ + 2 Na. Cl бледно-желтый осадок
Качественная реакция на катионы Zn 2+: Zn. Cl 2 + Na 2 S → Zn. S↓ + 2 Na. Cl бледно-желтый осадок
 Соединения ртути
Соединения ртути
 Оксид ртути (II) Hg. O – порошок оранжевого цвета Обладает основными свойствами. Hg. O + 2 HNO 3 → → Hg(NO 3)2 + H 2 O
Оксид ртути (II) Hg. O – порошок оранжевого цвета Обладает основными свойствами. Hg. O + 2 HNO 3 → → Hg(NO 3)2 + H 2 O
 Оксид (Hg. O) и гидроксид ртути (II) Hg(OH)2 – неустойчивы 2 Hg. O → 2 Hg + O 2 Hg. Cl 2 + 2 Na. OH → → Hg. O + H 2 O + 2 Na. Cl
Оксид (Hg. O) и гидроксид ртути (II) Hg(OH)2 – неустойчивы 2 Hg. O → 2 Hg + O 2 Hg. Cl 2 + 2 Na. OH → → Hg. O + H 2 O + 2 Na. Cl
 Соединения ртути: Ø Hg. Cl 2 – сулема бесцветное кристаллическое вещество Ø Hg 2 Cl 2 – каломель белый порошок Ø Hg. I 2 – иодид ртути (II) оранжевый порошок
Соединения ртути: Ø Hg. Cl 2 – сулема бесцветное кристаллическое вещество Ø Hg 2 Cl 2 – каломель белый порошок Ø Hg. I 2 – иодид ртути (II) оранжевый порошок
 Качественная реакция на катион Hg 2+: Hg. Cl 2 + 2 Na. I → Hg. I 2↓ + 2 Na. Cl оранжевый осадок Hg. I 2 + 2 KI(изб. ) → K 2[Hg. I 4] растворение осадка тетраиодогидрагират (II) калия реактив Несслера
Качественная реакция на катион Hg 2+: Hg. Cl 2 + 2 Na. I → Hg. I 2↓ + 2 Na. Cl оранжевый осадок Hg. I 2 + 2 KI(изб. ) → K 2[Hg. I 4] растворение осадка тетраиодогидрагират (II) калия реактив Несслера
 Переход соединений ртути (II) Hg 2+ в соединения ртути (I) Hg+: Hg + Hg(NO 3)2 → Hg 2(NO 3)2 Hg + Hg. Cl 2 → Hg 2 Cl 2
Переход соединений ртути (II) Hg 2+ в соединения ртути (I) Hg+: Hg + Hg(NO 3)2 → Hg 2(NO 3)2 Hg + Hg. Cl 2 → Hg 2 Cl 2
 Роль меди в организме: Содержание в организме – 150 мг. Входит в состав: Ø Дыхательных ферментов; Ø Белков, участвующих в переносе кислорода кровью. Недостаток – болезнь Менкеса; Избыток – болезнь Вильсона-Коновалова.
Роль меди в организме: Содержание в организме – 150 мг. Входит в состав: Ø Дыхательных ферментов; Ø Белков, участвующих в переносе кислорода кровью. Недостаток – болезнь Менкеса; Избыток – болезнь Вильсона-Коновалова.
 Применение в медицине и фармации: Сульфат меди (II) Cu. SO 4 : Ø Антисептическое, вяжущее средство. Ø Используется при коньюнктивитах и заболеваниях органов мочеполовой системы.
Применение в медицине и фармации: Сульфат меди (II) Cu. SO 4 : Ø Антисептическое, вяжущее средство. Ø Используется при коньюнктивитах и заболеваниях органов мочеполовой системы.
 Применение в медицине и фармации: Нитрат серебра (ляпис) Ag. NO 3 : Ø Вяжущее и противовоспалительное действие; Ø Прижигающее действие; Протаргол – коллоидный раствор протеината серебра: Ø Антисептическое и противовоспалительное средство; Ø Орошают слизистые оболочки глаз, органов дыхательной и мочеполовой системы.
Применение в медицине и фармации: Нитрат серебра (ляпис) Ag. NO 3 : Ø Вяжущее и противовоспалительное действие; Ø Прижигающее действие; Протаргол – коллоидный раствор протеината серебра: Ø Антисептическое и противовоспалительное средство; Ø Орошают слизистые оболочки глаз, органов дыхательной и мочеполовой системы.


