ОРГАНИЧЕСКАЯ ХИМИЯ-4-chem-bis.ppt
- Количество слайдов: 16
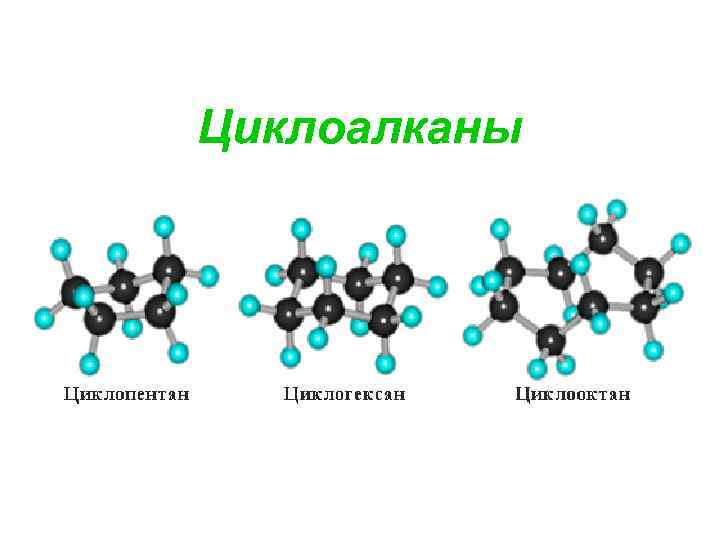 Циклоалканы
Циклоалканы
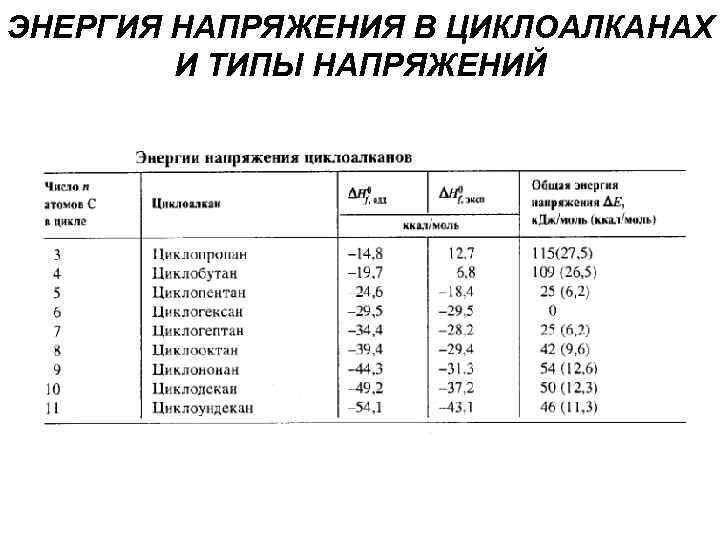 ЭНЕРГИЯ НАПРЯЖЕНИЯ В ЦИКЛОАЛКАНАХ И ТИПЫ НАПРЯЖЕНИЙ
ЭНЕРГИЯ НАПРЯЖЕНИЯ В ЦИКЛОАЛКАНАХ И ТИПЫ НАПРЯЖЕНИЙ
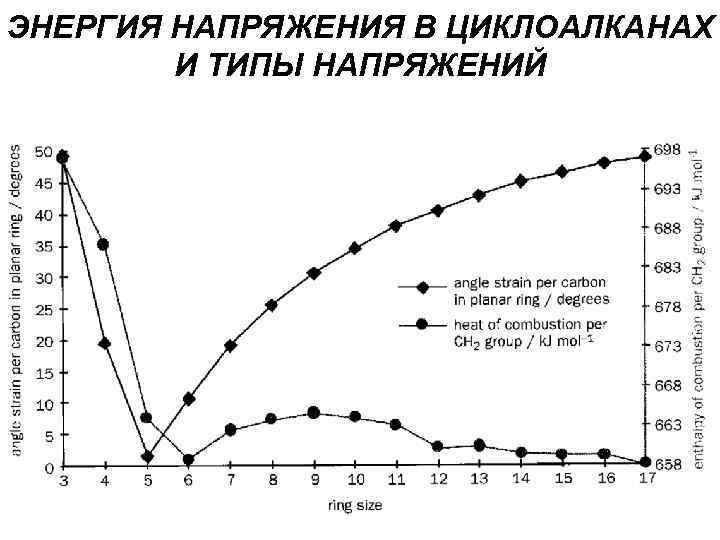 ЭНЕРГИЯ НАПРЯЖЕНИЯ В ЦИКЛОАЛКАНАХ И ТИПЫ НАПРЯЖЕНИЙ
ЭНЕРГИЯ НАПРЯЖЕНИЯ В ЦИКЛОАЛКАНАХ И ТИПЫ НАПРЯЖЕНИЙ
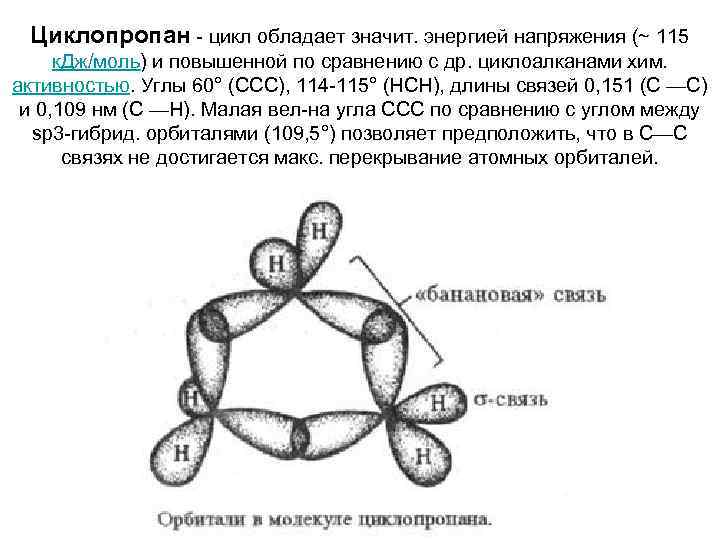 Циклопропан - цикл обладает значит. энергией напряжения (~ 115 к. Дж/моль) и повышенной по сравнению с др. циклоалканами хим. активностью. Углы 60° (ССС), 114 -115° (НСН), длины связей 0, 151 (С —С) и 0, 109 нм (С —Н). Малая вел-на угла ССС по сравнению с углом между sр3 -гибрид. орбиталями (109, 5°) позволяет предположить, что в С—С связях не достигается макс. перекрывание атомных орбиталей.
Циклопропан - цикл обладает значит. энергией напряжения (~ 115 к. Дж/моль) и повышенной по сравнению с др. циклоалканами хим. активностью. Углы 60° (ССС), 114 -115° (НСН), длины связей 0, 151 (С —С) и 0, 109 нм (С —Н). Малая вел-на угла ССС по сравнению с углом между sр3 -гибрид. орбиталями (109, 5°) позволяет предположить, что в С—С связях не достигается макс. перекрывание атомных орбиталей.
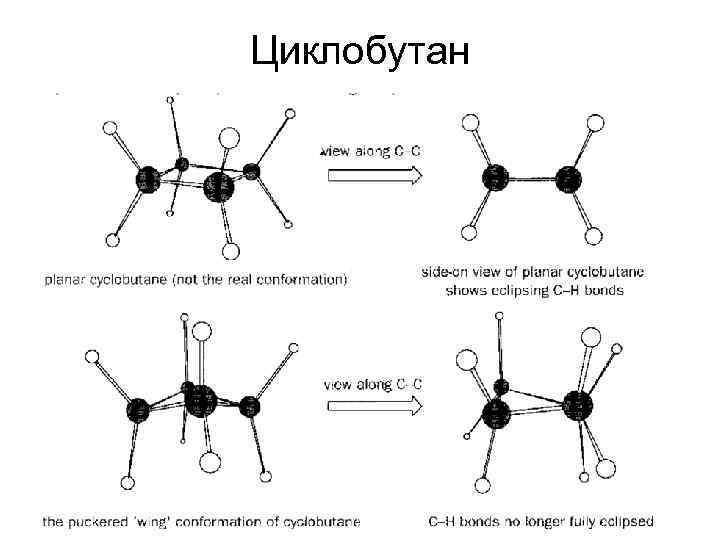 Циклобутан
Циклобутан
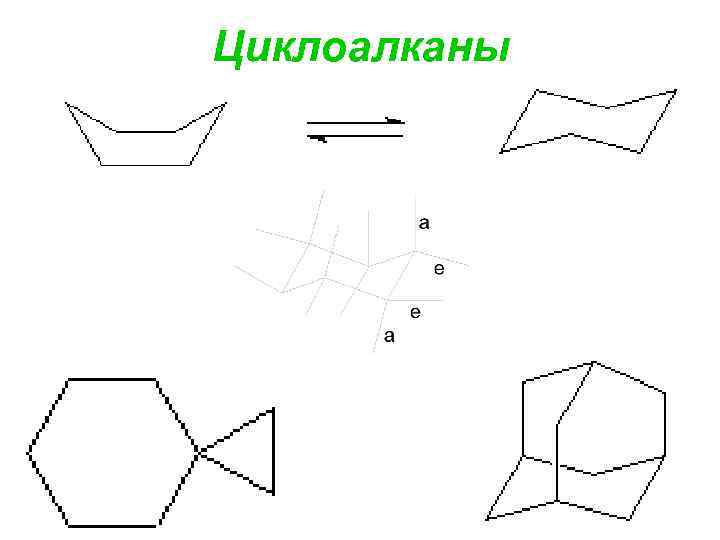 Циклоалканы
Циклоалканы

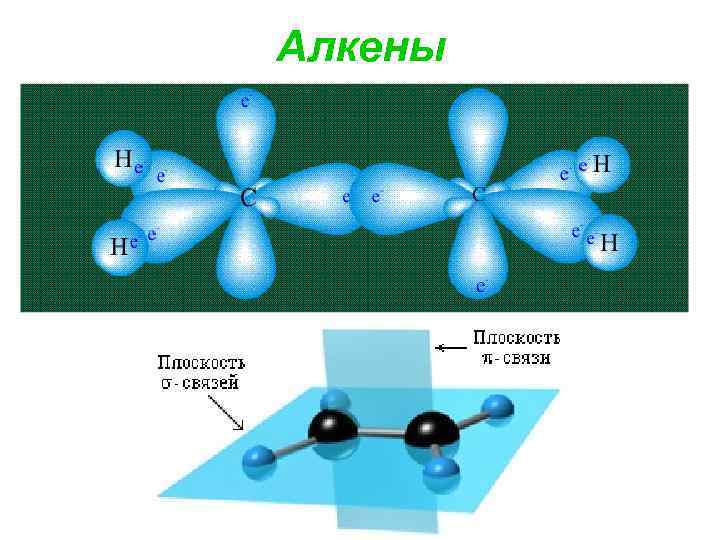 Алкены
Алкены
 Этиленовые углеводороды образуют гомологический ряд с общей формулой Сn. Н 2 n, родоначальником которого является этилен (СН 2=СН 2). Структурная изомерия для ряда этиленовых углеводородов начинается с 4 -ого члена, но изомеров больше, чем у алканов. Число структурных изомеров для С 4 равно трем, для С 5 пяти, для С 6 тринадцати т. д. Это связано с существованием изомерии положения двойной связи: СН 2=СН-СН 2 -СН 3 (бутен-1) и СН 3 -СН=СН-СН 3 (бутен-2) цис-2 -бутен транс-2 -бутен
Этиленовые углеводороды образуют гомологический ряд с общей формулой Сn. Н 2 n, родоначальником которого является этилен (СН 2=СН 2). Структурная изомерия для ряда этиленовых углеводородов начинается с 4 -ого члена, но изомеров больше, чем у алканов. Число структурных изомеров для С 4 равно трем, для С 5 пяти, для С 6 тринадцати т. д. Это связано с существованием изомерии положения двойной связи: СН 2=СН-СН 2 -СН 3 (бутен-1) и СН 3 -СН=СН-СН 3 (бутен-2) цис-2 -бутен транс-2 -бутен
 Получение алкенов • Дегалогенирование алкил галогенидов • Дегидратация спиртов • Дегалогенирование вицинальных дигалогенидов • Элиминирование третичных аминов по Гофману • Дегидрирование алканов • Восстановление алкинов до цис- и трансалкенов • Реакция Виттига
Получение алкенов • Дегалогенирование алкил галогенидов • Дегидратация спиртов • Дегалогенирование вицинальных дигалогенидов • Элиминирование третичных аминов по Гофману • Дегидрирование алканов • Восстановление алкинов до цис- и трансалкенов • Реакция Виттига
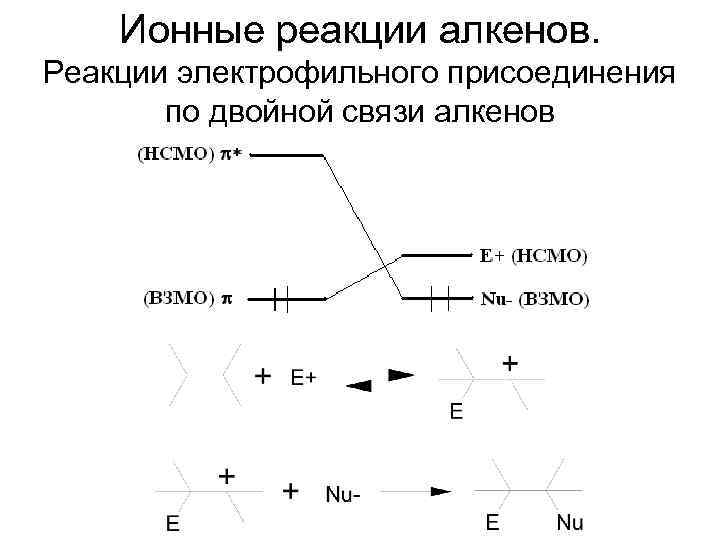 Ионные реакции алкенов. Реакции электрофильного присоединения по двойной связи алкенов
Ионные реакции алкенов. Реакции электрофильного присоединения по двойной связи алкенов
 Химические свойства 1. Присоединение водорода (гидрирование) в присутствии катализатора (Рt, Рd, Ni): СН 2=СН-СН 2 -СН 3 + H 2 С 4 Н 10 бутен-1 н-бутан 2. Присоединение галогенов (галогенирование): СН 2=СН 2 + Вr 2 - CBr. Н 2 -СBr. Н 2 (1, 2 -дибромэтан) При этом происходит обесцвечивание бромной воды - качественная реакция на кратную (двойную) связь. 3. Присоединение галогеноводородов (гидрогалогенирование): СН 3 -СН=СН 2 + НСl СН 3 -СНCl-СН 3 (хлористый изопропил или 2 -хлорпропан) 4. Присоединение воды (гидратация) протекает по правилу Марковникова. бутанол-2
Химические свойства 1. Присоединение водорода (гидрирование) в присутствии катализатора (Рt, Рd, Ni): СН 2=СН-СН 2 -СН 3 + H 2 С 4 Н 10 бутен-1 н-бутан 2. Присоединение галогенов (галогенирование): СН 2=СН 2 + Вr 2 - CBr. Н 2 -СBr. Н 2 (1, 2 -дибромэтан) При этом происходит обесцвечивание бромной воды - качественная реакция на кратную (двойную) связь. 3. Присоединение галогеноводородов (гидрогалогенирование): СН 3 -СН=СН 2 + НСl СН 3 -СНCl-СН 3 (хлористый изопропил или 2 -хлорпропан) 4. Присоединение воды (гидратация) протекает по правилу Марковникова. бутанол-2
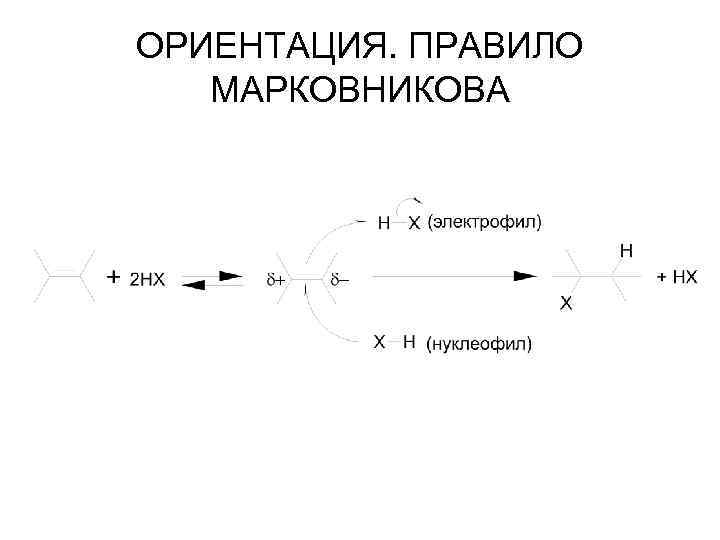 ОРИЕНТАЦИЯ. ПРАВИЛО МАРКОВНИКОВА
ОРИЕНТАЦИЯ. ПРАВИЛО МАРКОВНИКОВА
 5. Олефины взаимодействуют с серной кислотой изопропилсульфокислота 6. Алкилирование алканов алкенами (используется в производстве высококачественных топлив для ДВС). (2, 2, 4 -триметилпентан) Реакция алкилирования – это электрофильное замещение (SЕ). (1) и (2) стадии можно рассматривать как димеризацию изобутилена. далее поторяются стадии (2), (3), . . . На стадии (3) карбкатион вырывает атом водорода с его парой электронов (гидрид-ион) из молекулы алкана.
5. Олефины взаимодействуют с серной кислотой изопропилсульфокислота 6. Алкилирование алканов алкенами (используется в производстве высококачественных топлив для ДВС). (2, 2, 4 -триметилпентан) Реакция алкилирования – это электрофильное замещение (SЕ). (1) и (2) стадии можно рассматривать как димеризацию изобутилена. далее поторяются стадии (2), (3), . . . На стадии (3) карбкатион вырывает атом водорода с его парой электронов (гидрид-ион) из молекулы алкана.
 7. Окисление олефинов. Окисляются алкены различными окислителями, в зависимости от их природы и условий реакции образуются различные продукты окисления: а) окисление разбавленным водным раствором КМn. О 4 – качественная реакция на двойную связь этиленгликоль б) окисление концентрированным водным раствором КМn. О 4 или другими сильными окислителями приводит к разрыву двойной связи: 2 -метил-бутен-2 диметилкетон уксусная кислота в) кислород воздуха в присутствии Аg (катализатор) окисляет олефины до окисей (эпоксидов): окись этилена г) озонирование по Гарриесу - метод установления строения олефинов: триметилэтилен озонид ацетон этаналь
7. Окисление олефинов. Окисляются алкены различными окислителями, в зависимости от их природы и условий реакции образуются различные продукты окисления: а) окисление разбавленным водным раствором КМn. О 4 – качественная реакция на двойную связь этиленгликоль б) окисление концентрированным водным раствором КМn. О 4 или другими сильными окислителями приводит к разрыву двойной связи: 2 -метил-бутен-2 диметилкетон уксусная кислота в) кислород воздуха в присутствии Аg (катализатор) окисляет олефины до окисей (эпоксидов): окись этилена г) озонирование по Гарриесу - метод установления строения олефинов: триметилэтилен озонид ацетон этаналь
 8. Реакция полимеризации - процесс образования высокомолекулярных веществ путем соединения друг с другом молекул исходного низкомолекулярного вещества мономера. n А (А)n , где n - степень полимеризации. Высокомолекулярные вещества имеют Мr = 104 - 105 , n - несколько тысяч. Если n 10, то образуется олигомер - низкомолекулярный полимер. Различают два вида реакций полимеризации: а) ступенчатая полимеризация – когда образуются продукты с малым молекулярным весом, продукты реакции на каждой стадии могут быть изолированы. Так, Бутлеров получал из изобутилена диизобутилен, триизобутилен и т. д. б) линейная полимеризация – когда получаются вещества с большим молекулярным весом, начальные продукты полимеризации не могут быть изолированы.
8. Реакция полимеризации - процесс образования высокомолекулярных веществ путем соединения друг с другом молекул исходного низкомолекулярного вещества мономера. n А (А)n , где n - степень полимеризации. Высокомолекулярные вещества имеют Мr = 104 - 105 , n - несколько тысяч. Если n 10, то образуется олигомер - низкомолекулярный полимер. Различают два вида реакций полимеризации: а) ступенчатая полимеризация – когда образуются продукты с малым молекулярным весом, продукты реакции на каждой стадии могут быть изолированы. Так, Бутлеров получал из изобутилена диизобутилен, триизобутилен и т. д. б) линейная полимеризация – когда получаются вещества с большим молекулярным весом, начальные продукты полимеризации не могут быть изолированы.


