10_Карбоновые кислоты_2013.pptx
- Количество слайдов: 39
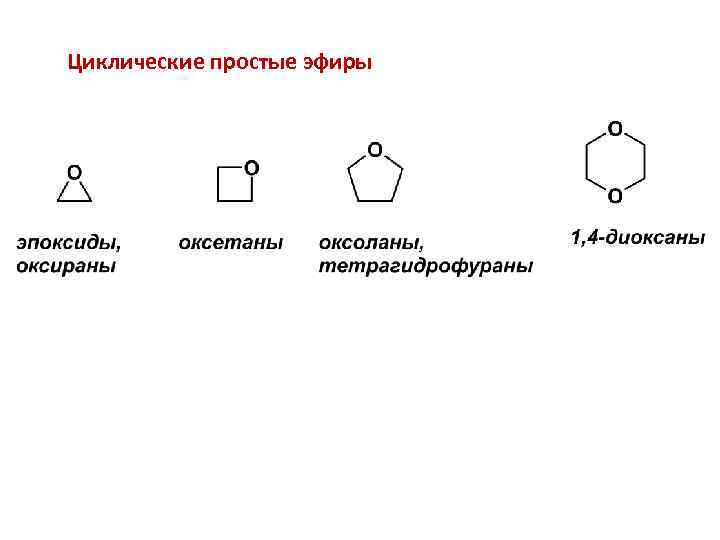 Циклические простые эфиры
Циклические простые эфиры
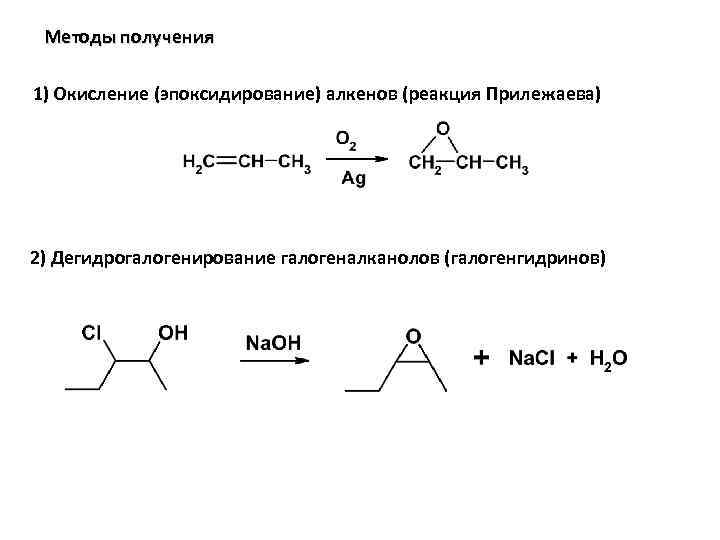 Методы получения 1) Окисление (эпоксидирование) алкенов (реакция Прилежаева) 2) Дегидрогалогенирование галогеналканолов (галогенгидринов)
Методы получения 1) Окисление (эпоксидирование) алкенов (реакция Прилежаева) 2) Дегидрогалогенирование галогеналканолов (галогенгидринов)
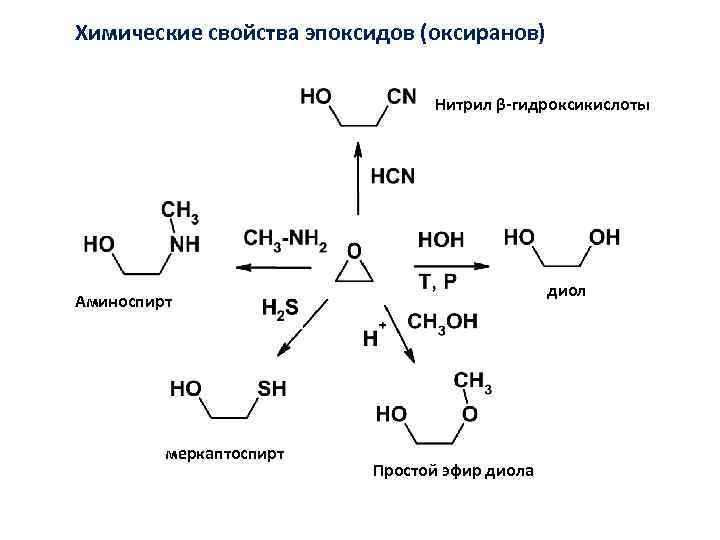 Химические свойства эпоксидов (оксиранов) Нитрил β-гидроксикислоты диол Аминоспирт меркаптоспирт Простой эфир диола
Химические свойства эпоксидов (оксиранов) Нитрил β-гидроксикислоты диол Аминоспирт меркаптоспирт Простой эфир диола

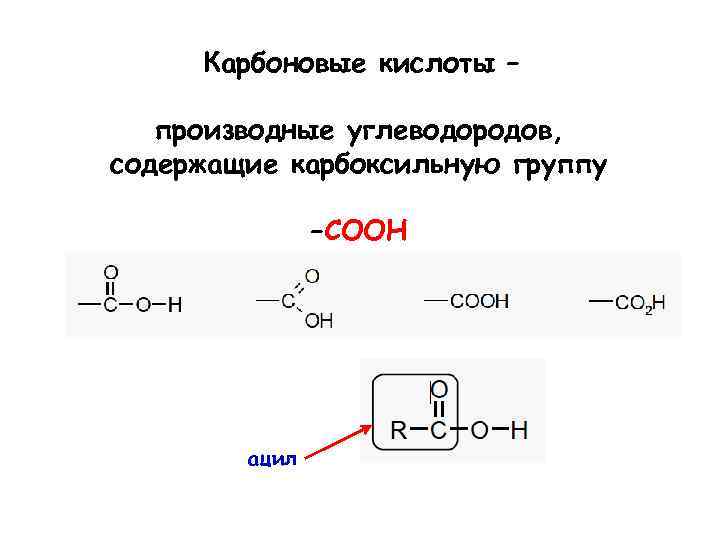 Карбоновые кислоты – производные углеводородов, содержащие карбоксильную группу –COOH ацил
Карбоновые кислоты – производные углеводородов, содержащие карбоксильную группу –COOH ацил
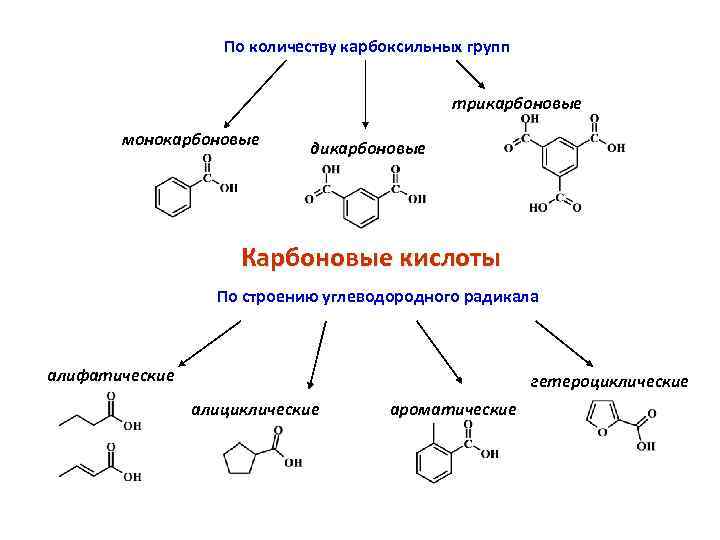 По количеству карбоксильных групп трикарбоновые монокарбоновые дикарбоновые Карбоновые кислоты По строению углеводородного радикала алифатические гетероциклические алициклические ароматические
По количеству карбоксильных групп трикарбоновые монокарбоновые дикарбоновые Карбоновые кислоты По строению углеводородного радикала алифатические гетероциклические алициклические ароматические
 Номенклатура
Номенклатура
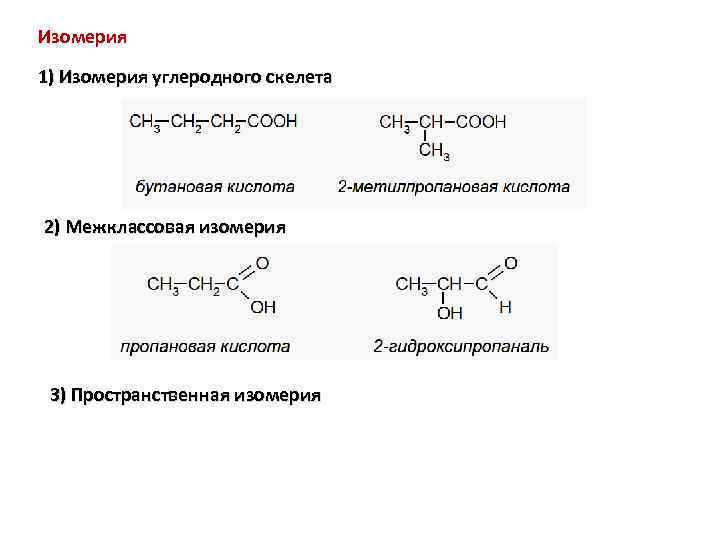 Изомерия 1) Изомерия углеродного скелета 2) Межклассовая изомерия 3) Пространственная изомерия
Изомерия 1) Изомерия углеродного скелета 2) Межклассовая изомерия 3) Пространственная изомерия
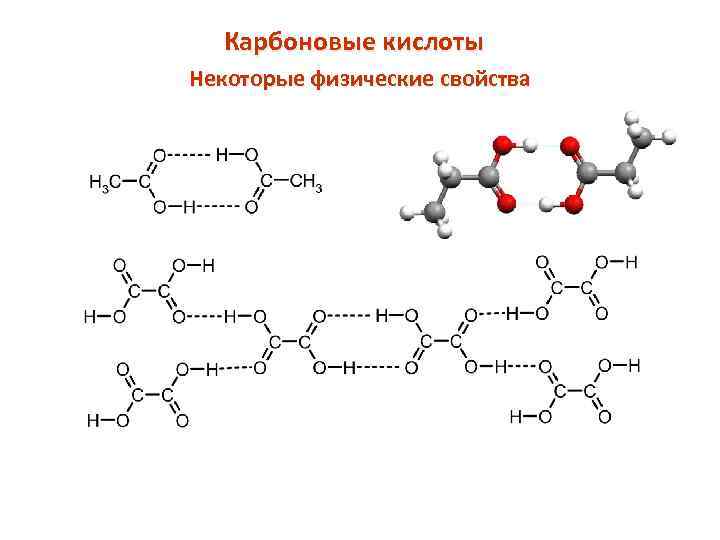 Карбоновые кислоты Некоторые физические свойства
Карбоновые кислоты Некоторые физические свойства
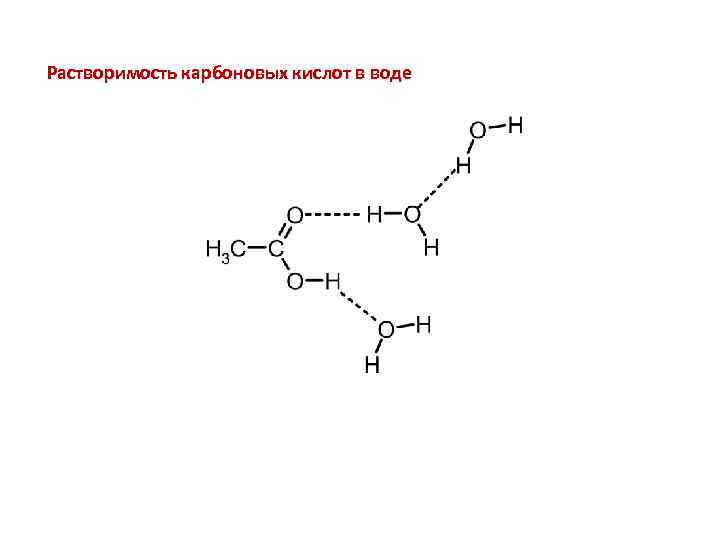 Растворимость карбоновых кислот в воде
Растворимость карбоновых кислот в воде
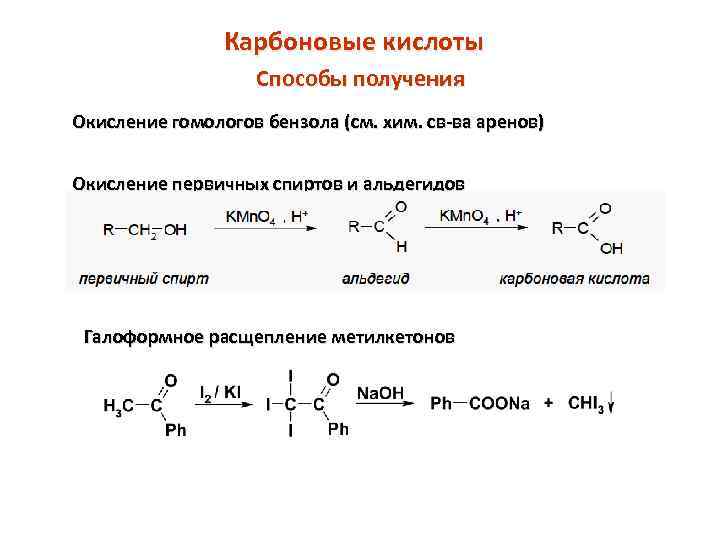 Карбоновые кислоты Способы получения Окисление гомологов бензола (см. хим. св-ва аренов) Окисление первичных спиртов и альдегидов Галоформное расщепление метилкетонов
Карбоновые кислоты Способы получения Окисление гомологов бензола (см. хим. св-ва аренов) Окисление первичных спиртов и альдегидов Галоформное расщепление метилкетонов
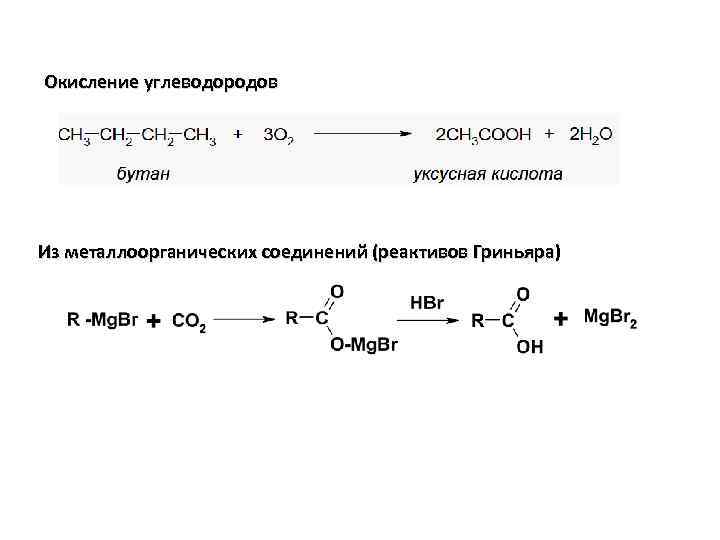 Окисление углеводородов Из металлоорганических соединений (реактивов Гриньяра)
Окисление углеводородов Из металлоорганических соединений (реактивов Гриньяра)
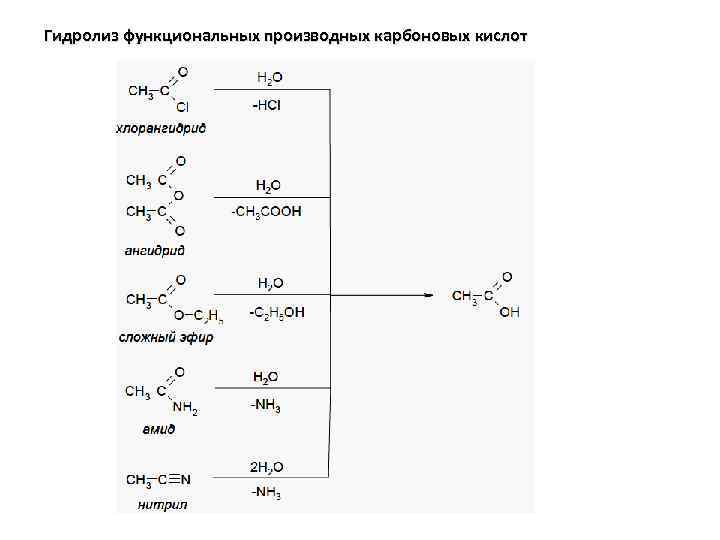 Гидролиз функциональных производных карбоновых кислот
Гидролиз функциональных производных карбоновых кислот
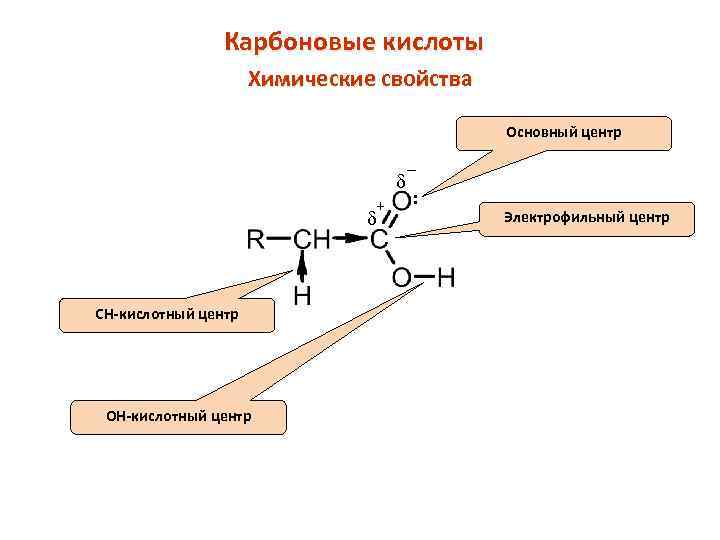 Карбоновые кислоты Химические свойства Основный центр d + d CH-кислотный центр ОН-кислотный центр _ : Электрофильный центр
Карбоновые кислоты Химические свойства Основный центр d + d CH-кислотный центр ОН-кислотный центр _ : Электрофильный центр
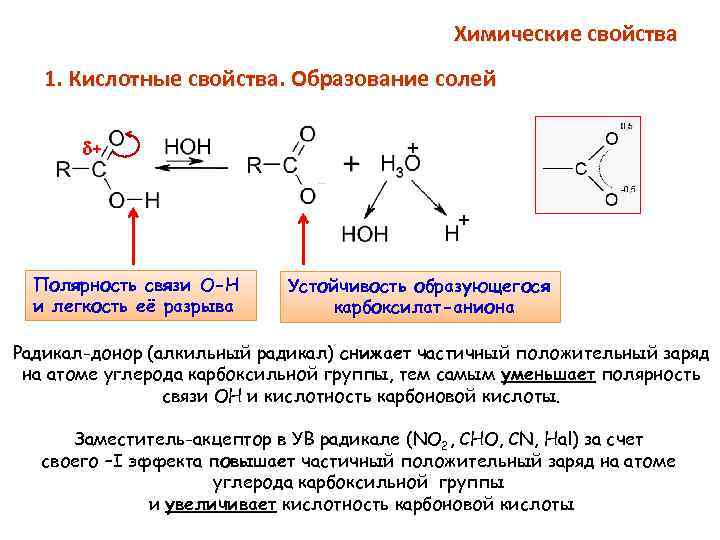 Химические свойства 1. Кислотные свойства. Образование солей + Полярность связи О-Н и легкость её разрыва Устойчивость образующегося карбоксилат-аниона Радикал-донор (алкильный радикал) снижает частичный положительный заряд на атоме углерода карбоксильной группы, тем самым уменьшает полярность связи ОН и кислотность карбоновой кислоты. Заместитель-акцептор в УВ радикале (NO 2, CHO, CN, Hal) за счет своего –I эффекта повышает частичный положительный заряд на атоме углерода карбоксильной группы и увеличивает кислотность карбоновой кислоты
Химические свойства 1. Кислотные свойства. Образование солей + Полярность связи О-Н и легкость её разрыва Устойчивость образующегося карбоксилат-аниона Радикал-донор (алкильный радикал) снижает частичный положительный заряд на атоме углерода карбоксильной группы, тем самым уменьшает полярность связи ОН и кислотность карбоновой кислоты. Заместитель-акцептор в УВ радикале (NO 2, CHO, CN, Hal) за счет своего –I эффекта повышает частичный положительный заряд на атоме углерода карбоксильной группы и увеличивает кислотность карбоновой кислоты
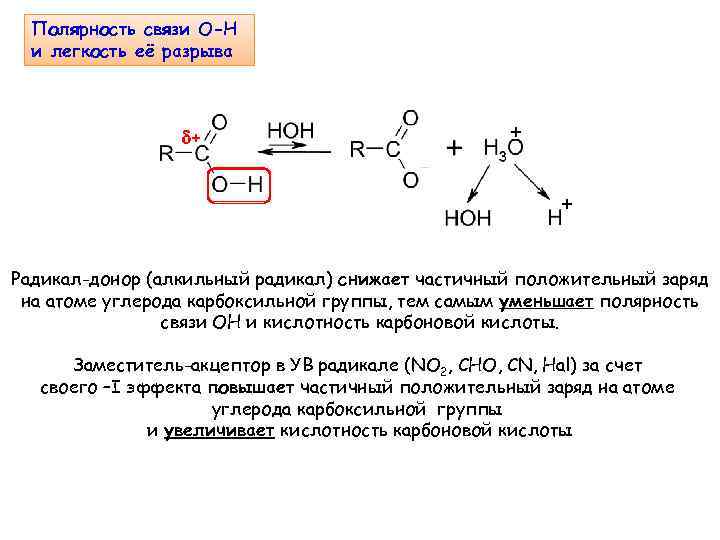 Полярность связи О-Н и легкость её разрыва + Радикал-донор (алкильный радикал) снижает частичный положительный заряд на атоме углерода карбоксильной группы, тем самым уменьшает полярность связи ОН и кислотность карбоновой кислоты. Заместитель-акцептор в УВ радикале (NO 2, CHO, CN, Hal) за счет своего –I эффекта повышает частичный положительный заряд на атоме углерода карбоксильной группы и увеличивает кислотность карбоновой кислоты
Полярность связи О-Н и легкость её разрыва + Радикал-донор (алкильный радикал) снижает частичный положительный заряд на атоме углерода карбоксильной группы, тем самым уменьшает полярность связи ОН и кислотность карбоновой кислоты. Заместитель-акцептор в УВ радикале (NO 2, CHO, CN, Hal) за счет своего –I эффекта повышает частичный положительный заряд на атоме углерода карбоксильной группы и увеличивает кислотность карбоновой кислоты
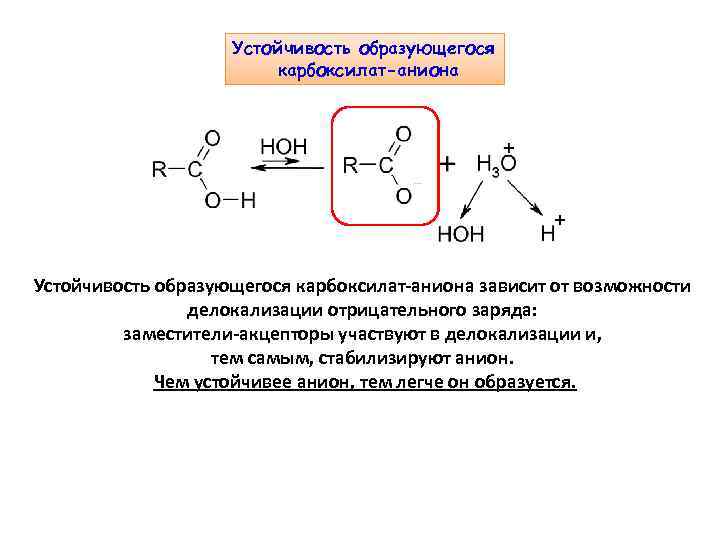 Устойчивость образующегося карбоксилат-аниона зависит от возможности делокализации отрицательного заряда: заместители-акцепторы участвуют в делокализации и, тем самым, стабилизируют анион. Чем устойчивее анион, тем легче он образуется.
Устойчивость образующегося карбоксилат-аниона зависит от возможности делокализации отрицательного заряда: заместители-акцепторы участвуют в делокализации и, тем самым, стабилизируют анион. Чем устойчивее анион, тем легче он образуется.
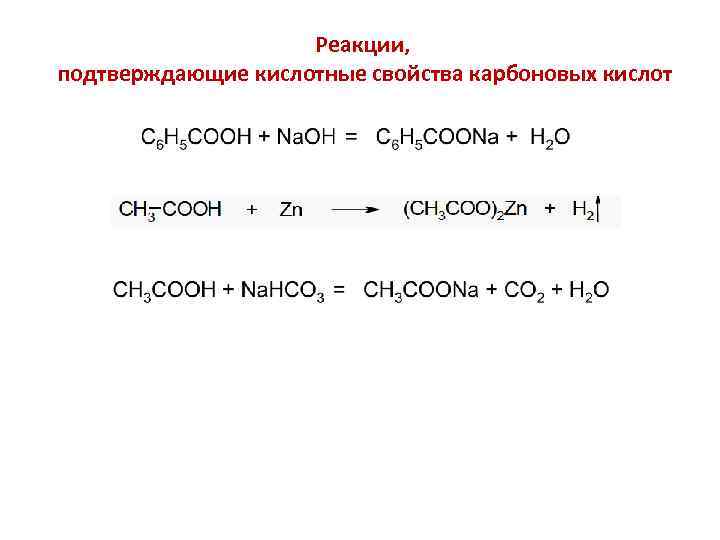 Реакции, подтверждающие кислотные свойства карбоновых кислот
Реакции, подтверждающие кислотные свойства карбоновых кислот
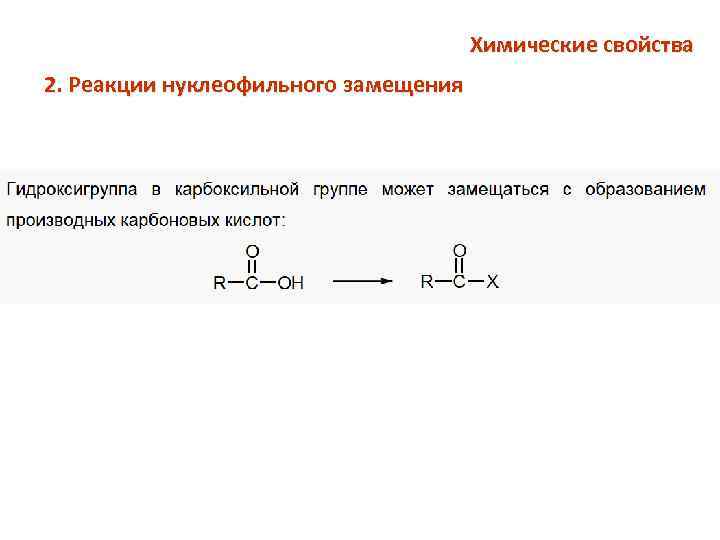 Химические свойства 2. Реакции нуклеофильного замещения
Химические свойства 2. Реакции нуклеофильного замещения
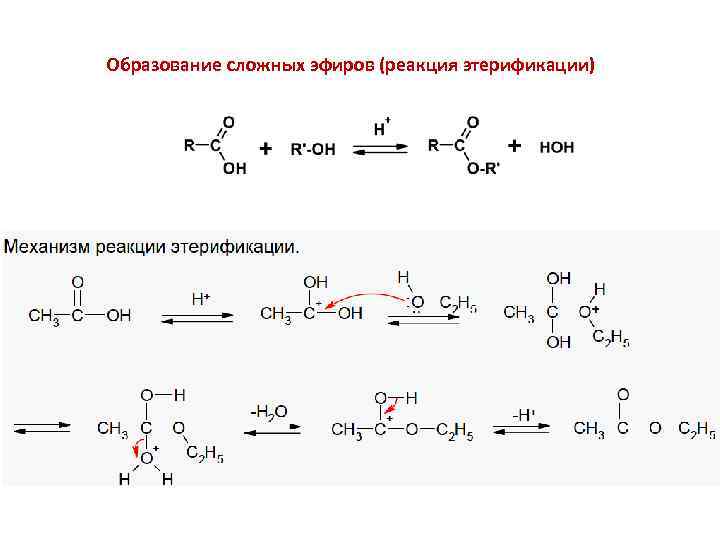 Образование сложных эфиров (реакция этерификации)
Образование сложных эфиров (реакция этерификации)
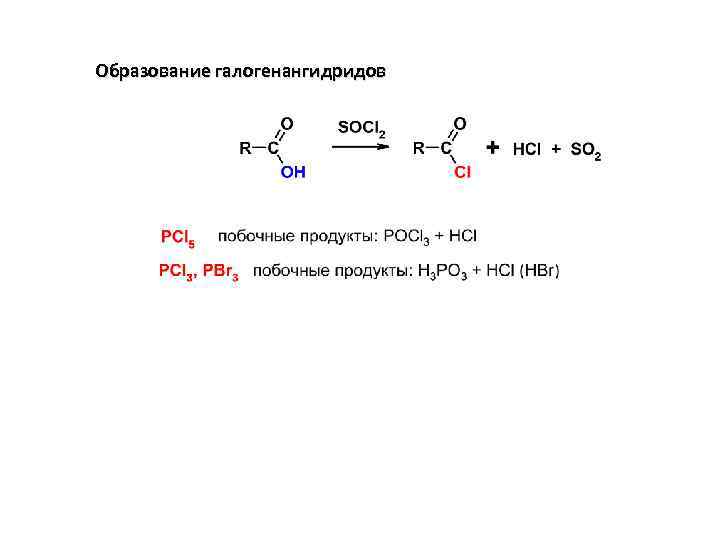 Образование галогенангидридов
Образование галогенангидридов
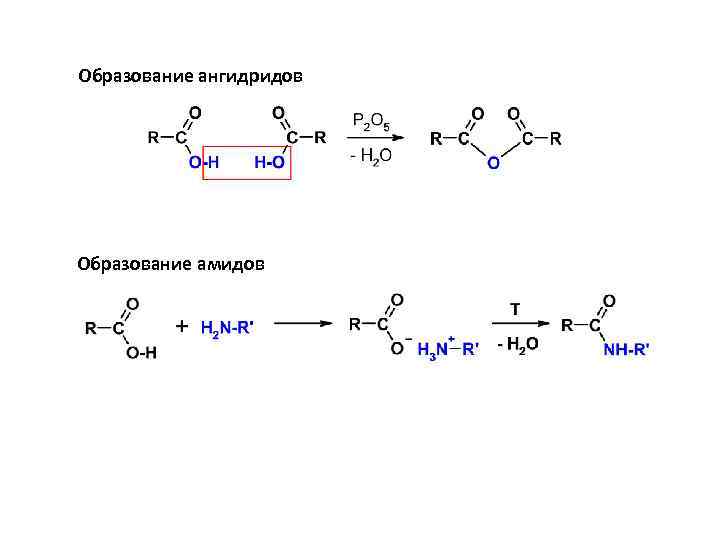 Образование ангидридов Образование амидов
Образование ангидридов Образование амидов
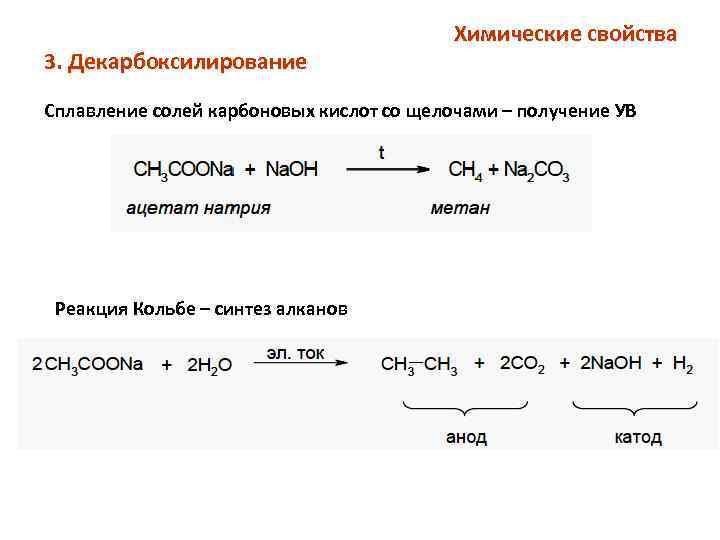 3. Декарбоксилирование Химические свойства Сплавление солей карбоновых кислот со щелочами – получение УВ Реакция Кольбе – синтез алканов
3. Декарбоксилирование Химические свойства Сплавление солей карбоновых кислот со щелочами – получение УВ Реакция Кольбе – синтез алканов
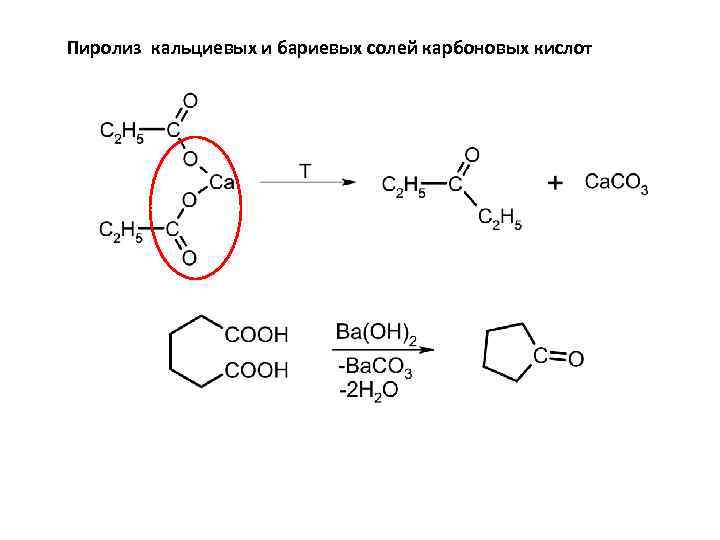 Пиролиз кальциевых и бариевых солей карбоновых кислот
Пиролиз кальциевых и бариевых солей карбоновых кислот
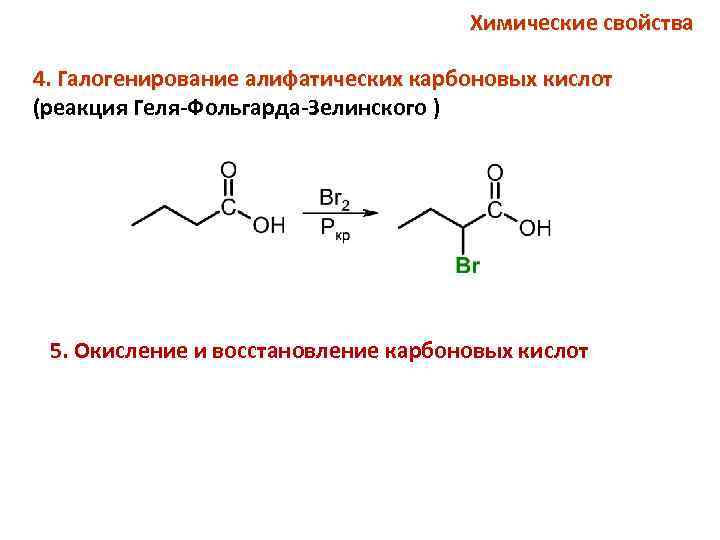 Химические свойства 4. Галогенирование алифатических карбоновых кислот (реакция Геля-Фольгарда-Зелинского ) 5. Окисление и восстановление карбоновых кислот
Химические свойства 4. Галогенирование алифатических карбоновых кислот (реакция Геля-Фольгарда-Зелинского ) 5. Окисление и восстановление карбоновых кислот
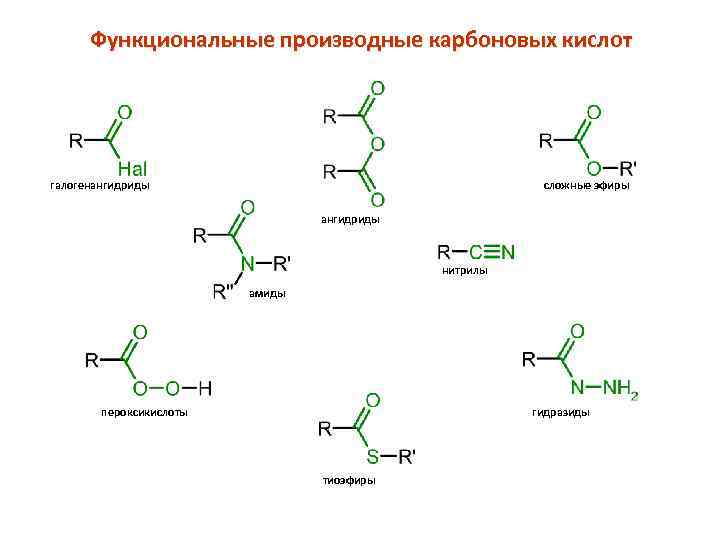 Функциональные производные карбоновых кислот галогенангидриды сложные эфиры ангидриды нитрилы амиды пероксикислоты гидразиды тиоэфиры
Функциональные производные карбоновых кислот галогенангидриды сложные эфиры ангидриды нитрилы амиды пероксикислоты гидразиды тиоэфиры
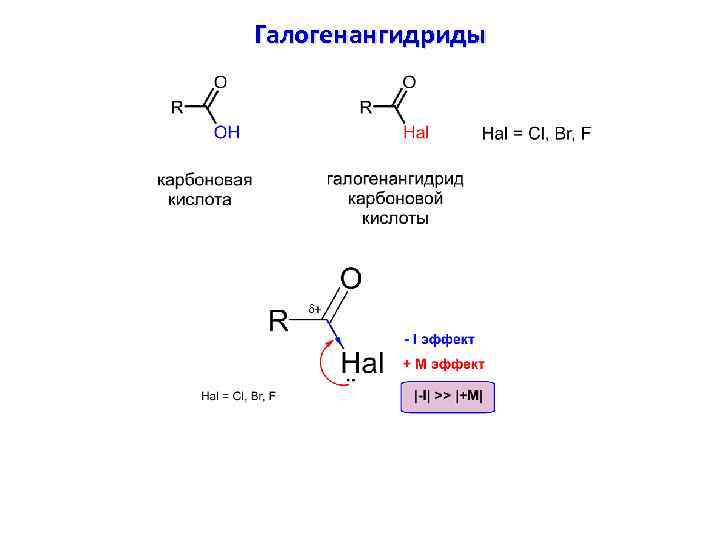 Галогенангидриды
Галогенангидриды
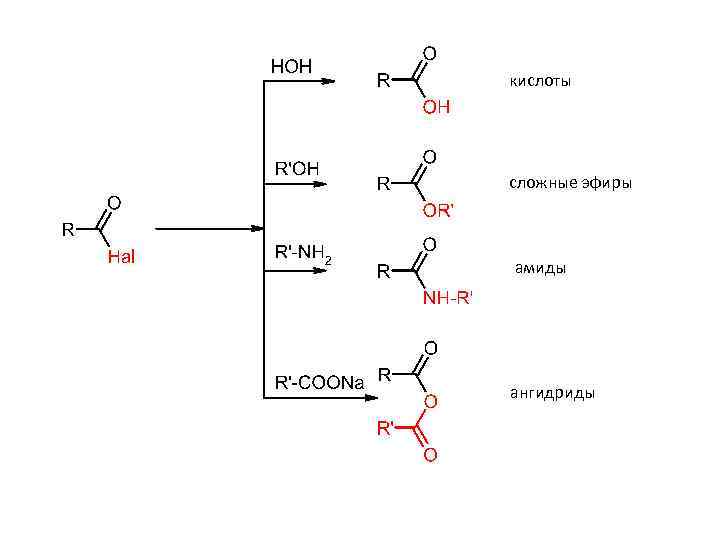 кислоты сложные эфиры амиды ангидриды
кислоты сложные эфиры амиды ангидриды
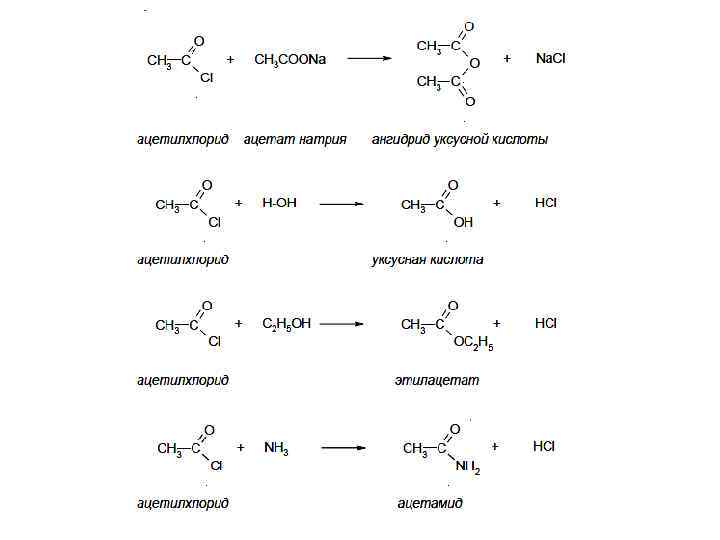
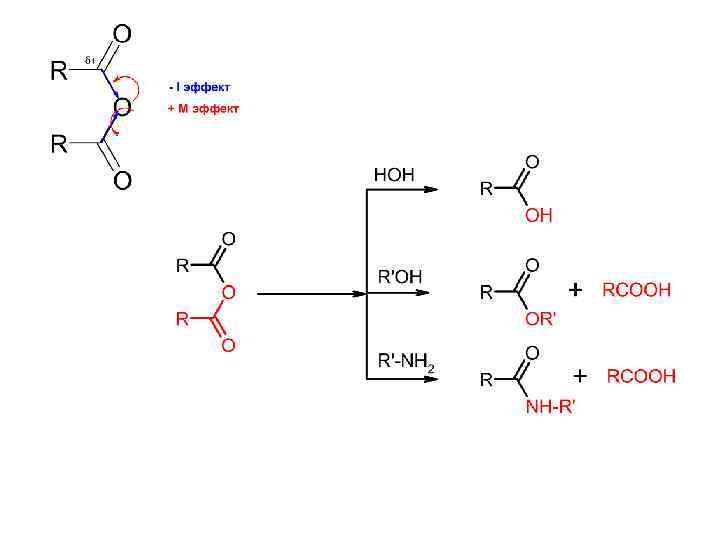
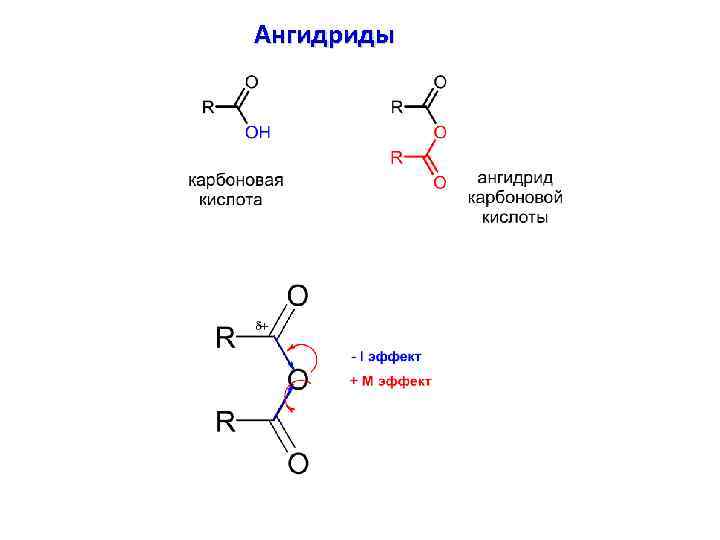 Ангидриды
Ангидриды
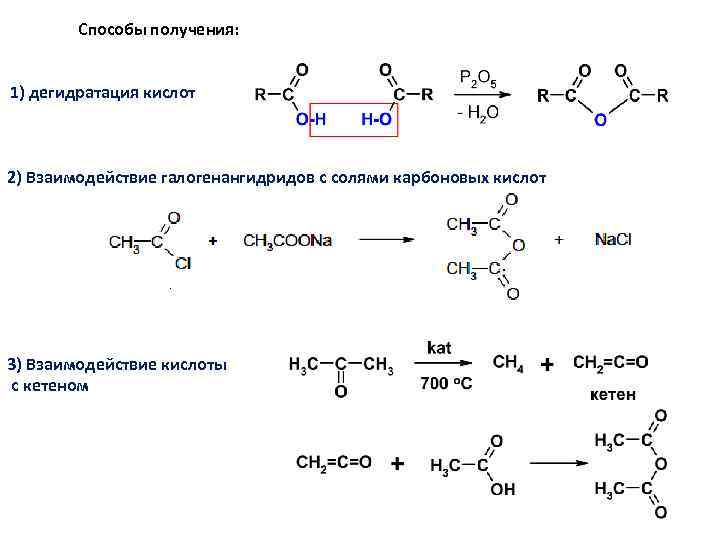 Способы получения: 1) дегидратация кислот 2) Взаимодействие галогенангидридов с солями карбоновых кислот 3) Взаимодействие кислоты с кетеном
Способы получения: 1) дегидратация кислот 2) Взаимодействие галогенангидридов с солями карбоновых кислот 3) Взаимодействие кислоты с кетеном
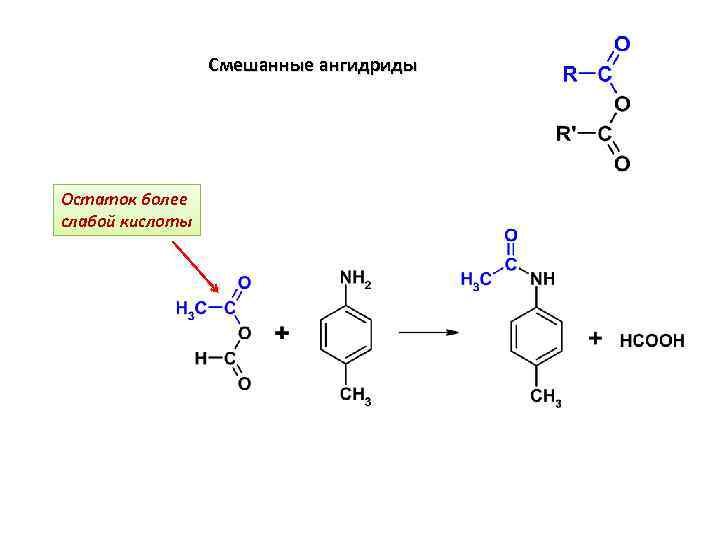 Смешанные ангидриды Остаток более слабой кислоты
Смешанные ангидриды Остаток более слабой кислоты
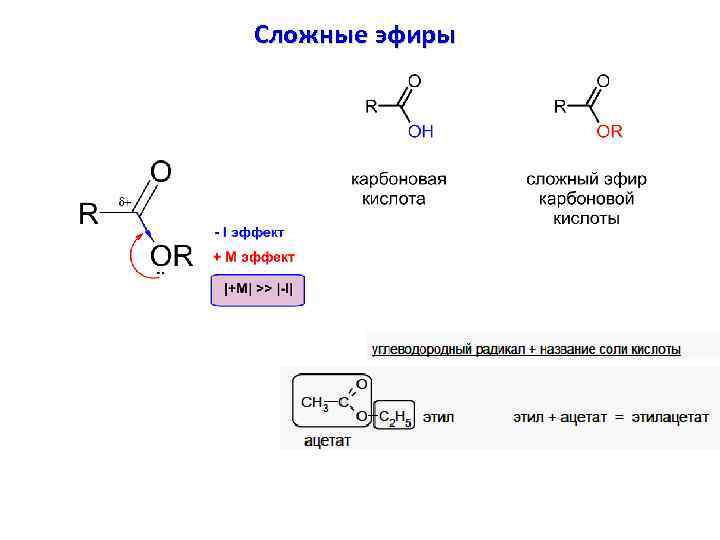 Сложные эфиры
Сложные эфиры
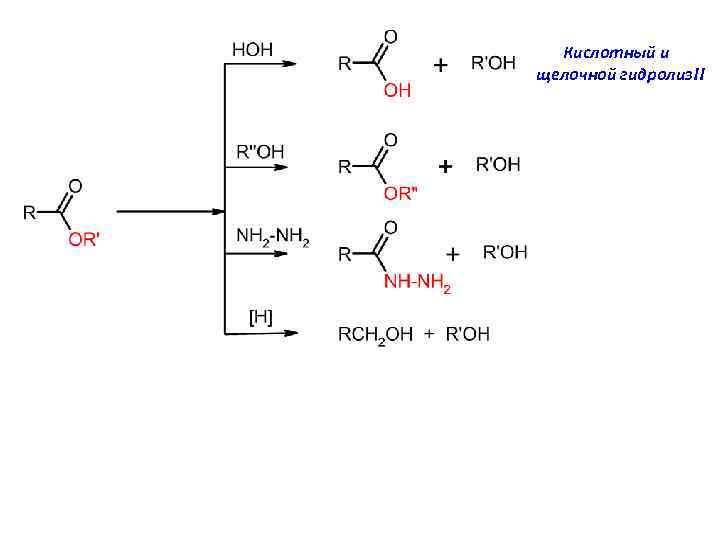 Кислотный и щелочной гидролиз!!
Кислотный и щелочной гидролиз!!
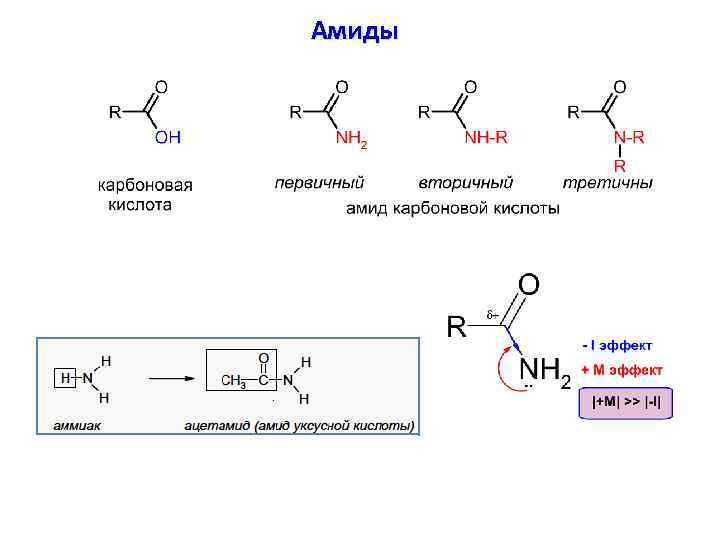 Амиды
Амиды
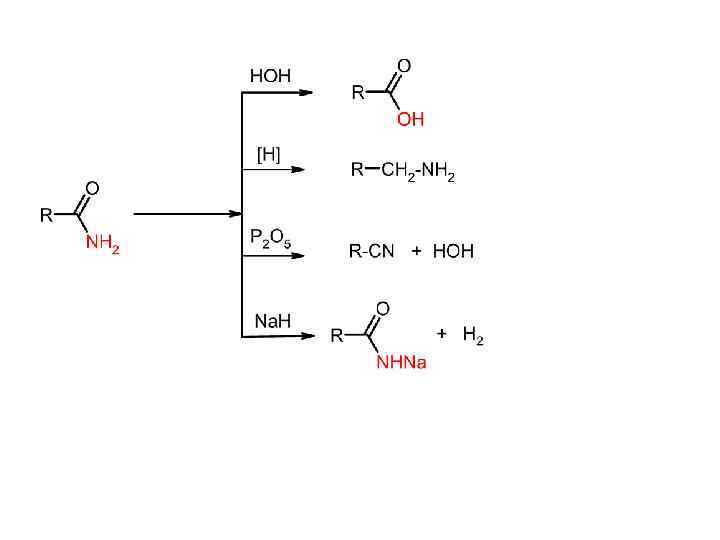
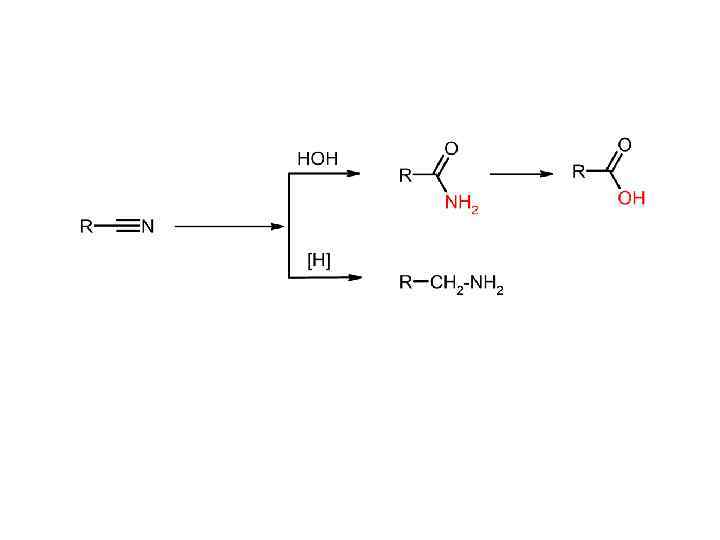
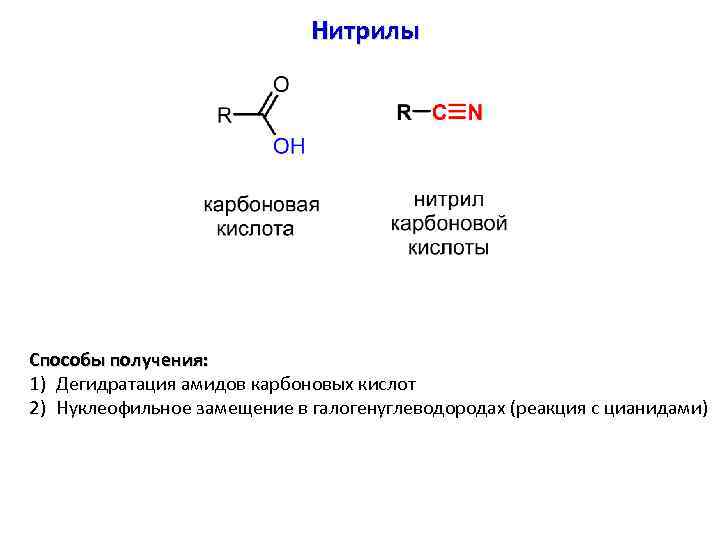 Нитрилы Способы получения: 1) Дегидратация амидов карбоновых кислот 2) Нуклеофильное замещение в галогенуглеводородах (реакция с цианидами)
Нитрилы Способы получения: 1) Дегидратация амидов карбоновых кислот 2) Нуклеофильное замещение в галогенуглеводородах (реакция с цианидами)