3cycl nucl.ppt
- Количество слайдов: 88
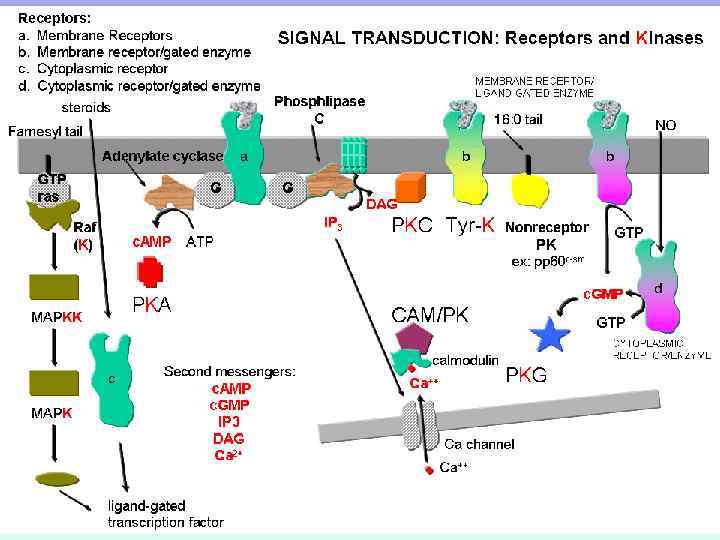
 ЦИКЛИЧЕСКИЕ НУКЛЕОТИДЫ В РОЛИ ВТОРИЧНЫХ ПОСРЕДНИКОВ
ЦИКЛИЧЕСКИЕ НУКЛЕОТИДЫ В РОЛИ ВТОРИЧНЫХ ПОСРЕДНИКОВ
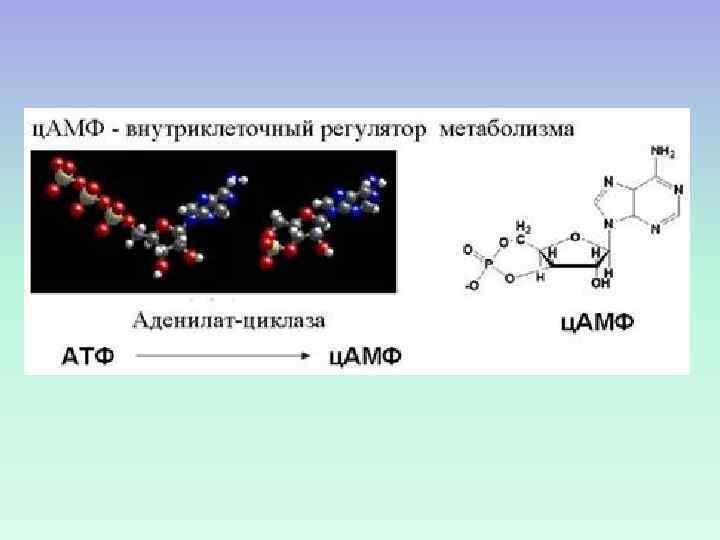
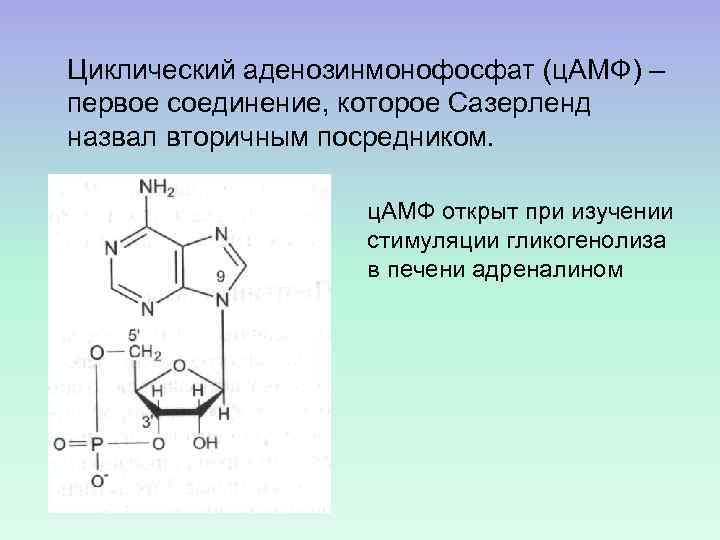 Циклический аденозинмонофосфат (ц. АМФ) – первое соединение, которое Сазерленд назвал вторичным посредником. ц. АМФ открыт при изучении стимуляции гликогенолиза в печени адреналином
Циклический аденозинмонофосфат (ц. АМФ) – первое соединение, которое Сазерленд назвал вторичным посредником. ц. АМФ открыт при изучении стимуляции гликогенолиза в печени адреналином
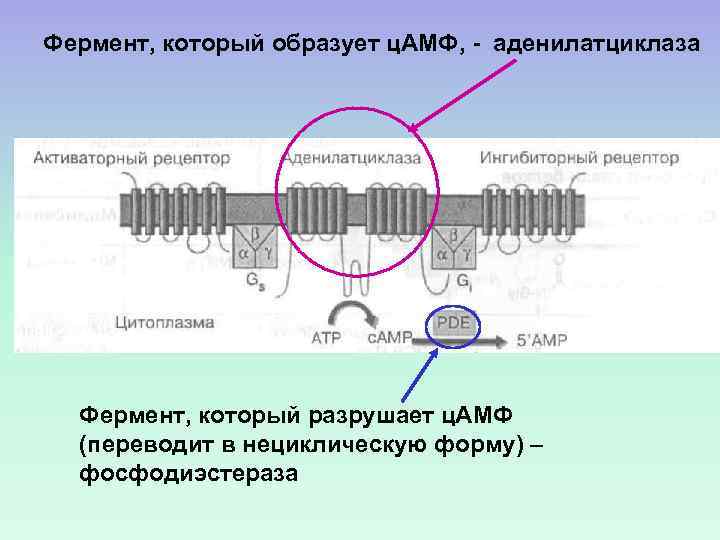 Фермент, который образует ц. АМФ, - аденилатциклаза Фермент, который разрушает ц. АМФ (переводит в нециклическую форму) – фосфодиэстераза
Фермент, который образует ц. АМФ, - аденилатциклаза Фермент, который разрушает ц. АМФ (переводит в нециклическую форму) – фосфодиэстераза
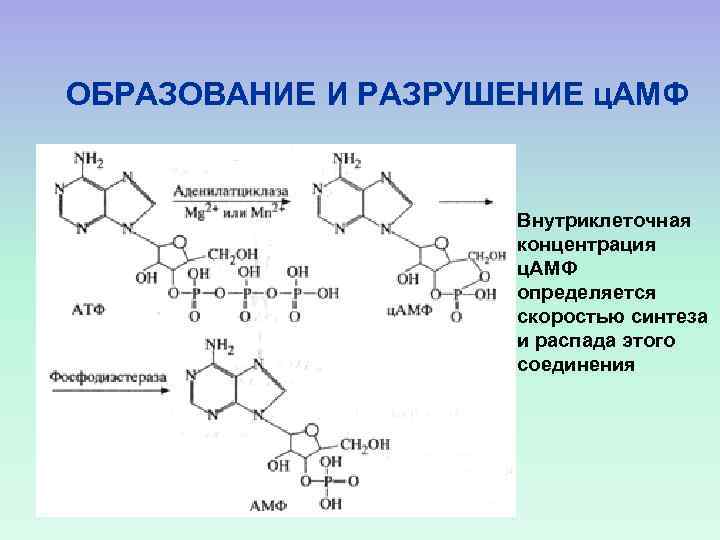 ОБРАЗОВАНИЕ И РАЗРУШЕНИЕ ц. АМФ Внутриклеточная концентрация ц. АМФ определяется скоростью синтеза и распада этого соединения
ОБРАЗОВАНИЕ И РАЗРУШЕНИЕ ц. АМФ Внутриклеточная концентрация ц. АМФ определяется скоростью синтеза и распада этого соединения
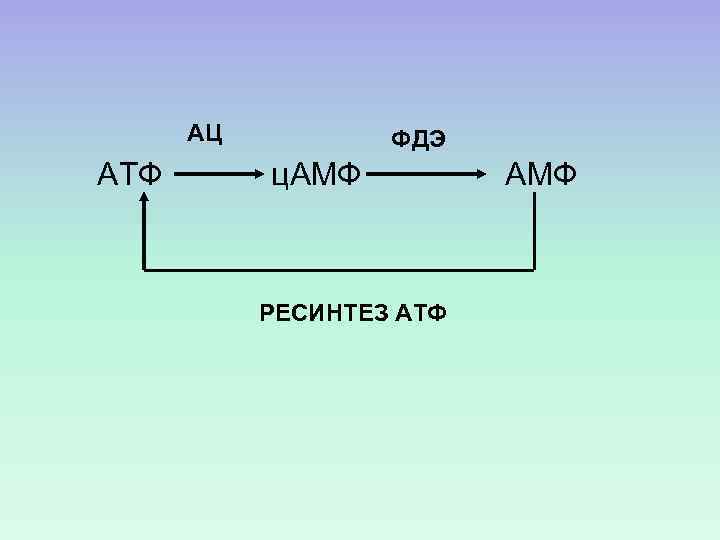 АЦ АТФ ФДЭ ц. АМФ РЕСИНТЕЗ АТФ АМФ
АЦ АТФ ФДЭ ц. АМФ РЕСИНТЕЗ АТФ АМФ
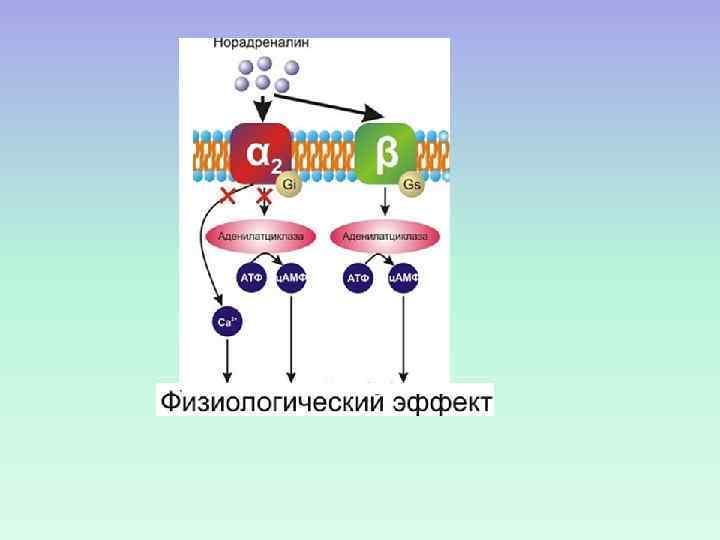
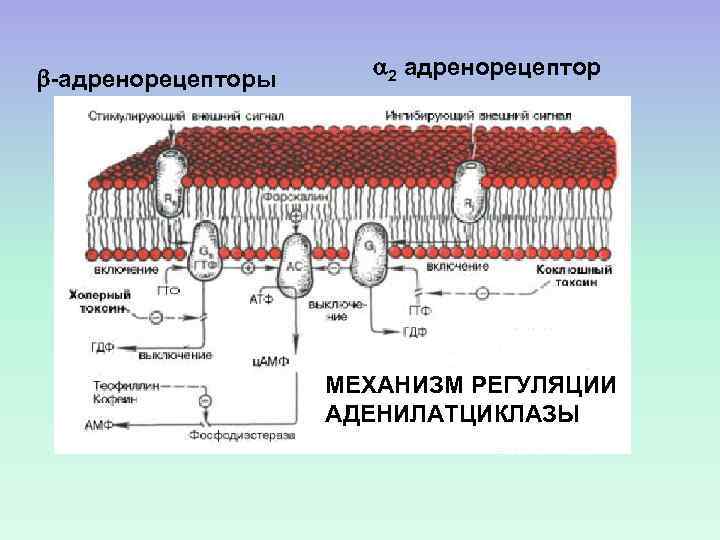 -адренорецепторы 2 адренорецептор МЕХАНИЗМ РЕГУЛЯЦИИ АДЕНИЛАТЦИКЛАЗЫ
-адренорецепторы 2 адренорецептор МЕХАНИЗМ РЕГУЛЯЦИИ АДЕНИЛАТЦИКЛАЗЫ
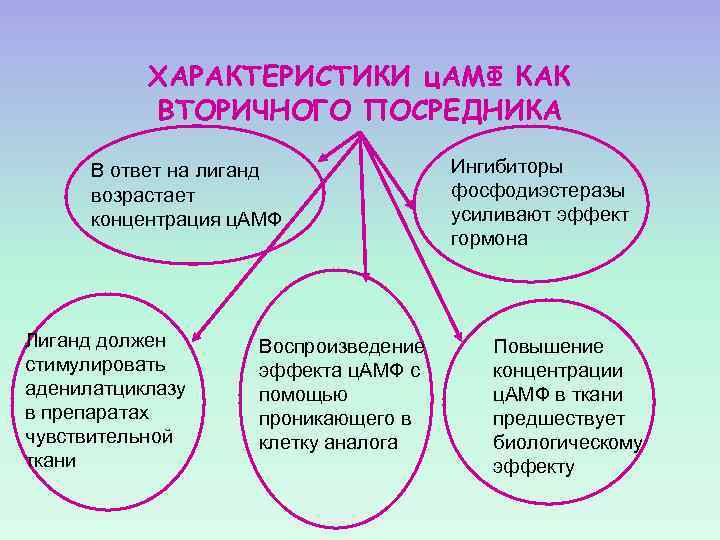 ХАРАКТЕРИСТИКИ ц. АМФ КАК ВТОРИЧНОГО ПОСРЕДНИКА В ответ на лиганд возрастает концентрация ц. АМФ Лиганд должен стимулировать аденилатциклазу в препаратах чувствительной ткани Воспроизведение эффекта ц. АМФ с помощью проникающего в клетку аналога Ингибиторы фосфодиэстеразы усиливают эффект гормона Повышение концентрации ц. АМФ в ткани предшествует биологическому эффекту
ХАРАКТЕРИСТИКИ ц. АМФ КАК ВТОРИЧНОГО ПОСРЕДНИКА В ответ на лиганд возрастает концентрация ц. АМФ Лиганд должен стимулировать аденилатциклазу в препаратах чувствительной ткани Воспроизведение эффекта ц. АМФ с помощью проникающего в клетку аналога Ингибиторы фосфодиэстеразы усиливают эффект гормона Повышение концентрации ц. АМФ в ткани предшествует биологическому эффекту
 ПРИМЕРЫ ц. АМФ-ЗАВИСИМЫХ ПРОЦЕССОВ
ПРИМЕРЫ ц. АМФ-ЗАВИСИМЫХ ПРОЦЕССОВ
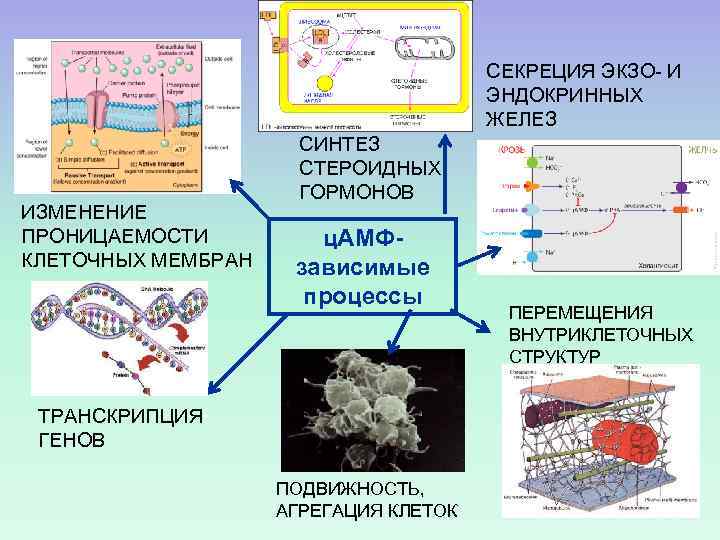 СЕКРЕЦИЯ ЭКЗО- И ЭНДОКРИННЫХ ЖЕЛЕЗ ИЗМЕНЕНИЕ ПРОНИЦАЕМОСТИ КЛЕТОЧНЫХ МЕМБРАН СИНТЕЗ СТЕРОИДНЫХ ГОРМОНОВ ц. АМФзависимые процессы ТРАНСКРИПЦИЯ ГЕНОВ ПОДВИЖНОСТЬ, АГРЕГАЦИЯ КЛЕТОК ПЕРЕМЕЩЕНИЯ ВНУТРИКЛЕТОЧНЫХ СТРУКТУР
СЕКРЕЦИЯ ЭКЗО- И ЭНДОКРИННЫХ ЖЕЛЕЗ ИЗМЕНЕНИЕ ПРОНИЦАЕМОСТИ КЛЕТОЧНЫХ МЕМБРАН СИНТЕЗ СТЕРОИДНЫХ ГОРМОНОВ ц. АМФзависимые процессы ТРАНСКРИПЦИЯ ГЕНОВ ПОДВИЖНОСТЬ, АГРЕГАЦИЯ КЛЕТОК ПЕРЕМЕЩЕНИЯ ВНУТРИКЛЕТОЧНЫХ СТРУКТУР
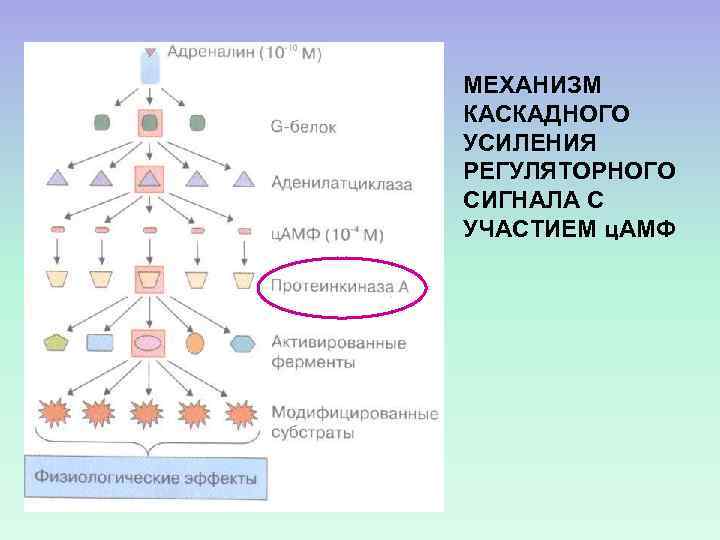 МЕХАНИЗМ КАСКАДНОГО УСИЛЕНИЯ РЕГУЛЯТОРНОГО СИГНАЛА С УЧАСТИЕМ ц. АМФ
МЕХАНИЗМ КАСКАДНОГО УСИЛЕНИЯ РЕГУЛЯТОРНОГО СИГНАЛА С УЧАСТИЕМ ц. АМФ
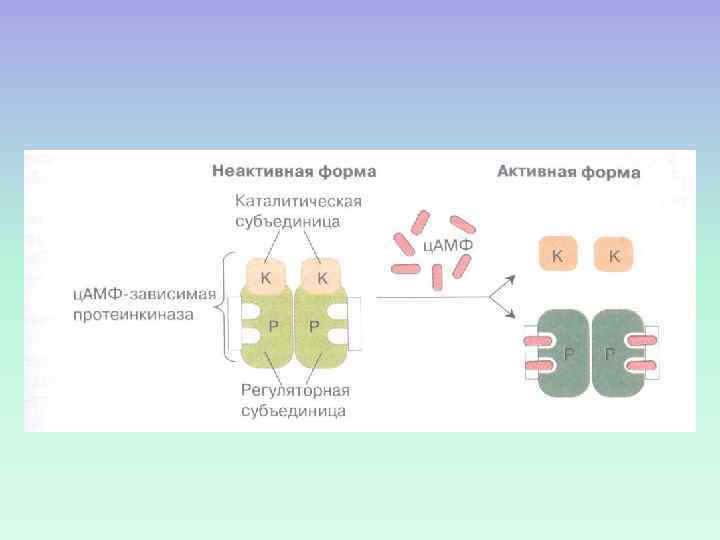
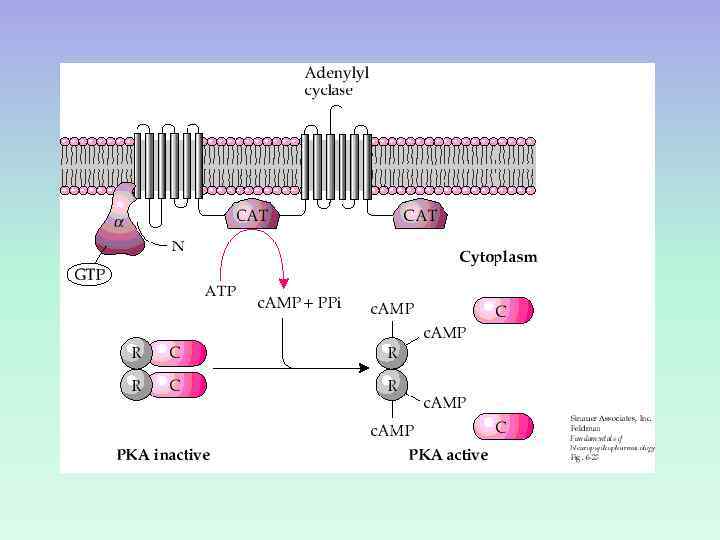
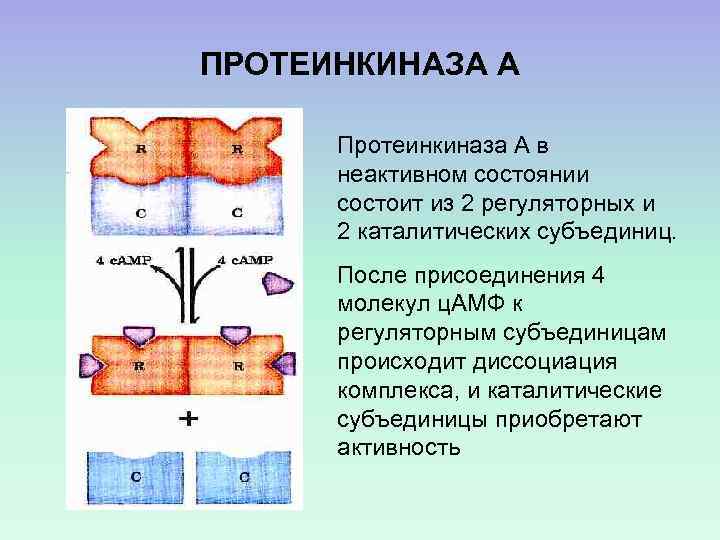 ПРОТЕИНКИНАЗА А Протеинкиназа А в неактивном состоянии состоит из 2 регуляторных и 2 каталитических субъединиц. После присоединения 4 молекул ц. АМФ к регуляторным субъединицам происходит диссоциация комплекса, и каталитические субъединицы приобретают активность
ПРОТЕИНКИНАЗА А Протеинкиназа А в неактивном состоянии состоит из 2 регуляторных и 2 каталитических субъединиц. После присоединения 4 молекул ц. АМФ к регуляторным субъединицам происходит диссоциация комплекса, и каталитические субъединицы приобретают активность
 БЕЛКИ-СУБСТРАТЫ ДЛЯ ПРОТЕИНКИНАЗЫ А • БЕЛКИ ИОННЫХ КАНАЛОВ • ИОНООБМЕННИКИ • ТРАНСПОРТНЫЕ АТФазы • БЕЛКИ ЦИТОСКЕЛЕТА • ФЕРМЕНТЫ, РЕГУЛИРУЮЩМЕ МЕТАБОЛИЧЕСКИЕ ПРОЦЕССЫ • БЕЛКИ РИБОСОМ • ЯДЕРНЫЕ БЕЛКИ
БЕЛКИ-СУБСТРАТЫ ДЛЯ ПРОТЕИНКИНАЗЫ А • БЕЛКИ ИОННЫХ КАНАЛОВ • ИОНООБМЕННИКИ • ТРАНСПОРТНЫЕ АТФазы • БЕЛКИ ЦИТОСКЕЛЕТА • ФЕРМЕНТЫ, РЕГУЛИРУЮЩМЕ МЕТАБОЛИЧЕСКИЕ ПРОЦЕССЫ • БЕЛКИ РИБОСОМ • ЯДЕРНЫЕ БЕЛКИ
 ц. ГМФ ОКАЗАЛОСЬ, ЧТО И ц. ГМФ ЯВЛЯЕТСЯ ВТОРИЧНЫМ ПОСРЕДНИКОМ
ц. ГМФ ОКАЗАЛОСЬ, ЧТО И ц. ГМФ ЯВЛЯЕТСЯ ВТОРИЧНЫМ ПОСРЕДНИКОМ
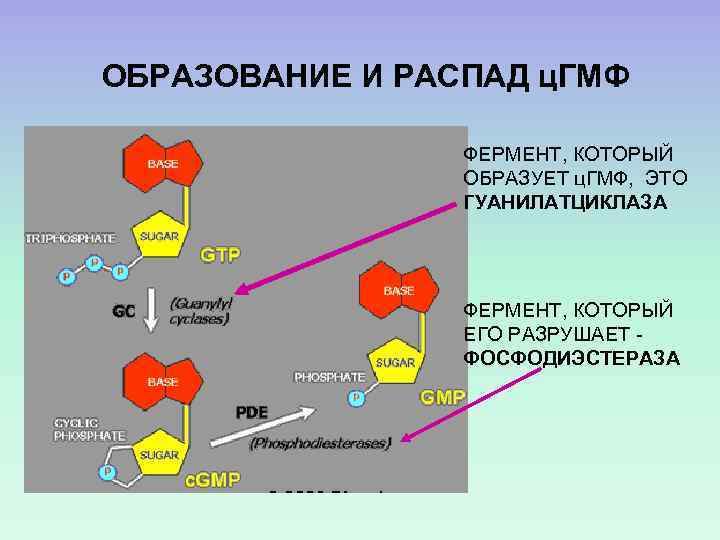 ОБРАЗОВАНИЕ И РАСПАД ц. ГМФ ФЕРМЕНТ, КОТОРЫЙ ОБРАЗУЕТ ц. ГМФ, ЭТО ГУАНИЛАТЦИКЛАЗА ФЕРМЕНТ, КОТОРЫЙ ЕГО РАЗРУШАЕТ ФОСФОДИЭСТЕРАЗА
ОБРАЗОВАНИЕ И РАСПАД ц. ГМФ ФЕРМЕНТ, КОТОРЫЙ ОБРАЗУЕТ ц. ГМФ, ЭТО ГУАНИЛАТЦИКЛАЗА ФЕРМЕНТ, КОТОРЫЙ ЕГО РАЗРУШАЕТ ФОСФОДИЭСТЕРАЗА
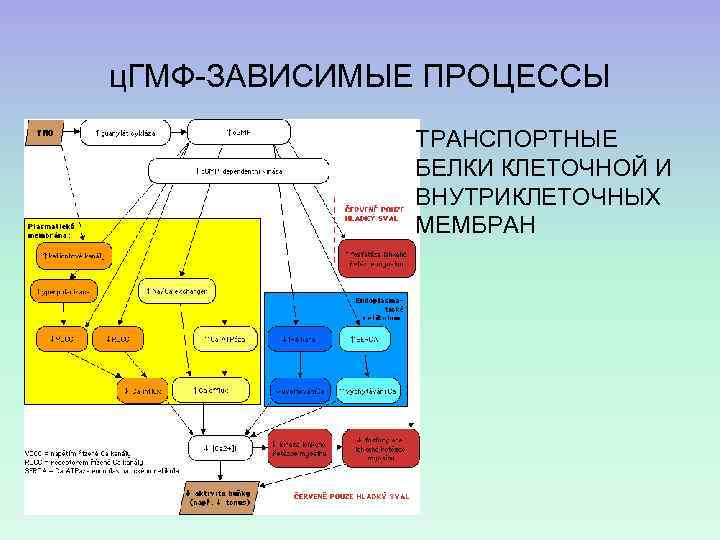 ц. ГМФ-ЗАВИСИМЫЕ ПРОЦЕССЫ ТРАНСПОРТНЫЕ БЕЛКИ КЛЕТОЧНОЙ И ВНУТРИКЛЕТОЧНЫХ МЕМБРАН
ц. ГМФ-ЗАВИСИМЫЕ ПРОЦЕССЫ ТРАНСПОРТНЫЕ БЕЛКИ КЛЕТОЧНОЙ И ВНУТРИКЛЕТОЧНЫХ МЕМБРАН
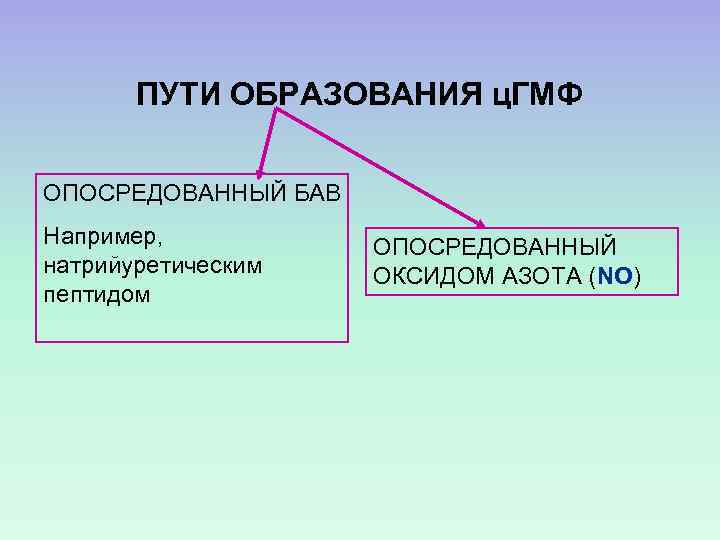 ПУТИ ОБРАЗОВАНИЯ ц. ГМФ ОПОСРЕДОВАННЫЙ БАВ Например, натрийуретическим пептидом ОПОСРЕДОВАННЫЙ ОКСИДОМ АЗОТА (NO)
ПУТИ ОБРАЗОВАНИЯ ц. ГМФ ОПОСРЕДОВАННЫЙ БАВ Например, натрийуретическим пептидом ОПОСРЕДОВАННЫЙ ОКСИДОМ АЗОТА (NO)
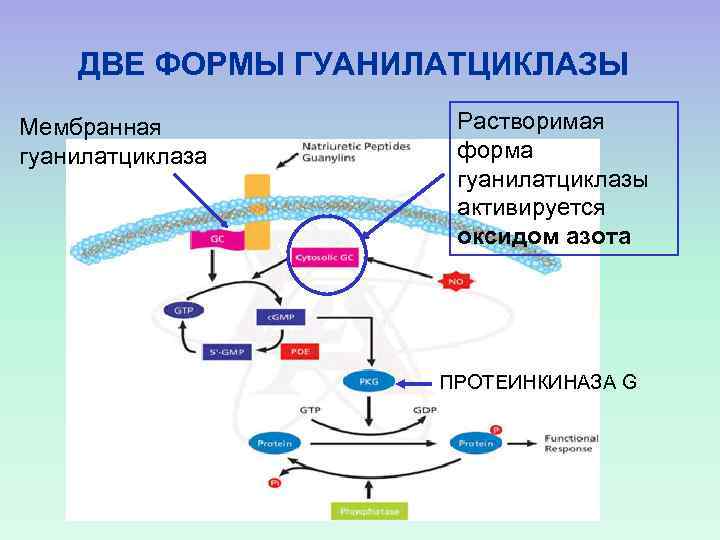 ДВЕ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ Мембранная гуанилатциклаза Растворимая форма гуанилатциклазы активируется оксидом азота ПРОТЕИНКИНАЗА G
ДВЕ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ Мембранная гуанилатциклаза Растворимая форма гуанилатциклазы активируется оксидом азота ПРОТЕИНКИНАЗА G
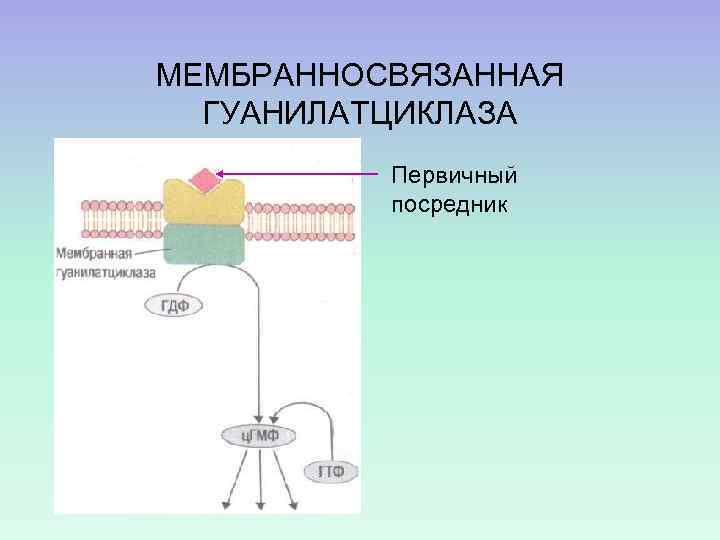 МЕМБРАННОСВЯЗАННАЯ ГУАНИЛАТЦИКЛАЗА Первичный посредник
МЕМБРАННОСВЯЗАННАЯ ГУАНИЛАТЦИКЛАЗА Первичный посредник
 МЕХАНИЗМ ДЕЙСТВИЯ НАТРИЙУРЕТИЧЕСКОГО ПЕПТИДА Na. УП + R ГЦ ц. ГМФ ПК G фосфорилирует Na, K-АТФазу эпителиоцитов почечных канальцев, что приводит к торможению насоса. Результат этого – ослабление реабсорбции ионов натрия, а значит и воды из первичной мочи.
МЕХАНИЗМ ДЕЙСТВИЯ НАТРИЙУРЕТИЧЕСКОГО ПЕПТИДА Na. УП + R ГЦ ц. ГМФ ПК G фосфорилирует Na, K-АТФазу эпителиоцитов почечных канальцев, что приводит к торможению насоса. Результат этого – ослабление реабсорбции ионов натрия, а значит и воды из первичной мочи.
 ОСОБЕННОСТИ ц. ГМФ-ЗАВИСИМОЙ РЕГУЛЯЦИИ • ОТСУТСТВУЮТ G-БЕЛКИ • СВЯЗЫВАНИЕ АГОНИСТА С РЕЦЕПТОРОМ ВСЕГДА ПРИВОДИТ К АКТИВАЦИИ ГУАНИЛАТЦИКЛАЗЫ
ОСОБЕННОСТИ ц. ГМФ-ЗАВИСИМОЙ РЕГУЛЯЦИИ • ОТСУТСТВУЮТ G-БЕЛКИ • СВЯЗЫВАНИЕ АГОНИСТА С РЕЦЕПТОРОМ ВСЕГДА ПРИВОДИТ К АКТИВАЦИИ ГУАНИЛАТЦИКЛАЗЫ
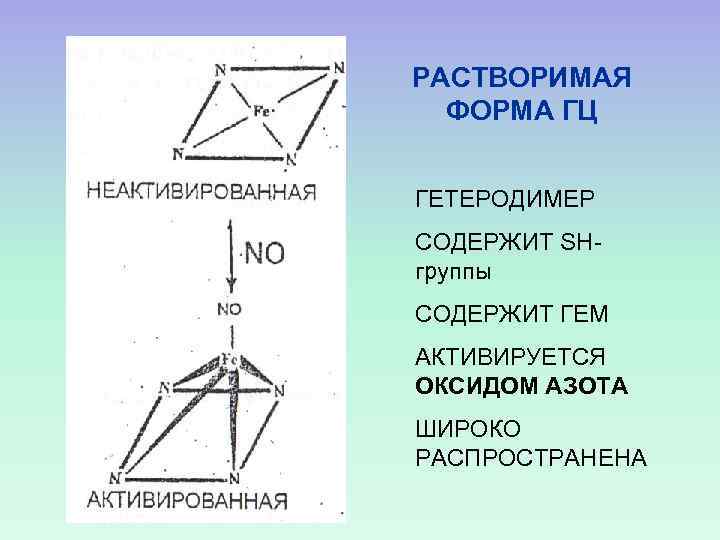 РАСТВОРИМАЯ ФОРМА ГЦ ГЕТЕРОДИМЕР СОДЕРЖИТ SHгруппы СОДЕРЖИТ ГЕМ АКТИВИРУЕТСЯ ОКСИДОМ АЗОТА ШИРОКО РАСПРОСТРАНЕНА
РАСТВОРИМАЯ ФОРМА ГЦ ГЕТЕРОДИМЕР СОДЕРЖИТ SHгруппы СОДЕРЖИТ ГЕМ АКТИВИРУЕТСЯ ОКСИДОМ АЗОТА ШИРОКО РАСПРОСТРАНЕНА
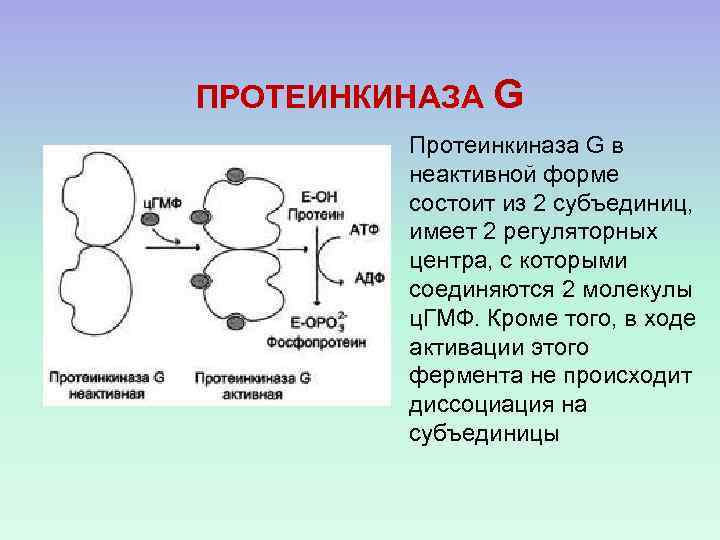 ПРОТЕИНКИНАЗА G Протеинкиназа G в неактивной форме состоит из 2 субъединиц, имеет 2 регуляторных центра, с которыми соединяются 2 молекулы ц. ГМФ. Кроме того, в ходе активации этого фермента не происходит диссоциация на субъединицы
ПРОТЕИНКИНАЗА G Протеинкиназа G в неактивной форме состоит из 2 субъединиц, имеет 2 регуляторных центра, с которыми соединяются 2 молекулы ц. ГМФ. Кроме того, в ходе активации этого фермента не происходит диссоциация на субъединицы

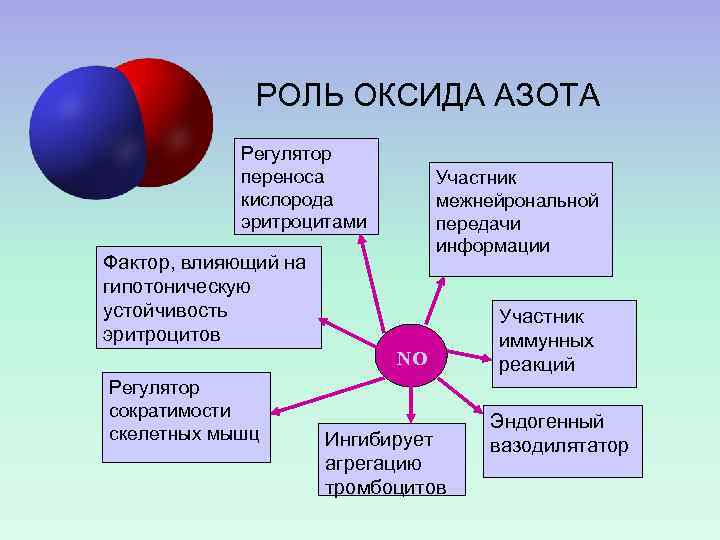 РОЛЬ ОКСИДА АЗОТА Регулятор переноса кислорода эритроцитами Участник межнейрональной передачи информации Фактор, влияющий на гипотоническую устойчивость эритроцитов NO Регулятор сократимости скелетных мышц Ингибирует агрегацию тромбоцитов Участник иммунных реакций Эндогенный вазодилятатор
РОЛЬ ОКСИДА АЗОТА Регулятор переноса кислорода эритроцитами Участник межнейрональной передачи информации Фактор, влияющий на гипотоническую устойчивость эритроцитов NO Регулятор сократимости скелетных мышц Ингибирует агрегацию тромбоцитов Участник иммунных реакций Эндогенный вазодилятатор
 NO ВЫРАБАТЫВАЕТСЯ ВО МНОГИХ КЛЕТКАХ, НО СУЩЕСТВУЮТ ТРИ КАТЕГОРИИ КЛЕТОК, В КОТОРЫХ ПРОЯВЛЯЮТСЯ ФУНКЦИИ ЭТОЙ МОЛЕКУЛЫ ØЭНДОТЕЛИАЛЬНЫЕ КЛЕТКИ (РАССЛАБЛЕНИЕ ГМК) ØНЕЙРОНЫ (ПЕРЕДАЧА СИГНАЛА) ØИММУНОКОМПЕТЕНТНЫЕ КЛЕТКИ (УЧАСТИЕ В ИММУННОМ ОТВЕТЕ)
NO ВЫРАБАТЫВАЕТСЯ ВО МНОГИХ КЛЕТКАХ, НО СУЩЕСТВУЮТ ТРИ КАТЕГОРИИ КЛЕТОК, В КОТОРЫХ ПРОЯВЛЯЮТСЯ ФУНКЦИИ ЭТОЙ МОЛЕКУЛЫ ØЭНДОТЕЛИАЛЬНЫЕ КЛЕТКИ (РАССЛАБЛЕНИЕ ГМК) ØНЕЙРОНЫ (ПЕРЕДАЧА СИГНАЛА) ØИММУНОКОМПЕТЕНТНЫЕ КЛЕТКИ (УЧАСТИЕ В ИММУННОМ ОТВЕТЕ)
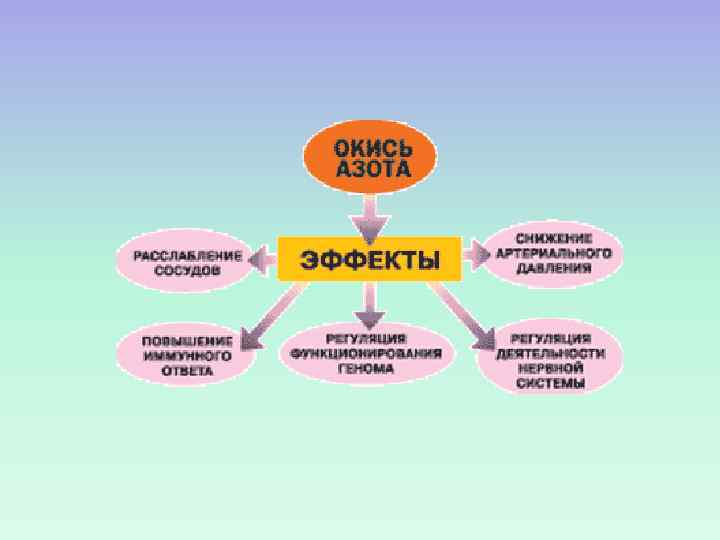
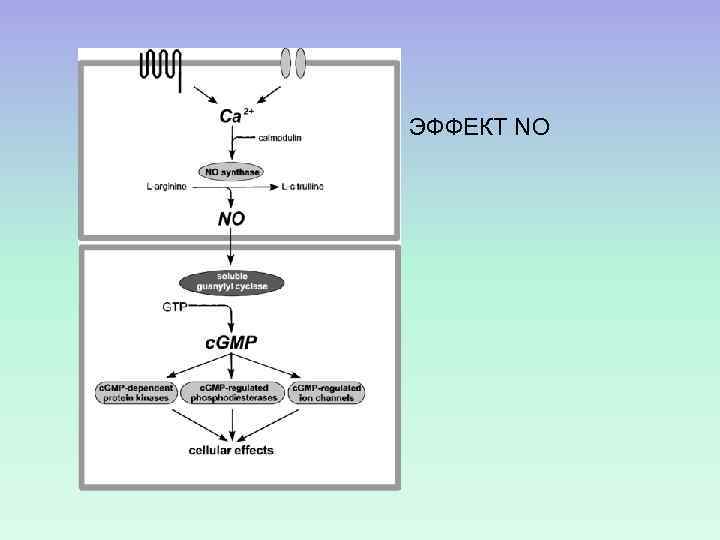 ЭФФЕКТ NO
ЭФФЕКТ NO
 ИЗОФОРМЫ NO-СИНТАЗЫ ОКСИД АЗОТА ВЫРАБАТЫВАЕТСЯ ИЗ L-АРГИНИНА ПОД ДЕЙСТВИЕМ NO-СИНТАЗЫ Конститутивная форма • В эндотелиальных клетках и нейронах • Активность зависит от Са 2+ • Связана с мембраной • Концентрация образуемого NO невелика • Функции: расслабление ГМК сосудов, межнейрональная передача Индуцибельная форма • В макрофагах • Активируется цитокинами • Цитозольный фермент • Концентрация образуемого NO большая • Функции: цитотоксическое и цитостатическое действие на атакуемые макрофагами клетки
ИЗОФОРМЫ NO-СИНТАЗЫ ОКСИД АЗОТА ВЫРАБАТЫВАЕТСЯ ИЗ L-АРГИНИНА ПОД ДЕЙСТВИЕМ NO-СИНТАЗЫ Конститутивная форма • В эндотелиальных клетках и нейронах • Активность зависит от Са 2+ • Связана с мембраной • Концентрация образуемого NO невелика • Функции: расслабление ГМК сосудов, межнейрональная передача Индуцибельная форма • В макрофагах • Активируется цитокинами • Цитозольный фермент • Концентрация образуемого NO большая • Функции: цитотоксическое и цитостатическое действие на атакуемые макрофагами клетки

 Эндотелиальная NO-синтаза миристоилированный нерастворимый фермент с молекулярной массой около 135 к. Да. NO, продуцируемый эндотелиальной синтазой, Ø регулирует тонус кровеносных и лимфатических сосудов, Øпредупреждает тромбообразование.
Эндотелиальная NO-синтаза миристоилированный нерастворимый фермент с молекулярной массой около 135 к. Да. NO, продуцируемый эндотелиальной синтазой, Ø регулирует тонус кровеносных и лимфатических сосудов, Øпредупреждает тромбообразование.

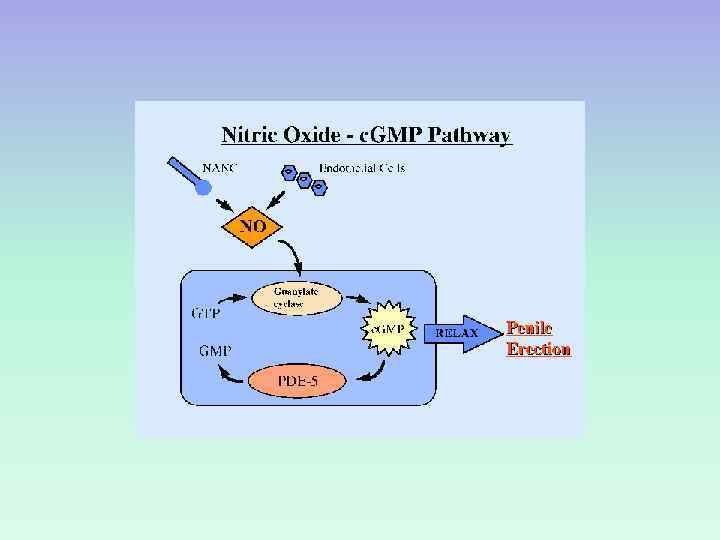
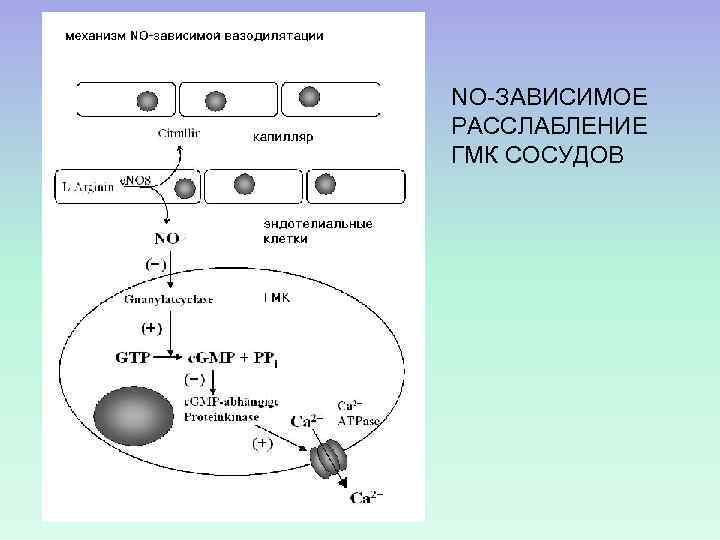 NO-ЗАВИСИМОЕ РАССЛАБЛЕНИЕ ГМК СОСУДОВ
NO-ЗАВИСИМОЕ РАССЛАБЛЕНИЕ ГМК СОСУДОВ
 Нейрональная NO-синтаза Øрастворимый гомодимер с молекулярной массой около 150 к. Да Øсодержит кальмодулин-связывающий центр, осуществляющий Са+-зависимую регуляцию синтеза NO Øсодержит атом железа, входящий в состав гемовой простетическкои группы
Нейрональная NO-синтаза Øрастворимый гомодимер с молекулярной массой около 150 к. Да Øсодержит кальмодулин-связывающий центр, осуществляющий Са+-зависимую регуляцию синтеза NO Øсодержит атом железа, входящий в состав гемовой простетическкои группы
 Функции нейронального NO: Øконтролирует осциляторную активность нейронов Øявляется медиатором ноцицепции, термочувствительности, обоняния Øрегулирует выход нейромедиаторов Øиграет центральную роль в процессах обучения и памяти
Функции нейронального NO: Øконтролирует осциляторную активность нейронов Øявляется медиатором ноцицепции, термочувствительности, обоняния Øрегулирует выход нейромедиаторов Øиграет центральную роль в процессах обучения и памяти
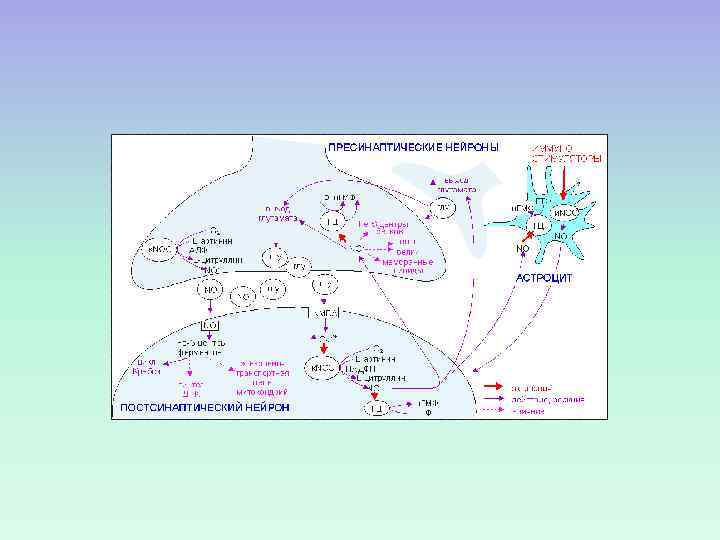
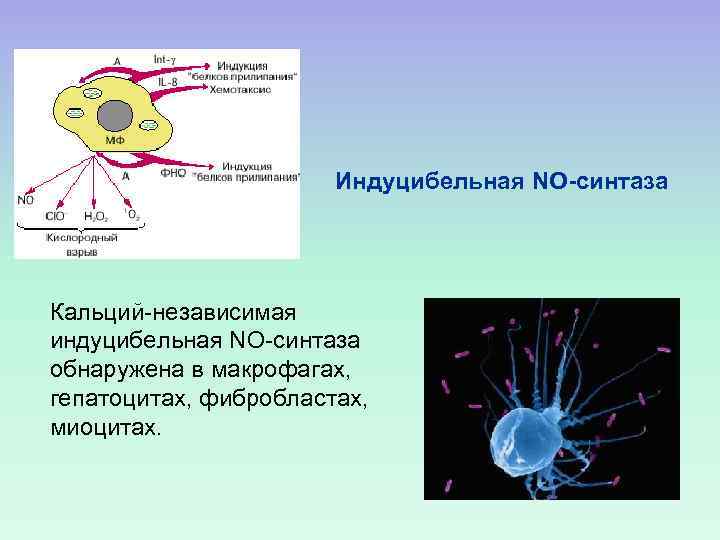 Индуцибельная NO-синтаза Кальций-независимая индуцибельная NO-синтаза обнаружена в макрофагах, гепатоцитах, фибробластах, миоцитах.
Индуцибельная NO-синтаза Кальций-независимая индуцибельная NO-синтаза обнаружена в макрофагах, гепатоцитах, фибробластах, миоцитах.
 Индуцибельная NO-синтаза При активации синтеза фермента образование NO возрастает в десятки раз и максимальных значений достигает через часы. i. NOS индуцируется в зараженных вирусом клетках. i. NOS стимулирует образование нестабильных свободных радикалов
Индуцибельная NO-синтаза При активации синтеза фермента образование NO возрастает в десятки раз и максимальных значений достигает через часы. i. NOS индуцируется в зараженных вирусом клетках. i. NOS стимулирует образование нестабильных свободных радикалов
 КАЛЬЦИЙ-ЗАВИСИМЫЕ ПУТИ РЕГУЛЯЦИИ КЛЕТОЧНОЙ АКТИВНОСТИ
КАЛЬЦИЙ-ЗАВИСИМЫЕ ПУТИ РЕГУЛЯЦИИ КЛЕТОЧНОЙ АКТИВНОСТИ
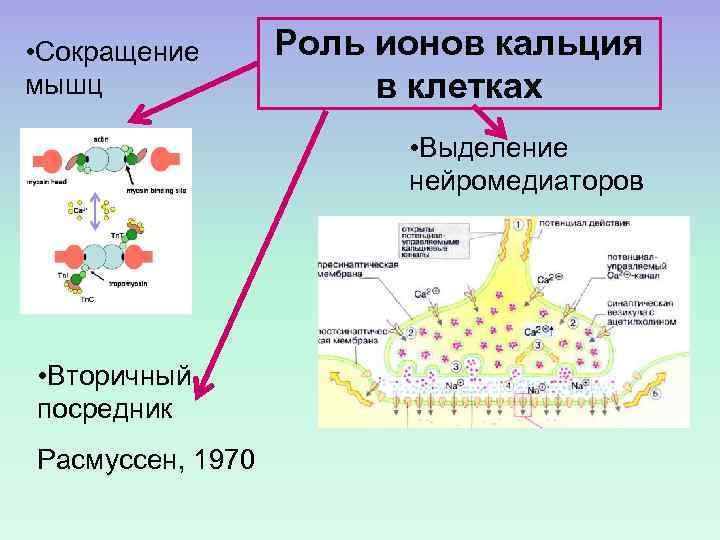 • Сокращение мышц Роль ионов кальция в клетках • Выделение нейромедиаторов • Вторичный посредник Расмуссен, 1970
• Сокращение мышц Роль ионов кальция в клетках • Выделение нейромедиаторов • Вторичный посредник Расмуссен, 1970
 Известно более 30 БАВ (гормоны, факторы роста, простагландины, цитокины), действие которых опосредовано ионами кальция. Большинство агонистов вызывает повышение внутриклеточной концентрации ионов кальция (например, ангиотензин II, эндотелин I, тромбоксан, брадикинин, гистамин, серотонин и др. ) Гораздо меньше агентов, приводящих к снижению внутриклеточной концентрации ионов кальция (например, простациклин, простагландин Е 1, Na-уретический пептид)
Известно более 30 БАВ (гормоны, факторы роста, простагландины, цитокины), действие которых опосредовано ионами кальция. Большинство агонистов вызывает повышение внутриклеточной концентрации ионов кальция (например, ангиотензин II, эндотелин I, тромбоксан, брадикинин, гистамин, серотонин и др. ) Гораздо меньше агентов, приводящих к снижению внутриклеточной концентрации ионов кальция (например, простациклин, простагландин Е 1, Na-уретический пептид)
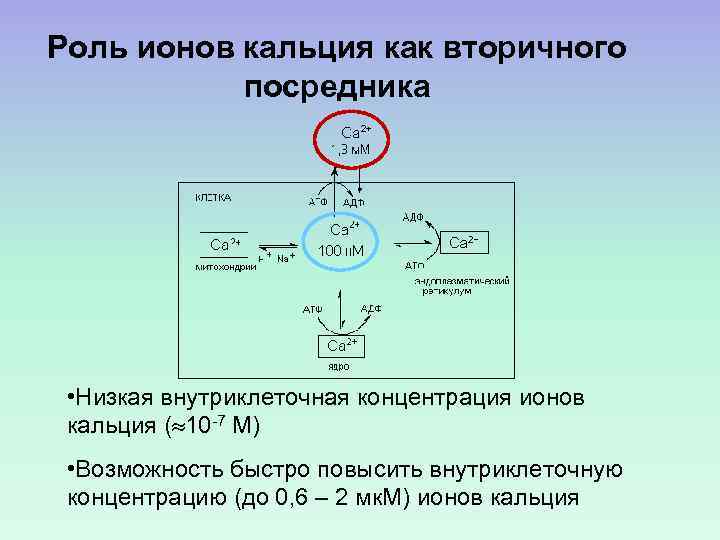 Роль ионов кальция как вторичного посредника • Низкая внутриклеточная концентрация ионов кальция ( 10 -7 М) • Возможность быстро повысить внутриклеточную концентрацию (до 0, 6 – 2 мк. М) ионов кальция
Роль ионов кальция как вторичного посредника • Низкая внутриклеточная концентрация ионов кальция ( 10 -7 М) • Возможность быстро повысить внутриклеточную концентрацию (до 0, 6 – 2 мк. М) ионов кальция
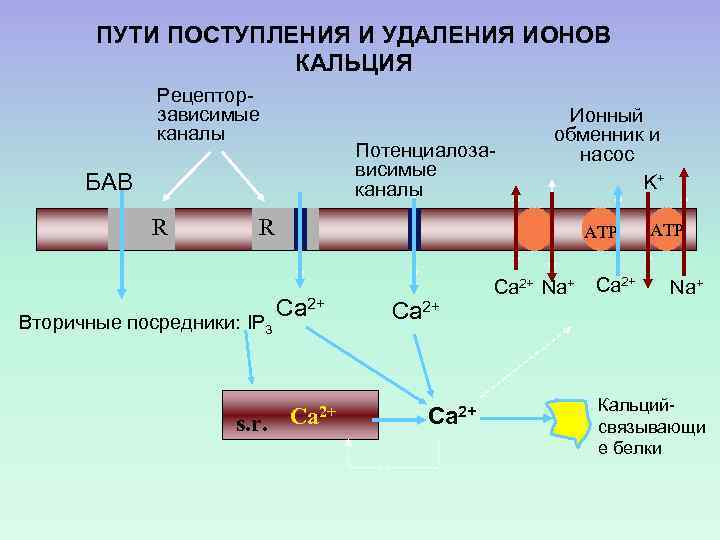 ПУТИ ПОСТУПЛЕНИЯ И УДАЛЕНИЯ ИОНОВ КАЛЬЦИЯ Рецепторзависимые каналы Потенциалозависимые каналы БАВ R Ионный обменник и насос K+ R Вторичные посредники: IP 3 s. r. ATP Ca 2+ Ca 2+ Na+ Ca 2+ ATP Na+ Кальцийсвязывающи е белки
ПУТИ ПОСТУПЛЕНИЯ И УДАЛЕНИЯ ИОНОВ КАЛЬЦИЯ Рецепторзависимые каналы Потенциалозависимые каналы БАВ R Ионный обменник и насос K+ R Вторичные посредники: IP 3 s. r. ATP Ca 2+ Ca 2+ Na+ Ca 2+ ATP Na+ Кальцийсвязывающи е белки
 Характеристики Ca 2+как вторичного посредника 1. В ответ на действие БАВ активируются структуры, которые поставляют ионы кальция в клетку. 2. В ответ на БАВ увеличивается [Ca 2+]in. 3. Снижение активности Ca 2+-АТФазы приводит к усилению эффекта ионов Ca 2+. 4. Эффект БАВ воспроизводится с помощью Ca 2+ионофора. 5. Повышение [Ca 2+]in предшествует биологическому эффекту.
Характеристики Ca 2+как вторичного посредника 1. В ответ на действие БАВ активируются структуры, которые поставляют ионы кальция в клетку. 2. В ответ на БАВ увеличивается [Ca 2+]in. 3. Снижение активности Ca 2+-АТФазы приводит к усилению эффекта ионов Ca 2+. 4. Эффект БАВ воспроизводится с помощью Ca 2+ионофора. 5. Повышение [Ca 2+]in предшествует биологическому эффекту.
 Кальций-связывающие белки I. Кальций-связывающие белки с ферментативной активностью II. Кальций-фосфолипид-связывающие белки III. Кальций-запасающие белки IV. Кальций-связывающие белки в составе ионных каналов и др. ион-транспортных систем V. Регуляторные кальций-связывающие белки, не проявляющие ферментативной активности
Кальций-связывающие белки I. Кальций-связывающие белки с ферментативной активностью II. Кальций-фосфолипид-связывающие белки III. Кальций-запасающие белки IV. Кальций-связывающие белки в составе ионных каналов и др. ион-транспортных систем V. Регуляторные кальций-связывающие белки, не проявляющие ферментативной активности
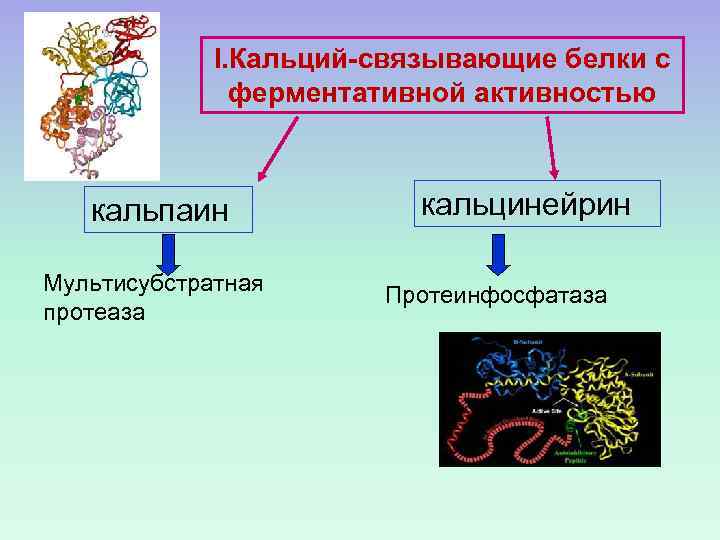 I. Кальций-связывающие белки с ферментативной активностью кальпаин Мультисубстратная протеаза кальцинейрин Протеинфосфатаза
I. Кальций-связывающие белки с ферментативной активностью кальпаин Мультисубстратная протеаза кальцинейрин Протеинфосфатаза
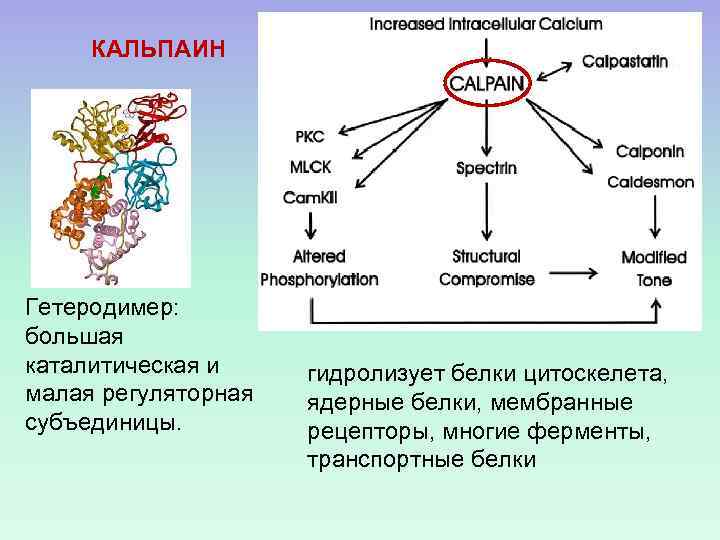 КАЛЬПАИН Гетеродимер: большая каталитическая и малая регуляторная субъединицы. гидролизует белки цитоскелета, ядерные белки, мембранные рецепторы, многие ферменты, транспортные белки
КАЛЬПАИН Гетеродимер: большая каталитическая и малая регуляторная субъединицы. гидролизует белки цитоскелета, ядерные белки, мембранные рецепторы, многие ферменты, транспортные белки
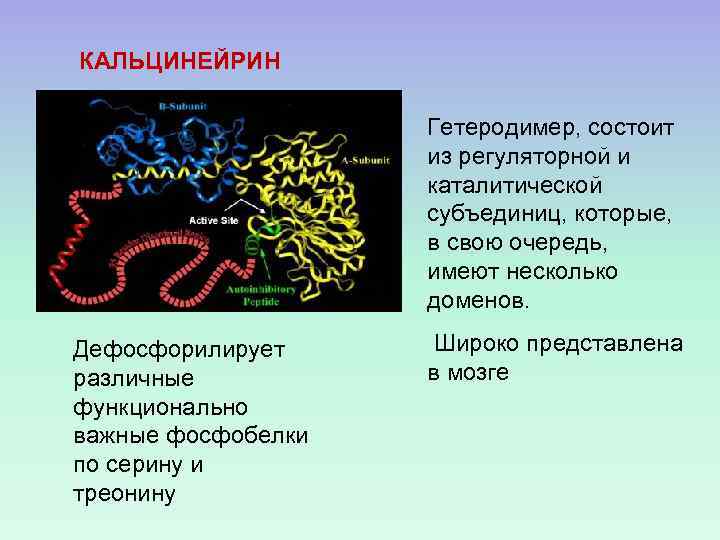 КАЛЬЦИНЕЙРИН Гетеродимер, состоит из регуляторной и каталитической субъединиц, которые, в свою очередь, имеют несколько доменов. Дефосфорилирует различные функционально важные фосфобелки по серину и треонину Широко представлена в мозге
КАЛЬЦИНЕЙРИН Гетеродимер, состоит из регуляторной и каталитической субъединиц, которые, в свою очередь, имеют несколько доменов. Дефосфорилирует различные функционально важные фосфобелки по серину и треонину Широко представлена в мозге
 II. Кальций-фосфолипид-связывающие белки АННЕКСИНЫ (известно более 10) Содержат 4 Са 2+-связывающих домена В ПРИСУТСТВИИ ИОНОВ КАЛЬЦИЯ СВЯЗЫВАЮТ ФОСФОЛИПИДЫ МЕМБРАН, ТЕМ САМЫМ • УЧАСТВУЮТ В ПРОЦЕССАХ СЛИЯНИЯ И АГРЕГАЦИИ МЕМБРАН • ИНГИБИРУЮТ ФОСФОЛИПАЗУ А 2 • КОНТРОЛИРУЮТ ПРОЛИФЕРАЦИЮ И ДИФФЕРЕНЦИРОВКУ КЛЕТОК
II. Кальций-фосфолипид-связывающие белки АННЕКСИНЫ (известно более 10) Содержат 4 Са 2+-связывающих домена В ПРИСУТСТВИИ ИОНОВ КАЛЬЦИЯ СВЯЗЫВАЮТ ФОСФОЛИПИДЫ МЕМБРАН, ТЕМ САМЫМ • УЧАСТВУЮТ В ПРОЦЕССАХ СЛИЯНИЯ И АГРЕГАЦИИ МЕМБРАН • ИНГИБИРУЮТ ФОСФОЛИПАЗУ А 2 • КОНТРОЛИРУЮТ ПРОЛИФЕРАЦИЮ И ДИФФЕРЕНЦИРОВКУ КЛЕТОК
 Во время апоптоза клетки высвобождают фосфатидилсерин на клеточной поверхности. Аннексин V, являющийся фосфолипид-связывающим протеином, в присутствии ионов кальция селективно, с высокой аффинностью, связывает фосфатидилсерин. Он проявляет очень низкую аффинность к таким фракциям фосфолипидов, как фосфатидилэтаноламин, сфингомиелин и фосфатидилхолин. Такой профиль связывания позволяет использовать аннексин V в качестве высокоспецифичного агента для определения апоптических клеток.
Во время апоптоза клетки высвобождают фосфатидилсерин на клеточной поверхности. Аннексин V, являющийся фосфолипид-связывающим протеином, в присутствии ионов кальция селективно, с высокой аффинностью, связывает фосфатидилсерин. Он проявляет очень низкую аффинность к таким фракциям фосфолипидов, как фосфатидилэтаноламин, сфингомиелин и фосфатидилхолин. Такой профиль связывания позволяет использовать аннексин V в качестве высокоспецифичного агента для определения апоптических клеток.
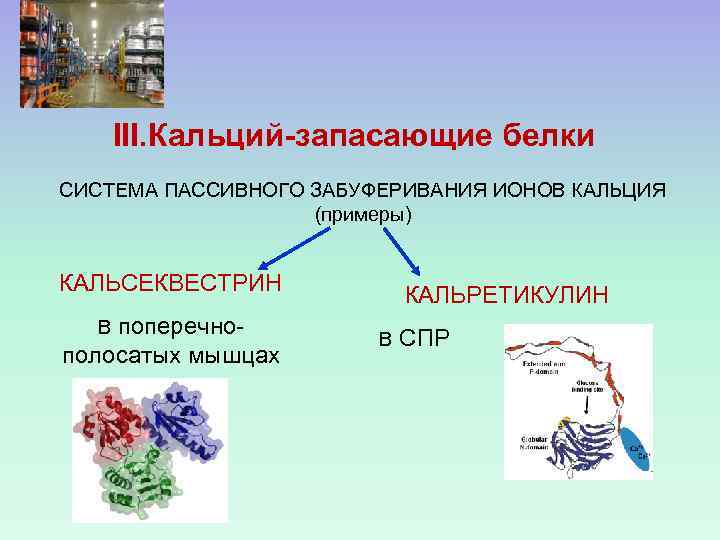 III. Кальций-запасающие белки СИСТЕМА ПАССИВНОГО ЗАБУФЕРИВАНИЯ ИОНОВ КАЛЬЦИЯ (примеры) КАЛЬСЕКВЕСТРИН поперечнополосатых мышцах В КАЛЬРЕТИКУЛИН В СПР
III. Кальций-запасающие белки СИСТЕМА ПАССИВНОГО ЗАБУФЕРИВАНИЯ ИОНОВ КАЛЬЦИЯ (примеры) КАЛЬСЕКВЕСТРИН поперечнополосатых мышцах В КАЛЬРЕТИКУЛИН В СПР
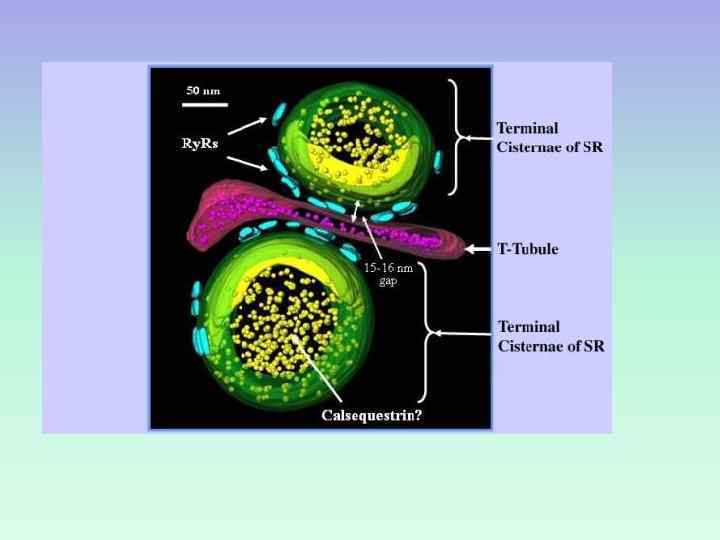
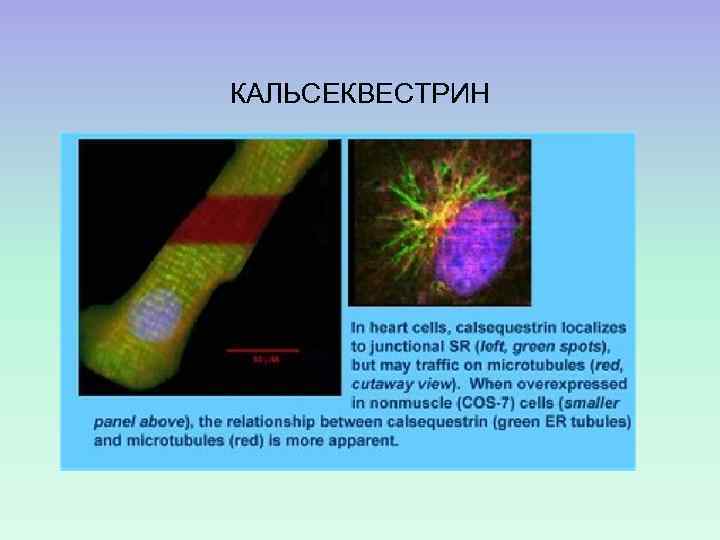 КАЛЬСЕКВЕСТРИН
КАЛЬСЕКВЕСТРИН
 IV. Кальций-связывающие белки в составе ион-транспортных систем Са 2+зависимые калиевые каналы Са 2+зависимые хлорные каналы Na+/Ca 2+ обменник Са 2+ -АТФаза Са 2+
IV. Кальций-связывающие белки в составе ион-транспортных систем Са 2+зависимые калиевые каналы Са 2+зависимые хлорные каналы Na+/Ca 2+ обменник Са 2+ -АТФаза Са 2+
 V. Регуляторные кальций-связывающие белки, не проявляющие ферментативной активности Центральное место среди этих белков занимает КАЛЬМОДУЛИН Впервые обнаружен Ченгом в мозге КРС в качестве Са 2+зависимого активатора фосфодиэстеразы циклических нуклеотидов. Впоследствии обнаружен во всех эукариотических клетках.
V. Регуляторные кальций-связывающие белки, не проявляющие ферментативной активности Центральное место среди этих белков занимает КАЛЬМОДУЛИН Впервые обнаружен Ченгом в мозге КРС в качестве Са 2+зависимого активатора фосфодиэстеразы циклических нуклеотидов. Впоследствии обнаружен во всех эукариотических клетках.
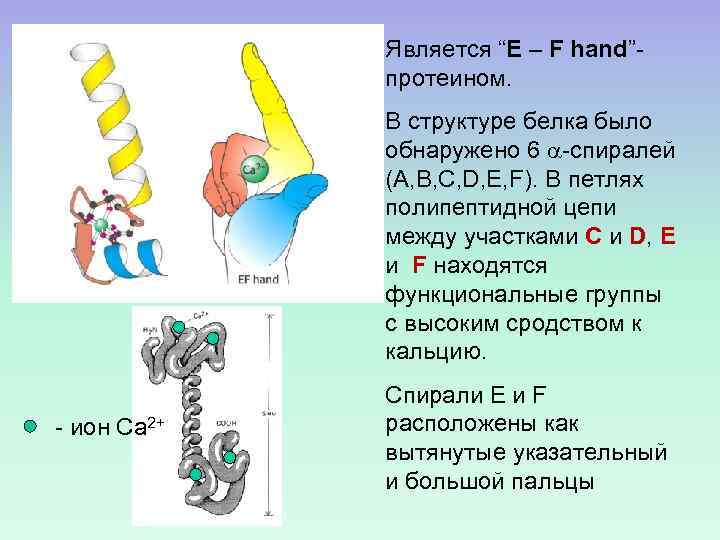 Является “E – F hand”протеином. В структуре белка было обнаружено 6 -спиралей (A, B, C, D, E, F). В петлях полипептидной цепи между участками C и D, E и F находятся функциональные группы с высоким сродством к кальцию. - ион Са 2+ Спирали E и F расположены как вытянутые указательный и большой пальцы
Является “E – F hand”протеином. В структуре белка было обнаружено 6 -спиралей (A, B, C, D, E, F). В петлях полипептидной цепи между участками C и D, E и F находятся функциональные группы с высоким сродством к кальцию. - ион Са 2+ Спирали E и F расположены как вытянутые указательный и большой пальцы
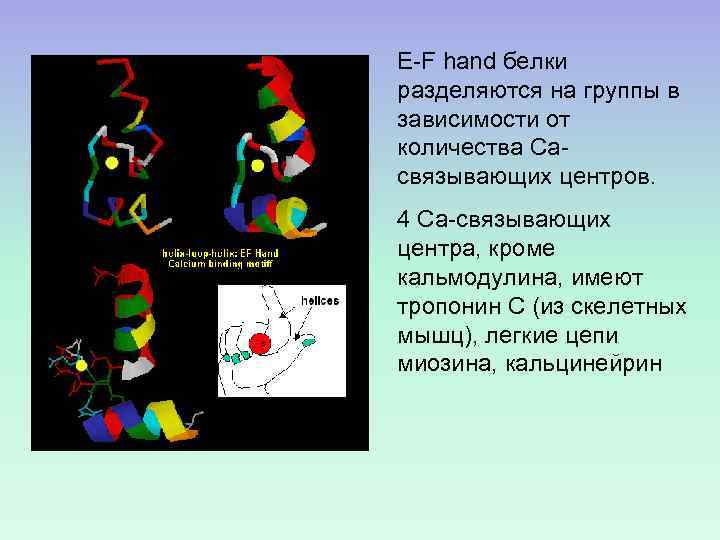 E-F hand белки разделяются на группы в зависимости от количества Сасвязывающих центров. 4 Са-связывающих центра, кроме кальмодулина, имеют тропонин С (из скелетных мышц), легкие цепи миозина, кальцинейрин
E-F hand белки разделяются на группы в зависимости от количества Сасвязывающих центров. 4 Са-связывающих центра, кроме кальмодулина, имеют тропонин С (из скелетных мышц), легкие цепи миозина, кальцинейрин
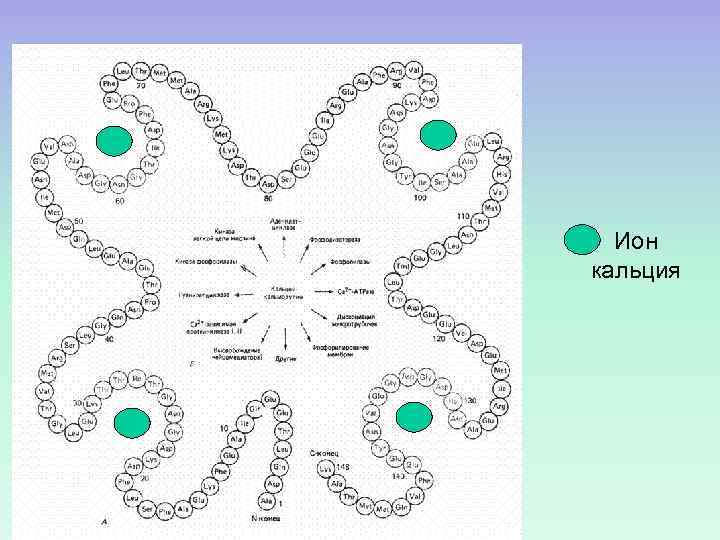 Ион кальция
Ион кальция
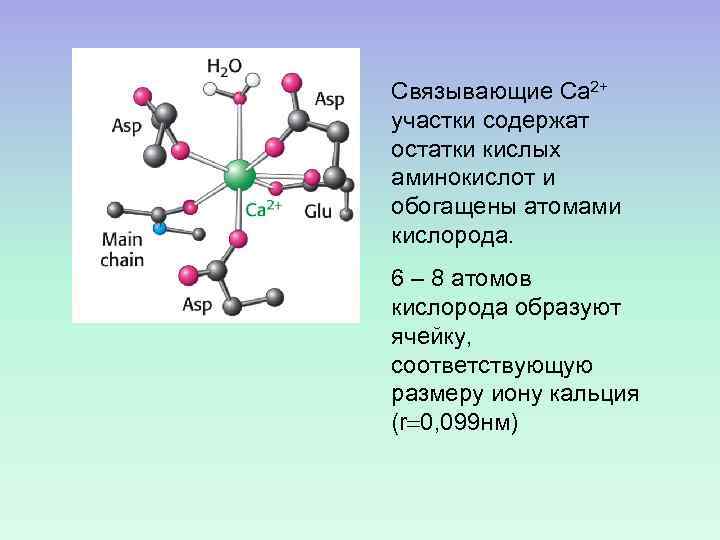 Связывающие Са 2+ участки содержат остатки кислых аминокислот и обогащены атомами кислорода. 6 – 8 атомов кислорода образуют ячейку, соответствующую размеру иону кальция (r 0, 099 нм)
Связывающие Са 2+ участки содержат остатки кислых аминокислот и обогащены атомами кислорода. 6 – 8 атомов кислорода образуют ячейку, соответствующую размеру иону кальция (r 0, 099 нм)
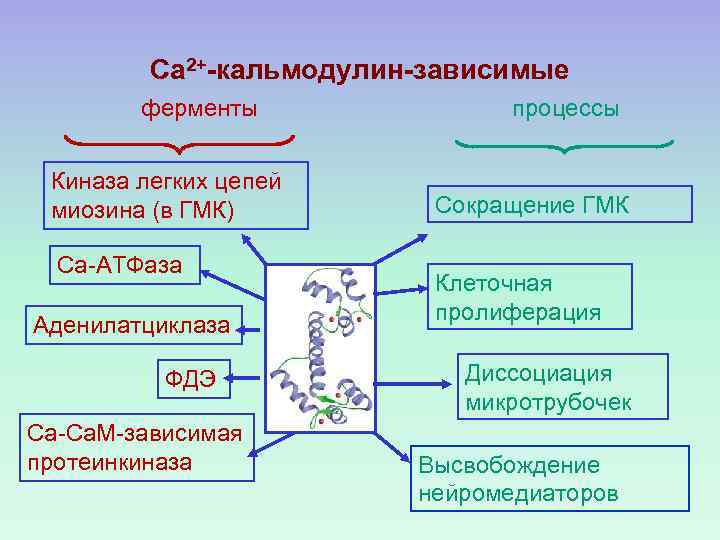 Са 2+-кальмодулин-зависимые ферменты Киназа легких цепей миозина (в ГМК) Са-АТФаза Аденилатциклаза ФДЭ Са-Са. М-зависимая протеинкиназа процессы Сокращение ГМК Клеточная пролиферация Диссоциация микротрубочек Высвобождение нейромедиаторов
Са 2+-кальмодулин-зависимые ферменты Киназа легких цепей миозина (в ГМК) Са-АТФаза Аденилатциклаза ФДЭ Са-Са. М-зависимая протеинкиназа процессы Сокращение ГМК Клеточная пролиферация Диссоциация микротрубочек Высвобождение нейромедиаторов
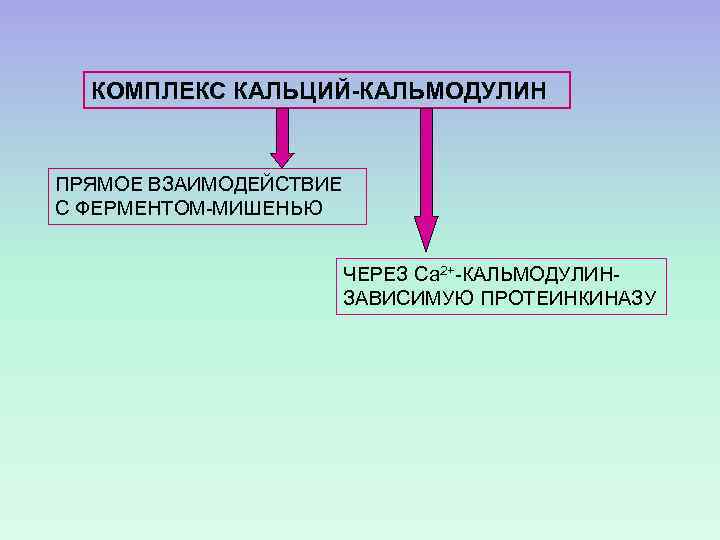 КОМПЛЕКС КАЛЬЦИЙ-КАЛЬМОДУЛИН ПРЯМОЕ ВЗАИМОДЕЙСТВИЕ С ФЕРМЕНТОМ-МИШЕНЬЮ ЧЕРЕЗ Са 2+-КАЛЬМОДУЛИНЗАВИСИМУЮ ПРОТЕИНКИНАЗУ
КОМПЛЕКС КАЛЬЦИЙ-КАЛЬМОДУЛИН ПРЯМОЕ ВЗАИМОДЕЙСТВИЕ С ФЕРМЕНТОМ-МИШЕНЬЮ ЧЕРЕЗ Са 2+-КАЛЬМОДУЛИНЗАВИСИМУЮ ПРОТЕИНКИНАЗУ
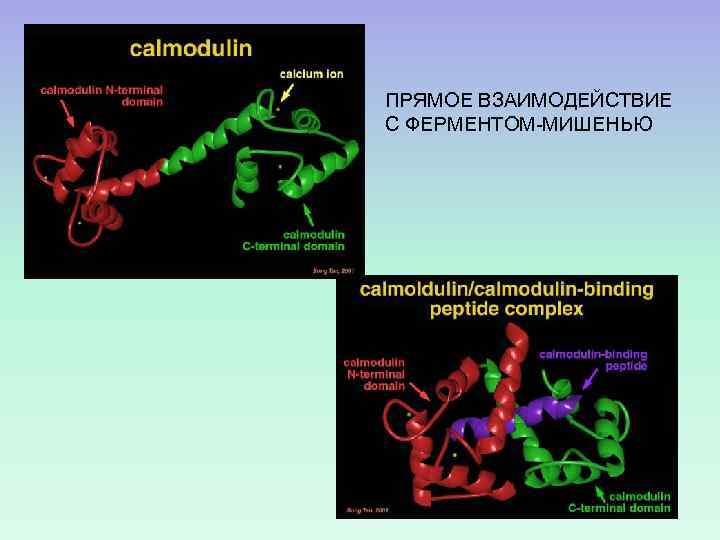 ПРЯМОЕ ВЗАИМОДЕЙСТВИЕ С ФЕРМЕНТОМ-МИШЕНЬЮ
ПРЯМОЕ ВЗАИМОДЕЙСТВИЕ С ФЕРМЕНТОМ-МИШЕНЬЮ
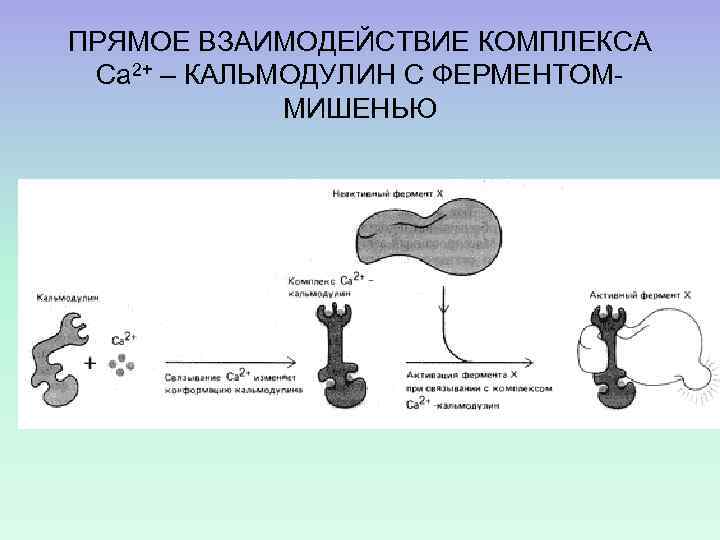 ПРЯМОЕ ВЗАИМОДЕЙСТВИЕ КОМПЛЕКСА Са 2+ – КАЛЬМОДУЛИН С ФЕРМЕНТОММИШЕНЬЮ
ПРЯМОЕ ВЗАИМОДЕЙСТВИЕ КОМПЛЕКСА Са 2+ – КАЛЬМОДУЛИН С ФЕРМЕНТОММИШЕНЬЮ
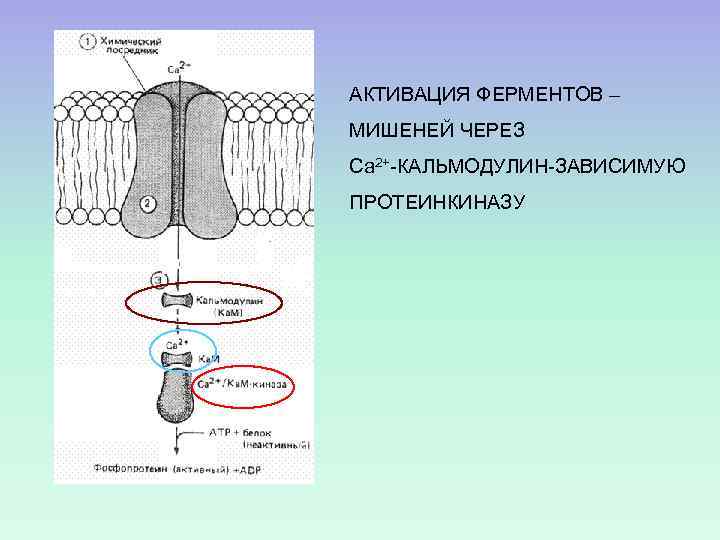 АКТИВАЦИЯ ФЕРМЕНТОВ – МИШЕНЕЙ ЧЕРЕЗ Са 2+-КАЛЬМОДУЛИН-ЗАВИСИМУЮ ПРОТЕИНКИНАЗУ
АКТИВАЦИЯ ФЕРМЕНТОВ – МИШЕНЕЙ ЧЕРЕЗ Са 2+-КАЛЬМОДУЛИН-ЗАВИСИМУЮ ПРОТЕИНКИНАЗУ
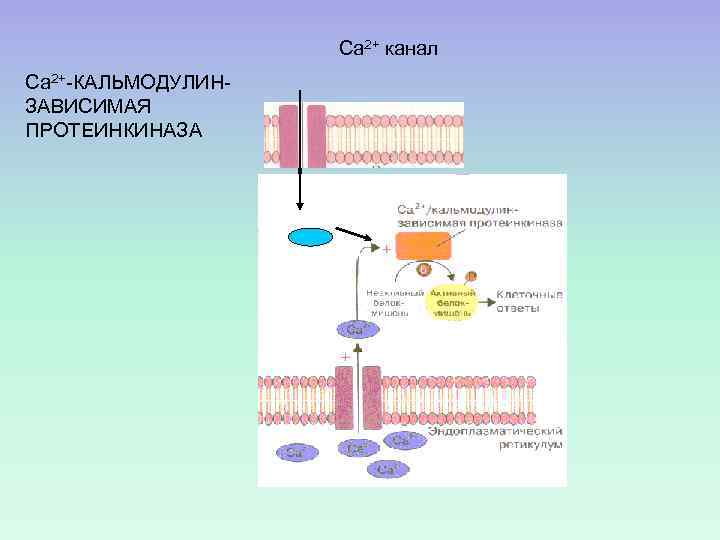 Са 2+ канал Са 2+-КАЛЬМОДУЛИНЗАВИСИМАЯ ПРОТЕИНКИНАЗА С а
Са 2+ канал Са 2+-КАЛЬМОДУЛИНЗАВИСИМАЯ ПРОТЕИНКИНАЗА С а
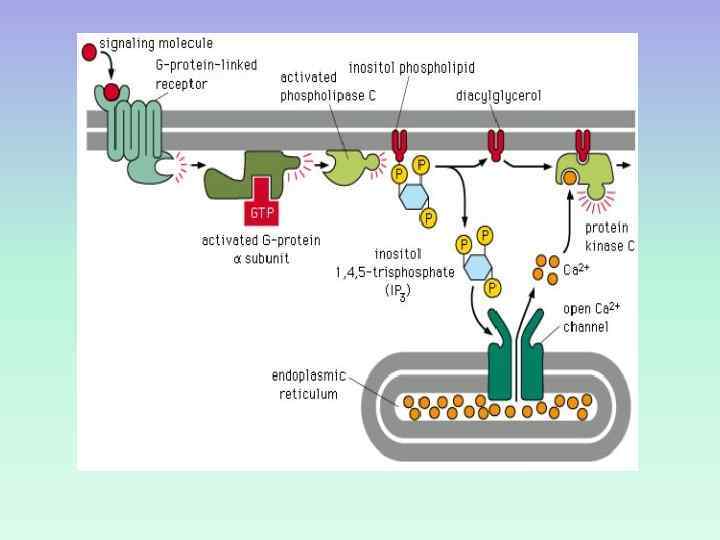
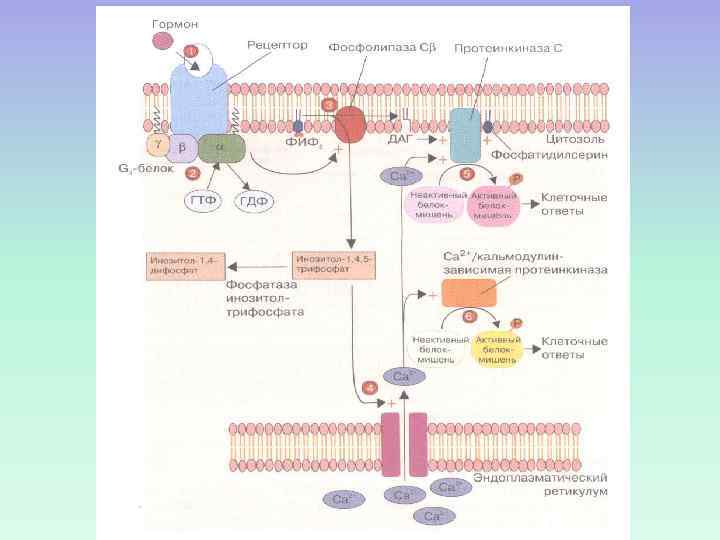
 СИГНАЛЬНАЯ СИСТЕМА, ОПОСРЕДОВАННАЯ ИОНАМИ КАЛЬЦИЯ И ПРОДУКТАМИ ГИДРОЛИЗА МЕМБРАННЫХ ФОСФОИНОЗИТИДОВ
СИГНАЛЬНАЯ СИСТЕМА, ОПОСРЕДОВАННАЯ ИОНАМИ КАЛЬЦИЯ И ПРОДУКТАМИ ГИДРОЛИЗА МЕМБРАННЫХ ФОСФОИНОЗИТИДОВ
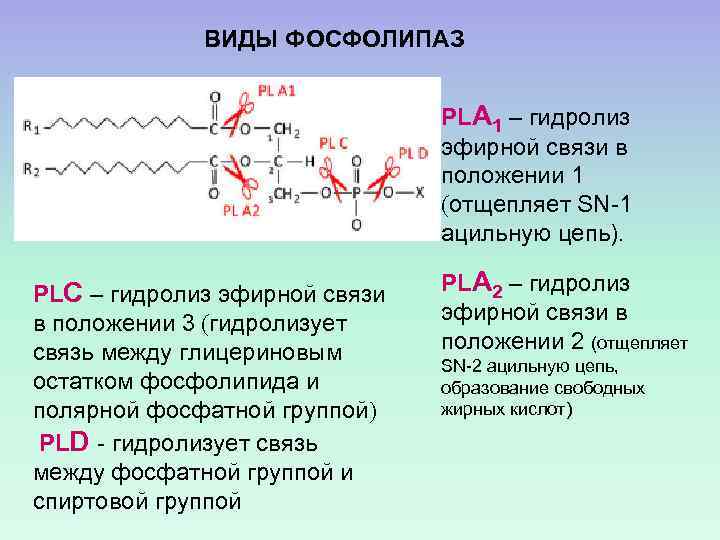 ВИДЫ ФОСФОЛИПАЗ PLА 1 – гидролиз эфирной связи в положении 1 (отщепляет SN-1 ацильную цепь). PLС – гидролиз эфирной связи в положении 3 (гидролизует связь между глицериновым остатком фосфолипида и полярной фосфатной группой) PLD - гидролизует связь между фосфатной группой и спиртовой группой PLА 2 – гидролиз эфирной связи в положении 2 (отщепляет SN-2 ацильную цепь, образование свободных жирных кислот)
ВИДЫ ФОСФОЛИПАЗ PLА 1 – гидролиз эфирной связи в положении 1 (отщепляет SN-1 ацильную цепь). PLС – гидролиз эфирной связи в положении 3 (гидролизует связь между глицериновым остатком фосфолипида и полярной фосфатной группой) PLD - гидролизует связь между фосфатной группой и спиртовой группой PLА 2 – гидролиз эфирной связи в положении 2 (отщепляет SN-2 ацильную цепь, образование свободных жирных кислот)
 ФОСФОЛИПАЗА С ГИДРОЛИЗУЕТ МИНОРНЫЕ ФОСФОЛИПИДЫ МЕМБРАН ФОСФОИНОЗИТИДЫ
ФОСФОЛИПАЗА С ГИДРОЛИЗУЕТ МИНОРНЫЕ ФОСФОЛИПИДЫ МЕМБРАН ФОСФОИНОЗИТИДЫ
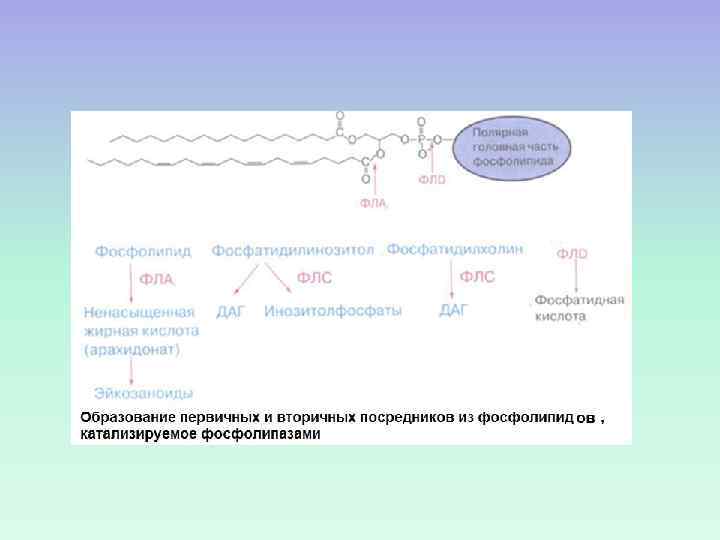
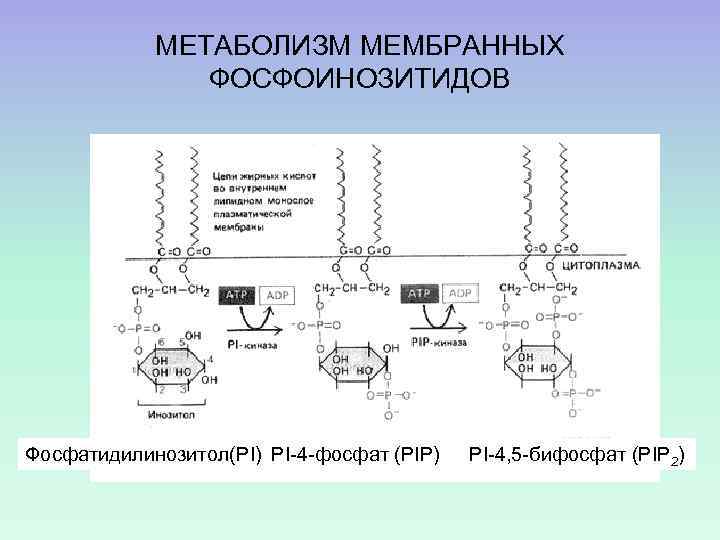 МЕТАБОЛИЗМ МЕМБРАННЫХ ФОСФОИНОЗИТИДОВ Фосфатидилинозитол(PI) PI-4 -фосфат (PIP) PI-4, 5 -бифосфат (PIP 2)
МЕТАБОЛИЗМ МЕМБРАННЫХ ФОСФОИНОЗИТИДОВ Фосфатидилинозитол(PI) PI-4 -фосфат (PIP) PI-4, 5 -бифосфат (PIP 2)
 ИЗОФОРМЫ ФОСФОЛИПАЗЫ С
ИЗОФОРМЫ ФОСФОЛИПАЗЫ С
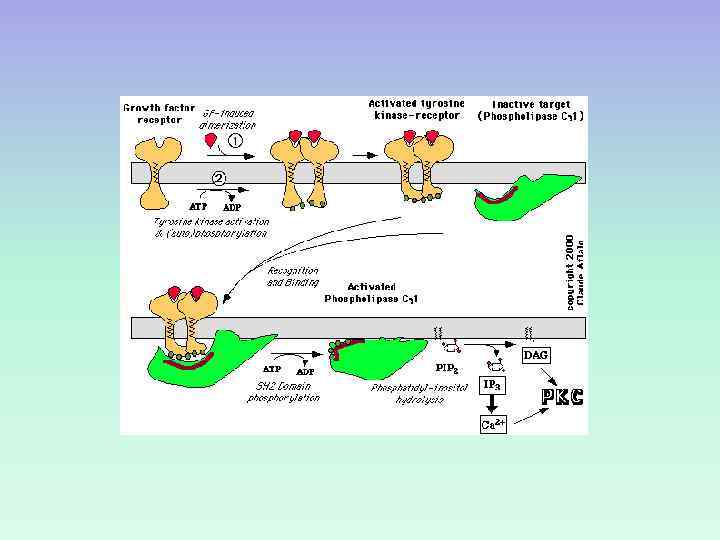
 ФОСФОЛИПАЗА С: изоформы и ФОСФОЛИПАЗА С активируется через рецепторы, связанные с Gбелками (Gqбелок) ФОСФОЛИПАЗА С активируется благодаря фосфорилированию ее тирозинкиназой.
ФОСФОЛИПАЗА С: изоформы и ФОСФОЛИПАЗА С активируется через рецепторы, связанные с Gбелками (Gqбелок) ФОСФОЛИПАЗА С активируется благодаря фосфорилированию ее тирозинкиназой.
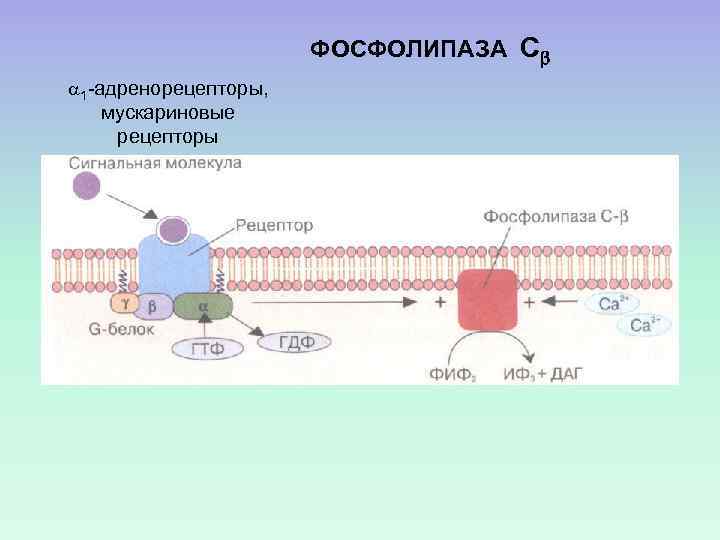 ФОСФОЛИПАЗА С 1 -адренорецепторы, мускариновые рецепторы
ФОСФОЛИПАЗА С 1 -адренорецепторы, мускариновые рецепторы
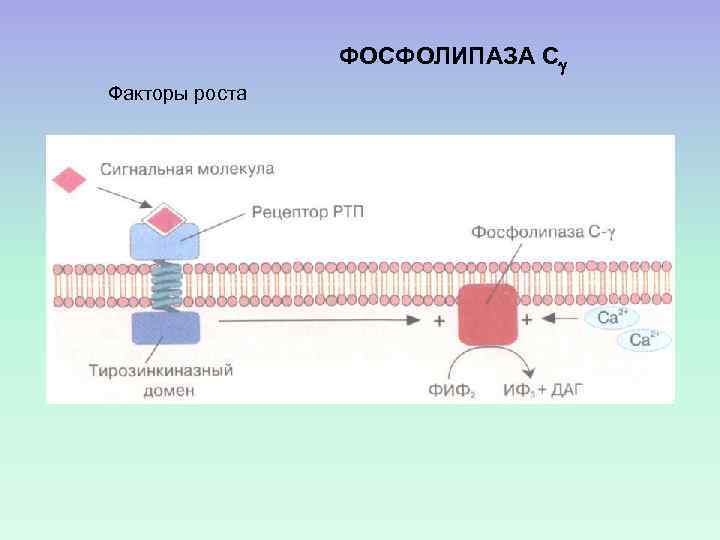 ФОСФОЛИПАЗА С Факторы роста
ФОСФОЛИПАЗА С Факторы роста
 ПРОДУКТЫ ГИДРОЛИЗА ФОСФОИНОЗИТИДОВ: ВТОРИЧНЫЕ ПОСРЕДНИКИ Инозитолтрифосфат – гидрофильная молекула, которая диффундирует в цитозоль и взаимодействует с рецепторами ретикулума Диацилглицерол – гидрофобная молекула, которая остается в мембране. Под действием фосфолипазы А 2 дает арахидоновую кислоту, которая является предшественником эйкозаноидов.
ПРОДУКТЫ ГИДРОЛИЗА ФОСФОИНОЗИТИДОВ: ВТОРИЧНЫЕ ПОСРЕДНИКИ Инозитолтрифосфат – гидрофильная молекула, которая диффундирует в цитозоль и взаимодействует с рецепторами ретикулума Диацилглицерол – гидрофобная молекула, которая остается в мембране. Под действием фосфолипазы А 2 дает арахидоновую кислоту, которая является предшественником эйкозаноидов.

 ПРОЦЕССЫ, В КОТОРЫХ УЧАСТВУЕТ ПРОТЕИНКИНАЗА С Секреция Сокращения ГМК Агрегация тромбоцитов Фосфорилирование рецепторов
ПРОЦЕССЫ, В КОТОРЫХ УЧАСТВУЕТ ПРОТЕИНКИНАЗА С Секреция Сокращения ГМК Агрегация тромбоцитов Фосфорилирование рецепторов
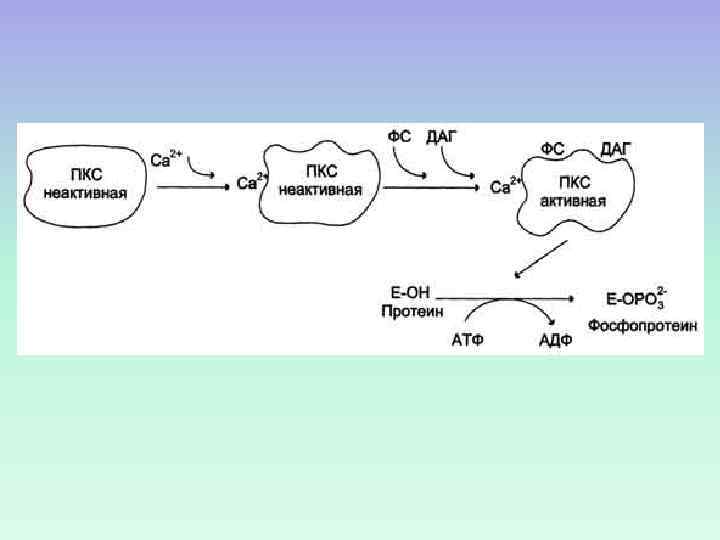
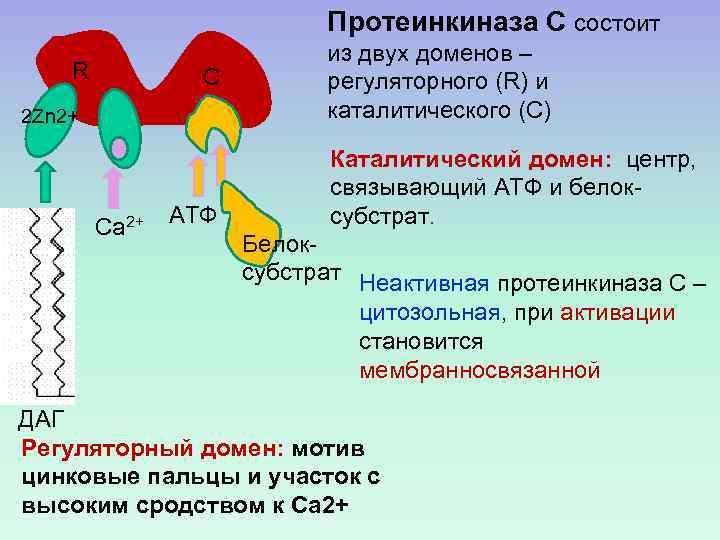 Протеинкиназа С состоит R С 2 Zn 2+ Са 2+ АТФ из двух доменов – регуляторного (R) и каталитического (C) Каталитический домен: центр, связывающий АТФ и белоксубстрат. Белоксубстрат Неактивная протеинкиназа С – цитозольная, при активации становится мембранносвязанной ДАГ Регуляторный домен: мотив цинковые пальцы и участок с высоким сродством к Са 2+
Протеинкиназа С состоит R С 2 Zn 2+ Са 2+ АТФ из двух доменов – регуляторного (R) и каталитического (C) Каталитический домен: центр, связывающий АТФ и белоксубстрат. Белоксубстрат Неактивная протеинкиназа С – цитозольная, при активации становится мембранносвязанной ДАГ Регуляторный домен: мотив цинковые пальцы и участок с высоким сродством к Са 2+