круговорот серы.ppt
- Количество слайдов: 23
 Цикл серы
Цикл серы
 Сера, которая встречается на суше, представляет собой смесь изотопов с массами: 32, 33, 34 и 36 в (%): 95. 02 0. 75, 4. 21, 0. 02 Валентность серы меняется от (-2) в сульфидах до (+6) в сульфатах. Наиболее часто встречаемые соединения: сульфаты, сульфиды, полисульфиды и элементарная сера
Сера, которая встречается на суше, представляет собой смесь изотопов с массами: 32, 33, 34 и 36 в (%): 95. 02 0. 75, 4. 21, 0. 02 Валентность серы меняется от (-2) в сульфидах до (+6) в сульфатах. Наиболее часто встречаемые соединения: сульфаты, сульфиды, полисульфиды и элементарная сера
 Глобальный биогеохимический цикл серы – целый комплекс химических и биохимических реакций, в которых сера участвует в различных формах с разными физико-химическими свойствами и агрегатными состояниями Газообразные формы серы: H 2 S (сероводород), SO 2 (двуокись серы), SO 3 (триокись серы) Серосодержащие газы образуются как в природе, так и в промышленном производстве
Глобальный биогеохимический цикл серы – целый комплекс химических и биохимических реакций, в которых сера участвует в различных формах с разными физико-химическими свойствами и агрегатными состояниями Газообразные формы серы: H 2 S (сероводород), SO 2 (двуокись серы), SO 3 (триокись серы) Серосодержащие газы образуются как в природе, так и в промышленном производстве
 Все серосодержащие газы хорошо растворимы в воде и образуют растворы с ярко выраженными кислотными свойствами В атмосфере H 2 S быстро окисляется до SO 2, который очень реакционен и вступает в реакции окисления, гидратации: SO 2 + 2 H 2 S 2 SO 2 + O 2 3 S + 2 H 2 O 2 SO 3 хорошо растворим в воде с образованием H 2 SO 4, которая ведет себя очень агрессивно, способствуя выветриванию минералов и коррозии металлов.
Все серосодержащие газы хорошо растворимы в воде и образуют растворы с ярко выраженными кислотными свойствами В атмосфере H 2 S быстро окисляется до SO 2, который очень реакционен и вступает в реакции окисления, гидратации: SO 2 + 2 H 2 S 2 SO 2 + O 2 3 S + 2 H 2 O 2 SO 3 хорошо растворим в воде с образованием H 2 SO 4, которая ведет себя очень агрессивно, способствуя выветриванию минералов и коррозии металлов.
 Большинство сульфатов широко распространено в природе: Ca. SO 4 – ангидрит; Ca. SO 4 H 2 O – гипс Окисленная сера выводится из цикла преимущественно в кальциевых соединениях. Отложения ангидрита и гипса – самые громадные резервуары серы. Сульфиды образуются из водных растворов H 2 S. Большинство сульфидов металлов (за исключением щелочных и щелочеземельных) очень плохо растворимы в воде.
Большинство сульфатов широко распространено в природе: Ca. SO 4 – ангидрит; Ca. SO 4 H 2 O – гипс Окисленная сера выводится из цикла преимущественно в кальциевых соединениях. Отложения ангидрита и гипса – самые громадные резервуары серы. Сульфиды образуются из водных растворов H 2 S. Большинство сульфидов металлов (за исключением щелочных и щелочеземельных) очень плохо растворимы в воде.
 Серосодержащие соединения с металлами меняются в зависимости от окислительно-восстановительных условий: анаэробные сульфиды аэробные сульфаты Окисленные формы, сульфаты металлов, более растворимы и могут вымываться, а сульфиды – плохо растворимы, иммобилизуют металлы. Из всех сульфидов наибольшее распространение имеет сульфид железа – Fe. S 2 или пирит, широко встречаемый в природе. Наряду с элементарной серой пирит используется для производства серной кислоты.
Серосодержащие соединения с металлами меняются в зависимости от окислительно-восстановительных условий: анаэробные сульфиды аэробные сульфаты Окисленные формы, сульфаты металлов, более растворимы и могут вымываться, а сульфиды – плохо растворимы, иммобилизуют металлы. Из всех сульфидов наибольшее распространение имеет сульфид железа – Fe. S 2 или пирит, широко встречаемый в природе. Наряду с элементарной серой пирит используется для производства серной кислоты.
 ВЫСОКОТЕМПЕРАТУРНЫЕ РЕАКЦИИ В силикатных расплавах сера может присутствовать как в виде сульфидов, так и сульфатов. Базальтовые расплавы при 12000 С в зависимости от парциального давления О 2 могут давать сульфаты и сульфиды S 2 (газ) + 2 Ме. О (расплав) 2 Ме. S + О 2 В условиях быстрого охлаждения (при подводных извержениях вулканов), изверженный материал быстро кристаллизуется и сера изолируется в виде сульфидных инклюзий.
ВЫСОКОТЕМПЕРАТУРНЫЕ РЕАКЦИИ В силикатных расплавах сера может присутствовать как в виде сульфидов, так и сульфатов. Базальтовые расплавы при 12000 С в зависимости от парциального давления О 2 могут давать сульфаты и сульфиды S 2 (газ) + 2 Ме. О (расплав) 2 Ме. S + О 2 В условиях быстрого охлаждения (при подводных извержениях вулканов), изверженный материал быстро кристаллизуется и сера изолируется в виде сульфидных инклюзий.
 ОБРАЗОВАНИЕ И РАЗЛОЖЕНИЕ S-СОДЕРЖАЩИХ СОЕДИНЕНИЙ В БИОЛОГИЧЕСКИХ ПРОЦЕССАХ Сера входит в состав многих аминокислот и является одним из главных биофильных элементов. Подавляющее большинство растений и микроорганизмов используют реакцию восстановления при ассимиляции сульфатов. Сера затем включается в серосодержащие аминокислоты: цистин, цистеин и метионин.
ОБРАЗОВАНИЕ И РАЗЛОЖЕНИЕ S-СОДЕРЖАЩИХ СОЕДИНЕНИЙ В БИОЛОГИЧЕСКИХ ПРОЦЕССАХ Сера входит в состав многих аминокислот и является одним из главных биофильных элементов. Подавляющее большинство растений и микроорганизмов используют реакцию восстановления при ассимиляции сульфатов. Сера затем включается в серосодержащие аминокислоты: цистин, цистеин и метионин.
 Другая группа живых организмов (животные и некоторые микроорганизмы) утилизируют серу для своего метаболизма и роста только в виде серосодержащих аминокислот. Некоторые микроорганизмы не ограничиваются только использованием серы из сульфатов, а могут использовать ее из сульфитов и сульфидов. После отмирания биомассы, сера минерализуется с высвобождением либо сульфатов (аэробное разложение) либо сульфидов (анаэробное)
Другая группа живых организмов (животные и некоторые микроорганизмы) утилизируют серу для своего метаболизма и роста только в виде серосодержащих аминокислот. Некоторые микроорганизмы не ограничиваются только использованием серы из сульфатов, а могут использовать ее из сульфитов и сульфидов. После отмирания биомассы, сера минерализуется с высвобождением либо сульфатов (аэробное разложение) либо сульфидов (анаэробное)
 В определенных условиях в процессе разложения органических S-содержащих продуктов могут образовываться другие летучие S-содержащие продукты: метилмеркаптан (CH 3 SH) и диметилсульфид (CH 3 SCH 3) Эти соединения могут продуцироваться многими бактериями, дрожжами на среде, содержащей метионин и другие S-содержащие органические соединения.
В определенных условиях в процессе разложения органических S-содержащих продуктов могут образовываться другие летучие S-содержащие продукты: метилмеркаптан (CH 3 SH) и диметилсульфид (CH 3 SCH 3) Эти соединения могут продуцироваться многими бактериями, дрожжами на среде, содержащей метионин и другие S-содержащие органические соединения.
 ОКИСЛЕНИЕ S-СОДЕРЖАЩИХ СОЕДИНЕНИЙ МИКРООРГАНИЗМАМИ S 2 O 32 - + 2 O 2 + H 2 O 2 SO 42 - + 2 H+ + 211 кал Осуществляется хемотрофными серными микроорганизмами. Род Thiobacillus способствует переводу пирита в сульфаты и сульфиты и тем самым делает растворимыми металлы. Группа анаэробных бактерий, которые окисляют восстановленную серу, являются фототрофными и работают в присутствии света: 2 СО 2 + H 2 S + 2 H 2 O 2 CH 2 O + SO 42 - + 2 H+ ВОССТАНОВЛЕНИЕ СЕРЫ МИКРООРГАНИЗМАМИ 2 CH 3 CHOH COOH+H 2 SO 4 2 CH 3 COOH+2 H 2 O+H 2 S
ОКИСЛЕНИЕ S-СОДЕРЖАЩИХ СОЕДИНЕНИЙ МИКРООРГАНИЗМАМИ S 2 O 32 - + 2 O 2 + H 2 O 2 SO 42 - + 2 H+ + 211 кал Осуществляется хемотрофными серными микроорганизмами. Род Thiobacillus способствует переводу пирита в сульфаты и сульфиты и тем самым делает растворимыми металлы. Группа анаэробных бактерий, которые окисляют восстановленную серу, являются фототрофными и работают в присутствии света: 2 СО 2 + H 2 S + 2 H 2 O 2 CH 2 O + SO 42 - + 2 H+ ВОССТАНОВЛЕНИЕ СЕРЫ МИКРООРГАНИЗМАМИ 2 CH 3 CHOH COOH+H 2 SO 4 2 CH 3 COOH+2 H 2 O+H 2 S
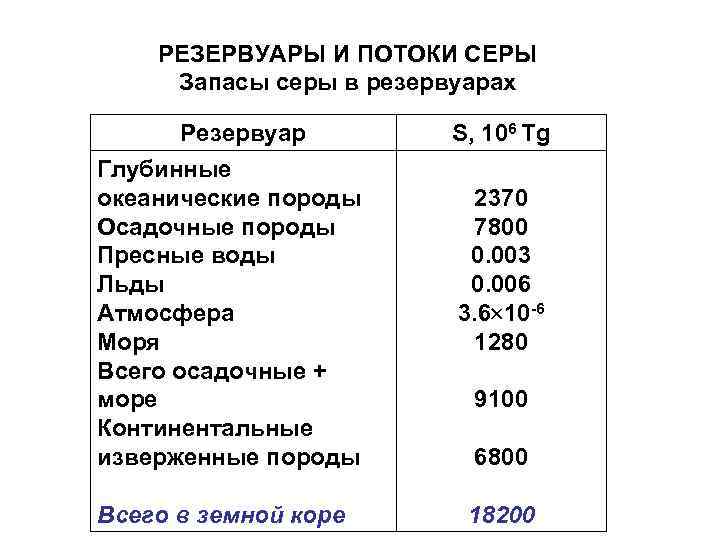 РЕЗЕРВУАРЫ И ПОТОКИ СЕРЫ Запасы серы в резервуарах Резервуар Глубинные океанические породы Осадочные породы Пресные воды Льды Атмосфера Моря Всего осадочные + море Континентальные изверженные породы Всего в земной коре S, 106 Tg 2370 7800 0. 003 0. 006 3. 6 10 -6 1280 9100 6800 18200
РЕЗЕРВУАРЫ И ПОТОКИ СЕРЫ Запасы серы в резервуарах Резервуар Глубинные океанические породы Осадочные породы Пресные воды Льды Атмосфера Моря Всего осадочные + море Континентальные изверженные породы Всего в земной коре S, 106 Tg 2370 7800 0. 003 0. 006 3. 6 10 -6 1280 9100 6800 18200
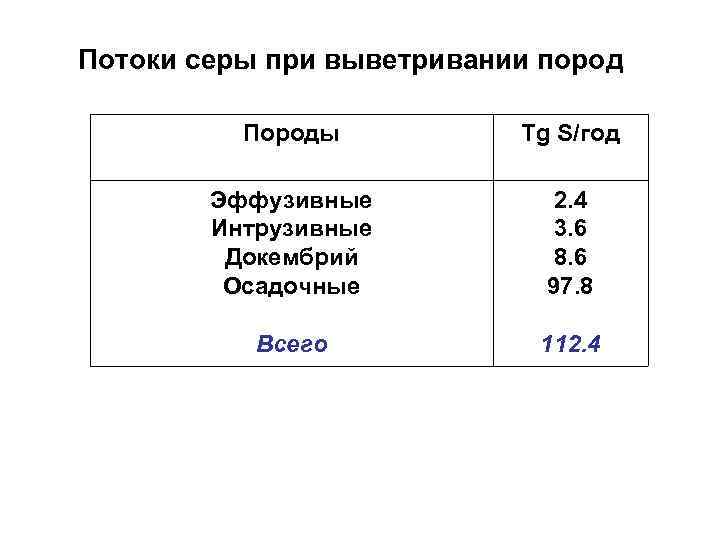 Потоки серы при выветривании пород Породы Tg S/год Эффузивные Интрузивные Докембрий Осадочные 2. 4 3. 6 8. 6 97. 8 Всего 112. 4
Потоки серы при выветривании пород Породы Tg S/год Эффузивные Интрузивные Докембрий Осадочные 2. 4 3. 6 8. 6 97. 8 Всего 112. 4
 ПОТОКИ СЕРЫ Существуют только два естественных процесса, приводящие к поступлению серы в атмосферу: Вулканическая деятельность и биогенная эмиссия. 450 (578, 850) действующих вулканов выбрасывают 1 км 3 лавы, пепла и других материалов. Выбросы SO 2 оцениваются от 1. 5 до 34 Tg. S/год. Сера из космоса Каждый год на поверхность Земли выпадает 1. 0 Tg космических материалов (метеориты и др. ). Сера в них составляет 1000 т/год. Поток в виде циклических соединений 6 Tg/год в результате разложения органических материалов. Отложения в виде новообразований торфа 0. 6 Tg. S/год
ПОТОКИ СЕРЫ Существуют только два естественных процесса, приводящие к поступлению серы в атмосферу: Вулканическая деятельность и биогенная эмиссия. 450 (578, 850) действующих вулканов выбрасывают 1 км 3 лавы, пепла и других материалов. Выбросы SO 2 оцениваются от 1. 5 до 34 Tg. S/год. Сера из космоса Каждый год на поверхность Земли выпадает 1. 0 Tg космических материалов (метеориты и др. ). Сера в них составляет 1000 т/год. Поток в виде циклических соединений 6 Tg/год в результате разложения органических материалов. Отложения в виде новообразований торфа 0. 6 Tg. S/год
 ПОТОК СЕРЫ ЗА СЧЕТ ВЫВЕТРИВАНИЯ ПОРОД, ОБУСЛОВЛЕННОГО ХОЗЯЙСТВЕННОЙ ДЕЯТЕЛЬНОСТЬЮ ЧЕЛОВЕКА Механическое выветривание. Руды и основные породы, которые извлекаются на поверхность Земли с содержанием серы 0. 1% и выше составляют 20 103 Tg/год или 20 Tg S/год. Выветривание, связанное с добычей и сжиганием топлива Во время сжигания органическая и пиритная сера окисляется до SO 2 (94%) или SO 3 (4%)
ПОТОК СЕРЫ ЗА СЧЕТ ВЫВЕТРИВАНИЯ ПОРОД, ОБУСЛОВЛЕННОГО ХОЗЯЙСТВЕННОЙ ДЕЯТЕЛЬНОСТЬЮ ЧЕЛОВЕКА Механическое выветривание. Руды и основные породы, которые извлекаются на поверхность Земли с содержанием серы 0. 1% и выше составляют 20 103 Tg/год или 20 Tg S/год. Выветривание, связанное с добычей и сжиганием топлива Во время сжигания органическая и пиритная сера окисляется до SO 2 (94%) или SO 3 (4%)
 Содержание S в топливах (%%): Уголь – 1 -14 (уголь из Рура, Донбаса содержит 8 -14% S) Общий пул S в каменном угле оценивается в 20 103 Tg при общих запасах каменного угля 1300 103 Tg. В настоящее время выделение S при сжигании угля 60 -70 Tg/год Нефть Содержит 0. 1 – 3% S Газ Содержит 0. 1 -40% S Эмиссия S при сжигании нефти и газа 20 -25 Tg. S/год
Содержание S в топливах (%%): Уголь – 1 -14 (уголь из Рура, Донбаса содержит 8 -14% S) Общий пул S в каменном угле оценивается в 20 103 Tg при общих запасах каменного угля 1300 103 Tg. В настоящее время выделение S при сжигании угля 60 -70 Tg/год Нефть Содержит 0. 1 – 3% S Газ Содержит 0. 1 -40% S Эмиссия S при сжигании нефти и газа 20 -25 Tg. S/год
 ЭМИССИЯ СЕРЫ В МЕТАЛЛУРГИЧЕСКИХ ПРОИЗВОДСТВАХ Сульфиды присутствуют во всех рудах нежелезных металлов. В некоторых пиритах S 45%. При выплавке меди, цинка, никеля, свинца и др. металлов сульфиды окисляются до SO 2 и выделяются в атмосферу Выделение S в металлургических производствах составляет 10 -29% от количества, выделяемого при сжигании угля, что составляет 10 -20 Tg. S/год
ЭМИССИЯ СЕРЫ В МЕТАЛЛУРГИЧЕСКИХ ПРОИЗВОДСТВАХ Сульфиды присутствуют во всех рудах нежелезных металлов. В некоторых пиритах S 45%. При выплавке меди, цинка, никеля, свинца и др. металлов сульфиды окисляются до SO 2 и выделяются в атмосферу Выделение S в металлургических производствах составляет 10 -29% от количества, выделяемого при сжигании угля, что составляет 10 -20 Tg. S/год
 Окисление сульфидных руд в отвале на месторождении Ниттис-Кумужье (Кольский п-в, Печенга. Никель) а - руда в отвале; а б б - отложение оксидов меди и никеля из воды, просачивающейся из руды в отвале.
Окисление сульфидных руд в отвале на месторождении Ниттис-Кумужье (Кольский п-в, Печенга. Никель) а - руда в отвале; а б б - отложение оксидов меди и никеля из воды, просачивающейся из руды в отвале.
 Баланс потоков серы в литосфере (Tg S/год) Естественные потоки Приход Расход Осадочная аккумуляция В океане – 100 В озерах и других водоемах – 16. 5 Вулканическая эмиссия С пеплом в океан – 1. 4 Улетучивание в атмосферу – 28 Выветривание на континентах без стока в океан – Речной сток– 74. 0 19 Подземный сток – 9. 2 абсорбция из атмосферы – 4. 5 минерализация органического торфообразование – 0. 6 вещества – 19. 0 из космоса – 0. 00001 ветровая эрозия – 10. 8 всего – 142. 4 всего – 142 Антропогенная эмиссия Сжигание топлив – 90 Выбросы твердых отходов – 1 Экстракция при извлечении металлов – 10 Из другого сырья – 52 Всего - 153
Баланс потоков серы в литосфере (Tg S/год) Естественные потоки Приход Расход Осадочная аккумуляция В океане – 100 В озерах и других водоемах – 16. 5 Вулканическая эмиссия С пеплом в океан – 1. 4 Улетучивание в атмосферу – 28 Выветривание на континентах без стока в океан – Речной сток– 74. 0 19 Подземный сток – 9. 2 абсорбция из атмосферы – 4. 5 минерализация органического торфообразование – 0. 6 вещества – 19. 0 из космоса – 0. 00001 ветровая эрозия – 10. 8 всего – 142. 4 всего – 142 Антропогенная эмиссия Сжигание топлив – 90 Выбросы твердых отходов – 1 Экстракция при извлечении металлов – 10 Из другого сырья – 52 Всего - 153
 СЕРА В ПОЧВЕ Формы: сульфатная, органическая – нормальные, аэрируемые почвы сульфиды и другие соединения с низкой степенью окисления – анаэробные условия, переувлажненные почвы C: N: S в почвах зависит от почвообразующей породы, типа почвообразования (климата, растительности, интенсивности промывания, дренируемости, температуры и др. ), обработки почвы, культивирования серые лесные почвы: 119: 10: 1. 56 – (Канада) 109: 10: 2. 18 – (центр. Волга) 104: 10: 1. 75 – (Пущино) черноземы: 112: 10: 1. 30 (Канада) 112: 10: 1. 59 (Поволжье) 115: 10: 1. 34 (Воронеж) сероземы: 71: 10: 2. 97 (Узбекистан) такыры: 67: 10. 5 (То же) Содержание S в почвах колеблется от 0. 1 т/га в подзолистых до 30 – 450 т/га в пустынных и полупустынных S-удобрения: сульфат аммония, простой суперфосфат
СЕРА В ПОЧВЕ Формы: сульфатная, органическая – нормальные, аэрируемые почвы сульфиды и другие соединения с низкой степенью окисления – анаэробные условия, переувлажненные почвы C: N: S в почвах зависит от почвообразующей породы, типа почвообразования (климата, растительности, интенсивности промывания, дренируемости, температуры и др. ), обработки почвы, культивирования серые лесные почвы: 119: 10: 1. 56 – (Канада) 109: 10: 2. 18 – (центр. Волга) 104: 10: 1. 75 – (Пущино) черноземы: 112: 10: 1. 30 (Канада) 112: 10: 1. 59 (Поволжье) 115: 10: 1. 34 (Воронеж) сероземы: 71: 10: 2. 97 (Узбекистан) такыры: 67: 10. 5 (То же) Содержание S в почвах колеблется от 0. 1 т/га в подзолистых до 30 – 450 т/га в пустынных и полупустынных S-удобрения: сульфат аммония, простой суперфосфат
 КИСЛОТНЫЕ ДОЖДИ В незагрязненных районах р. Н осадков 5. 7 при 25 о. С В районах с карбонатными почвами, попадание пыли в атмосферу вызывает подщелачивание осадков. В прединдустриальную эпоху р. Н осадков везде был выше 5, 0 В Антарктиде, в снеговом-ледовом профиле пробы имеют р. Н 6. 30 В настоящее время, в индустриальных районах кислотность осадков повысилась в 5 -30 раз по сравнению с незагрязненными районами р. Н осадков в странах Западной и Центральной Европы, а также Восточное побережье США и Ю. В. Канады 4. 0 -4. 5
КИСЛОТНЫЕ ДОЖДИ В незагрязненных районах р. Н осадков 5. 7 при 25 о. С В районах с карбонатными почвами, попадание пыли в атмосферу вызывает подщелачивание осадков. В прединдустриальную эпоху р. Н осадков везде был выше 5, 0 В Антарктиде, в снеговом-ледовом профиле пробы имеют р. Н 6. 30 В настоящее время, в индустриальных районах кислотность осадков повысилась в 5 -30 раз по сравнению с незагрязненными районами р. Н осадков в странах Западной и Центральной Европы, а также Восточное побережье США и Ю. В. Канады 4. 0 -4. 5
 Количество серы, необходимое для образования H 2 SO 4, которая снизила бы р. Н осадков до 4. 0 равно всего 1. 5 ppm S Сильно страдают от подкисления прежде всего водоемы. Почва, в силу своей естественной буферности выдерживает гораздо бóльшую нагрузку кислотными дождями без видимых изменений своих свойств.
Количество серы, необходимое для образования H 2 SO 4, которая снизила бы р. Н осадков до 4. 0 равно всего 1. 5 ppm S Сильно страдают от подкисления прежде всего водоемы. Почва, в силу своей естественной буферности выдерживает гораздо бóльшую нагрузку кислотными дождями без видимых изменений своих свойств.
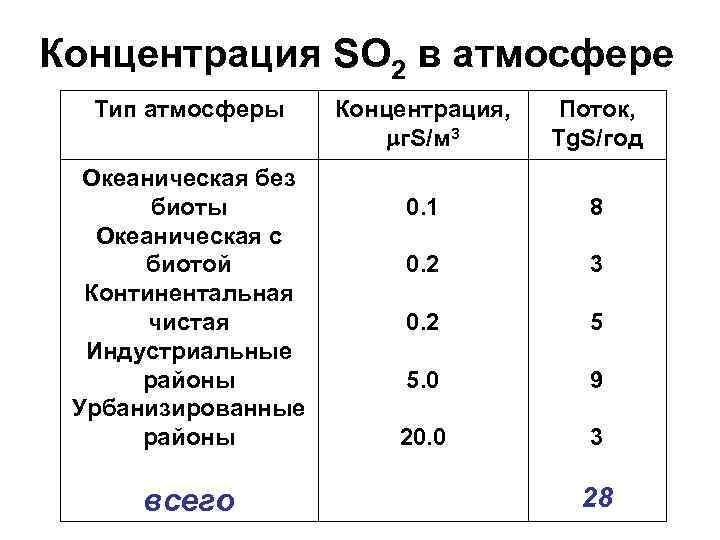 Концентрация SO 2 в атмосфере Тип атмосферы Океаническая без биоты Океаническая с биотой Континентальная чистая Индустриальные районы Урбанизированные районы всего Концентрация, г. S/м 3 Поток, Tg. S/год 0. 1 8 0. 2 3 0. 2 5 5. 0 9 20. 0 3 28
Концентрация SO 2 в атмосфере Тип атмосферы Океаническая без биоты Океаническая с биотой Континентальная чистая Индустриальные районы Урбанизированные районы всего Концентрация, г. S/м 3 Поток, Tg. S/год 0. 1 8 0. 2 3 0. 2 5 5. 0 9 20. 0 3 28


