Лекция_1_культуры растительных клеток_2012_нов.ppt
- Количество слайдов: 87
 • • • • • Что такое генная инженерия, на знаниях каких наук она основана. Что такое рекомбинантные ДНК технологии. Какие ферменты в ней используются. Принципы действия каждого из них. Векторные молекулы. Требования к векторным молекулам. Основные элементы векторных конструкций, отвечающих за экспрессию. Какие существуют векторные молекулы для трансформации животных клеток, каковы их особенности? Какие существуют векторные молекулы для трансформации растений? Строение агробактерий. Отличие Agrobacterium tumefaciens от A. rhizogenes Как агробактерия воздействует на клетку? Что встраивается в растительный геном? Что такое Ti плазмида и «обезоруженная» плазмида, их строение, чем отличаются Ti и Ri плазмиды? Принципы создания генетически модифицированных организмов (ГМО). Какие существуют методы трансформации животных. Какие методы существуют для трансформации растений. Как можно провести отбор трансформированных клеток. Селективные и репортерные гены. Какими способами доказывают трансгенность организмов. Для чего создают трансгенных животных. Для чего создают трансгенные растения. 1
• • • • • Что такое генная инженерия, на знаниях каких наук она основана. Что такое рекомбинантные ДНК технологии. Какие ферменты в ней используются. Принципы действия каждого из них. Векторные молекулы. Требования к векторным молекулам. Основные элементы векторных конструкций, отвечающих за экспрессию. Какие существуют векторные молекулы для трансформации животных клеток, каковы их особенности? Какие существуют векторные молекулы для трансформации растений? Строение агробактерий. Отличие Agrobacterium tumefaciens от A. rhizogenes Как агробактерия воздействует на клетку? Что встраивается в растительный геном? Что такое Ti плазмида и «обезоруженная» плазмида, их строение, чем отличаются Ti и Ri плазмиды? Принципы создания генетически модифицированных организмов (ГМО). Какие существуют методы трансформации животных. Какие методы существуют для трансформации растений. Как можно провести отбор трансформированных клеток. Селективные и репортерные гены. Какими способами доказывают трансгенность организмов. Для чего создают трансгенных животных. Для чего создают трансгенные растения. 1
 Перечислите основные стадии биотехнологического производства. Что такое «масштабирование» культуры? Из каких компонентов может состоять питательная среда? Какие существуют режимы культивирования в ферментерах и их особенности. Каковы основные стадии выращивания культуры в ферментерах периодического действия? Какие основные продукты получают в биотехнологических процессах? Что такое биогеотехнология металлов? На чем основаны процессы бактериального выщелачивания? Что такое биосорбция металлов? На чем основан метод биологической очистки сточных вод? Каковы основные принципы действия биофильтра? Принцип действия аэротэнка. Что такое активный ил и его состав? Из каких фаз состоит процесс очистки воды в аэротэнке? Зачем при очистке сточных вод проводят процессы нитрификации 2 денитрификации и какие бактерии участвуют в нем?
Перечислите основные стадии биотехнологического производства. Что такое «масштабирование» культуры? Из каких компонентов может состоять питательная среда? Какие существуют режимы культивирования в ферментерах и их особенности. Каковы основные стадии выращивания культуры в ферментерах периодического действия? Какие основные продукты получают в биотехнологических процессах? Что такое биогеотехнология металлов? На чем основаны процессы бактериального выщелачивания? Что такое биосорбция металлов? На чем основан метод биологической очистки сточных вод? Каковы основные принципы действия биофильтра? Принцип действия аэротэнка. Что такое активный ил и его состав? Из каких фаз состоит процесс очистки воды в аэротэнке? Зачем при очистке сточных вод проводят процессы нитрификации 2 денитрификации и какие бактерии участвуют в нем?
 Культура клеток и тканей как основа клеточной и генетической инженерии 3
Культура клеток и тканей как основа клеточной и генетической инженерии 3
 Клеточные культуры • Культура тканей - метод длительного сохранения в живом Культура тканей состоянии клеток, тканей, небольших органов или их частей, выделенных из организма человека, животных или растений. • Метод культивирования тканей in vitro (в стекле) был создан французом А. Каррелем, который долгое время работал в Америке. В 1912 г. Каррель был удостоен за свое открытие Нобелевской премии по медицине. • Культура клеток представляет собой гомогенную Культура клеток популяцию генетически однородных клеток, растущих в постоянных условиях. • Основное условие успешного осуществления роста культур клеток и тканей — строгое соблюдение стерильности. 4
Клеточные культуры • Культура тканей - метод длительного сохранения в живом Культура тканей состоянии клеток, тканей, небольших органов или их частей, выделенных из организма человека, животных или растений. • Метод культивирования тканей in vitro (в стекле) был создан французом А. Каррелем, который долгое время работал в Америке. В 1912 г. Каррель был удостоен за свое открытие Нобелевской премии по медицине. • Культура клеток представляет собой гомогенную Культура клеток популяцию генетически однородных клеток, растущих в постоянных условиях. • Основное условие успешного осуществления роста культур клеток и тканей — строгое соблюдение стерильности. 4
 Использование культур клеток • Клеточные культуры — прекрасный объект для изучения действия на клетку физических, химических и биологических факторов. Особенно велико их значение в вирусологии: отдельные группы вирусов вызывают в культурах клеток специфический повреждающий эффект, поэтому клеточные культуры используют для диагностики вирусов. Кроме того, они являются субстратом для получения живых противовирусных вакцин. • На культурах тканей возможно изучение ряда общебиологических вопросов: взаимоотношения клеток и тканей, дифференцировка клеток, закономерности митоза, превращение нормальной клетки в раковую и т. д. • Культуры органов широко используются при изучении закономерностей развития зачатков в норме и при экспериментально измененных условиях, при совместном культивировании органов от животных разного возраста, вида и т. п. 5
Использование культур клеток • Клеточные культуры — прекрасный объект для изучения действия на клетку физических, химических и биологических факторов. Особенно велико их значение в вирусологии: отдельные группы вирусов вызывают в культурах клеток специфический повреждающий эффект, поэтому клеточные культуры используют для диагностики вирусов. Кроме того, они являются субстратом для получения живых противовирусных вакцин. • На культурах тканей возможно изучение ряда общебиологических вопросов: взаимоотношения клеток и тканей, дифференцировка клеток, закономерности митоза, превращение нормальной клетки в раковую и т. д. • Культуры органов широко используются при изучении закономерностей развития зачатков в норме и при экспериментально измененных условиях, при совместном культивировании органов от животных разного возраста, вида и т. п. 5
 Культуры in vitro тканей и клеток растений 6
Культуры in vitro тканей и клеток растений 6
 Культуры тканей in vitro • Термины • in vitro – выращивание растительных объектов в стекле на искусственных питательных средах; • Эксплант – фрагмент ткани или органа, инкубируемый на искусственной питательной среде самостоятельно или используемый для получения первичного каллуса или регенерантов • Пролиферация – новообразование клеток и тканей путем размножения • Каллус – ткань, возникшая in vivo или in vitro путем неорганизованной пролиферации клеток растений и эксплантов • Культура каллусных тканей – выращивание в длительной пересадочной культуре каллусов, возникших путем дедифференцировки и пролиферации клеток растений • Субкультивирование – перенос ткани на свежую питательную среду 7
Культуры тканей in vitro • Термины • in vitro – выращивание растительных объектов в стекле на искусственных питательных средах; • Эксплант – фрагмент ткани или органа, инкубируемый на искусственной питательной среде самостоятельно или используемый для получения первичного каллуса или регенерантов • Пролиферация – новообразование клеток и тканей путем размножения • Каллус – ткань, возникшая in vivo или in vitro путем неорганизованной пролиферации клеток растений и эксплантов • Культура каллусных тканей – выращивание в длительной пересадочной культуре каллусов, возникших путем дедифференцировки и пролиферации клеток растений • Субкультивирование – перенос ткани на свежую питательную среду 7
 Культуры in vitro тканей растений • Термины • Дедифференциация – переход специализированных клеток к пролиферации и неорганизованному каллусному росту • Дифференциация – комплекс процессов, приводящих к различиям между дочерними клетками, а также между материнскими и дочерними клетками • Дифференцировка – состояние специализации клеток, отличающее их от других • Изолированный протопласт – растительная клетка, лишенная клеточной стенки с помощью ферментативного разрушения • Культура изолированных протопластов – выращивание протопластов в жидкой или агаризованной среде, содержащей осмотическое вещество. При регенерации клеточных стенок протопласты превращаются в 8 культуру клеток.
Культуры in vitro тканей растений • Термины • Дедифференциация – переход специализированных клеток к пролиферации и неорганизованному каллусному росту • Дифференциация – комплекс процессов, приводящих к различиям между дочерними клетками, а также между материнскими и дочерними клетками • Дифференцировка – состояние специализации клеток, отличающее их от других • Изолированный протопласт – растительная клетка, лишенная клеточной стенки с помощью ферментативного разрушения • Культура изолированных протопластов – выращивание протопластов в жидкой или агаризованной среде, содержащей осмотическое вещество. При регенерации клеточных стенок протопласты превращаются в 8 культуру клеток.
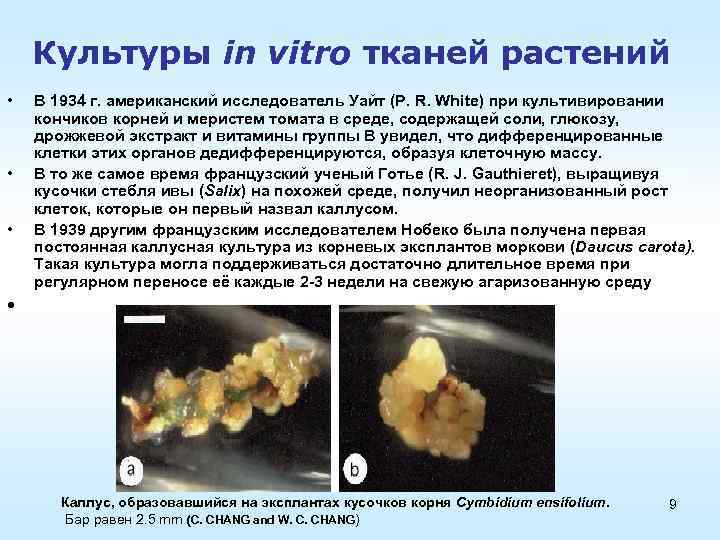 Культуры in vitro тканей растений • • • В 1934 г. американский исследователь Уайт (P. R. White) при культивировании кончиков корней и меристем томата в среде, содержащей соли, глюкозу, дрожжевой экстракт и витамины группы В увидел, что дифференцированные клетки этих органов дедифференцируются, образуя клеточную массу. В то же самое время французский ученый Готье (R. J. Gauthieret), выращивуя кусочки стебля ивы (Salix) на похожей среде, получил неорганизованный рост клеток, которые он первый назвал каллусом. В 1939 другим французским исследователем Нобеко была получена первая постоянная каллусная культура из корневых эксплантов моркови (Daucus carota). Такая культура могла поддерживаться достаточно длительное время при регулярном переносе её каждые 2 3 недели на свежую агаризованную среду • Каллус, образовавшийся на эксплантах кусочков корня Cymbidium ensifolium. Бар равен 2. 5 mm (С. CHANG and W. C. CHANG) 9
Культуры in vitro тканей растений • • • В 1934 г. американский исследователь Уайт (P. R. White) при культивировании кончиков корней и меристем томата в среде, содержащей соли, глюкозу, дрожжевой экстракт и витамины группы В увидел, что дифференцированные клетки этих органов дедифференцируются, образуя клеточную массу. В то же самое время французский ученый Готье (R. J. Gauthieret), выращивуя кусочки стебля ивы (Salix) на похожей среде, получил неорганизованный рост клеток, которые он первый назвал каллусом. В 1939 другим французским исследователем Нобеко была получена первая постоянная каллусная культура из корневых эксплантов моркови (Daucus carota). Такая культура могла поддерживаться достаточно длительное время при регулярном переносе её каждые 2 3 недели на свежую агаризованную среду • Каллус, образовавшийся на эксплантах кусочков корня Cymbidium ensifolium. Бар равен 2. 5 mm (С. CHANG and W. C. CHANG) 9
 Три фундаментальных свойства растений 1. Тотипотентность Потенциальная или наследуемая способность растительных тканей к развитию в полноценное растение при наличии подходящих условий. Это обозначает, что вся информация необходимая для развития находится в каждой отдельной клетке растения. 2. Дедифференциация Способность зрелых клеток возвращаться к неорганизованному росту и затем к меристематическому делению, способствующему образованию новых точек роста, которые затем могут дифференцироваться в новые органы. 3. Компетентность Наличие эндогенного потенциала данной клетки или ткани дающей возможность развиваться в определенном направлении 10
Три фундаментальных свойства растений 1. Тотипотентность Потенциальная или наследуемая способность растительных тканей к развитию в полноценное растение при наличии подходящих условий. Это обозначает, что вся информация необходимая для развития находится в каждой отдельной клетке растения. 2. Дедифференциация Способность зрелых клеток возвращаться к неорганизованному росту и затем к меристематическому делению, способствующему образованию новых точек роста, которые затем могут дифференцироваться в новые органы. 3. Компетентность Наличие эндогенного потенциала данной клетки или ткани дающей возможность развиваться в определенном направлении 10
 Типы культур in vitro • 1. Культура интактных растений (культивирование растений в стерильных условиях) • 2. Эмбриокультуры (культивирование зародышей) • 3. Органные культуры • • а) культивирование побегов б) культивирование корней в) культивирование листьев г) культирование пыльников • 3. Каллусные культуры • 4. Суспензионные культуры • 5. Культуры протопластов 11
Типы культур in vitro • 1. Культура интактных растений (культивирование растений в стерильных условиях) • 2. Эмбриокультуры (культивирование зародышей) • 3. Органные культуры • • а) культивирование побегов б) культивирование корней в) культивирование листьев г) культирование пыльников • 3. Каллусные культуры • 4. Суспензионные культуры • 5. Культуры протопластов 11
 Применение тканевых культур ü Микроразмножение ü Сохрание генотипов ü Сомаклональная вариабельность ü Получение дигаплоидов ü Слияние протопластов ü Получение вторичных метаболитов ü Генетическая инженерия 12
Применение тканевых культур ü Микроразмножение ü Сохрание генотипов ü Сомаклональная вариабельность ü Получение дигаплоидов ü Слияние протопластов ü Получение вторичных метаболитов ü Генетическая инженерия 12
 Основные требования к получению тканевых культур • 1. Наличие подходящего экспланта • 2. Подбор подходящей среды • 3. Выбор подходящих условий выращивания
Основные требования к получению тканевых культур • 1. Наличие подходящего экспланта • 2. Подбор подходящей среды • 3. Выбор подходящих условий выращивания
 Культуры in vitro тканей растений Виды эксплантов: Эксплантами для культивирования in vitro в зависимости от задач исследования могут быть все части растения: верхушки побегов, листья, пазушные почки, стебли, корни Любой фрагмент растения представляет собой мозаику различных тканей, и в зависимости от того, какая ткань даст начало каллусу, возникшие даже из одинаковых эксплантов каллусы будут гетерогенными и отличающимися друг от друга. Одинаковых, в полном смысле, эксплантов в природе быть не может, следовательно, неоднородность исходного материала (видовая, возрастная, физиологическая) предопределяет разнокачественность клеток в культуре. 14
Культуры in vitro тканей растений Виды эксплантов: Эксплантами для культивирования in vitro в зависимости от задач исследования могут быть все части растения: верхушки побегов, листья, пазушные почки, стебли, корни Любой фрагмент растения представляет собой мозаику различных тканей, и в зависимости от того, какая ткань даст начало каллусу, возникшие даже из одинаковых эксплантов каллусы будут гетерогенными и отличающимися друг от друга. Одинаковых, в полном смысле, эксплантов в природе быть не может, следовательно, неоднородность исходного материала (видовая, возрастная, физиологическая) предопределяет разнокачественность клеток в культуре. 14
 ТРЕБОВАНИЯ К КУЛЬТУРАЛЬНЫМ СРЕДАМ • • • 1. Минеральные компоненты А) макросоли Б) микросоли 2. Органические компоненты Сахароза, глюкоза, фруктоза, инозитол 3. Витамины В 1, В 6, В 12, рибофлавин, никотиновая кислота, никотинамин, 4. Регуляторы роста А) ауксины (α нафтилуксусная кислота, индолилуксусная к та, гибберелловая кислота) Б) цитокинины ( кинетин, зеатин, 6 бензиламинопурин)
ТРЕБОВАНИЯ К КУЛЬТУРАЛЬНЫМ СРЕДАМ • • • 1. Минеральные компоненты А) макросоли Б) микросоли 2. Органические компоненты Сахароза, глюкоза, фруктоза, инозитол 3. Витамины В 1, В 6, В 12, рибофлавин, никотиновая кислота, никотинамин, 4. Регуляторы роста А) ауксины (α нафтилуксусная кислота, индолилуксусная к та, гибберелловая кислота) Б) цитокинины ( кинетин, зеатин, 6 бензиламинопурин)
 • • • В состав питательных сред входят макро и микроэлементы (N, P, K, Ca, S, Mg, Fe, B, Zn, Cu, Co, Mn, J, Mo); витамины В 1, В 6, В 12, РР и другие; углеводы (сахароза, глюкоза, маннит); фитогормоны (чаще всего цитокинины и ауксины в определенном соотношении). Ауксины вызывают клеточную дедифференцировку, цитокинины индуцируют деление дедифференцированных клеток и необходимы для получения каллусных тканей. На средах без гормонов растут “привыкшие” и опухолевые ткани. Для получения стеблевого морфогенеза снижают содержание ауксинов. Из ауксинов чаще всего применяют 2, 4 дихлорфеноксиуксусную кислоту (2, 4 Д) 0. 1 10 мг/л, нафтилуксусную кислоту (НУК) 0. 1 2 мг/л, ИУК 1 30 мг/л. Необходимы также источники карбогидратов – сахароза, глюкоза, лактоза и др. Для роста большинства культур необходимы желирующие агенты Агар агар, агароза, фитогель
• • • В состав питательных сред входят макро и микроэлементы (N, P, K, Ca, S, Mg, Fe, B, Zn, Cu, Co, Mn, J, Mo); витамины В 1, В 6, В 12, РР и другие; углеводы (сахароза, глюкоза, маннит); фитогормоны (чаще всего цитокинины и ауксины в определенном соотношении). Ауксины вызывают клеточную дедифференцировку, цитокинины индуцируют деление дедифференцированных клеток и необходимы для получения каллусных тканей. На средах без гормонов растут “привыкшие” и опухолевые ткани. Для получения стеблевого морфогенеза снижают содержание ауксинов. Из ауксинов чаще всего применяют 2, 4 дихлорфеноксиуксусную кислоту (2, 4 Д) 0. 1 10 мг/л, нафтилуксусную кислоту (НУК) 0. 1 2 мг/л, ИУК 1 30 мг/л. Необходимы также источники карбогидратов – сахароза, глюкоза, лактоза и др. Для роста большинства культур необходимы желирующие агенты Агар агар, агароза, фитогель
 • Разработано много питательных сред, но большинство из них представляют модификации основных: Мурасиге Скуга (МС), Уайта, Шенка Хильдебрандта, Гамборга (В 5), Линсмайера Скуга, Хеллера, Чапека и др. • Составы питательных сред, получивших наибольшее распространение приведены в справочниках по физиологии растений и биотехнологии. • Для индукции каллусогенеза используют примерно равные соотношения регуляторов роста • В качестве цитокининов используют кинетин, 6 бензиламинопурин (БАП), зеатин (0. 001 10 мг/л); из них кинетин наименее активен. • В состав некоторых сред входит аденин. Иногда используют гибберелловую кислоту (ГК). В качестве ростактиваторов применяют также кокосовое молоко, дрожжевой экстракт, гидролизат казеина и др.
• Разработано много питательных сред, но большинство из них представляют модификации основных: Мурасиге Скуга (МС), Уайта, Шенка Хильдебрандта, Гамборга (В 5), Линсмайера Скуга, Хеллера, Чапека и др. • Составы питательных сред, получивших наибольшее распространение приведены в справочниках по физиологии растений и биотехнологии. • Для индукции каллусогенеза используют примерно равные соотношения регуляторов роста • В качестве цитокининов используют кинетин, 6 бензиламинопурин (БАП), зеатин (0. 001 10 мг/л); из них кинетин наименее активен. • В состав некоторых сред входит аденин. Иногда используют гибберелловую кислоту (ГК). В качестве ростактиваторов применяют также кокосовое молоко, дрожжевой экстракт, гидролизат казеина и др.
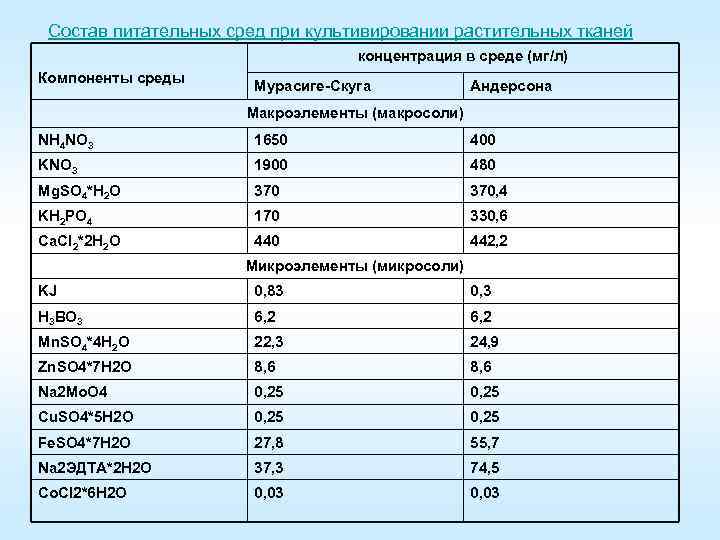 Состав питательных сред при культивировании растительных тканей концентрация в среде (мг/л) Компоненты среды Мурасиге Скуга Андерсона Макроэлементы (макросоли) NH 4 NO 3 1650 400 KNO 3 1900 480 Mg. SO 4*H 2 O 370, 4 KH 2 PO 4 170 330, 6 Ca. Cl 2*2 H 2 O 440 442, 2 Микроэлементы (микросоли) KJ 0, 83 0, 3 H 3 BO 3 6, 2 Mn. SO 4*4 H 2 O 22, 3 24, 9 Zn. SO 4*7 H 2 O 8, 6 Na 2 Mo. O 4 0, 25 Cu. SO 4*5 H 2 O 0, 25 Fe. SO 4*7 H 2 O 27, 8 55, 7 Na 2 ЭДТА*2 H 2 O 37, 3 74, 5 Co. Cl 2*6 H 2 O 0, 03
Состав питательных сред при культивировании растительных тканей концентрация в среде (мг/л) Компоненты среды Мурасиге Скуга Андерсона Макроэлементы (макросоли) NH 4 NO 3 1650 400 KNO 3 1900 480 Mg. SO 4*H 2 O 370, 4 KH 2 PO 4 170 330, 6 Ca. Cl 2*2 H 2 O 440 442, 2 Микроэлементы (микросоли) KJ 0, 83 0, 3 H 3 BO 3 6, 2 Mn. SO 4*4 H 2 O 22, 3 24, 9 Zn. SO 4*7 H 2 O 8, 6 Na 2 Mo. O 4 0, 25 Cu. SO 4*5 H 2 O 0, 25 Fe. SO 4*7 H 2 O 27, 8 55, 7 Na 2 ЭДТА*2 H 2 O 37, 3 74, 5 Co. Cl 2*6 H 2 O 0, 03
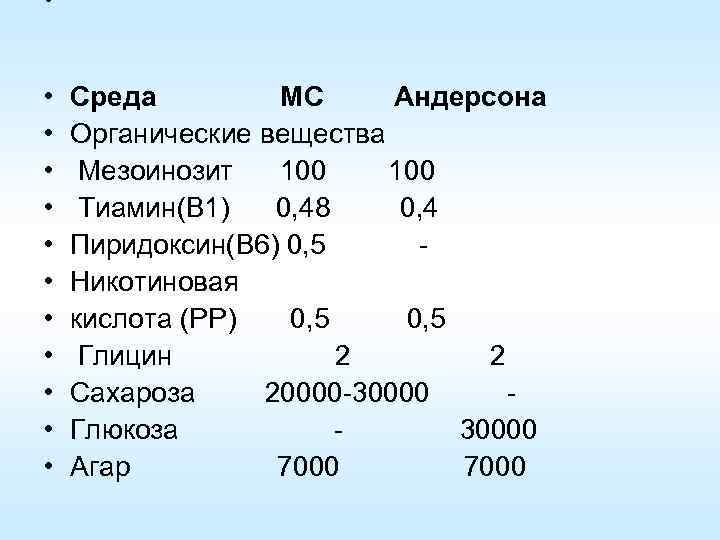 • • • • Среда МС Андерсона Органические вещества Мезоинозит 100 Тиамин(B 1) 0, 48 0, 4 Пиридоксин(B 6) 0, 5 Никотиновая кислота (PP) 0, 5 Глицин 2 Сахароза 20000 -30000 Глюкоза - 30000 Агар 7000
• • • • Среда МС Андерсона Органические вещества Мезоинозит 100 Тиамин(B 1) 0, 48 0, 4 Пиридоксин(B 6) 0, 5 Никотиновая кислота (PP) 0, 5 Глицин 2 Сахароза 20000 -30000 Глюкоза - 30000 Агар 7000
 Каллус • Эквимолярные количества ауксинов и цитокининов стимулируют клеточное деление и ведут к появлению массы неорганизованных (дедифференцированных) клеток, которые и называются каллусом. 20
Каллус • Эквимолярные количества ауксинов и цитокининов стимулируют клеточное деление и ведут к появлению массы неорганизованных (дедифференцированных) клеток, которые и называются каллусом. 20
 A B C Индукция каллуса : (A) из зрелых семян (B) корневых сегментов of Oryza sativa L. cv. Fujisaka (C) каллус, сформировавшийся на корневых волосках
A B C Индукция каллуса : (A) из зрелых семян (B) корневых сегментов of Oryza sativa L. cv. Fujisaka (C) каллус, сформировавшийся на корневых волосках
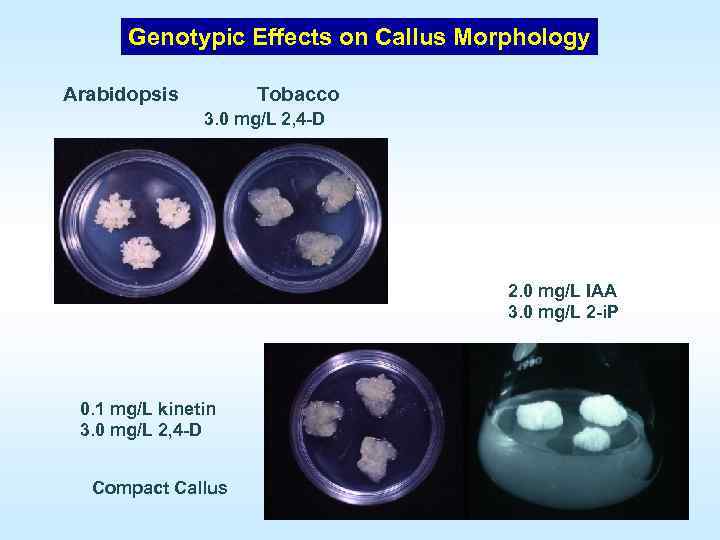 Genotypic Effects on Callus Morphology Arabidopsis Tobacco 3. 0 mg/L 2, 4 D 2. 0 mg/L IAA 3. 0 mg/L 2 i. P 0. 1 mg/L kinetin 3. 0 mg/L 2, 4 D Compact Callus Friable Callus
Genotypic Effects on Callus Morphology Arabidopsis Tobacco 3. 0 mg/L 2, 4 D 2. 0 mg/L IAA 3. 0 mg/L 2 i. P 0. 1 mg/L kinetin 3. 0 mg/L 2, 4 D Compact Callus Friable Callus
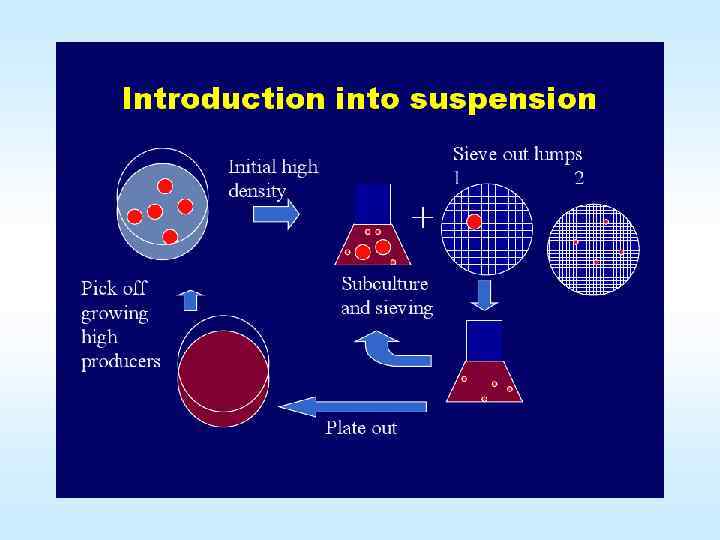
 Суспензионные культуры растительных клеток • Суспензионные культуры, растут в виде суспензии, то есть в жидкой питательной среде. Клетки тяжелее окружающей их жидкости, поэтому, чтобы они не затонули и не задохнулись, использовав весь растворенный кислород, их надо постоянно перемешивать. Такие культуры обычно выращивают в колбах, на специальных качалках. Частота вращения качалки тоже важна – с одной стороны необходимо добиться перемешивания, а с другой – не вызвать механический стресс. Суспензионные культуры отдельные клетки или группы клеток, выращиваемые во взвешенном состоянии в жидкой среде. Представляют собой относительно гомогенную популяцию клеток, которую легко подвергнуть воздействию химических веществ. Их получают, помещая каллусную ткань в колбу с жидкой питательной средой и затем длительно перемешивают на качалке, удаляя при пересадках крупные агрегаты. 23
Суспензионные культуры растительных клеток • Суспензионные культуры, растут в виде суспензии, то есть в жидкой питательной среде. Клетки тяжелее окружающей их жидкости, поэтому, чтобы они не затонули и не задохнулись, использовав весь растворенный кислород, их надо постоянно перемешивать. Такие культуры обычно выращивают в колбах, на специальных качалках. Частота вращения качалки тоже важна – с одной стороны необходимо добиться перемешивания, а с другой – не вызвать механический стресс. Суспензионные культуры отдельные клетки или группы клеток, выращиваемые во взвешенном состоянии в жидкой среде. Представляют собой относительно гомогенную популяцию клеток, которую легко подвергнуть воздействию химических веществ. Их получают, помещая каллусную ткань в колбу с жидкой питательной средой и затем длительно перемешивают на качалке, удаляя при пересадках крупные агрегаты. 23
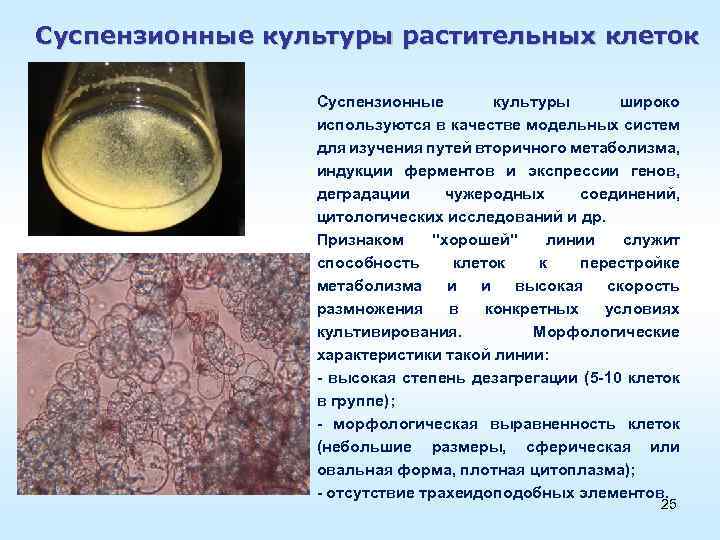 Суспензионные культуры растительных клеток Суспензионные культуры широко используются в качестве модельных систем для изучения путей вторичного метаболизма, индукции ферментов и экспрессии генов, деградации чужеродных соединений, цитологических исследований и др. Признаком "хорошей" линии служит способность клеток к перестройке метаболизма и и высокая скорость размножения в конкретных условиях культивирования. Морфологические характеристики такой линии: высокая степень дезагрегации (5 10 клеток в группе); морфологическая выравненность клеток (небольшие размеры, сферическая или овальная форма, плотная цитоплазма); отсутствие трахеидоподобных элементов. 25
Суспензионные культуры растительных клеток Суспензионные культуры широко используются в качестве модельных систем для изучения путей вторичного метаболизма, индукции ферментов и экспрессии генов, деградации чужеродных соединений, цитологических исследований и др. Признаком "хорошей" линии служит способность клеток к перестройке метаболизма и и высокая скорость размножения в конкретных условиях культивирования. Морфологические характеристики такой линии: высокая степень дезагрегации (5 10 клеток в группе); морфологическая выравненность клеток (небольшие размеры, сферическая или овальная форма, плотная цитоплазма); отсутствие трахеидоподобных элементов. 25
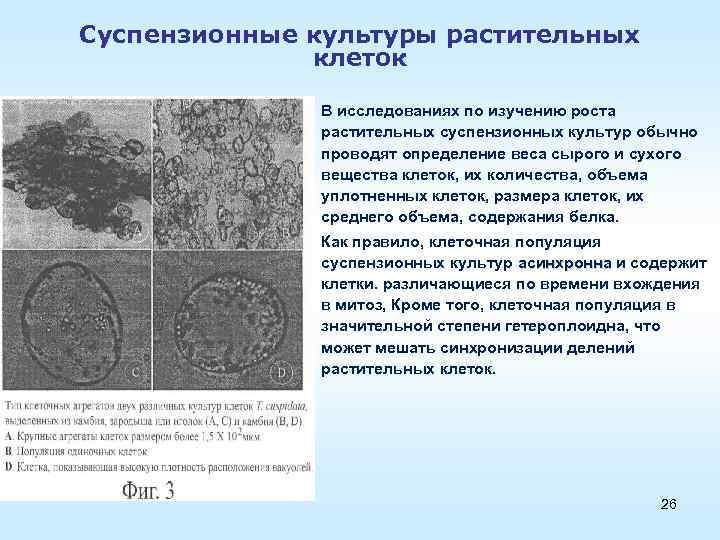 Суспензионные культуры растительных клеток • В исследованиях по изучению роста растительных суспензионных культур обычно проводят определение веса сырого и сухого вещества клеток, их количества, объема уплотненных клеток, размера клеток, их среднего объема, содержания белка. • Как правило, клеточная популяция суспензионных культур асинхронна и содержит асинхронна клетки. различающиеся по времени вхождения в митоз, Кроме того, клеточная популяция в значительной степени гетероплоидна, что может мешать синхронизации делений растительных клеток. 26
Суспензионные культуры растительных клеток • В исследованиях по изучению роста растительных суспензионных культур обычно проводят определение веса сырого и сухого вещества клеток, их количества, объема уплотненных клеток, размера клеток, их среднего объема, содержания белка. • Как правило, клеточная популяция суспензионных культур асинхронна и содержит асинхронна клетки. различающиеся по времени вхождения в митоз, Кроме того, клеточная популяция в значительной степени гетероплоидна, что может мешать синхронизации делений растительных клеток. 26
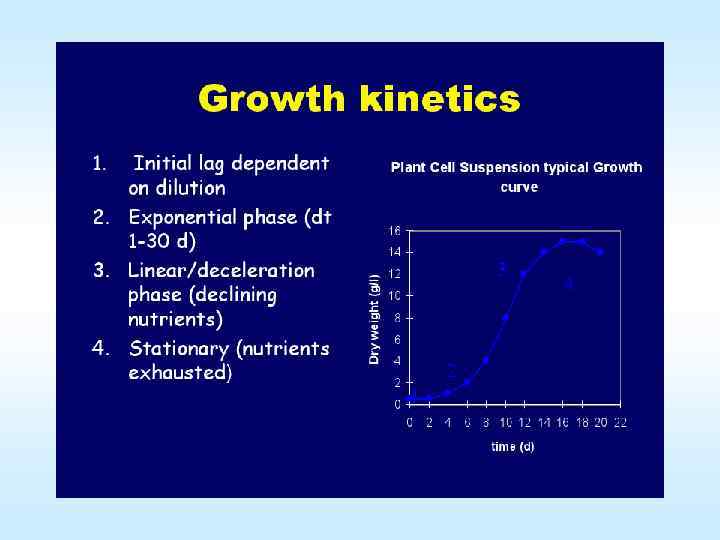
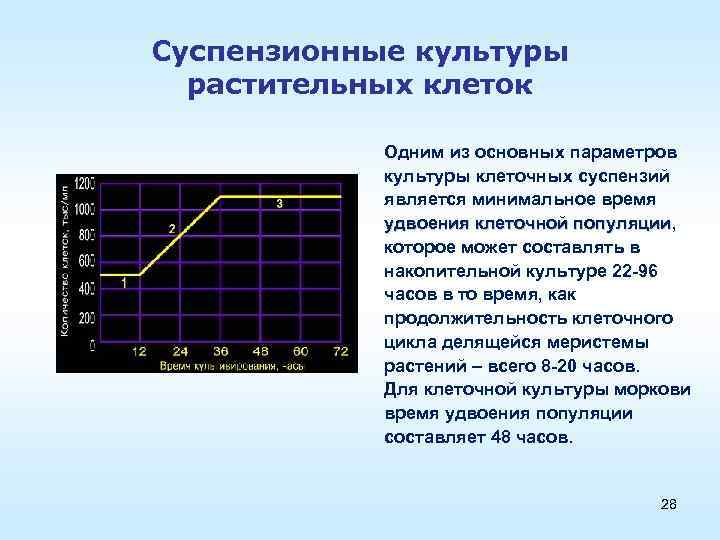 Суспензионные культуры растительных клеток Одним из основных параметров культуры клеточных суспензий является минимальное время удвоения клеточной популяции, удвоения клеточной популяции которое может составлять в накопительной культуре 22 96 часов в то время, как продолжительность клеточного цикла делящейся меристемы растений – всего 8 20 часов. Для клеточной культуры моркови время удвоения популяции составляет 48 часов. 28
Суспензионные культуры растительных клеток Одним из основных параметров культуры клеточных суспензий является минимальное время удвоения клеточной популяции, удвоения клеточной популяции которое может составлять в накопительной культуре 22 96 часов в то время, как продолжительность клеточного цикла делящейся меристемы растений – всего 8 20 часов. Для клеточной культуры моркови время удвоения популяции составляет 48 часов. 28
 Культивирование отдельных клеток • Отдельные клетки культивируют для получения клонов, изучения их генетической и физиологической изменчивости или стабильности, а также для клоновой селекции мутантных, гибридных и трансформированных линий. • Культивирование отдельных клеток позволяет изучать условия, определяющие возникновение стимулов к делению у клеток, изолированных от влияния других клеток популяции или ткани. • Кроме того, отдельные клетки могут служить моделью для сравнительного изучения физиологических процессов в ткани и изолированной клетке. Например, для изучения фотодыхания можно сравнивать процесс фотосинтеза на уровне отдельных клеток мезофилла листа и целой ткани. • 29
Культивирование отдельных клеток • Отдельные клетки культивируют для получения клонов, изучения их генетической и физиологической изменчивости или стабильности, а также для клоновой селекции мутантных, гибридных и трансформированных линий. • Культивирование отдельных клеток позволяет изучать условия, определяющие возникновение стимулов к делению у клеток, изолированных от влияния других клеток популяции или ткани. • Кроме того, отдельные клетки могут служить моделью для сравнительного изучения физиологических процессов в ткани и изолированной клетке. Например, для изучения фотодыхания можно сравнивать процесс фотосинтеза на уровне отдельных клеток мезофилла листа и целой ткани. • 29
 Культивирование отдельных клеток • Выращивание изолированных клеток складывается из двух этапов: • 1) изолирование неповрежденной клетки растительной или каллусной ткани; • 2) создание условий, благоприятных для роста и развития изолированной клетки. • На первом этапе необходимо выделить неповрежденную и жизнеспособную клетку из ткани целого растения или каллусной ткани. Этого можно достичь путем обработки ткани пектиназами, что ведет к мацерации ее клеток. Однако не пектиназами, всегда после такой обработки клетки сохраняют способность к последующим делениям и образованию ткани. Лучше получать отдельные клетки из суспензионных культур или рыхлого каллуса. • Идеальными отдельными клетками являются протопласты, образовавшие клеточную стенку. • Далее клетки изолируют либо при помощи микроманипуляторов, либо путем ряда последовательных разведений. • Отдельные клетки вели себя иначе, чем их скопления в виде агрегатов в суспензии или каллусной массы на поверхности питательной среды и требуются специальные добавки к питательной среде, чтобы заставить их делится. 30
Культивирование отдельных клеток • Выращивание изолированных клеток складывается из двух этапов: • 1) изолирование неповрежденной клетки растительной или каллусной ткани; • 2) создание условий, благоприятных для роста и развития изолированной клетки. • На первом этапе необходимо выделить неповрежденную и жизнеспособную клетку из ткани целого растения или каллусной ткани. Этого можно достичь путем обработки ткани пектиназами, что ведет к мацерации ее клеток. Однако не пектиназами, всегда после такой обработки клетки сохраняют способность к последующим делениям и образованию ткани. Лучше получать отдельные клетки из суспензионных культур или рыхлого каллуса. • Идеальными отдельными клетками являются протопласты, образовавшие клеточную стенку. • Далее клетки изолируют либо при помощи микроманипуляторов, либо путем ряда последовательных разведений. • Отдельные клетки вели себя иначе, чем их скопления в виде агрегатов в суспензии или каллусной массы на поверхности питательной среды и требуются специальные добавки к питательной среде, чтобы заставить их делится. 30
 Протопласты растительных клеток как объект биологического конструирования • Способы получения протопластов • Протопласт клетка, лишенная целлюлозной оболочки, окруженная цитоплазматической мембраной, сохраняющая все свойства, присущие растительной клетке. Впервые протопласты в 1892 г. выделил Дж. Клеркер, который использовал механический способ Другой метод выделения протопластов энзиматический, с использованием ферментов. энзиматический, Для удаления клеточной стенки используют ферменты трех типов: целлюлазы, гемицеллюлазы и пектиназы. Комбинация ферментов и их соотношение специфично для каждого типа клеток. Выделение протопластов проводят в три этапа: обработка ферментами, растворенными в осмотике выделение протопластов из клеточных стенок, отделение интактных протопластов от 31 клеточных осколков. • • •
Протопласты растительных клеток как объект биологического конструирования • Способы получения протопластов • Протопласт клетка, лишенная целлюлозной оболочки, окруженная цитоплазматической мембраной, сохраняющая все свойства, присущие растительной клетке. Впервые протопласты в 1892 г. выделил Дж. Клеркер, который использовал механический способ Другой метод выделения протопластов энзиматический, с использованием ферментов. энзиматический, Для удаления клеточной стенки используют ферменты трех типов: целлюлазы, гемицеллюлазы и пектиназы. Комбинация ферментов и их соотношение специфично для каждого типа клеток. Выделение протопластов проводят в три этапа: обработка ферментами, растворенными в осмотике выделение протопластов из клеточных стенок, отделение интактных протопластов от 31 клеточных осколков. • • •
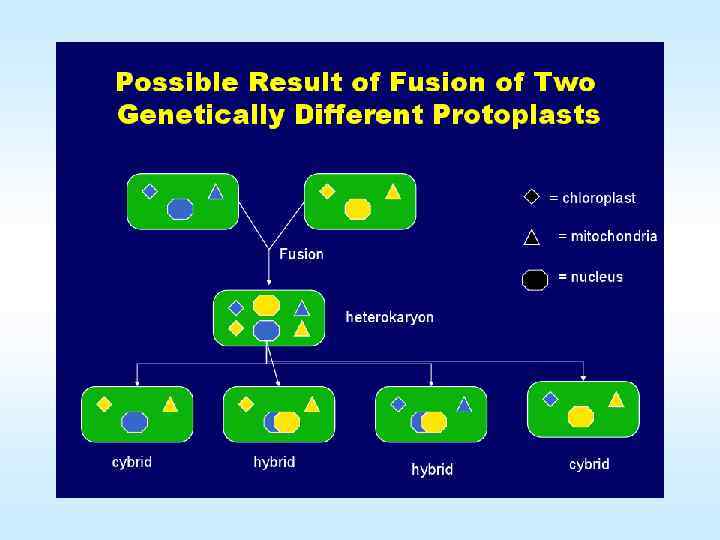
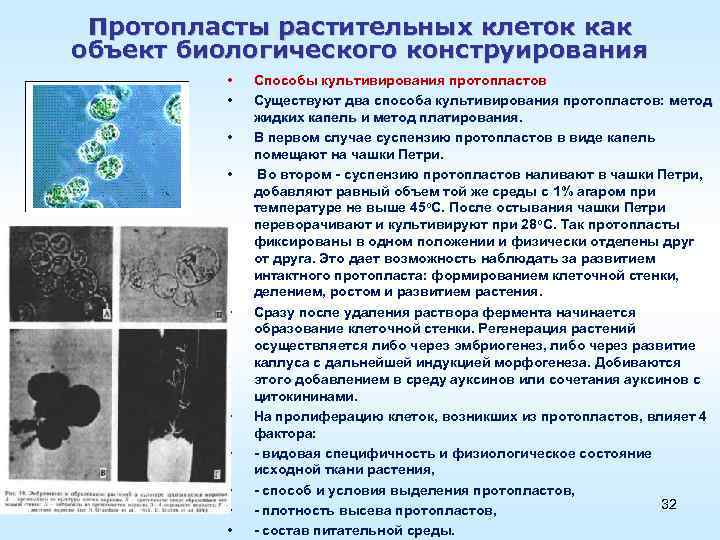 Протопласты растительных клеток как объект биологического конструирования • • • Способы культивирования протопластов Существуют два способа культивирования протопластов: метод жидких капель и метод платирования. В первом случае суспензию протопластов в виде капель помещают на чашки Петри. Во втором суспензию протопластов наливают в чашки Петри, добавляют равный объем той же среды с 1% агаром при температуре не выше 45 о. С. После остывания чашки Петри переворачивают и культивируют при 28 о. С. Так протопласты фиксированы в одном положении и физически отделены друг от друга. Это дает возможность наблюдать за развитием интактного протопласта: формированием клеточной стенки, делением, ростом и развитием растения. Сразу после удаления раствора фермента начинается образование клеточной стенки. Регенерация растений осуществляется либо через эмбриогенез, либо через развитие каллуса с дальнейшей индукцией морфогенеза. Добиваются этого добавлением в среду ауксинов или сочетания ауксинов с цитокининами. На пролиферацию клеток, возникших из протопластов, влияет 4 фактора: видовая специфичность и физиологическое состояние исходной ткани растения, способ и условия выделения протопластов, 32 плотность высева протопластов, состав питательной среды.
Протопласты растительных клеток как объект биологического конструирования • • • Способы культивирования протопластов Существуют два способа культивирования протопластов: метод жидких капель и метод платирования. В первом случае суспензию протопластов в виде капель помещают на чашки Петри. Во втором суспензию протопластов наливают в чашки Петри, добавляют равный объем той же среды с 1% агаром при температуре не выше 45 о. С. После остывания чашки Петри переворачивают и культивируют при 28 о. С. Так протопласты фиксированы в одном положении и физически отделены друг от друга. Это дает возможность наблюдать за развитием интактного протопласта: формированием клеточной стенки, делением, ростом и развитием растения. Сразу после удаления раствора фермента начинается образование клеточной стенки. Регенерация растений осуществляется либо через эмбриогенез, либо через развитие каллуса с дальнейшей индукцией морфогенеза. Добиваются этого добавлением в среду ауксинов или сочетания ауксинов с цитокининами. На пролиферацию клеток, возникших из протопластов, влияет 4 фактора: видовая специфичность и физиологическое состояние исходной ткани растения, способ и условия выделения протопластов, 32 плотность высева протопластов, состав питательной среды.
 Культуры in vitro тканей растений • Образовавшиеся на эксплантах каллусные дедифференцированные клетки, при воздействии соответствующих концентраций фитогормонов или регуляторов роста (синтетических фитогормонов) могут начать дифференцироваться. • Типы дифференцировки клеток растений in vitro • • • Дифференцировка клеток может проходить различными путями и с различной степенью – от дифференцировки отдельных клеток до развития отдельного растения. Простой вид – появление в каллусной ткани дифференцированных клеток, имеющих специфическое строение и несущих особые функции, например, клеток депонирующих запасные вещества или метаболиты. Гистологическая дифференцировка – образование в каллусе различных тканей, например, элементов сосудистой системы. Органогенез (монополярные структуры) – дифференциация каллусных клеток в целые органы: превращение их в апексы стеблей или корней. Соматический эмбриогенез (биполярные структуры) – образование в каллусной культуре эмбриоидов, т. е зачатков интактного растения, способных развиться во взрослое растение. 33
Культуры in vitro тканей растений • Образовавшиеся на эксплантах каллусные дедифференцированные клетки, при воздействии соответствующих концентраций фитогормонов или регуляторов роста (синтетических фитогормонов) могут начать дифференцироваться. • Типы дифференцировки клеток растений in vitro • • • Дифференцировка клеток может проходить различными путями и с различной степенью – от дифференцировки отдельных клеток до развития отдельного растения. Простой вид – появление в каллусной ткани дифференцированных клеток, имеющих специфическое строение и несущих особые функции, например, клеток депонирующих запасные вещества или метаболиты. Гистологическая дифференцировка – образование в каллусе различных тканей, например, элементов сосудистой системы. Органогенез (монополярные структуры) – дифференциация каллусных клеток в целые органы: превращение их в апексы стеблей или корней. Соматический эмбриогенез (биполярные структуры) – образование в каллусной культуре эмбриоидов, т. е зачатков интактного растения, способных развиться во взрослое растение. 33

 Основные требования для получения морфогенеза в культуре клеток • Два гормона влияют на дифференциацию клеток в культуре: • ауксин – стимуляция развития корней • цитокинин – стимуляция развития побегов • Отношение этих двух гормонов может определять растительное развитие • ↓цитокинин ↑ауксин –корнеобразование • ↑цитокинин ↓ ауксин – побегообразование • Ауксин=цитокини – развитие каллуса 35
Основные требования для получения морфогенеза в культуре клеток • Два гормона влияют на дифференциацию клеток в культуре: • ауксин – стимуляция развития корней • цитокинин – стимуляция развития побегов • Отношение этих двух гормонов может определять растительное развитие • ↓цитокинин ↑ауксин –корнеобразование • ↑цитокинин ↓ ауксин – побегообразование • Ауксин=цитокини – развитие каллуса 35
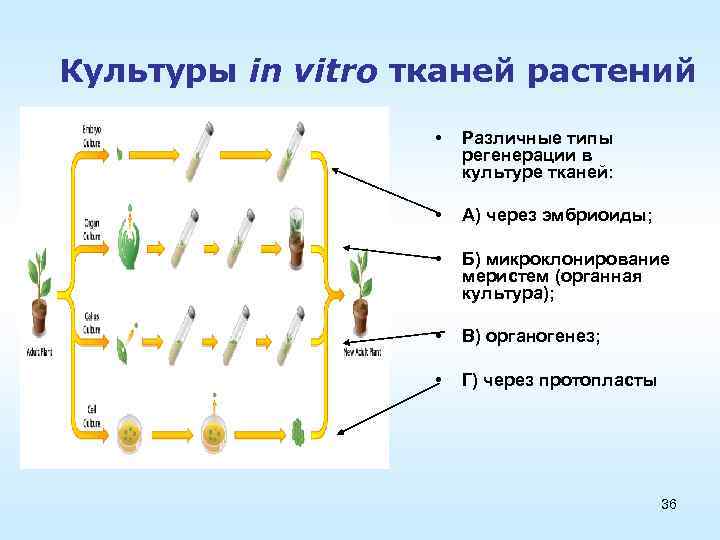 Культуры in vitro тканей растений • Различные типы регенерации в культуре тканей: • А) через эмбриоиды; • Б) микроклонирование меристем (органная культура); • В) органогенез; • Г) через протопласты 36
Культуры in vitro тканей растений • Различные типы регенерации в культуре тканей: • А) через эмбриоиды; • Б) микроклонирование меристем (органная культура); • В) органогенез; • Г) через протопласты 36
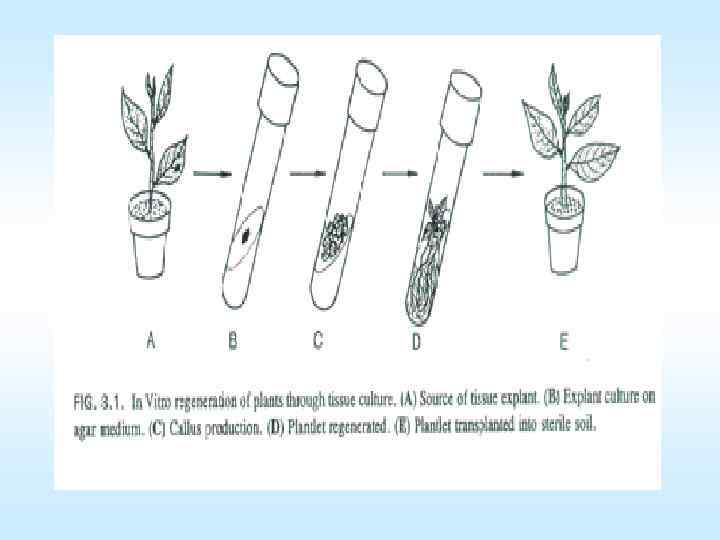
 Культуры in vitro тканей растений Схема, показывающая клонирование моркови через стадии дедифференциации, формирования каллуса и роста эмбриоидов 38
Культуры in vitro тканей растений Схема, показывающая клонирование моркови через стадии дедифференциации, формирования каллуса и роста эмбриоидов 38
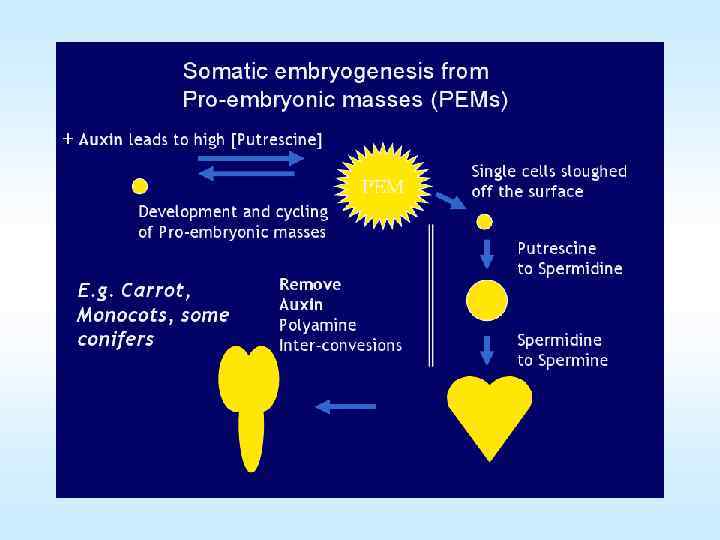
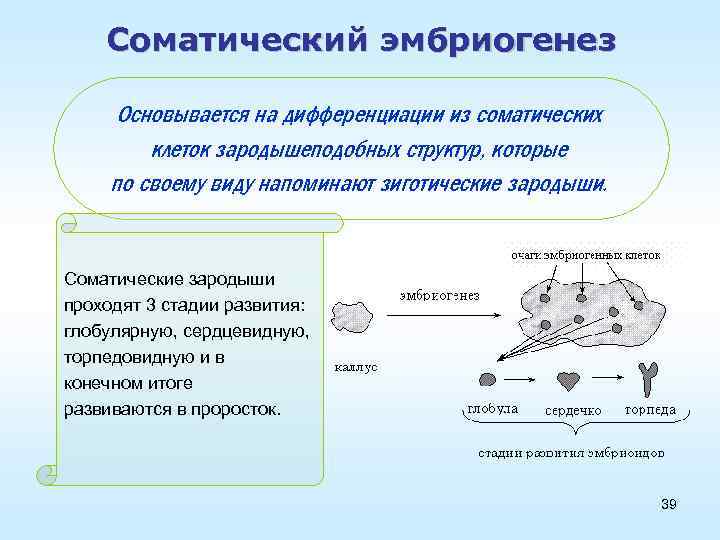 Соматический эмбриогенез Основывается на дифференциации из соматических клеток зародышеподобных структур, которые по своему виду напоминают зиготические зародыши. Соматические зародыши проходят 3 стадии развития: глобулярную, сердцевидную, торпедовидную и в конечном итоге развиваются в проросток. 39
Соматический эмбриогенез Основывается на дифференциации из соматических клеток зародышеподобных структур, которые по своему виду напоминают зиготические зародыши. Соматические зародыши проходят 3 стадии развития: глобулярную, сердцевидную, торпедовидную и в конечном итоге развиваются в проросток. 39
 Культуры in vitro тканей растений Каллусные и эмбриоидные образования на сегментах корня Cymbidium ensifolium. Бар - 500 µm C. CHANG and W. C. CHANG, 1998 Эмбриоидный каллус с дифференцированными областями Образование меристематической ткани на части каллусной поверхности (срез через эмбриоиды). Регенерация эмбриоидов на каллусах из Сканирующая электронная микроскопия корневых эксплантов эмбриоидной поверхности. Стрелочками показаны вторичные эмбриоиды. 40
Культуры in vitro тканей растений Каллусные и эмбриоидные образования на сегментах корня Cymbidium ensifolium. Бар - 500 µm C. CHANG and W. C. CHANG, 1998 Эмбриоидный каллус с дифференцированными областями Образование меристематической ткани на части каллусной поверхности (срез через эмбриоиды). Регенерация эмбриоидов на каллусах из Сканирующая электронная микроскопия корневых эксплантов эмбриоидной поверхности. Стрелочками показаны вторичные эмбриоиды. 40

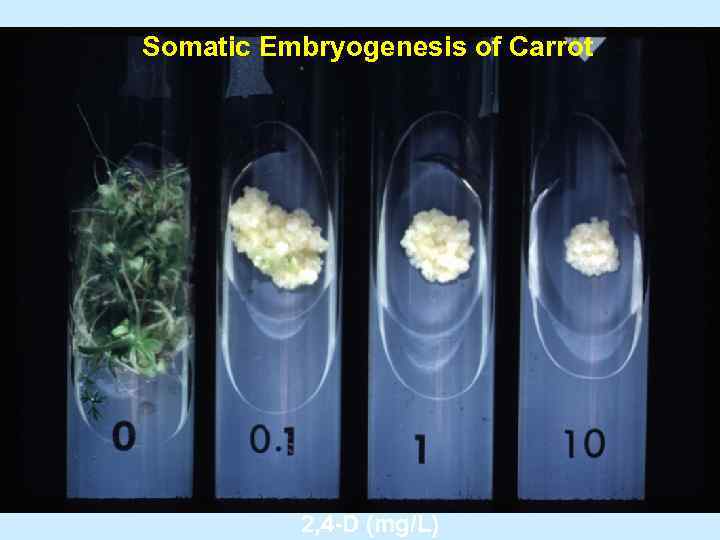 Somatic Embryogenesis of Carrot 2, 4 D (mg/L)
Somatic Embryogenesis of Carrot 2, 4 D (mg/L)
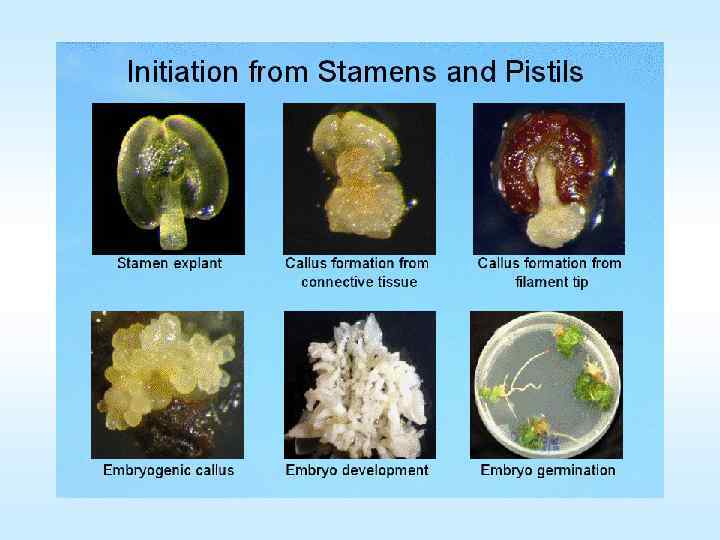

 Органогенез • • • Процесс инициации и развития структур, которые формируют естественный орган с его всеми функциями Способность немеристематической ткани к формированию различных органов de novo Образование корней, побегов, листьев или др. органов Эти органы могут образовываться из предсуществующих зачатков или формироваться заново Так что могут образовываться или из каллуса или из предшествующих структур 47
Органогенез • • • Процесс инициации и развития структур, которые формируют естественный орган с его всеми функциями Способность немеристематической ткани к формированию различных органов de novo Образование корней, побегов, листьев или др. органов Эти органы могут образовываться из предсуществующих зачатков или формироваться заново Так что могут образовываться или из каллуса или из предшествующих структур 47
 Культуры in vitro тканей растений Дифференциация побегов из каллуса лен яблоня 48
Культуры in vitro тканей растений Дифференциация побегов из каллуса лен яблоня 48




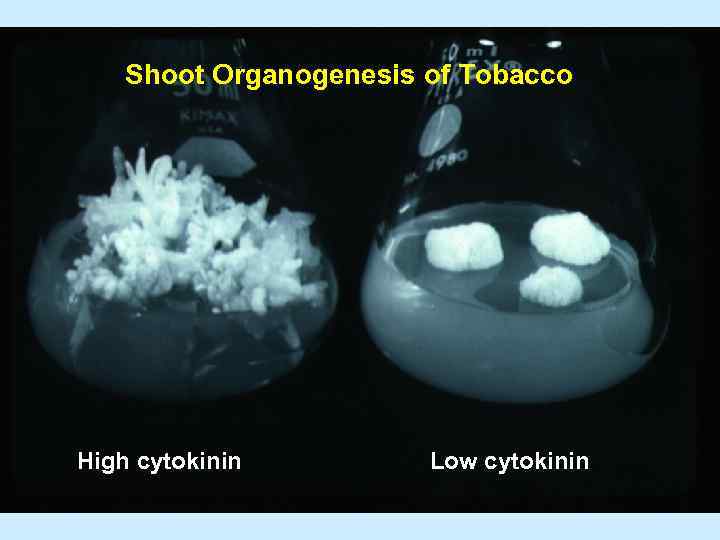 Shoot Organogenesis of Tobacco High cytokinin Low cytokinin
Shoot Organogenesis of Tobacco High cytokinin Low cytokinin
 Tobacco Regeneration
Tobacco Regeneration
 II. Regeneration - The process whereby a part of a plant can be turned into a whole new plant African violet leaf sprouting new shoots
II. Regeneration - The process whereby a part of a plant can be turned into a whole new plant African violet leaf sprouting new shoots
 Индукция возникновения адвентивных почек непосредственно тканями экспланта q Основан на способности изолированных частей растения при благоприятных условиях питательной среды восстанавливать недостающие органы и таким образом регенерировать целые растения. q Таким способом были размножены многие представители семейства лилейных, томаты, древесные растения. 56
Индукция возникновения адвентивных почек непосредственно тканями экспланта q Основан на способности изолированных частей растения при благоприятных условиях питательной среды восстанавливать недостающие органы и таким образом регенерировать целые растения. q Таким способом были размножены многие представители семейства лилейных, томаты, древесные растения. 56
 Дифференциация адвентивных почек в каллусной ткани Через каллусную культуру успешно размножаются сахарная свекла, злаковые капустные, подсолнечник и другие культуры. Растениерегенерант твердой пшеницы К классификации методов Каллус - особая ткань, состоящая из недифференцированных клеток Каллус на питательной среде 57 конец
Дифференциация адвентивных почек в каллусной ткани Через каллусную культуру успешно размножаются сахарная свекла, злаковые капустные, подсолнечник и другие культуры. Растениерегенерант твердой пшеницы К классификации методов Каллус - особая ткань, состоящая из недифференцированных клеток Каллус на питательной среде 57 конец
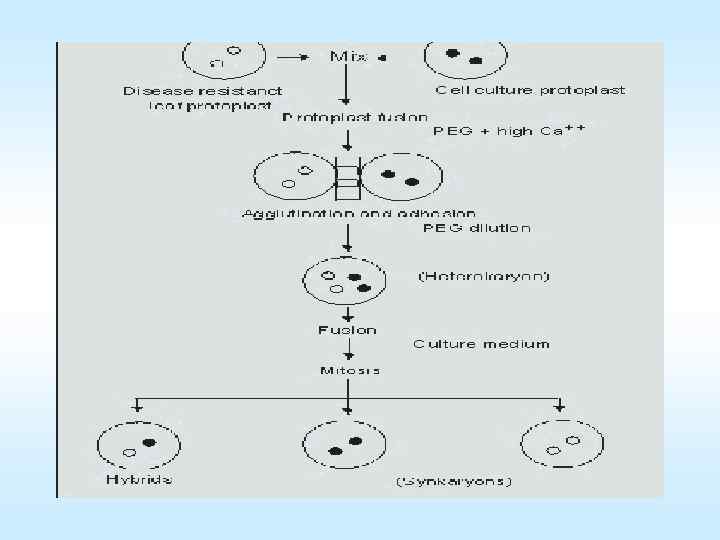
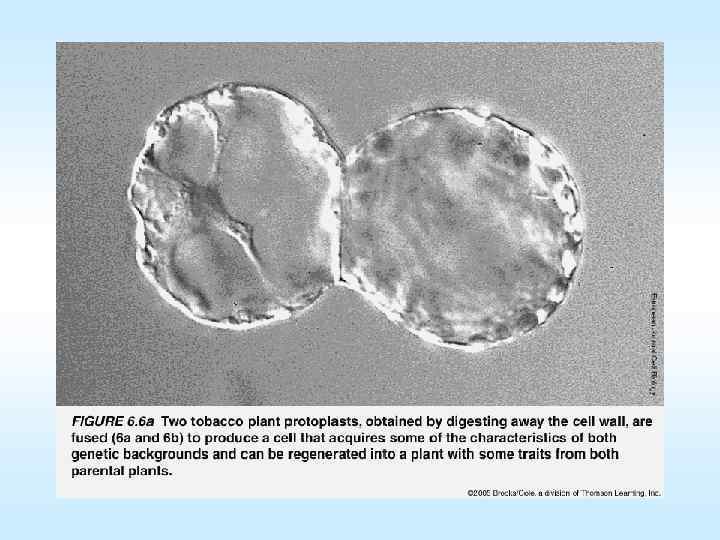
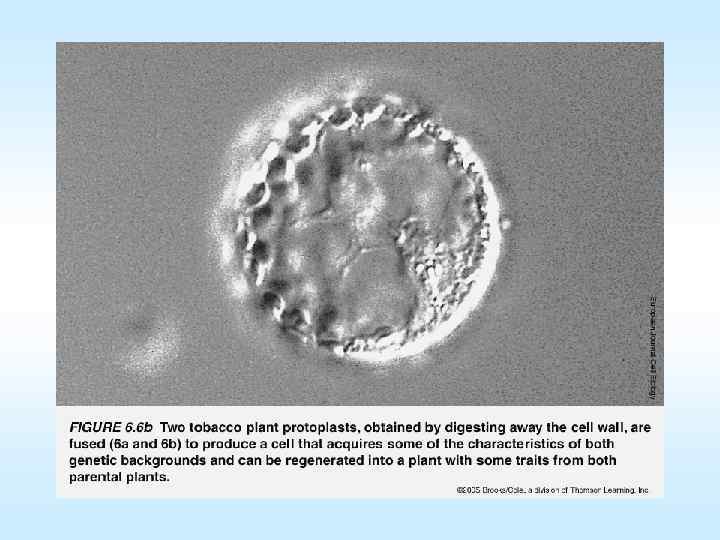
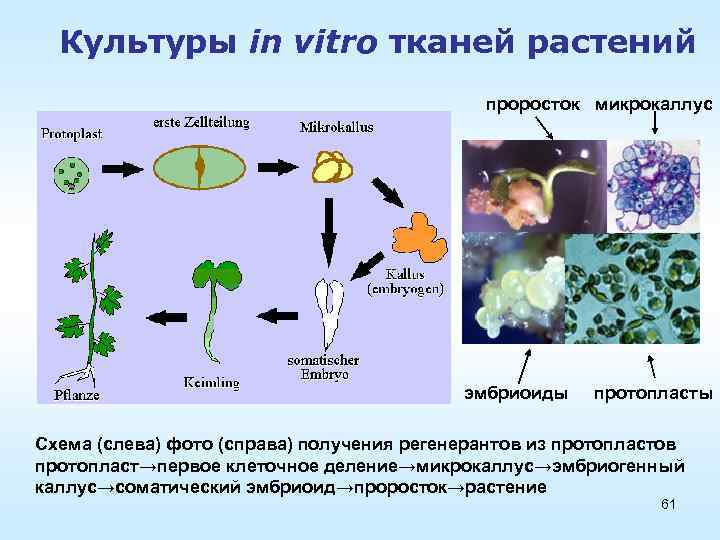 Культуры in vitro тканей растений проросток микрокаллус эмбриоиды протопласты Схема (слева) фото (справа) получения регенерантов из протопластов протопласт→первое клеточное деление→микрокаллус→эмбриогенный каллус→соматический эмбриоид→проросток→растение 61
Культуры in vitro тканей растений проросток микрокаллус эмбриоиды протопласты Схема (слева) фото (справа) получения регенерантов из протопластов протопласт→первое клеточное деление→микрокаллус→эмбриогенный каллус→соматический эмбриоид→проросток→растение 61
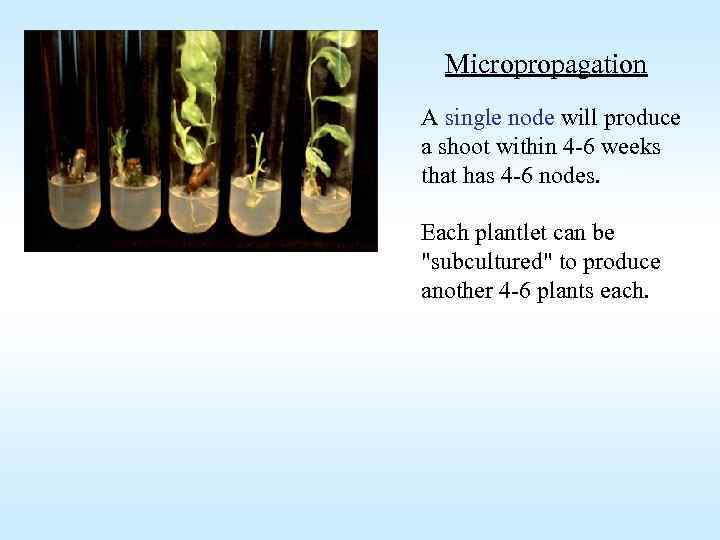 Micropropagation A single node will produce a shoot within 4 -6 weeks that has 4 -6 nodes. Each plantlet can be "subcultured" to produce another 4 -6 plants each.
Micropropagation A single node will produce a shoot within 4 -6 weeks that has 4 -6 nodes. Each plantlet can be "subcultured" to produce another 4 -6 plants each.
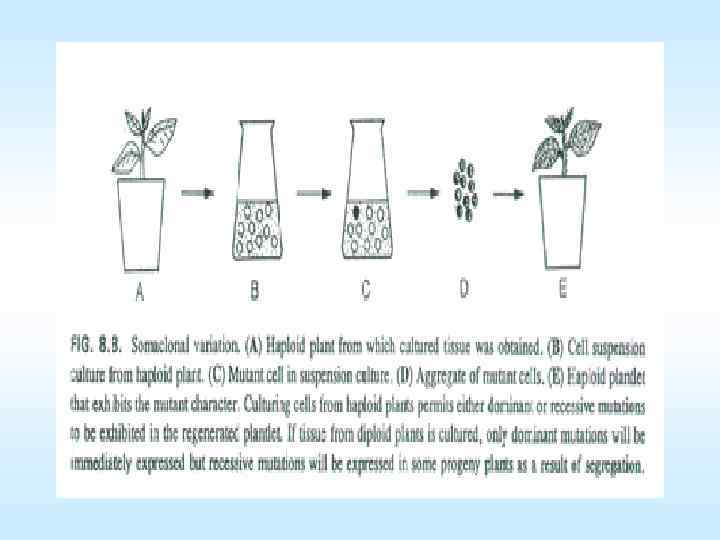
 Культуры растительных клеток • Клеточная селекция • Генетические основы применения культуры клеток растений в селекционных целях • Клетки в культуре in vitro отличаются по морфологии, по биохимическим свойствам, по физиологическому состоянию и генетически. Разнообразие (вариабельность) среди клеточных линий или растений регенерантов называют сомаклональной вариабельностью. Генетическая природа и механизм возникновения сомаклональной изменчивости пока мало изучены. Однако четко можно выделить зависимость возникновения сомаклональных вариантов, прежде всего, от генетической гетерогенности соматических клеток исходного экспланта, генетической и эпигенетической изменчивости, индуцируемой условиями культивирования in vitro , а также от генотипа и исходного экспланта. • Полиморфизм культивируемых клеток можно объяснить видовыми и возрастными особенностями, уровнем плоидности, влиянием состава питательной среды и условий культивирования, отсутствием коррелятивных связей. Последний фактор, ведущий к нарушению жесткой регуляции, существовавшей в целом растении, видимо, является основной причиной спонтанной изменчивости клеток in vitro. 68
Культуры растительных клеток • Клеточная селекция • Генетические основы применения культуры клеток растений в селекционных целях • Клетки в культуре in vitro отличаются по морфологии, по биохимическим свойствам, по физиологическому состоянию и генетически. Разнообразие (вариабельность) среди клеточных линий или растений регенерантов называют сомаклональной вариабельностью. Генетическая природа и механизм возникновения сомаклональной изменчивости пока мало изучены. Однако четко можно выделить зависимость возникновения сомаклональных вариантов, прежде всего, от генетической гетерогенности соматических клеток исходного экспланта, генетической и эпигенетической изменчивости, индуцируемой условиями культивирования in vitro , а также от генотипа и исходного экспланта. • Полиморфизм культивируемых клеток можно объяснить видовыми и возрастными особенностями, уровнем плоидности, влиянием состава питательной среды и условий культивирования, отсутствием коррелятивных связей. Последний фактор, ведущий к нарушению жесткой регуляции, существовавшей в целом растении, видимо, является основной причиной спонтанной изменчивости клеток in vitro. 68
 Культуры растительных клеток Спонтанный и индуцированный мутагенез в культуре клеток, тканей и протопластов позволяет получать растения, представляющие практический интерес для селекционеров. Важное практическое значение имеет создание форм растений, устойчивых к неблагоприятному действию факторов внешней среды, таких как низкие температуры, засоление почв, загрязнение природной среды токсическими веществами, поражение вредителями и возбудителями болезней. Эти факторы могут быть использованы в качестве селективного фона в процессе клеточной селекции. Клетки, сохранившие при этом жизнеспособность, могут быть регенерированы в целые растения. В качестве селективных агентов используют антибиотики, ингибиторы синтеза нуклеиновых кислот, аналоги пуриновых и пиримидиновых оснований, фито и патотоксины, агенты, вызывающие солевой и водный стресс, аналоги аминокислот. 69
Культуры растительных клеток Спонтанный и индуцированный мутагенез в культуре клеток, тканей и протопластов позволяет получать растения, представляющие практический интерес для селекционеров. Важное практическое значение имеет создание форм растений, устойчивых к неблагоприятному действию факторов внешней среды, таких как низкие температуры, засоление почв, загрязнение природной среды токсическими веществами, поражение вредителями и возбудителями болезней. Эти факторы могут быть использованы в качестве селективного фона в процессе клеточной селекции. Клетки, сохранившие при этом жизнеспособность, могут быть регенерированы в целые растения. В качестве селективных агентов используют антибиотики, ингибиторы синтеза нуклеиновых кислот, аналоги пуриновых и пиримидиновых оснований, фито и патотоксины, агенты, вызывающие солевой и водный стресс, аналоги аминокислот. 69
 Культуры растительных клеток Для проведения клеточной селекции используют следующие приемы: • — прямая (позитивная) селекция, при которой выживает лишь определенный искомый мутантный тип клеток; • — непрямая (негативная) селекция, основанная на избирательной гибели делящихся клеток дикого типа и выживания метаболически неактивных клеток, но требующая дополнительной идентификации у них мутационных изменений; • — тотальная селекция, при которой индивидуально тестируются все клеточные клоны; • — визуальная селекция и неселективный отбор, когда ва риантная линия может быть идентифицирована среди всей популяции клеток визуально или при использовании биохимических методов (тонкослойная или жидкостная хроматография, радиоиммунный анализ, микроспектрофотометрия и др. ). Из перечисленных выше приемов клеточной селекции прямая селекция является наиболее распространенным методом и используется главным образом для выделения растений регенерантов, устойчивых, например, к гербицидам, антибиотикам, токсинам, тяжелым металлам, солям и другим антиметаболитам. 70
Культуры растительных клеток Для проведения клеточной селекции используют следующие приемы: • — прямая (позитивная) селекция, при которой выживает лишь определенный искомый мутантный тип клеток; • — непрямая (негативная) селекция, основанная на избирательной гибели делящихся клеток дикого типа и выживания метаболически неактивных клеток, но требующая дополнительной идентификации у них мутационных изменений; • — тотальная селекция, при которой индивидуально тестируются все клеточные клоны; • — визуальная селекция и неселективный отбор, когда ва риантная линия может быть идентифицирована среди всей популяции клеток визуально или при использовании биохимических методов (тонкослойная или жидкостная хроматография, радиоиммунный анализ, микроспектрофотометрия и др. ). Из перечисленных выше приемов клеточной селекции прямая селекция является наиболее распространенным методом и используется главным образом для выделения растений регенерантов, устойчивых, например, к гербицидам, антибиотикам, токсинам, тяжелым металлам, солям и другим антиметаболитам. 70
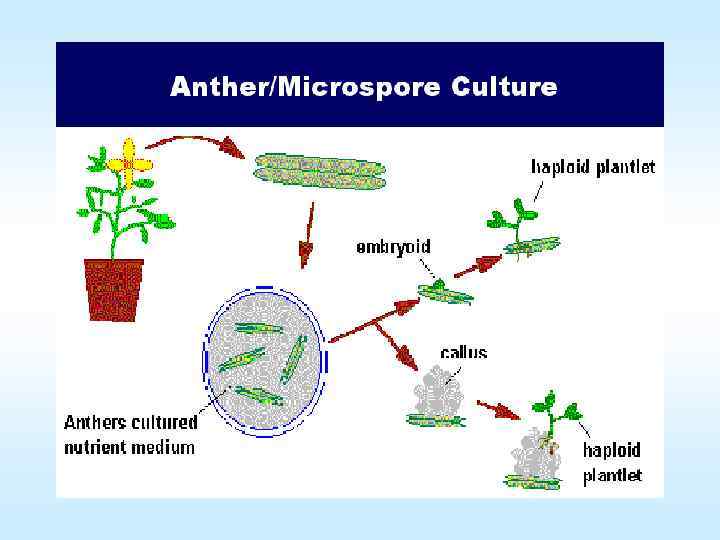
 Использование культур in vitro в селекции • • • Методы клеточной селекции Одно из направлений клеточных технологий — это использование их в селекции, которое облегчает и ускоряет традиционный селекционный процесс в создании новых форм и сортов растений. Существующие методы культивирования изолированных клеток и тканей in vitro условно можно разделить на две группы. Первая группа — это вспомогательные технологии, которые не подменяют обычную селекцию, а служат ей. К ним можно отнести: оплодотворение in vitro (преодоление прогамной несовместимости), культивирование семяпочек и незрелых гибридных зародышей (преодоление постгамной несовместимости), получение гаплоидов путем культивирования пыльников и микроспор, криосохранение изолированных клеток, тканей и органов, клональное микроразмножение отдаленных гибридов. Вторая группа методов ведет к самостоятельному, независимому от традиционных методов селекции, получению новых форм и сортов растений: клеточная селекция с использованием каллусной ткани, соматическая гибридизация (слияние изолированных протопластов и получение неполовых гибридов), применение методов генной инженерии. В отдаленной гибридизации находят применение такие методы культуры изолированных тканей, как оплодотворение in vitro, эмбриокультура (выращивание изолированных зародышей на искусственных питательных средах), клональное микроразмножение ценных гибридов, а также получение 71 гаплоидов in vitro и криосохранение.
Использование культур in vitro в селекции • • • Методы клеточной селекции Одно из направлений клеточных технологий — это использование их в селекции, которое облегчает и ускоряет традиционный селекционный процесс в создании новых форм и сортов растений. Существующие методы культивирования изолированных клеток и тканей in vitro условно можно разделить на две группы. Первая группа — это вспомогательные технологии, которые не подменяют обычную селекцию, а служат ей. К ним можно отнести: оплодотворение in vitro (преодоление прогамной несовместимости), культивирование семяпочек и незрелых гибридных зародышей (преодоление постгамной несовместимости), получение гаплоидов путем культивирования пыльников и микроспор, криосохранение изолированных клеток, тканей и органов, клональное микроразмножение отдаленных гибридов. Вторая группа методов ведет к самостоятельному, независимому от традиционных методов селекции, получению новых форм и сортов растений: клеточная селекция с использованием каллусной ткани, соматическая гибридизация (слияние изолированных протопластов и получение неполовых гибридов), применение методов генной инженерии. В отдаленной гибридизации находят применение такие методы культуры изолированных тканей, как оплодотворение in vitro, эмбриокультура (выращивание изолированных зародышей на искусственных питательных средах), клональное микроразмножение ценных гибридов, а также получение 71 гаплоидов in vitro и криосохранение.
 Использование культур in vitro в селекции • Оплодотворение in vitro (преодоление прогамной несовместимости) проводится в том случае, когда невозможно осуществить оплодотворение между выбранными парами в естественных условиях. Это вызвано несколькими причинами: 1) физиологические (несоответствие во времени созревания пыльцы и т. д. ); 2) морфологические (короткая пыльцевая трубка или блокирование роста ее на раз ных этапах развития и т. д. ). • Оплодотворение in vitro можно осуществить двумя способами: а) культивирование на искусственной агаризованной питательной среде завязи с нанесенной на нее готовой пыльцой; б) завязь вскрывается и на питательную среду переносятся кусочки плаценты с семяпочками, вблизи которых или непосредственно на ткани плаценты культивируется готовая пыльца. • Визуально определить, прошло оплодотворение in vitro или нет, можно по быстро увеличивающимся в размерах семяпочкам. Сформировавшийся зародыш, как правило, не переходит в состояние покоя, а сразу прорастает и дает начало гибридному поколению. • Постгамная несовместимость при отдаленной гибридизации возникает после оплодотворения. Часто при этом образуются щуплые невсхожие семена. Причиной может быть расхождение во времени развития зародыша и эндосперма. Из за слабого развития эндосперма зародыш бывает неспособен к нормальному прорастанию. В таких случаях из зрелой щуплой зерновки изолируют зародыш и 72 выращивают его в питательной среде.
Использование культур in vitro в селекции • Оплодотворение in vitro (преодоление прогамной несовместимости) проводится в том случае, когда невозможно осуществить оплодотворение между выбранными парами в естественных условиях. Это вызвано несколькими причинами: 1) физиологические (несоответствие во времени созревания пыльцы и т. д. ); 2) морфологические (короткая пыльцевая трубка или блокирование роста ее на раз ных этапах развития и т. д. ). • Оплодотворение in vitro можно осуществить двумя способами: а) культивирование на искусственной агаризованной питательной среде завязи с нанесенной на нее готовой пыльцой; б) завязь вскрывается и на питательную среду переносятся кусочки плаценты с семяпочками, вблизи которых или непосредственно на ткани плаценты культивируется готовая пыльца. • Визуально определить, прошло оплодотворение in vitro или нет, можно по быстро увеличивающимся в размерах семяпочкам. Сформировавшийся зародыш, как правило, не переходит в состояние покоя, а сразу прорастает и дает начало гибридному поколению. • Постгамная несовместимость при отдаленной гибридизации возникает после оплодотворения. Часто при этом образуются щуплые невсхожие семена. Причиной может быть расхождение во времени развития зародыша и эндосперма. Из за слабого развития эндосперма зародыш бывает неспособен к нормальному прорастанию. В таких случаях из зрелой щуплой зерновки изолируют зародыш и 72 выращивают его в питательной среде.
 Использование культур in vitro в селекции • • Выращивание зародышей в искусственной питательной среде называется эмбриокультурой. Применение эмбриокультуры в селекции приобретает в последнее время большое значение для получения отдаленных гибридов зерновых, злаковых и других сельскохозяйственных культур. Показана возможность увеличения выхода пшенично ржаных гибридов путем доращивания незрелых зародышей. Метод эмбриокультуры находит все более широкое применение в межвидовой гибридизации овощных растений. Для лука разработаны приемы выращивания in vitro абортивных зародышей от гибридных семян с разных этапов эмбриогенеза, выращивание зародышей от частично фертильных межвидовых гибридов. Культура изолированных зародышей используется в селекции томатов и других овощных растений. Культура изолированных зародышей как вспомогательный метод при отдаленной гибридизации применяется не только для преодоления постгамной несовместимости, но также с целью микроразмножения ценных гибридов. В этом случае микроразмножение идет путем каллусогенеза, индукции морфогенеза и получения растений регенерантов из каллусной ткани. Техника клонирования незрелых зародышей позволяет размножать ценные генотипы растений на ранних стадиях жизненного цикла. Еще одна возможность применения культуры зародышей — использование ее в клеточной селекции. Таким образом, проведение селекции на клеточном уровне позволяет создавать новые формы растений в 2— 4 раза быстрее по сравнению с традиционными способами селекции 73
Использование культур in vitro в селекции • • Выращивание зародышей в искусственной питательной среде называется эмбриокультурой. Применение эмбриокультуры в селекции приобретает в последнее время большое значение для получения отдаленных гибридов зерновых, злаковых и других сельскохозяйственных культур. Показана возможность увеличения выхода пшенично ржаных гибридов путем доращивания незрелых зародышей. Метод эмбриокультуры находит все более широкое применение в межвидовой гибридизации овощных растений. Для лука разработаны приемы выращивания in vitro абортивных зародышей от гибридных семян с разных этапов эмбриогенеза, выращивание зародышей от частично фертильных межвидовых гибридов. Культура изолированных зародышей используется в селекции томатов и других овощных растений. Культура изолированных зародышей как вспомогательный метод при отдаленной гибридизации применяется не только для преодоления постгамной несовместимости, но также с целью микроразмножения ценных гибридов. В этом случае микроразмножение идет путем каллусогенеза, индукции морфогенеза и получения растений регенерантов из каллусной ткани. Техника клонирования незрелых зародышей позволяет размножать ценные генотипы растений на ранних стадиях жизненного цикла. Еще одна возможность применения культуры зародышей — использование ее в клеточной селекции. Таким образом, проведение селекции на клеточном уровне позволяет создавать новые формы растений в 2— 4 раза быстрее по сравнению с традиционными способами селекции 73
 • Культуры растительных клеток могут использоваться: • в селекции, с целью получения нового селекционного материала проведение селекции на клеточном уровне позволяет создавать новые формы растений в 2— 4 раза быстрее по сравнению с традиционными способами селекции; • для получения различных соединений, которые синтезируются в растениях ; • для получения трансгенных растений. 74
• Культуры растительных клеток могут использоваться: • в селекции, с целью получения нового селекционного материала проведение селекции на клеточном уровне позволяет создавать новые формы растений в 2— 4 раза быстрее по сравнению с традиционными способами селекции; • для получения различных соединений, которые синтезируются в растениях ; • для получения трансгенных растений. 74
 • Виды культур растительных клеток, используемых в клеточной селекции • Для проведения работ по клеточной селекции растений в условиях in vitro в качестве объекта исследования могут быть использованы: • 1) каллусные культуры; • 2) суспензионные культуры ; • 3) изолированные протопласты. • Выбор объекта зависит от наличия разработанных технологий применительно к различным видам растений, а также от конечных целей исследования. • Каллусная ткань представляет собой легко доступный материал, который наиболее часто используют для клеточной селекции. Как правило, работу проводят на первичной или пересадочной каллусной ткани, которая не утрачивает способности к регенерации на протяжении ряда субкультивирований. 75
• Виды культур растительных клеток, используемых в клеточной селекции • Для проведения работ по клеточной селекции растений в условиях in vitro в качестве объекта исследования могут быть использованы: • 1) каллусные культуры; • 2) суспензионные культуры ; • 3) изолированные протопласты. • Выбор объекта зависит от наличия разработанных технологий применительно к различным видам растений, а также от конечных целей исследования. • Каллусная ткань представляет собой легко доступный материал, который наиболее часто используют для клеточной селекции. Как правило, работу проводят на первичной или пересадочной каллусной ткани, которая не утрачивает способности к регенерации на протяжении ряда субкультивирований. 75
 Однако при работе с каллусными культурами многие исследователи отмечают существенные недостатки данного объекта: 1) медленный рост ткани, 2) неравноценное для всех клеток действие токсических веществ, которые применяются в качестве селективного фактора, 3) потеря регенерационной способности в процессе культивирования каллусных клеток. Проводить селекцию целесообразно на уровне одиночных клеток (суспензионная культура, протопласты). Однако для многих видов растений не разработаны эффективные технологии и способы культивирования одиночных клеток. Поэтому, несмотря на перечисленные выше недостатки использования каллусных культур, этот способ селекции остается для некоторых видов растений пока единственным. 76
Однако при работе с каллусными культурами многие исследователи отмечают существенные недостатки данного объекта: 1) медленный рост ткани, 2) неравноценное для всех клеток действие токсических веществ, которые применяются в качестве селективного фактора, 3) потеря регенерационной способности в процессе культивирования каллусных клеток. Проводить селекцию целесообразно на уровне одиночных клеток (суспензионная культура, протопласты). Однако для многих видов растений не разработаны эффективные технологии и способы культивирования одиночных клеток. Поэтому, несмотря на перечисленные выше недостатки использования каллусных культур, этот способ селекции остается для некоторых видов растений пока единственным. 76
 • Преимущества метода клеточной селекции in vitro • По сравнению с экспериментальным мутагенезом на уровне целых растений метод мутагенеза на уровне клеток имеет ряд преимуществ: • экономится площадь, так как в одной чашке Петри диаметром 10 см можно культивировать 107 – 108 клеток, а для такого же количества растений необходима площадь свыше тысячи гектаров; • мутантные признаки на уровне отдельных клеток проявляются довольно быстро; • возможно получение новых типов мутаций, в том числе и биохимического характера; • экономится время и трудозатраты на получение нового желаемого признака. • 77
• Преимущества метода клеточной селекции in vitro • По сравнению с экспериментальным мутагенезом на уровне целых растений метод мутагенеза на уровне клеток имеет ряд преимуществ: • экономится площадь, так как в одной чашке Петри диаметром 10 см можно культивировать 107 – 108 клеток, а для такого же количества растений необходима площадь свыше тысячи гектаров; • мутантные признаки на уровне отдельных клеток проявляются довольно быстро; • возможно получение новых типов мутаций, в том числе и биохимического характера; • экономится время и трудозатраты на получение нового желаемого признака. • 77
 • Основным требованием для успешного использования клеточного мутагенеза является хорошо разработанная система регенерации растений. Важным условием является также возможность получения гаплоидов у того или иного вида растений. В дальнейшую селекционную работу включаются только те генотипы, у которых мутации проявляются на уровне целого растения. • Растения с измененными признаками, полученные в результате мутагенеза на клеточном уровне, называются вариантами (термин «мутант» используется тогда, когда мутация подтверждается генетическими или молекулярно генетическими методами). Рекомендуются следующие обозначения: R 0 – растения регенеранты, полученные из соответствующих клеточных клонов, R, R 2 и т. д. – первое и последующее поколения после самоопыления. • Общая схема получения мутантных форм путем селекции на клеточном уровне состоит из нескольких этапов 78
• Основным требованием для успешного использования клеточного мутагенеза является хорошо разработанная система регенерации растений. Важным условием является также возможность получения гаплоидов у того или иного вида растений. В дальнейшую селекционную работу включаются только те генотипы, у которых мутации проявляются на уровне целого растения. • Растения с измененными признаками, полученные в результате мутагенеза на клеточном уровне, называются вариантами (термин «мутант» используется тогда, когда мутация подтверждается генетическими или молекулярно генетическими методами). Рекомендуются следующие обозначения: R 0 – растения регенеранты, полученные из соответствующих клеточных клонов, R, R 2 и т. д. – первое и последующее поколения после самоопыления. • Общая схема получения мутантных форм путем селекции на клеточном уровне состоит из нескольких этапов 78
 Измененные при мутагенной обработке клетки могут быть выделены в условиях культивирования in vitro путем прямого и непрямого отборов, а также при тестировании отдельных клеточных колоний. Прямой отбор состоит в добавлении к питательным средам отдельных компонентов, к которым обычные, неизмененные клетки не устойчивы. Непрямой отбор (негативная селекция) заключается в создании условий культивирования, при которых рост неизмененных клеток либо задерживается, либо эти клетки погибают (например, культивирование при низких или высоких температурах на средах с недостатком отдельных компонентов и т. д. ). Существует ряд факторов, ограничивающих селекцию in vitro Многие хозяйственно важные признаки, такие, как урожайность, количество зерна, устойчивость к пестицидам и другие трудно или практически невозможно получить при культивировании in vitro поскольку они не проявляются на клеточном уровне. 79
Измененные при мутагенной обработке клетки могут быть выделены в условиях культивирования in vitro путем прямого и непрямого отборов, а также при тестировании отдельных клеточных колоний. Прямой отбор состоит в добавлении к питательным средам отдельных компонентов, к которым обычные, неизмененные клетки не устойчивы. Непрямой отбор (негативная селекция) заключается в создании условий культивирования, при которых рост неизмененных клеток либо задерживается, либо эти клетки погибают (например, культивирование при низких или высоких температурах на средах с недостатком отдельных компонентов и т. д. ). Существует ряд факторов, ограничивающих селекцию in vitro Многие хозяйственно важные признаки, такие, как урожайность, количество зерна, устойчивость к пестицидам и другие трудно или практически невозможно получить при культивировании in vitro поскольку они не проявляются на клеточном уровне. 79
 • Не все селектируемые признаки, проявляющиеся на уровне клеток, сохраняются на уровне растений регенерантов. • Причины: • 1) некоторая часть изменений не затрагивает генетический аппарат клетки, поэтому не сохраняется у потомков; • 2) генетические изменения могут элиминироваться в процессе дифференциации и мейоза; • 3) функция мутированного гена может быть ограничена состоянием дифференцируемых и культивируемых клеток; • 4) мутация одного гена может сопровождаться активацией различных генов, кодирующих изоферменты; • 5) часть генотипов неспособна регенерировать нормальные фертильные растения. 80
• Не все селектируемые признаки, проявляющиеся на уровне клеток, сохраняются на уровне растений регенерантов. • Причины: • 1) некоторая часть изменений не затрагивает генетический аппарат клетки, поэтому не сохраняется у потомков; • 2) генетические изменения могут элиминироваться в процессе дифференциации и мейоза; • 3) функция мутированного гена может быть ограничена состоянием дифференцируемых и культивируемых клеток; • 4) мутация одного гена может сопровождаться активацией различных генов, кодирующих изоферменты; • 5) часть генотипов неспособна регенерировать нормальные фертильные растения. 80
 Недостаточно также биохимических и молекулярных маркеров, которые коррелировали бы с этими признаками на уровне целых растений. Не все селектируемые признаки, проявляющиеся на уровне клеток, сохраняются на уровне растений регенерантов. Тому несколько причин: некоторая часть изменений не затрагивает генетический аппарат клетки, поэтому не сохраняется у потомков; генетические изменения могут элиминироваться в процессе дифференциации и мейоза; функция мутированного гена может быть ограничена состоянием дифференцируемых и культивируемых клеток; мутация одного гена может сопровождаться активацией различных генов, кодирующих изоферменты; часть генотипов неспособна регенерировать нормальные фертильные растения. 81
Недостаточно также биохимических и молекулярных маркеров, которые коррелировали бы с этими признаками на уровне целых растений. Не все селектируемые признаки, проявляющиеся на уровне клеток, сохраняются на уровне растений регенерантов. Тому несколько причин: некоторая часть изменений не затрагивает генетический аппарат клетки, поэтому не сохраняется у потомков; генетические изменения могут элиминироваться в процессе дифференциации и мейоза; функция мутированного гена может быть ограничена состоянием дифференцируемых и культивируемых клеток; мутация одного гена может сопровождаться активацией различных генов, кодирующих изоферменты; часть генотипов неспособна регенерировать нормальные фертильные растения. 81
 Методы микроклонального размножения: • • Активация уже существующих в растении меристем (апекс стебля, пазушные и спящие почки стебля). Индукция возникновения почек или эмбриоидов de novo: – образование адвентивных побегов непосредственно тканями экспланта; – индукция соматического эмбриогенеза; – дифференциация адвентивных почек в первичной и пересадочной каллусной ткани. далее 82
Методы микроклонального размножения: • • Активация уже существующих в растении меристем (апекс стебля, пазушные и спящие почки стебля). Индукция возникновения почек или эмбриоидов de novo: – образование адвентивных побегов непосредственно тканями экспланта; – индукция соматического эмбриогенеза; – дифференциация адвентивных почек в первичной и пересадочной каллусной ткани. далее 82
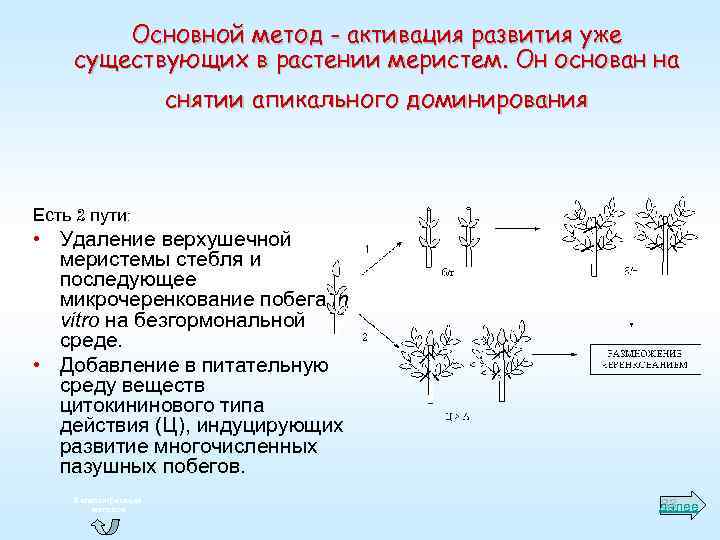 Основной метод - активация развития уже существующих в растении меристем. Он основан на снятии апикального доминирования Есть 2 пути: • Удаление верхушечной меристемы стебля и последующее микрочеренкование побега in vitro на безгормональной среде. • Добавление в питательную среду веществ цитокининового типа действия (Ц), индуцирующих развитие многочисленных пазушных побегов. К классификации методов 83 далее
Основной метод - активация развития уже существующих в растении меристем. Он основан на снятии апикального доминирования Есть 2 пути: • Удаление верхушечной меристемы стебля и последующее микрочеренкование побега in vitro на безгормональной среде. • Добавление в питательную среду веществ цитокининового типа действия (Ц), индуцирующих развитие многочисленных пазушных побегов. К классификации методов 83 далее
 Этапы размножения: 1. Выбор растения-донора, изолирование эксплантов и получение хорошо растущей стерильной культуры. 2. Собственно микроразмножение, когда достигается получение максимального количества меристематических клонов. 3. Укоренение размноженных побегов с последующей адаптацией их к почвенным условиям. 4. Выращивание растений в условиях теплицы и подготовка их к реализации или посадке в поле. далее 84
Этапы размножения: 1. Выбор растения-донора, изолирование эксплантов и получение хорошо растущей стерильной культуры. 2. Собственно микроразмножение, когда достигается получение максимального количества меристематических клонов. 3. Укоренение размноженных побегов с последующей адаптацией их к почвенным условиям. 4. Выращивание растений в условиях теплицы и подготовка их к реализации или посадке в поле. далее 84
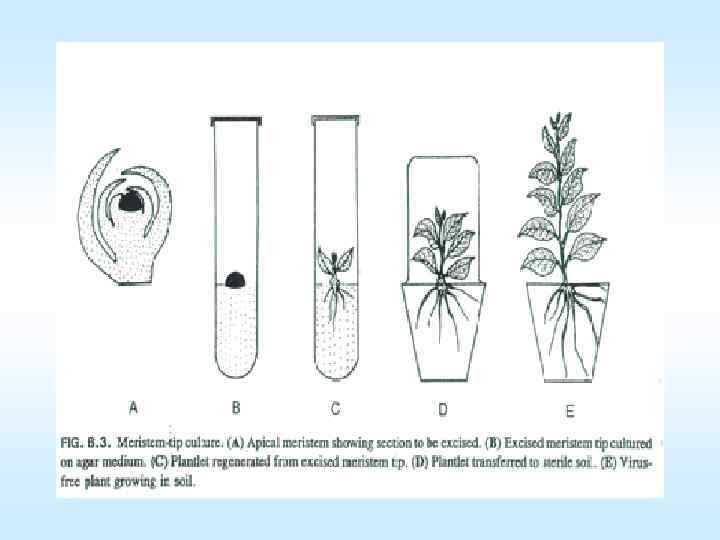
 Клональное микроразмножение и оздоровление растений • • Оздоровление посадочного материала от вирусов Основное преимущество клонального микроразмножения получение генетически однородного, безвирусного посадочного материала. Предположение о возможности отсутствия вирусов в меристематических тканях больных растений впервые было высказано в 1936 г. Чунгом, а позднее, в 1943 г. , и Уайтом. В 1949 г. этот факт был подтвержден экспериментально. В 1952 г. Морелю и Мартену из Национального агрономического института (Франция) удалось получить безвирусные георгины из зараженных растений. Структурной основой используемого на практике явления служит специфика строения точки роста растений: дистальная ее часть, представленная апикальной меристемой, у разных растений имеет средний диаметр 200 мкм и высоту от 20 до 150 мкм. В нижних слоях дифференцирующиеся клетки меристемы образуют прокамбий, дающий начало пучкам проводящей системы. Известно, что успех клонального микроразмножения зависит от меристематического экспланта. При этом отмечается закономерность: чем больше листовых зачатков и тканей, тем легче идут процессы морфогенеза, заканчивающиеся образованием целого растения. Вместе с тем, при таком развитии конуса нарастания увеличивается риск быстрой транспортировки вируса по проводящей системе. Кроме того, даже небольшой меристематический эксплант может содержать вирусы, проникшие в клетки 85 в результате медленного распространения через плазмодесмы.
Клональное микроразмножение и оздоровление растений • • Оздоровление посадочного материала от вирусов Основное преимущество клонального микроразмножения получение генетически однородного, безвирусного посадочного материала. Предположение о возможности отсутствия вирусов в меристематических тканях больных растений впервые было высказано в 1936 г. Чунгом, а позднее, в 1943 г. , и Уайтом. В 1949 г. этот факт был подтвержден экспериментально. В 1952 г. Морелю и Мартену из Национального агрономического института (Франция) удалось получить безвирусные георгины из зараженных растений. Структурной основой используемого на практике явления служит специфика строения точки роста растений: дистальная ее часть, представленная апикальной меристемой, у разных растений имеет средний диаметр 200 мкм и высоту от 20 до 150 мкм. В нижних слоях дифференцирующиеся клетки меристемы образуют прокамбий, дающий начало пучкам проводящей системы. Известно, что успех клонального микроразмножения зависит от меристематического экспланта. При этом отмечается закономерность: чем больше листовых зачатков и тканей, тем легче идут процессы морфогенеза, заканчивающиеся образованием целого растения. Вместе с тем, при таком развитии конуса нарастания увеличивается риск быстрой транспортировки вируса по проводящей системе. Кроме того, даже небольшой меристематический эксплант может содержать вирусы, проникшие в клетки 85 в результате медленного распространения через плазмодесмы.
 Клональное микроразмножение и оздоровление растений • • • Эффективность применения апикальной меристемы в качестве метода оздоровления зараженных вирусами растений может оказаться довольно низкой. Снизить риск попадания вирусов в здоровые ткани можно путем применения предварительной термо или химиотерапии исходных растений. Метод термотерапии применяется как в условиях in vivo, так и in vitro и предусматривает использование горячего сухого воздуха. При этом при высоких температурах, вероятно, разрушаются белковая оболочка и нуклеиновая кислота вируса или высокая температура действует на вирусы через метаболизм растений. При такой температуре начинает преобладать деградация вирусных частиц, а синтез их, наоборот, уменьшается. Растения, подвергающиеся термотерапии, помещают в термокамеры, где температура постепеноо повышается с 25 до 37 о. С. Все остальные режимы обязательно поддерживаются в оптимальном состоянии: освещенность, высокая относительная влажность воздуха, определенный фотопериод. Продолжительность термостатирования зависит от состава вирусов и их термостойкости. Другой способ оздоровления химиотерапия. В питательную среду, на которой культивируют апикальные меристемы, добавляют препарат вирозола в . концентрации 20 50 мг/л Это противовирусный препарат широкого спектра действия. Применение его позволяет увеличить число безвирусных растений с 86 40% до 80 100%.
Клональное микроразмножение и оздоровление растений • • • Эффективность применения апикальной меристемы в качестве метода оздоровления зараженных вирусами растений может оказаться довольно низкой. Снизить риск попадания вирусов в здоровые ткани можно путем применения предварительной термо или химиотерапии исходных растений. Метод термотерапии применяется как в условиях in vivo, так и in vitro и предусматривает использование горячего сухого воздуха. При этом при высоких температурах, вероятно, разрушаются белковая оболочка и нуклеиновая кислота вируса или высокая температура действует на вирусы через метаболизм растений. При такой температуре начинает преобладать деградация вирусных частиц, а синтез их, наоборот, уменьшается. Растения, подвергающиеся термотерапии, помещают в термокамеры, где температура постепеноо повышается с 25 до 37 о. С. Все остальные режимы обязательно поддерживаются в оптимальном состоянии: освещенность, высокая относительная влажность воздуха, определенный фотопериод. Продолжительность термостатирования зависит от состава вирусов и их термостойкости. Другой способ оздоровления химиотерапия. В питательную среду, на которой культивируют апикальные меристемы, добавляют препарат вирозола в . концентрации 20 50 мг/л Это противовирусный препарат широкого спектра действия. Применение его позволяет увеличить число безвирусных растений с 86 40% до 80 100%.
 Микроклональное размножение – размножение растений in vitro, «в пробирке» . Его преимущества перед традиционными способами размножения растений: получение генетически однородного посадочного материала; освобождение растений от вирусов; высокий коэффициент размножения (от 104 для хвойных до 106 - для травянистых растений); сокращение продолжительности селекционного процесса; ускорение перехода растений от ювенильной к репродуктивной фазе развития; размножение растений, трудно размножаемых традиционными способами; возможность проведения работ в течение всего года; возможность автоматизации процесса выращивания. 87
Микроклональное размножение – размножение растений in vitro, «в пробирке» . Его преимущества перед традиционными способами размножения растений: получение генетически однородного посадочного материала; освобождение растений от вирусов; высокий коэффициент размножения (от 104 для хвойных до 106 - для травянистых растений); сокращение продолжительности селекционного процесса; ускорение перехода растений от ювенильной к репродуктивной фазе развития; размножение растений, трудно размножаемых традиционными способами; возможность проведения работ в течение всего года; возможность автоматизации процесса выращивания. 87


