d3f52529eb8ed4c5467f5fcc1781348b.ppt
- Количество слайдов: 22

Что нас объединяет?

Из своего жизненного опыта вы знаете, что многие продукты питания обладают кислым вкусом. Кислый вкус этим продуктам придают кислоты. Кислый вкус лимону придает лимонная кислота, яблоку—яблочная кислота, скисшему молоку—молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.

ТЕМА Кислоты, их состав и названия Классификация кислот

Цели урока: ØПознакомиться с составом, названиями, классификацией и представителями кислот ØСовершенствовать экспериментальные навыки
Страна Кислот г. Информаций H 2 SO 4 , HCl ПТБ г. Номенклатурий Названия кислот. Остров Экспериментальный г. Классификаций HCl, H 2 SO 4 , H 3 PO 4 Станция: Расчетная

Серная кислота

Хлороводородная (соляная) кислота

H 3 BO 3 Борная кислота

Уксусная кислота
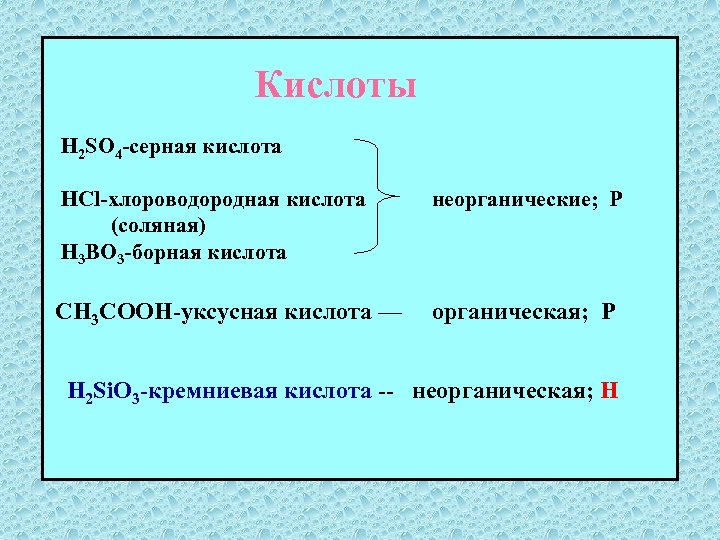
Кислоты H 2 SO 4 -серная кислота HCl-хлороводородная кислота (соляная) H 3 BO 3 -борная кислота неорганические; Р CH 3 COOH-уксусная кислота — органическая; Р H 2 Si. O 3 -кремниевая кислота -- неорганическая; Н
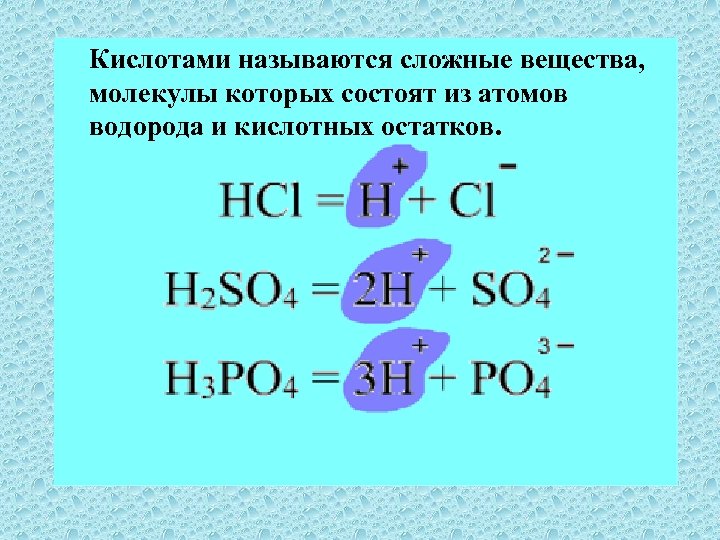
Кислотами называются сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков.

Формулы кислот H 2 OSOHBr. Na 2 CО 3 Mg. Ba. H 2 CO 3 SO 4 KOH H 3 PO 4 P 2 O 5 Ca. H 2 SKPHNO 2 CS 2 NH 3 O 3 C HCl. Ba. SHKSHH 2 Na 2 OH 2 Si. O 3 Na. Cl. H 2 SO 4 1 балл

По какому признаку кислоты разделены на группы HF - фтороводородная HCl - хлороводородная HBr - бромоводородная HI - йодоводородная H 2 S - сероводородная HNO 3 - азотная HNO 2 - азотистая HCl. O 4 - хлорная H 2 SO 4 - серная H 2 SO 3 - сернистая H 2 CO 3 - угольная H 2 Si. O 3 - кремниевая H 3 PO 4 - фосфорная H 3 BO 3 - борная
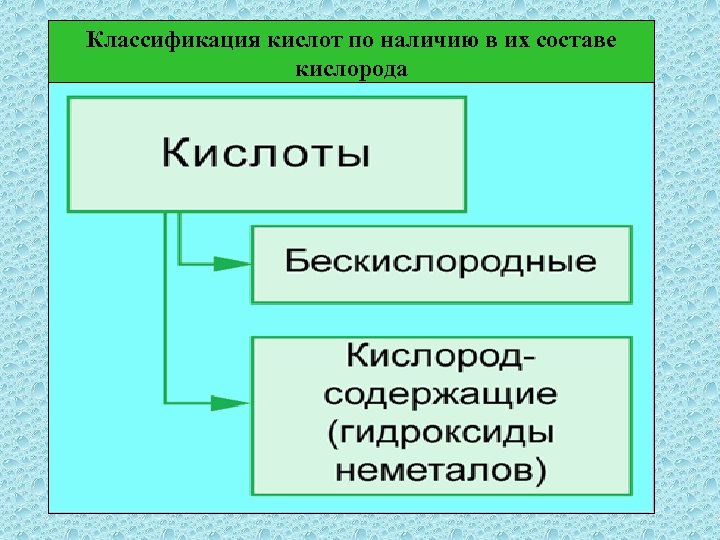
Классификация кислот по наличию в их составе кислорода

Классификация кислот Кислородсодержащие Бескислородные Одноосновные Двухосновные Трехосновные 1 балл

Классификация кислот Кислородсодержащие - HNO 3, H 2 SO 4, H 3 PO 4 Бескислородные - HCl, HF Одноосновные - HCl, HF, HNO 3 Двухосновные - H 2 SO 4 Трехосновные - H 3 PO 4 1 балл
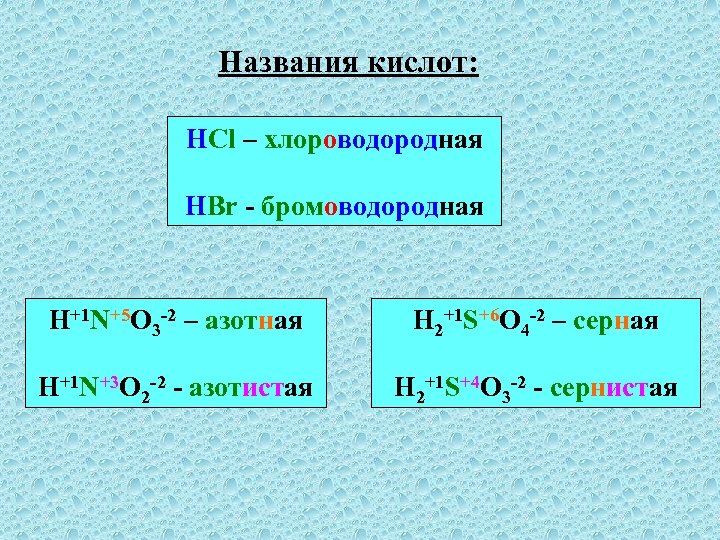
Названия кислот: HCl – хлороводородная HBr - бромоводородная H+1 N+5 O 3 -2 – азотная H 2+1 S+6 O 4 -2 – серная H+1 N+3 O 2 -2 - азотистая H 2+1 S+4 O 3 -2 - сернистая

Характеристика кислот H 2 S HCl. O 4 HF H 3 PO 4 сероводородная, бескислородная, двухосновная, растворимая. хлорная, кислородсодержащая, одноосновная, растворимая. фтороводородная, бескислородная, одноосновная, растворимая. фосфорная, кислородсодержащая, трехосновная, растворимая. 1 балл

ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ Едкое вещество— кислота! Разрушает и раздражает кожу, слизистые оболочки. Попавшие на кожу капли раствора кислоты немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды.

Лабораторная работа Распознавание кислот Задание 1: • проведите опыт, согласно инструкции; • сделайте вывод о распознавании кислот среди других растворов. Задание 2: Ø Определите, в каком из пронумерованных стаканов находится раствор лимонной кислоты. 1 балл

1. Рассчитайте молекулярную массу серной кислоты – H 2 SO 4 Ответ: 98 г/моль 2. Расставьте степени окисления: H 2 SO 4 ; HNO 3 ; H 3 PO 4 Ответ: H 2 +1 S+6 O 4 -2 ; H+1 N+5 O 3 -2 ; H 3 +1 P+5 O 4 -2 3. Вычислите количество вещества азотной кислоты (HNO 3 ), массой 87 грамм. n=mM M(HNO 3 ) = 1 + 14 + 16 * 3 = 63 г/моль n = 87 г : 63 г/моль = 1, 4 моль. Ответ: 1, 4 моль.

Домашнее задание: Какие кислоты Вы используете дома? Отчего укусы муравьев так болезненны? § 20 упр. 1, 4 § 20 Консультация учитель или одноклассника
d3f52529eb8ed4c5467f5fcc1781348b.ppt