2011_inorg_medbiol_4.ppt
- Количество слайдов: 42
 Четвертая лекция 1
Четвертая лекция 1
 Кислородсодержащие кислоты и их соли Степень окисления 1+ HXO: HCl. O, HBr. O, HJO Ka = 10 -8 (X = Cl), 10 -9 (X=Br), 10 -11 (X=J) Амфотерные свойства HJO = H+ + JOHJO = OH- + J+, Kb = 10 -10 Ag. NO 3 + J 2 + 2 Py = [J(Py)2]+(NO 3)- + Ag. J (тв) Растворимость J 2 в соляной кислоте увеличивается J 2 + H 2 O = HJ + HJO + HCl = H 2 O + JCl 2
Кислородсодержащие кислоты и их соли Степень окисления 1+ HXO: HCl. O, HBr. O, HJO Ka = 10 -8 (X = Cl), 10 -9 (X=Br), 10 -11 (X=J) Амфотерные свойства HJO = H+ + JOHJO = OH- + J+, Kb = 10 -10 Ag. NO 3 + J 2 + 2 Py = [J(Py)2]+(NO 3)- + Ag. J (тв) Растворимость J 2 в соляной кислоте увеличивается J 2 + H 2 O = HJ + HJO + HCl = H 2 O + JCl 2
 Получение кислот HXO X 2 + H 2 O + Ca. CO 3 (тв) = Ca. X 2 + CO 2 + HXO (X = Cl, Br) J 2 + H 2 O + Hg. O(тв) = Hg. J 2 + 2 HIO Соли подвергаются гидролизу (p. H 7) XO- + H 2 O = HXO + OHКислоты HXO являются сильными окислителями Уменьшение окислительных свойств HCl. O HBr. O HJO Уменьшение скорости ox/red реакций HCl. O HBr. O HJO 3
Получение кислот HXO X 2 + H 2 O + Ca. CO 3 (тв) = Ca. X 2 + CO 2 + HXO (X = Cl, Br) J 2 + H 2 O + Hg. O(тв) = Hg. J 2 + 2 HIO Соли подвергаются гидролизу (p. H 7) XO- + H 2 O = HXO + OHКислоты HXO являются сильными окислителями Уменьшение окислительных свойств HCl. O HBr. O HJO Уменьшение скорости ox/red реакций HCl. O HBr. O HJO 3
 Степень окисления +3 Нет HJO 2 и нет примеров солей Нет HBr. O 2, только ОДИН пример соли Ba(Br. O)2 +2 Br 2 + 4 KOH = Ba(Br. O 2)2 + 4 KBr + 4 H 2 O (0 o. C, p. H = 11, 2) Для кислоты HCl. O 2 и ее солей характерны реакции диспропорционирования (особенно быстро в кислой среде). Соли взрывают!! 4 HCl. O 2 = Cl. O 2 +HCl. O 3 +HCl +H 2 O Получение 2 Cl. O 2 +2 KOH = KCl. O 2 + KCl. O 3 + H 2 O Ba(OH)2 + H 2 O 2 + 2 Cl. O 2 = Ba(Cl. O 2)2 + 2 H 2 O + O 2 Ba(Cl. O 2)2(сусп. ) +H 2 SO 4 (разб. ) = Ba. SO 4(тв)+ HCl. O 2 4
Степень окисления +3 Нет HJO 2 и нет примеров солей Нет HBr. O 2, только ОДИН пример соли Ba(Br. O)2 +2 Br 2 + 4 KOH = Ba(Br. O 2)2 + 4 KBr + 4 H 2 O (0 o. C, p. H = 11, 2) Для кислоты HCl. O 2 и ее солей характерны реакции диспропорционирования (особенно быстро в кислой среде). Соли взрывают!! 4 HCl. O 2 = Cl. O 2 +HCl. O 3 +HCl +H 2 O Получение 2 Cl. O 2 +2 KOH = KCl. O 2 + KCl. O 3 + H 2 O Ba(OH)2 + H 2 O 2 + 2 Cl. O 2 = Ba(Cl. O 2)2 + 2 H 2 O + O 2 Ba(Cl. O 2)2(сусп. ) +H 2 SO 4 (разб. ) = Ba. SO 4(тв)+ HCl. O 2 4
 Степень окисления +5 Сильные кислоты HXO 3 (X = Cl, Br, J) HCl. O 3 и HBr. O 3 – только растворы (до 40%) HJO 3 – получена твердая и в растворах Обезвоживание (P 4 O 10) HJO 3 HJ 3 O 8 (J 2 O 5. HJO 3) J 2 O 5 Разложение при нагревании 40% р-ров: 3 HCl. O 3 = HCl. O 4 + 2 Cl. O 2 +H 2 O 8 HCl. O 3 = 4 HCl. O 4 + 2 Cl 2 + 3 O 2 +2 H 2 O 4 HBr. O 3 = 2 Br 2 + 5 O 2 + 2 H 2 O 5
Степень окисления +5 Сильные кислоты HXO 3 (X = Cl, Br, J) HCl. O 3 и HBr. O 3 – только растворы (до 40%) HJO 3 – получена твердая и в растворах Обезвоживание (P 4 O 10) HJO 3 HJ 3 O 8 (J 2 O 5. HJO 3) J 2 O 5 Разложение при нагревании 40% р-ров: 3 HCl. O 3 = HCl. O 4 + 2 Cl. O 2 +H 2 O 8 HCl. O 3 = 4 HCl. O 4 + 2 Cl 2 + 3 O 2 +2 H 2 O 4 HBr. O 3 = 2 Br 2 + 5 O 2 + 2 H 2 O 5
 Получение соединений X(+5) ХЛОРАТЫ Электрохимическое окисление хлоридов KCl +3 H 2 O = KCl. O 3 (анод) + 3 H 2(катод) Или: 6 KOH (гор. р-р) + 3 Cl 2 = KCl. O 3 + 5 KCl +3 H 2 O БРОМАТЫ Br 2 + 5 Cl 2 + 12 KOH = 2 KBr. O 3 + 10 KCl +6 H 2 O KBr + 3 Cl 2 +6 KOH = KBr. O 3 + 6 KCl + 3 H 2 O ИОДАТЫ J 2 (тв) + 10 HNO 3(конц) = 2 HJO 3 + 10 NO 2 +4 H 2 O 6
Получение соединений X(+5) ХЛОРАТЫ Электрохимическое окисление хлоридов KCl +3 H 2 O = KCl. O 3 (анод) + 3 H 2(катод) Или: 6 KOH (гор. р-р) + 3 Cl 2 = KCl. O 3 + 5 KCl +3 H 2 O БРОМАТЫ Br 2 + 5 Cl 2 + 12 KOH = 2 KBr. O 3 + 10 KCl +6 H 2 O KBr + 3 Cl 2 +6 KOH = KBr. O 3 + 6 KCl + 3 H 2 O ИОДАТЫ J 2 (тв) + 10 HNO 3(конц) = 2 HJO 3 + 10 NO 2 +4 H 2 O 6
 Бертолетова соль (хлорат калия) Впервые получена Клодом Бертолле в 1786 году при пропускании хлора через горячий концентрированный раствор гидроксида калия: 2 KOH + Cl 2 = KCl + KCl. O + H 2 O; 3 KCl. O = KCl. O 3 + 2 KCl, Смеси хлората калия с восстановителями ( фосфором, серой, органическими соединениями) взрывчаты и чувствительны к трению и ударам, чувствительность повышается в присутствии броматов и солей аммония. 7
Бертолетова соль (хлорат калия) Впервые получена Клодом Бертолле в 1786 году при пропускании хлора через горячий концентрированный раствор гидроксида калия: 2 KOH + Cl 2 = KCl + KCl. O + H 2 O; 3 KCl. O = KCl. O 3 + 2 KCl, Смеси хлората калия с восстановителями ( фосфором, серой, органическими соединениями) взрывчаты и чувствительны к трению и ударам, чувствительность повышается в присутствии броматов и солей аммония. 7
 Ox/red свойства X(+5) Все X(+5)– сильные окислители, как правило, восстанавливаются до XKCl. O 3(тв) + 6 HCl (конц) = 3 Cl 2 + 3 H 2 O + KCl 4 KCl. O 3(тв) + C 6 H 12 O 6(тв) = 4 KCl + 6 CO 2 + 6 H 2 O 10 KCl. O 3(тв) + 12 P(тв) = 10 KCl + 3 P 4 O 10 8
Ox/red свойства X(+5) Все X(+5)– сильные окислители, как правило, восстанавливаются до XKCl. O 3(тв) + 6 HCl (конц) = 3 Cl 2 + 3 H 2 O + KCl 4 KCl. O 3(тв) + C 6 H 12 O 6(тв) = 4 KCl + 6 CO 2 + 6 H 2 O 10 KCl. O 3(тв) + 12 P(тв) = 10 KCl + 3 P 4 O 10 8
 Разложение твердых солей при нагревании 4 KCl. O 3 = 3 KCl. O 4 + KCl (400 o. C) Лабораторный способ получения О 2 2 KCl. O 3 = 2 KCl + 3 O 2 (100 o. C, Mn. O 2) Нагревание до 300 – 350 о. С 2 KJO 3 = 2 KJ + 3 O 2 2 Cu(Br. O 3)2 = 2 Cu. O + Br 2 +5 O 2 9
Разложение твердых солей при нагревании 4 KCl. O 3 = 3 KCl. O 4 + KCl (400 o. C) Лабораторный способ получения О 2 2 KCl. O 3 = 2 KCl + 3 O 2 (100 o. C, Mn. O 2) Нагревание до 300 – 350 о. С 2 KJO 3 = 2 KJ + 3 O 2 2 Cu(Br. O 3)2 = 2 Cu. O + Br 2 +5 O 2 9
 Соединения Х(+7) HCl. O 4 – получены 100% растворы (взрывоопасно!), сильная кислота HBr. O 4 – получены 100% растворы (взрывоопасно!), сильная кислота HJO 4 – метаиодная кислота, Ka = 3. 10 -2 H 5 JO 6 – ортоиодная кислота, Ka 1 = 2. 10 -2; Ka 2 = 10 -9 Растворимые соли Na. XO 4, Na. H 4 JO 6, Na 2 H 3 JO 6 Нерастворимые соли KCl. O 4, Ag 5 JO 6, Ba 5(JO 6)2, 10 Na 3 H 2 JO 6
Соединения Х(+7) HCl. O 4 – получены 100% растворы (взрывоопасно!), сильная кислота HBr. O 4 – получены 100% растворы (взрывоопасно!), сильная кислота HJO 4 – метаиодная кислота, Ka = 3. 10 -2 H 5 JO 6 – ортоиодная кислота, Ka 1 = 2. 10 -2; Ka 2 = 10 -9 Растворимые соли Na. XO 4, Na. H 4 JO 6, Na 2 H 3 JO 6 Нерастворимые соли KCl. O 4, Ag 5 JO 6, Ba 5(JO 6)2, 10 Na 3 H 2 JO 6
 Получение соединений X(+7) Электролиз XO 3 - + H 2 O = XO 4 -(анод) + H 2(катод) Реакции в растворах: KBr. O 3 + O 3 = KBr. O 4 +O 2 1968 год: облучение нейтронами Rb 2 Se. O 4 82 Se + n = 83 Se = β + 83 Br Na. JO 3+ Cl 2 +4 Na. OH = Na 3 H 2 JO 6 + 2 Na. Cl + H 2 O 11
Получение соединений X(+7) Электролиз XO 3 - + H 2 O = XO 4 -(анод) + H 2(катод) Реакции в растворах: KBr. O 3 + O 3 = KBr. O 4 +O 2 1968 год: облучение нейтронами Rb 2 Se. O 4 82 Se + n = 83 Se = β + 83 Br Na. JO 3+ Cl 2 +4 Na. OH = Na 3 H 2 JO 6 + 2 Na. Cl + H 2 O 11
 Свойства соединений X(+7) Проявляют сильные окислительные свойства при нагревании (расплавы) ПЕРХЛОРАТЫ ВЗРЫВАЮТСЯ!!!!!!! KCl. O 4(тв) = KCl + 2 O 2 (выше 500 о. С) 2 NH 4 Cl. O 4(тв) = N 2 + Cl 2 + 2 O 2 + 4 H 2 O (ВЗРЫВ при 200 о. С) 12
Свойства соединений X(+7) Проявляют сильные окислительные свойства при нагревании (расплавы) ПЕРХЛОРАТЫ ВЗРЫВАЮТСЯ!!!!!!! KCl. O 4(тв) = KCl + 2 O 2 (выше 500 о. С) 2 NH 4 Cl. O 4(тв) = N 2 + Cl 2 + 2 O 2 + 4 H 2 O (ВЗРЫВ при 200 о. С) 12
 Межгалоидные соединения XY XY 3 XY 5 XY 7 Cl. F 3 Cl. F 5 газ Br. F 3 Br. F 5 жидкость Агрегатное состояние IF (IF 3)n IF 5 IF 7 жидкость (неуст. ) Кристаллические вещества Хлориды: Br. Cl, JCl 3(J 2 Cl 6) Бромиды: JBr JCl + H 2 O = HCl + HJO 13
Межгалоидные соединения XY XY 3 XY 5 XY 7 Cl. F 3 Cl. F 5 газ Br. F 3 Br. F 5 жидкость Агрегатное состояние IF (IF 3)n IF 5 IF 7 жидкость (неуст. ) Кристаллические вещества Хлориды: Br. Cl, JCl 3(J 2 Cl 6) Бромиды: JBr JCl + H 2 O = HCl + HJO 13
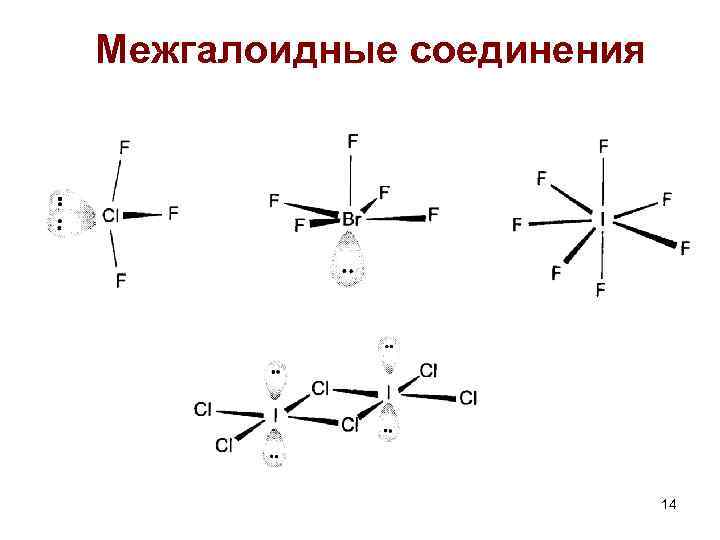 Межгалоидные соединения 14
Межгалоидные соединения 14
 Межгалоидные соединения Чаще всего используют Cl. F 3 и Br. F 3 Окислители, бурно реагируют с органикой (взрыв), горит асбест, вытесняют кислород из оксидов. 2 Co 3 O 4 + 6 Cl. F 3 = 6 Co. F 3 + 3 Cl 2 + 4 O 2 Используют в промышленности для получения UF 6 UF 4 + Cl. F 3 = UF 6 + Cl. F 15
Межгалоидные соединения Чаще всего используют Cl. F 3 и Br. F 3 Окислители, бурно реагируют с органикой (взрыв), горит асбест, вытесняют кислород из оксидов. 2 Co 3 O 4 + 6 Cl. F 3 = 6 Co. F 3 + 3 Cl 2 + 4 O 2 Используют в промышленности для получения UF 6 UF 4 + Cl. F 3 = UF 6 + Cl. F 15
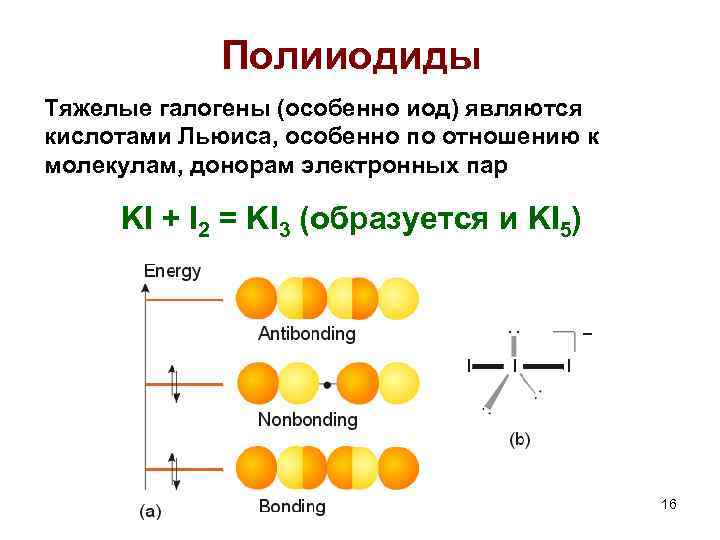 Полииодиды Тяжелые галогены (особенно иод) являются кислотами Льюиса, особенно по отношению к молекулам, донорам электронных пар KI + I 2 = KI 3 (образуется и KI 5) 16
Полииодиды Тяжелые галогены (особенно иод) являются кислотами Льюиса, особенно по отношению к молекулам, донорам электронных пар KI + I 2 = KI 3 (образуется и KI 5) 16
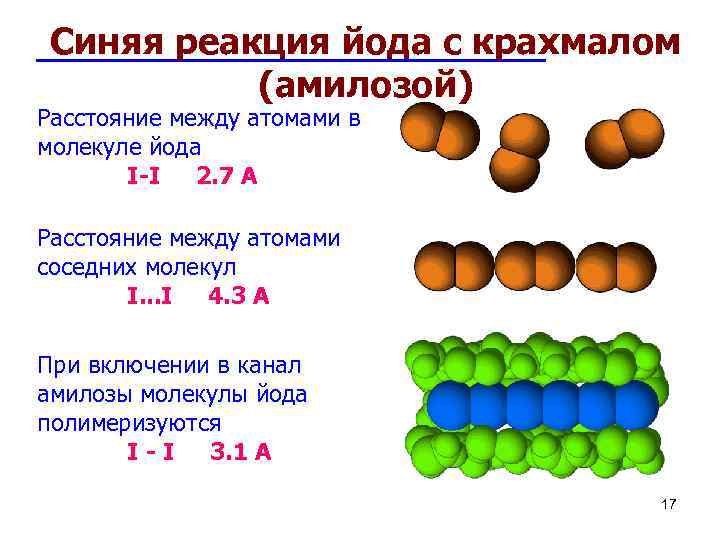 1 7 Синяя реакция йода с крахмалом (амилозой) Расстояние между атомами в молекуле йода I-I 2. 7 A Расстояние между атомами соседних молекул I. . . I 4. 3 A При включении в канал амилозы молекулы йода полимеризуются I - I 3. 1 A 17
1 7 Синяя реакция йода с крахмалом (амилозой) Расстояние между атомами в молекуле йода I-I 2. 7 A Расстояние между атомами соседних молекул I. . . I 4. 3 A При включении в канал амилозы молекулы йода полимеризуются I - I 3. 1 A 17
 Побочная подгруппа VII группы периодической системы 18
Побочная подгруппа VII группы периодической системы 18
 Mn, Tc, Re (n-1)d 5 ns 2 Электро отриц. Степени окисления Mn 1, 60 0, +2, +3, +4, (+5), +6, +7 Tc 1, 36 0, (+3), +4, (+5), +6, +7 Re 1, 46 0, (+3), +4, (+5), +6, +7 Свойства Tc и Re очень похожи и сильно отличаюся от свойств Mn 19
Mn, Tc, Re (n-1)d 5 ns 2 Электро отриц. Степени окисления Mn 1, 60 0, +2, +3, +4, (+5), +6, +7 Tc 1, 36 0, (+3), +4, (+5), +6, +7 Re 1, 46 0, (+3), +4, (+5), +6, +7 Свойства Tc и Re очень похожи и сильно отличаюся от свойств Mn 19
 Содержание в земной коре и минералы Mn – 15 место Mn. O 2. x. H 2 O (пиролюзит), Mn 2 O 3 (браунит), Tc – первый искуственный элемент, 97 Tc: t = 2, 6. 106 лет 1/2 Re – 81 место, очень редкий и рассеянный 20
Содержание в земной коре и минералы Mn – 15 место Mn. O 2. x. H 2 O (пиролюзит), Mn 2 O 3 (браунит), Tc – первый искуственный элемент, 97 Tc: t = 2, 6. 106 лет 1/2 Re – 81 место, очень редкий и рассеянный 20
 Открытие элементов • Mn – шведы К. Шееле и Ш. Ган в 1774 г. Мангановый камень (пиролюзит) ремесленники добавляли в стекло • Tc – в 1871 г. Д. И. Менделеев предсказал существование экамарганца; итальянцы Сегре и Перрье получили в 1936 г. 98 Mo + 2 D = 99 Tc + 1 n • Re – в 1925 г. немцы супруги Ноддак. По имени Рейнской провинции. 21
Открытие элементов • Mn – шведы К. Шееле и Ш. Ган в 1774 г. Мангановый камень (пиролюзит) ремесленники добавляли в стекло • Tc – в 1871 г. Д. И. Менделеев предсказал существование экамарганца; итальянцы Сегре и Перрье получили в 1936 г. 98 Mo + 2 D = 99 Tc + 1 n • Re – в 1925 г. немцы супруги Ноддак. По имени Рейнской провинции. 21
 Получение • Дешевый метод Mn. O 2 + Fe 2 O 3 +5 C = Mn + 2 Fe + 5 CO • Дорогой метод – алюмотермия 3 Mn. O 2. x. H 2 O = Mn 3 O 4 + O 2 +3 x. H 2 O 3 Mn 3 O 4 + 8 Al = 9 Mn + 4 Al 2 O 3 22
Получение • Дешевый метод Mn. O 2 + Fe 2 O 3 +5 C = Mn + 2 Fe + 5 CO • Дорогой метод – алюмотермия 3 Mn. O 2. x. H 2 O = Mn 3 O 4 + O 2 +3 x. H 2 O 3 Mn 3 O 4 + 8 Al = 9 Mn + 4 Al 2 O 3 22
 Применение • Mn – марганцовые стали (твердость, износоустойчивость). Микроудобрения • Tc – радиодиагностика • Re – сплавы (жаропрочность, кислотоустойчивость), катализатор гидрирования 23
Применение • Mn – марганцовые стали (твердость, износоустойчивость). Микроудобрения • Tc – радиодиагностика • Re – сплавы (жаропрочность, кислотоустойчивость), катализатор гидрирования 23
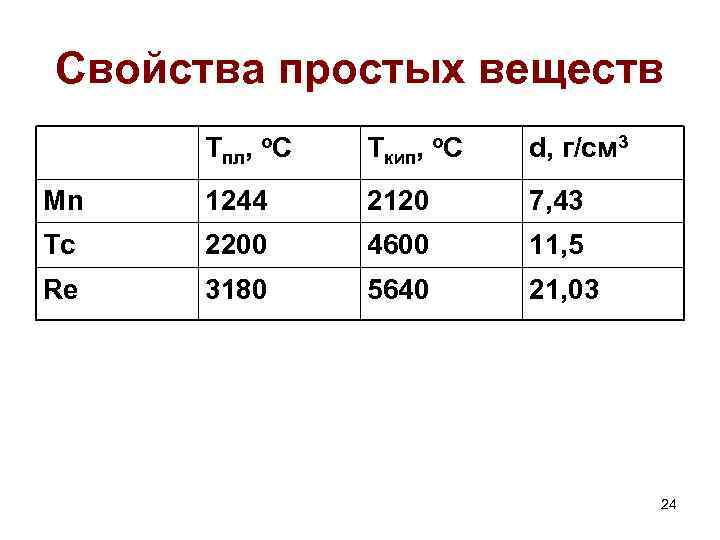 Свойства простых веществ Тпл, о. С Ткип, о. С d, г/см 3 Mn 1244 2120 7, 43 Tc 2200 4600 11, 5 Re 3180 5640 21, 03 24
Свойства простых веществ Тпл, о. С Ткип, о. С d, г/см 3 Mn 1244 2120 7, 43 Tc 2200 4600 11, 5 Re 3180 5640 21, 03 24
 Хим. cвойства простых веществ Положение в ряду напряж. металлов …. Mg Mn Zn…H Cu Tc Re… Mn +2 HCl = Mn. Cl 2 + H 2 E 0 0 Mn + 4 HNO 3(конц)= Mn(NO 3)2 +2 NO 2 +2 H 2 O 4 Re + 4 KOH +7 O 2 = 4 KRe. O 4 +2 H 2 O (расплав) Re + 7 HNO 3(конц)= HRe. O 4 +7 NO 2 +3 H 2 O 2 Re + 7 H 2 O 2 = 2 HRe. O 4 +6 H 2 O 25
Хим. cвойства простых веществ Положение в ряду напряж. металлов …. Mg Mn Zn…H Cu Tc Re… Mn +2 HCl = Mn. Cl 2 + H 2 E 0 0 Mn + 4 HNO 3(конц)= Mn(NO 3)2 +2 NO 2 +2 H 2 O 4 Re + 4 KOH +7 O 2 = 4 KRe. O 4 +2 H 2 O (расплав) Re + 7 HNO 3(конц)= HRe. O 4 +7 NO 2 +3 H 2 O 2 Re + 7 H 2 O 2 = 2 HRe. O 4 +6 H 2 O 25
 ОПЫТЫ ! 26
ОПЫТЫ ! 26
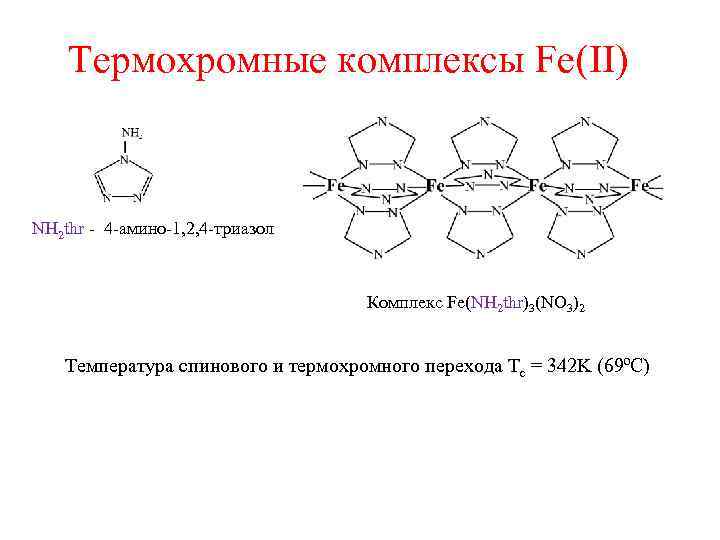 Термохромные комплексы Fe(II) NH 2 thr - 4 -амино-1, 2, 4 -триазол Комплекс Fe(NH 2 thr)3(NO 3)2 Температура спинового и термохромного перехода Tc = 342 K (69ºC)
Термохромные комплексы Fe(II) NH 2 thr - 4 -амино-1, 2, 4 -триазол Комплекс Fe(NH 2 thr)3(NO 3)2 Температура спинового и термохромного перехода Tc = 342 K (69ºC)
 Растворение малорастворимых осадков Ag за счет комплексообразования • • Ag+ + Cl- → Ag. Cl↓ ПРAg. Cl = 1, 7∙ 10 -10 Ag. Cl + 2 NH 3 →[Ag(NH 3)2]+ + Cl. K [Ag(NH 3)2] = 9, 3 ∙ 10 -8 [Ag(NH 3)2]+ + Br- → Ag. Br↓ + 2 NH 3 ПРAg. Br = 5, 0∙ 10 -13 Ag. Br + 2 S 2 O 32 - → [Ag(S 2 O 3)2]3 - + Br- K[Ag(S 2 O 3)2] = 3, 5 ∙ 10 -14 [Ag(S 2 O 3)2]3 - + I- → Ag. I↓ + 2 S 2 O 32 ПPAg. I = 8, 1∙ 10 -17 Ag. I + 2 S 2 O 32 - (избыток) → [Ag(S 2 O 3)2]3 - + I 2[Ag(S 2 O 3)2]3 - + S 2 - → Ag 2 S↓ + 4 S 2 O 32 - ПР Ag 2 S= 5, 0∙ 10 -51 KAg. L 2 = [Ag+][L]2/[Ag. L 2] ПРAg. L’ = [Ag+][L’]
Растворение малорастворимых осадков Ag за счет комплексообразования • • Ag+ + Cl- → Ag. Cl↓ ПРAg. Cl = 1, 7∙ 10 -10 Ag. Cl + 2 NH 3 →[Ag(NH 3)2]+ + Cl. K [Ag(NH 3)2] = 9, 3 ∙ 10 -8 [Ag(NH 3)2]+ + Br- → Ag. Br↓ + 2 NH 3 ПРAg. Br = 5, 0∙ 10 -13 Ag. Br + 2 S 2 O 32 - → [Ag(S 2 O 3)2]3 - + Br- K[Ag(S 2 O 3)2] = 3, 5 ∙ 10 -14 [Ag(S 2 O 3)2]3 - + I- → Ag. I↓ + 2 S 2 O 32 ПPAg. I = 8, 1∙ 10 -17 Ag. I + 2 S 2 O 32 - (избыток) → [Ag(S 2 O 3)2]3 - + I 2[Ag(S 2 O 3)2]3 - + S 2 - → Ag 2 S↓ + 4 S 2 O 32 - ПР Ag 2 S= 5, 0∙ 10 -51 KAg. L 2 = [Ag+][L]2/[Ag. L 2] ПРAg. L’ = [Ag+][L’]
 Сравнение восстановительных свойств галогенводородов KCl + H 2 SO 4 → KHSO 4 + HCl 2 KBr + 2 H 2 SO 4 → K 2 SO 4 + Br 2 + SO 2↑ + H 2 O 8 KI + 5 H 2 SO 4 → 4 K 2 SO 4 + 4 I 2 + H 2 S + H 2 O
Сравнение восстановительных свойств галогенводородов KCl + H 2 SO 4 → KHSO 4 + HCl 2 KBr + 2 H 2 SO 4 → K 2 SO 4 + Br 2 + SO 2↑ + H 2 O 8 KI + 5 H 2 SO 4 → 4 K 2 SO 4 + 4 I 2 + H 2 S + H 2 O
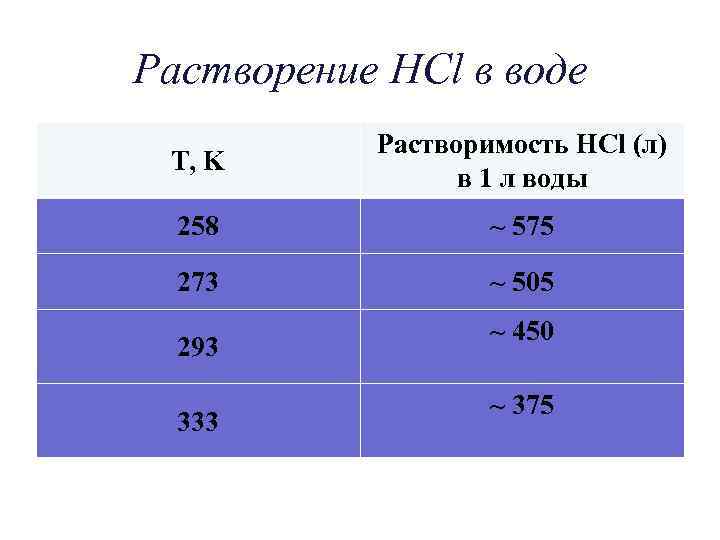 Растворение HCl в воде T, K Растворимость HCl (л) в 1 л воды 258 ~ 575 273 ~ 505 293 333 ~ 450 ~ 375
Растворение HCl в воде T, K Растворимость HCl (л) в 1 л воды 258 ~ 575 273 ~ 505 293 333 ~ 450 ~ 375
 Окислительные свойства KCl. O 3 2 KCl. O 3 + 3 C → 3 CO 2 + 2 KCl 10 KCl. O 3 + 12 P → 3 P 4 O 10 + 10 KCl C 12 H 22 O 11 + 8 KCl. O 3 → 8 KCl + 12 CO 2 + 11 H 2 O
Окислительные свойства KCl. O 3 2 KCl. O 3 + 3 C → 3 CO 2 + 2 KCl 10 KCl. O 3 + 12 P → 3 P 4 O 10 + 10 KCl C 12 H 22 O 11 + 8 KCl. O 3 → 8 KCl + 12 CO 2 + 11 H 2 O
 Реакции при нагревании 3 Mn + 2 O 2 = Mn 3 O 4 (Mn. III 2 O 4) 3 Mn + N 2 = Mn 3 N 2 (1200 o. C) Mn + Cl 2 = Mn. Cl 2 Mn + F 2 = Mn. F 2 (и Mn. F 3) 4 Re + 7 O 2 = 2 Re 2 O 7 (летучий оксид) 2 Re + 5 Cl 2 = 2 Re. Cl 5 Re + 2 S = Re. S 2 32
Реакции при нагревании 3 Mn + 2 O 2 = Mn 3 O 4 (Mn. III 2 O 4) 3 Mn + N 2 = Mn 3 N 2 (1200 o. C) Mn + Cl 2 = Mn. Cl 2 Mn + F 2 = Mn. F 2 (и Mn. F 3) 4 Re + 7 O 2 = 2 Re 2 O 7 (летучий оксид) 2 Re + 5 Cl 2 = 2 Re. Cl 5 Re + 2 S = Re. S 2 32
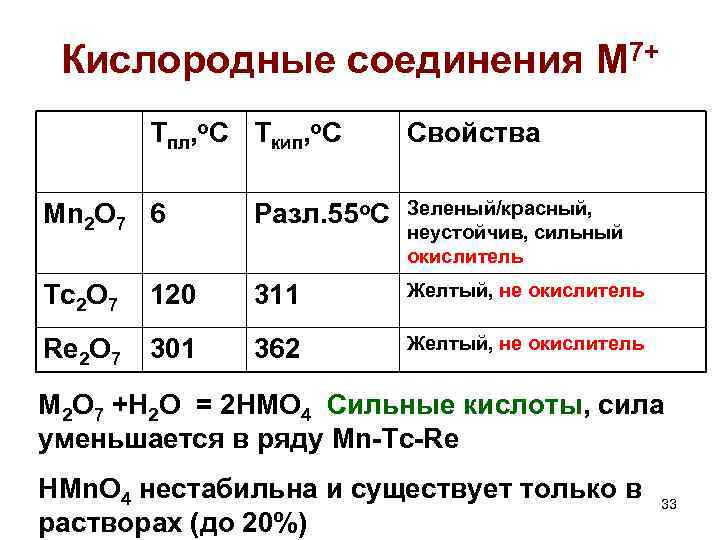 Кислородные соединения M 7+ Тпл, о. С Ткип, о. С Свойства Mn 2 O 7 6 Разл. 55 о. С Зеленый/красный, неустойчив, сильный окислитель Tc 2 O 7 120 311 Желтый, не окислитель Re 2 O 7 301 362 Желтый, не окислитель M 2 О 7 +Н 2 О = 2 НMО 4 Сильные кислоты, сила уменьшается в ряду Mn-Tc-Re HMn. O 4 нестабильна и существует только в растворах (до 20%) 33
Кислородные соединения M 7+ Тпл, о. С Ткип, о. С Свойства Mn 2 O 7 6 Разл. 55 о. С Зеленый/красный, неустойчив, сильный окислитель Tc 2 O 7 120 311 Желтый, не окислитель Re 2 O 7 301 362 Желтый, не окислитель M 2 О 7 +Н 2 О = 2 НMО 4 Сильные кислоты, сила уменьшается в ряду Mn-Tc-Re HMn. O 4 нестабильна и существует только в растворах (до 20%) 33
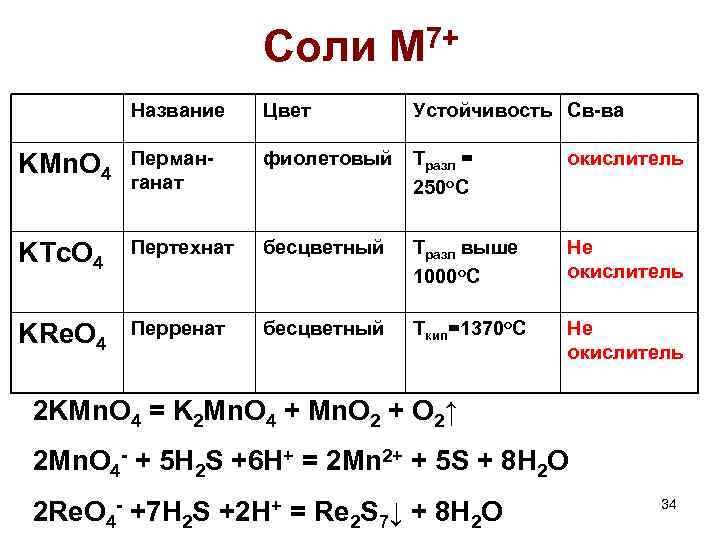 Соли M 7+ Название Цвет Устойчивость Св-ва KMn. O 4 Перманганат фиолетовый Тразл = 250 о. С окислитель KTc. O 4 Пертехнат бесцветный Тразл выше 1000 о. С Не окислитель KRe. O 4 Перренат бесцветный Ткип=1370 о. С Не окислитель 2 KMn. O 4 = K 2 Mn. O 4 + Mn. O 2 + O 2↑ 2 Mn. O 4 - + 5 H 2 S +6 H+ = 2 Mn 2+ + 5 S + 8 H 2 O 2 Re. O 4 - +7 H 2 S +2 H+ = Re 2 S 7↓ + 8 H 2 O 34
Соли M 7+ Название Цвет Устойчивость Св-ва KMn. O 4 Перманганат фиолетовый Тразл = 250 о. С окислитель KTc. O 4 Пертехнат бесцветный Тразл выше 1000 о. С Не окислитель KRe. O 4 Перренат бесцветный Ткип=1370 о. С Не окислитель 2 KMn. O 4 = K 2 Mn. O 4 + Mn. O 2 + O 2↑ 2 Mn. O 4 - + 5 H 2 S +6 H+ = 2 Mn 2+ + 5 S + 8 H 2 O 2 Re. O 4 - +7 H 2 S +2 H+ = Re 2 S 7↓ + 8 H 2 O 34
 KMn. O 4 как окислитель Среда p. H<7 p. H>>7 Продукт восстановления Mn 2+ Mn. O 2↓ Mn. O 42 - Цвет бесцветный бурый зеленый Конпропорционирование 3 Mn. SO 4 +2 KMn. O 4 + 2 H 2 O = 5 Mn. O 2 ↓ +K 2 SO 4 +2 H 2 SO 4 35
KMn. O 4 как окислитель Среда p. H<7 p. H>>7 Продукт восстановления Mn 2+ Mn. O 2↓ Mn. O 42 - Цвет бесцветный бурый зеленый Конпропорционирование 3 Mn. SO 4 +2 KMn. O 4 + 2 H 2 O = 5 Mn. O 2 ↓ +K 2 SO 4 +2 H 2 SO 4 35
 Получение KMn. O 4 1) Щелочное плавление пиролюзита: 3 Mn. O 2 + KCl. O 3 + 6 KOH = 3 K 2 Mn. O 4 + KCl + 3 H 2 O 2) Окисление до перманганата : Cl 2, O 3, Pb. O 2, (NH 4)2 S 2 O 8, KBi. O 3, Xe. F 4 Экономично электрохимическое окисление: КАТОД: 2 H 2 O + 2 e = H 2 + 2 OHАНОД: Mn. O 4 2 - - e = Mn. O 4 2 K 2 Mn. O 4 + 2 H 2 O = 2 KMn. O 4 +2 KOH +H 2↑ 36
Получение KMn. O 4 1) Щелочное плавление пиролюзита: 3 Mn. O 2 + KCl. O 3 + 6 KOH = 3 K 2 Mn. O 4 + KCl + 3 H 2 O 2) Окисление до перманганата : Cl 2, O 3, Pb. O 2, (NH 4)2 S 2 O 8, KBi. O 3, Xe. F 4 Экономично электрохимическое окисление: КАТОД: 2 H 2 O + 2 e = H 2 + 2 OHАНОД: Mn. O 4 2 - - e = Mn. O 4 2 K 2 Mn. O 4 + 2 H 2 O = 2 KMn. O 4 +2 KOH +H 2↑ 36
 Кислородные соединения Mn 6+ Mn. O 3 и H 2 Mn. O 4 – не известны Соли – манганаты (зеленый цвет) Манганаты склонны диспропорционировать, особенно в кислой среде 3 Mn. O 42 - + 4 H+ = 2 Mn. O 4 - + Mn. O 2↓ + 2 H 2 O (пропускание CO 2) 37
Кислородные соединения Mn 6+ Mn. O 3 и H 2 Mn. O 4 – не известны Соли – манганаты (зеленый цвет) Манганаты склонны диспропорционировать, особенно в кислой среде 3 Mn. O 42 - + 4 H+ = 2 Mn. O 4 - + Mn. O 2↓ + 2 H 2 O (пропускание CO 2) 37
 Кислородные соединения Mn 6+ Манганаты – сильные окислители, особенно в кислой среде, где восстанавливаются до Mn 2+; в щелочной среде восстанавливаются до Mn. O 2 Окисление органики 6 K 2 Mn. O 4 +C 2 H 5 OH +H 2 O = 6 Mn. O 2↓+ 2 K 2 CO 3 +8 KOH В зависимости от условий этанол можно окислить и до альдегида или кислоты 38
Кислородные соединения Mn 6+ Манганаты – сильные окислители, особенно в кислой среде, где восстанавливаются до Mn 2+; в щелочной среде восстанавливаются до Mn. O 2 Окисление органики 6 K 2 Mn. O 4 +C 2 H 5 OH +H 2 O = 6 Mn. O 2↓+ 2 K 2 CO 3 +8 KOH В зависимости от условий этанол можно окислить и до альдегида или кислоты 38
 Кислородные соединения Mn 4+ Mn. O 2 – важнейшее соединение Свойства окислителя (при нагревании): Mn. O 2 + 4 HClконц = Mn. Cl 2 + Cl 2↑ + 2 H 2 O 2 Mn. O 2 + 2 H 2 SO 4 = 2 Mn. SO 4 +O 2↑ +2 H 2 O Окисление до манганатов: (сплавление) 3 Mn. O 2 + KCl. O 3 + 3 K 2 CO 3 = 3 K 2 Mn. O 4 + KCl +3 CO 2 (KNO 3) 39
Кислородные соединения Mn 4+ Mn. O 2 – важнейшее соединение Свойства окислителя (при нагревании): Mn. O 2 + 4 HClконц = Mn. Cl 2 + Cl 2↑ + 2 H 2 O 2 Mn. O 2 + 2 H 2 SO 4 = 2 Mn. SO 4 +O 2↑ +2 H 2 O Окисление до манганатов: (сплавление) 3 Mn. O 2 + KCl. O 3 + 3 K 2 CO 3 = 3 K 2 Mn. O 4 + KCl +3 CO 2 (KNO 3) 39
 Кислородные соединения Mn 4+ Слабовыраженные амфотерные свойства Mn. O 2 + 4 HF = Mn. F 4 + 2 H 2 O Mn. O 2 + Ca. O = Ca. Mn. O 3 (метаманганат (IV)) Ca. Mn. O 3 + Ca. O = Ca 2 Mn. O 4 (ортоманганат (IV)) 40
Кислородные соединения Mn 4+ Слабовыраженные амфотерные свойства Mn. O 2 + 4 HF = Mn. F 4 + 2 H 2 O Mn. O 2 + Ca. O = Ca. Mn. O 3 (метаманганат (IV)) Ca. Mn. O 3 + Ca. O = Ca 2 Mn. O 4 (ортоманганат (IV)) 40
 Кислородные соединения Mn 2+ Mn. O – серо-зеленый, не растворим в воде Mn. CO 3 = Mn. O + CO 2 (при нагревании) Встречается в природе в виде минерала (розовые кристаллы) родохрозита (марганцевый шпат). Mn. Cl 2 + 2 Na. OH = Mn(OH)2↓ + 2 Na. Cl Mn(OH)2 – белый, окисляется на воздухе, легко растворим в кислотах, растворим в крепких щелочах Mn(OH)2 + H 2 SO 4 = Mn. SO 4 + 2 H 2 O Mn(OH)2 + KOH = K[Mn(OH)3] 41
Кислородные соединения Mn 2+ Mn. O – серо-зеленый, не растворим в воде Mn. CO 3 = Mn. O + CO 2 (при нагревании) Встречается в природе в виде минерала (розовые кристаллы) родохрозита (марганцевый шпат). Mn. Cl 2 + 2 Na. OH = Mn(OH)2↓ + 2 Na. Cl Mn(OH)2 – белый, окисляется на воздухе, легко растворим в кислотах, растворим в крепких щелочах Mn(OH)2 + H 2 SO 4 = Mn. SO 4 + 2 H 2 O Mn(OH)2 + KOH = K[Mn(OH)3] 41
 Соли Mn 2+ Водорастворимые соли: Mn. Cl 2. 4 H 2 O, Mn. SO 4. 5 H 2 O, Mn(NO 3)2. 6 H 2 O – в водных р-рах [Mn(H 2 O)6]2+ Не растворимые соли: Mn. CO 3, Mn. S, Mn. C 2 O 4 Mn. Cl 2 + (NH 4)2 S = Mn. S↓ + 2 NH 4 Cl Mn. S – темный, при стоянии зеленый ПРMn. S= 10 -10, поэтому не осаждается H 2 S, легко растворим в кислотах 42
Соли Mn 2+ Водорастворимые соли: Mn. Cl 2. 4 H 2 O, Mn. SO 4. 5 H 2 O, Mn(NO 3)2. 6 H 2 O – в водных р-рах [Mn(H 2 O)6]2+ Не растворимые соли: Mn. CO 3, Mn. S, Mn. C 2 O 4 Mn. Cl 2 + (NH 4)2 S = Mn. S↓ + 2 NH 4 Cl Mn. S – темный, при стоянии зеленый ПРMn. S= 10 -10, поэтому не осаждается H 2 S, легко растворим в кислотах 42


