 Чернышова Кристина Владимировна 541 гр.
Чернышова Кристина Владимировна 541 гр.
 Физические свойства • Бесцветная, тяжёлая, нелетучая жидкость • Гигроскопичная (водоотнимающая) • t кип. = 340ºС Н 2 О Сначала вода, потом кислота – иначе случится большая беда!
Физические свойства • Бесцветная, тяжёлая, нелетучая жидкость • Гигроскопичная (водоотнимающая) • t кип. = 340ºС Н 2 О Сначала вода, потом кислота – иначе случится большая беда!
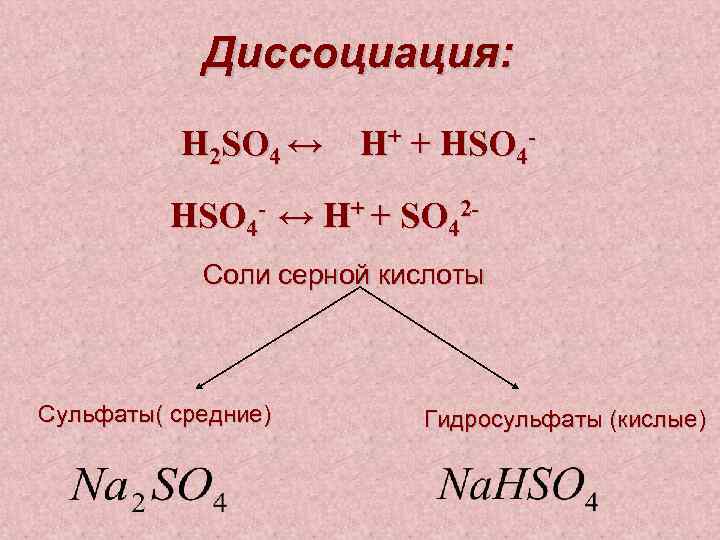 Диссоциация: H 2 SO 4 ↔ H+ + HSO 4 - ↔ H+ + SO 42 Соли серной кислоты Сульфаты( средние) Гидросульфаты (кислые)
Диссоциация: H 2 SO 4 ↔ H+ + HSO 4 - ↔ H+ + SO 42 Соли серной кислоты Сульфаты( средние) Гидросульфаты (кислые)
 Свойства разбавленной серной кислоты. Задание 1 – с металлами: Возьмите две пробирки. В одну пробирку поместите Zn, в другую пробирку поместите Cu, в обе пробирки прилейте раствор серной кислоты. Что наблюдаете? Запишите уравнения химических реакций в окислительно-восстановительном виде. !!! Помним и соблюдаем правила техники безопасности.
Свойства разбавленной серной кислоты. Задание 1 – с металлами: Возьмите две пробирки. В одну пробирку поместите Zn, в другую пробирку поместите Cu, в обе пробирки прилейте раствор серной кислоты. Что наблюдаете? Запишите уравнения химических реакций в окислительно-восстановительном виде. !!! Помним и соблюдаем правила техники безопасности.
 Задание 2 – с оксидами: В пробирку поместите Cu. O, прилейте раствор серной кислоты. Что наблюдаете? Запишите уравнения химических реакций в молекулярном и ионном виде. !!! Помним и соблюдаем правила техники безопасности.
Задание 2 – с оксидами: В пробирку поместите Cu. O, прилейте раствор серной кислоты. Что наблюдаете? Запишите уравнения химических реакций в молекулярном и ионном виде. !!! Помним и соблюдаем правила техники безопасности.
 Задание 3 – с основаниями: В пробирку налейте раствор Na. OH, затем добавьте фенолфталеин. Что наблюдаете? Добавьте раствор серной кислоты. Что наблюдаете? Запишите уравнение химических реакций в молекулярном и ионном виде. !!! Помним и соблюдаем правила техники безопасности.
Задание 3 – с основаниями: В пробирку налейте раствор Na. OH, затем добавьте фенолфталеин. Что наблюдаете? Добавьте раствор серной кислоты. Что наблюдаете? Запишите уравнение химических реакций в молекулярном и ионном виде. !!! Помним и соблюдаем правила техники безопасности.
 Качественная реакция на сульфат ион. Задание 4 - с кислотами: Налить в пробирку 0, 5 мл серной кислоты и прилить несколько капель Ва. Cl 2 Что вы наблюдаете? Запишите уравнение химических реакций в молекулярном и ионном виде. !!! Помним и соблюдаем правила техники безопасности.
Качественная реакция на сульфат ион. Задание 4 - с кислотами: Налить в пробирку 0, 5 мл серной кислоты и прилить несколько капель Ва. Cl 2 Что вы наблюдаете? Запишите уравнение химических реакций в молекулярном и ионном виде. !!! Помним и соблюдаем правила техники безопасности.
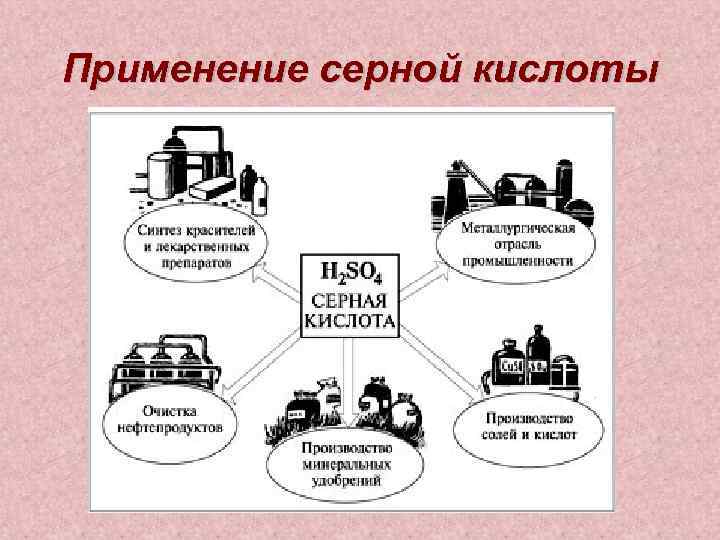 Применение серной кислоты
Применение серной кислоты
 Получение серной кислоты
Получение серной кислоты
 Серная кислота в природе • В одном из 3 кратеров вулкана Малый Семячик (Камчатка) образовалось озеро шириной 500 метров и глубиной 140 метров. Состоящий из прогретого до 40 градусов раствора серной и соляной кислоты средней концентрации.
Серная кислота в природе • В одном из 3 кратеров вулкана Малый Семячик (Камчатка) образовалось озеро шириной 500 метров и глубиной 140 метров. Состоящий из прогретого до 40 градусов раствора серной и соляной кислоты средней концентрации.
 Домашнее задание • § 23 упр. 3, 4 стр. 142
Домашнее задание • § 23 упр. 3, 4 стр. 142