лекция 4-кинетика.pptx
- Количество слайдов: 39
 Chemical kinetics - Lection 2 Konstantin GERMAN Chair Head of Natural and Biomedical Sciences, Medical Institute REAVIZ
Chemical kinetics - Lection 2 Konstantin GERMAN Chair Head of Natural and Biomedical Sciences, Medical Institute REAVIZ
 Лекция 4 ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ КИНЕТИКИ Зав. кафедрой естественных наук К. Э. Герман
Лекция 4 ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ КИНЕТИКИ Зав. кафедрой естественных наук К. Э. Герман
 Предмет и основные понятия химической кинетики (план) 1. 2. 3. 4. 5. Химическая кинетика как основа для изучения скоростей и механизмов биохимических процессов. Развитие учения о химической кинетике. Скорость химической реакции. Средняя скорость реакции в интервале, истинная скорость. Классификации реакций, применяющиеся в кинетике: реакции, гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные). Молекулярность элементарного акта реакции. Кинетические уравнения. Порядок реакции. Период полупревращения. Зависимость скорости реакции от концентрации. Кинетические уравнения Enzyme kinetics, the study of biochemical reaction rates catalysed by an enzyme – Michaelis–Menten kinetics, the widely accepted general model of enzyme kinetics – Goldbeter–Koshland kinetics – Langmuir–Hinshelwood kinetics
Предмет и основные понятия химической кинетики (план) 1. 2. 3. 4. 5. Химическая кинетика как основа для изучения скоростей и механизмов биохимических процессов. Развитие учения о химической кинетике. Скорость химической реакции. Средняя скорость реакции в интервале, истинная скорость. Классификации реакций, применяющиеся в кинетике: реакции, гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные). Молекулярность элементарного акта реакции. Кинетические уравнения. Порядок реакции. Период полупревращения. Зависимость скорости реакции от концентрации. Кинетические уравнения Enzyme kinetics, the study of biochemical reaction rates catalysed by an enzyme – Michaelis–Menten kinetics, the widely accepted general model of enzyme kinetics – Goldbeter–Koshland kinetics – Langmuir–Hinshelwood kinetics
 Химическая кинетика – это учение о скорости и механизме процесса и его зависимости от различных факторов, позволяющих ускорить или замедлить ход реакции. Kinetics (Greek: κίνησις "kinesis", движение или двигаться) • • • Предмет химической кинетики - изучение химической реакции: закономерности ее протекания во времени, зависимость от условий, механизм, связь кинетических характеристик со строением реактантов, энергетикой процесса и физикой активных частиц. Объект исследования химической кинетики - процесс превращения реагентов в продукты. Изучение кинетикой реакции как процесса обусловливает наличие у нее и специфической методологии – совокупности теоретических концепций и экспериментальных методов, позволяющих изучать и анализировать химическую реакцию как развертывающийся во времени эволюционный процесс. • Для получения кинетических закономерностей, в отличие от термодинамических, необходимо знать не только начальное и конечное состояние системы, но и путь, по которому протекает реакция. Поэтому получить кинетические закономерности сложнее. • Зная эти закономерности (математическую модель) и кинетические параметры изучаемой химической реакции, можно рассчитать ее скорость и оптимальные условия проведения в промышленном реакторе.
Химическая кинетика – это учение о скорости и механизме процесса и его зависимости от различных факторов, позволяющих ускорить или замедлить ход реакции. Kinetics (Greek: κίνησις "kinesis", движение или двигаться) • • • Предмет химической кинетики - изучение химической реакции: закономерности ее протекания во времени, зависимость от условий, механизм, связь кинетических характеристик со строением реактантов, энергетикой процесса и физикой активных частиц. Объект исследования химической кинетики - процесс превращения реагентов в продукты. Изучение кинетикой реакции как процесса обусловливает наличие у нее и специфической методологии – совокупности теоретических концепций и экспериментальных методов, позволяющих изучать и анализировать химическую реакцию как развертывающийся во времени эволюционный процесс. • Для получения кинетических закономерностей, в отличие от термодинамических, необходимо знать не только начальное и конечное состояние системы, но и путь, по которому протекает реакция. Поэтому получить кинетические закономерности сложнее. • Зная эти закономерности (математическую модель) и кинетические параметры изучаемой химической реакции, можно рассчитать ее скорость и оптимальные условия проведения в промышленном реакторе.
 Два направления в ХК • Формальная кинетика – направление химической кинетики, позволившее разработать методику расчета скорости химических реакций и динамику изменения концентрации реагирующих веществ с учетом специфики химического взаимодействия • Изучение механизма различных химических реакций и процессов, на основе которого находят решение практические задачи, в том числе связанные с разработкой новых и совершенствованием известных технологий
Два направления в ХК • Формальная кинетика – направление химической кинетики, позволившее разработать методику расчета скорости химических реакций и динамику изменения концентрации реагирующих веществ с учетом специфики химического взаимодействия • Изучение механизма различных химических реакций и процессов, на основе которого находят решение практические задачи, в том числе связанные с разработкой новых и совершенствованием известных технологий
 Классификация химических реакций. Скорость химической реакции. • • • Уравнение реакция в общем виде 1. Реакции с постоянной скоростью. Это можно записать как: имеет место лишь в особом случае гетерогенной реакции между твердым l. L + m. M +. . . = q. Q + r. R +. . (1. 1) веществом и жидкостью при условии, что а) где l; m и q; r - стехиометрические концентрация реагента постоянна; б) коэффициенты исходных и конечных поверхность твердого вещества не веществ; L; M и Q; R - исходные и изменяется в течение процесса. конечные вещества. Под скоростью химической реакции 2. Реакции, скорость которых уменьшается со временем. Это может происходить за подразумевается какое количество счет: а) снижения концентрации одного из молекул данного вида реагирует в реагентов; б) уменьшения площади единицу времени. поверхности одного из реагентов; в) Скорости различных реакций можно образования защитной пленки продуктов сравнивать, если относить скорость реакции на поверхности твердого реагента. реакции к единице объема. Поэтому 3. Реакции со скоростью, увеличивающейся с скорость реакции определяют течением времени. Такие процессы числом молекул или молей данного называют автокаталитическими; продукт вещества, реагирующих в единицу реакции в последствие реагирует с времени в единице объема. исходным веществом.
Классификация химических реакций. Скорость химической реакции. • • • Уравнение реакция в общем виде 1. Реакции с постоянной скоростью. Это можно записать как: имеет место лишь в особом случае гетерогенной реакции между твердым l. L + m. M +. . . = q. Q + r. R +. . (1. 1) веществом и жидкостью при условии, что а) где l; m и q; r - стехиометрические концентрация реагента постоянна; б) коэффициенты исходных и конечных поверхность твердого вещества не веществ; L; M и Q; R - исходные и изменяется в течение процесса. конечные вещества. Под скоростью химической реакции 2. Реакции, скорость которых уменьшается со временем. Это может происходить за подразумевается какое количество счет: а) снижения концентрации одного из молекул данного вида реагирует в реагентов; б) уменьшения площади единицу времени. поверхности одного из реагентов; в) Скорости различных реакций можно образования защитной пленки продуктов сравнивать, если относить скорость реакции на поверхности твердого реагента. реакции к единице объема. Поэтому 3. Реакции со скоростью, увеличивающейся с скорость реакции определяют течением времени. Такие процессы числом молекул или молей данного называют автокаталитическими; продукт вещества, реагирующих в единицу реакции в последствие реагирует с времени в единице объема. исходным веществом.
 При оценке скорости реакции следует учитывать следующие четыре параметра: • 1. Влияние концентрации реагентов. Если одним из реагентов является газ, то необходимо знать влияние давления, чтобы эффективно использовать сосуды высокого давления. • 2. Влияние температуры. Большинство реакций значительно ускоряются с повышением температуры. • 3. Влияние перемешивания или скорости потока газа. • 4. Влияние размеров частиц (дисперсность ) - для гетерогенных реакций.
При оценке скорости реакции следует учитывать следующие четыре параметра: • 1. Влияние концентрации реагентов. Если одним из реагентов является газ, то необходимо знать влияние давления, чтобы эффективно использовать сосуды высокого давления. • 2. Влияние температуры. Большинство реакций значительно ускоряются с повышением температуры. • 3. Влияние перемешивания или скорости потока газа. • 4. Влияние размеров частиц (дисперсность ) - для гетерогенных реакций.
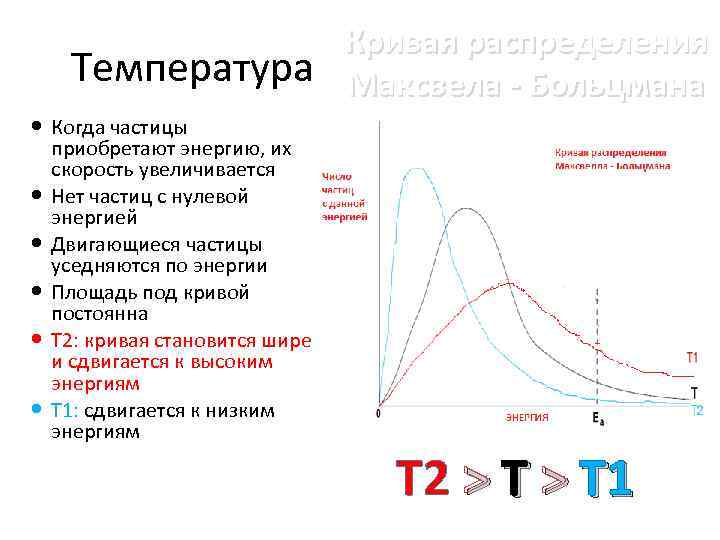 Температура Кривая распределения Максвела - Больцмана Когда частицы приобретают энергию, их скорость увеличивается Нет частиц с нулевой энергией Двигающиеся частицы уседняются по энергии Площадь под кривой постоянна T 2: кривая становится шире и сдвигается к высоким энергиям T 1: сдвигается к низким энергиям T 2 > T 1
Температура Кривая распределения Максвела - Больцмана Когда частицы приобретают энергию, их скорость увеличивается Нет частиц с нулевой энергией Двигающиеся частицы уседняются по энергии Площадь под кривой постоянна T 2: кривая становится шире и сдвигается к высоким энергиям T 1: сдвигается к низким энергиям T 2 > T 1
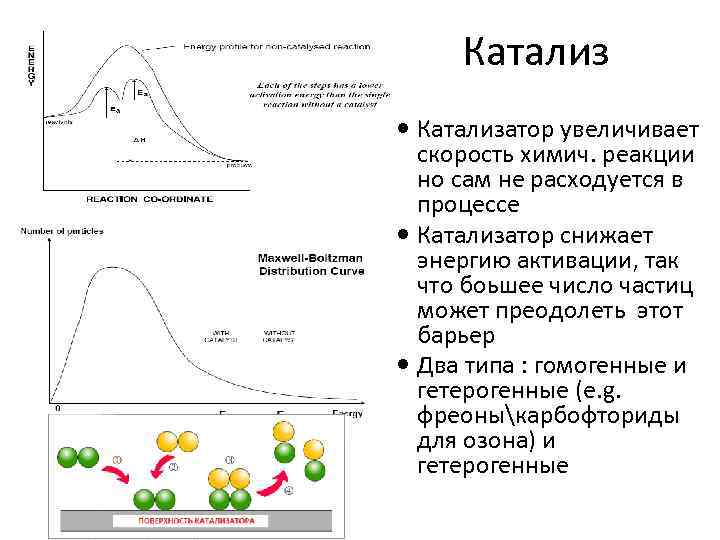 Катализ Катализатор увеличивает скорость химич. реакции но сам не расходуется в процессе Катализатор снижает энергию активации, так что боьшее число частиц может преодолеть этот барьер Два типа : гомогенные и гетерогенные (e. g. фреоныкарбофториды для озона) и гетерогенные
Катализ Катализатор увеличивает скорость химич. реакции но сам не расходуется в процессе Катализатор снижает энергию активации, так что боьшее число частиц может преодолеть этот барьер Два типа : гомогенные и гетерогенные (e. g. фреоныкарбофториды для озона) и гетерогенные
 Реагируют только те молекулы, которые сталкиваются. • Число столкновений прямо пропорционально числу молекул, • Константа скорости химической реакции есть поэтому скорость реакции должна скорость этой реакции при быть пропорциональна условии, что концентрации концентрациям реагирующих веществ, т. е. в общем, случае постоянны и равны единице. • Константу скорости иногда • . . (1. 2) называют удельной скоростью • где w - скорость химической реакции; k 1 - константа скорости • скорость реакции является химической реакции ; c. L и c. M функцией времени, так как с концентрации реагирующих течением времени изменяются веществ; l и m - стехиометрические концентрации реагирующих коэффициенты веществ. • Полученное выражение иногда называют основным постулатом химической кинетики.
Реагируют только те молекулы, которые сталкиваются. • Число столкновений прямо пропорционально числу молекул, • Константа скорости химической реакции есть поэтому скорость реакции должна скорость этой реакции при быть пропорциональна условии, что концентрации концентрациям реагирующих веществ, т. е. в общем, случае постоянны и равны единице. • Константу скорости иногда • . . (1. 2) называют удельной скоростью • где w - скорость химической реакции; k 1 - константа скорости • скорость реакции является химической реакции ; c. L и c. M функцией времени, так как с концентрации реагирующих течением времени изменяются веществ; l и m - стехиометрические концентрации реагирующих коэффициенты веществ. • Полученное выражение иногда называют основным постулатом химической кинетики.
 ОБРАТИМЫЕ И НЕОБРАТИМЫЕ РЕАКЦИИ • Обратимыми в химической кинетике называют такие реакции, которые одновременно и независимо протекают в двух направлениях - прямом и обратном, но с различными скоростями. Для обратимых реакций характерно, что через некоторое время после их начала скорости прямой и обратной реакций становятся равными и наступает состояние химического равновесия. • Все химические реакции обратимы, но при определенных условиях некоторые из них могут протекать только в одном направлении до практически полного исчезновения исходных продуктов. Такие реакции называют необратимыми. Обычно необратимыми бывают реакции, в которых хотя бы один продукт реакции выводится из области реакции (в случае реакции в растворах - выпадает в осадок или выделяется в виде газа), или реакции, которые сопровождаются большим положительным тепловым эффектом. В случае ионных реакций, реакция является практически необратимой, если в результате нее образуется очень малорастворимое или малодиссоциированное вещество.
ОБРАТИМЫЕ И НЕОБРАТИМЫЕ РЕАКЦИИ • Обратимыми в химической кинетике называют такие реакции, которые одновременно и независимо протекают в двух направлениях - прямом и обратном, но с различными скоростями. Для обратимых реакций характерно, что через некоторое время после их начала скорости прямой и обратной реакций становятся равными и наступает состояние химического равновесия. • Все химические реакции обратимы, но при определенных условиях некоторые из них могут протекать только в одном направлении до практически полного исчезновения исходных продуктов. Такие реакции называют необратимыми. Обычно необратимыми бывают реакции, в которых хотя бы один продукт реакции выводится из области реакции (в случае реакции в растворах - выпадает в осадок или выделяется в виде газа), или реакции, которые сопровождаются большим положительным тепловым эффектом. В случае ионных реакций, реакция является практически необратимой, если в результате нее образуется очень малорастворимое или малодиссоциированное вещество.
 Факторы, влияющие на скорость химической реакции • В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Никола й Никола евич Беке тов 1827 -1911, • Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: 1. природа реагирующих веществ, 2. наличие катализатора, 3. температура (правило Вант. Гоффа) 4. площадь поверхности раздела фаз.
Факторы, влияющие на скорость химической реакции • В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Никола й Никола евич Беке тов 1827 -1911, • Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: 1. природа реагирующих веществ, 2. наличие катализатора, 3. температура (правило Вант. Гоффа) 4. площадь поверхности раздела фаз.
 Закон действующих масс. • Скорость прямой химической реакции может быть, представлена в виде • • Скорость обратной - в виде: При равновесии • Чтобы произошла единичная реакция, необходимо столкновение молекул исходных веществ, т. е. молекулы должны сблизиться друг с другом на расстояние порядка атомных размеров. Вероятность найти в некотором малом объеме в данный момент l молекул вещества L , m молекул вещества M и т. д. пропорциональна (1. 4) • Это уравнение выражает закон действующих масс для химического равновесия в идеальных системах; К - к о н с т а н т а р а в н о в е с и я. . , следовательно, число столкновений в единице объема за единицу времени пропорционально этой величине; отсюда вытекает уравнение (1. 4).
Закон действующих масс. • Скорость прямой химической реакции может быть, представлена в виде • • Скорость обратной - в виде: При равновесии • Чтобы произошла единичная реакция, необходимо столкновение молекул исходных веществ, т. е. молекулы должны сблизиться друг с другом на расстояние порядка атомных размеров. Вероятность найти в некотором малом объеме в данный момент l молекул вещества L , m молекул вещества M и т. д. пропорциональна (1. 4) • Это уравнение выражает закон действующих масс для химического равновесия в идеальных системах; К - к о н с т а н т а р а в н о в е с и я. . , следовательно, число столкновений в единице объема за единицу времени пропорционально этой величине; отсюда вытекает уравнение (1. 4).
 Количественно скорость химической реакции ω выражается числом единиц массы одного из продуктов или реагентов, которые образуются или прореагируют в единицу времени τ в единице объема системы V. • гомогенные реакции : • где n- число частиц (молекул) реагентов. • При постоянном объеме • гетерогенные реакции где F- площадь поверхности Коэффициент пропорциональности – kc для каждой реакции при t = const является величиной постоянной и называется константой скорости реакции или удельной скоростью реакции. Физический смысл КС можно представить, если принять концентрацию компонента равной единице, тогда ω = kc. В действительности эта константа, согласно закону Аррениуса, является функцией температуры.
Количественно скорость химической реакции ω выражается числом единиц массы одного из продуктов или реагентов, которые образуются или прореагируют в единицу времени τ в единице объема системы V. • гомогенные реакции : • где n- число частиц (молекул) реагентов. • При постоянном объеме • гетерогенные реакции где F- площадь поверхности Коэффициент пропорциональности – kc для каждой реакции при t = const является величиной постоянной и называется константой скорости реакции или удельной скоростью реакции. Физический смысл КС можно представить, если принять концентрацию компонента равной единице, тогда ω = kc. В действительности эта константа, согласно закону Аррениуса, является функцией температуры.
 КИНЕТИЧЕСКАЯ КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ Химические реакции разделяют или по признаку молекулярности или по признаку порядка. • • • Молекулярность – определяется числом молекул, одновременно участвующих в химическом акте. Если превращение испытывает одна молекула, то реакция называется мономолекулярной, если в процессе участвуют две молекулы - бимолекулярной и т. д. Так как вероятность одновременного столкновения большого числа частиц мала, молекулярность одностадийного процесса не превышает трех. Тримолекулярные реакции встречаются редко. Реакций более высокой молекулярности практически неизвестно. Если в процессе участвует большее число молекул -процесс идет более сложным путем – через несколько стадий последовательно протекающих реакций, в каждой из которых участвует 2 молекулы, редко 3. Это сложные реакции и их рассматривают как совокупность последовательных или параллельных реакций. • • Мономолекулярные реакции – реакции разложения молекул и внутримолекулярных перегруппировок. F 2 = 2 F и 2 F = F 2 ω = k. C • Бимолекулярная реакция H 2 + F 2 = 2 HF Тримолекулярная реакция А + В + С = АВС Или для А=B=C
КИНЕТИЧЕСКАЯ КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ Химические реакции разделяют или по признаку молекулярности или по признаку порядка. • • • Молекулярность – определяется числом молекул, одновременно участвующих в химическом акте. Если превращение испытывает одна молекула, то реакция называется мономолекулярной, если в процессе участвуют две молекулы - бимолекулярной и т. д. Так как вероятность одновременного столкновения большого числа частиц мала, молекулярность одностадийного процесса не превышает трех. Тримолекулярные реакции встречаются редко. Реакций более высокой молекулярности практически неизвестно. Если в процессе участвует большее число молекул -процесс идет более сложным путем – через несколько стадий последовательно протекающих реакций, в каждой из которых участвует 2 молекулы, редко 3. Это сложные реакции и их рассматривают как совокупность последовательных или параллельных реакций. • • Мономолекулярные реакции – реакции разложения молекул и внутримолекулярных перегруппировок. F 2 = 2 F и 2 F = F 2 ω = k. C • Бимолекулярная реакция H 2 + F 2 = 2 HF Тримолекулярная реакция А + В + С = АВС Или для А=B=C
 ПОРЯДОК РЕАКЦИИ • Химические реакции редко протекают в одну стадию, как их принято записывать в учебниках химии. • В обычной одностадийной записи уравнений химических реакций указывается только начальное и конечное состояние системы, что является, по существу символическим выражением материального баланса (закона сохранения вещества). • В действительности реакция обычно протекает через ряд промежуточных стадий, причем скорость реакции определяется скоростью наиболее медленной стадии. • Общий порядок элементарной химической реакции равен сумме стехиометрических коэффициентов веществ, вступающих в реакцию, или, другими словами, числу молекул, участвующих в реакции. Например, рассмотрим распад перекиси водорода. Согласно уравнению реакции должен протекать как реакция второго порядка, на самом деле порядок этой реакции изменяется в зависимости от условий ее проведения и может быть первым или дробным. Последнее указывает, что реакция протекает через различные промежуточные стадии.
ПОРЯДОК РЕАКЦИИ • Химические реакции редко протекают в одну стадию, как их принято записывать в учебниках химии. • В обычной одностадийной записи уравнений химических реакций указывается только начальное и конечное состояние системы, что является, по существу символическим выражением материального баланса (закона сохранения вещества). • В действительности реакция обычно протекает через ряд промежуточных стадий, причем скорость реакции определяется скоростью наиболее медленной стадии. • Общий порядок элементарной химической реакции равен сумме стехиометрических коэффициентов веществ, вступающих в реакцию, или, другими словами, числу молекул, участвующих в реакции. Например, рассмотрим распад перекиси водорода. Согласно уравнению реакции должен протекать как реакция второго порядка, на самом деле порядок этой реакции изменяется в зависимости от условий ее проведения и может быть первым или дробным. Последнее указывает, что реакция протекает через различные промежуточные стадии.
 В применении к гетерогенным процессам различают истинный и кажущийся порядок реакции • Истинный порядок – порядок реакции относительно концентрации компонента участвующего на поверхности твердой фазы. • Кажущийся порядок – порядок реакции зависит от соотношения между объемной и поверхностной концентрациями. • Кинетическому уравнению с этой точки зрения отвечает кажущийся порядок. • Величина наблюдаемого (кажущегося) на опыте порядка реакции может зависеть от условий эксперимента. • Если реакция проводится в многократном избытке одного из компонентов, таким образом изменение его концентрации и влияние на скорость будет незаметным. • Тогда nкаж = 0 по данному компоненту.
В применении к гетерогенным процессам различают истинный и кажущийся порядок реакции • Истинный порядок – порядок реакции относительно концентрации компонента участвующего на поверхности твердой фазы. • Кажущийся порядок – порядок реакции зависит от соотношения между объемной и поверхностной концентрациями. • Кинетическому уравнению с этой точки зрения отвечает кажущийся порядок. • Величина наблюдаемого (кажущегося) на опыте порядка реакции может зависеть от условий эксперимента. • Если реакция проводится в многократном избытке одного из компонентов, таким образом изменение его концентрации и влияние на скорость будет незаметным. • Тогда nкаж = 0 по данному компоненту.
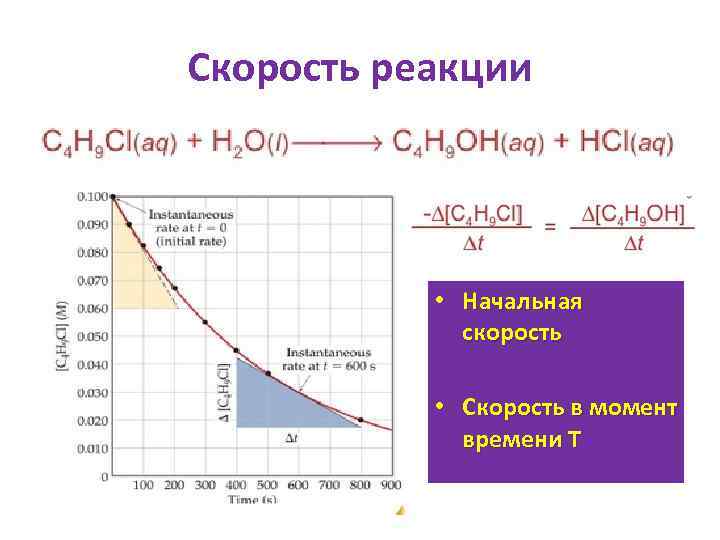 Скорость реакции • Начальная скорость • Скорость в момент времени Т
Скорость реакции • Начальная скорость • Скорость в момент времени Т
 Если стехиометрия не 1: 1 , а 2 : 1 ? • Тогда скорость убыли реагентов вдвое больше скорости образования продукта !
Если стехиометрия не 1: 1 , а 2 : 1 ? • Тогда скорость убыли реагентов вдвое больше скорости образования продукта !
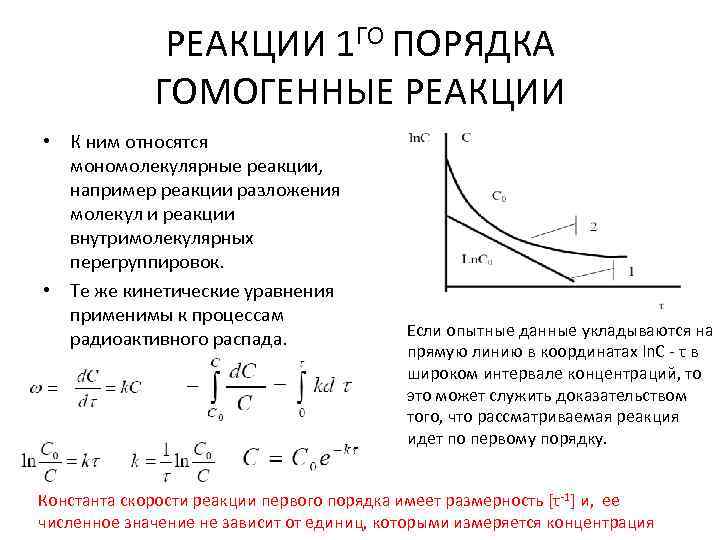 РЕАКЦИИ 1 ГО ПОРЯДКА ГОМОГЕННЫЕ РЕАКЦИИ • К ним относятся мономолекулярные реакции, например реакции разложения молекул и реакции внутримолекулярных перегруппировок. • Те же кинетические уравнения применимы к процессам радиоактивного распада. Если опытные данные укладываются на прямую линию в координатах ln. C - τ в широком интервале концентраций, то это может служить доказательством того, что рассматриваемая реакция идет по первому порядку. Константа скорости реакции первого порядка имеет размерность [τ-1] и, ее численное значение не зависит от единиц, которыми измеряется концентрация
РЕАКЦИИ 1 ГО ПОРЯДКА ГОМОГЕННЫЕ РЕАКЦИИ • К ним относятся мономолекулярные реакции, например реакции разложения молекул и реакции внутримолекулярных перегруппировок. • Те же кинетические уравнения применимы к процессам радиоактивного распада. Если опытные данные укладываются на прямую линию в координатах ln. C - τ в широком интервале концентраций, то это может служить доказательством того, что рассматриваемая реакция идет по первому порядку. Константа скорости реакции первого порядка имеет размерность [τ-1] и, ее численное значение не зависит от единиц, которыми измеряется концентрация
 РЕАКЦИИ 1 ГО ПОРЯДКА • В несколько иной форме: вводят концентрацию x образовавшегося к моменту τ продукта реакции и обозначают через a начальную концентрацию C 0. В этом случае
РЕАКЦИИ 1 ГО ПОРЯДКА • В несколько иной форме: вводят концентрацию x образовавшегося к моменту τ продукта реакции и обозначают через a начальную концентрацию C 0. В этом случае
 РЕАКЦИИ ВТОРОГО ПОРЯДКА • Для реакций второго порядка, если реагенты имеют одинаковые концентрации, кинетическое уравнение имеет вид Для реакции второго порядка должна соблюдаться прямолинейная зависимость между величиной 1/С и временем А время полураспада - зависит от начальной концентрации:
РЕАКЦИИ ВТОРОГО ПОРЯДКА • Для реакций второго порядка, если реагенты имеют одинаковые концентрации, кинетическое уравнение имеет вид Для реакции второго порядка должна соблюдаться прямолинейная зависимость между величиной 1/С и временем А время полураспада - зависит от начальной концентрации:
 МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОРЯДКА РЕАКЦИИ • • Метод подстановки: • Заключается в подстановке • экспериментальных данных ( τ, τ1, τ2, τ3; С 0, С 1, С 2, С 3) последовательно в уравнения кинетики реакции 0, 1, 2 и 3 порядков и определении, какое из них • приводит к постоянному значению k. Порядок будет • такой, какая формула дает лучшее постоянство k для • различного времени. Графический метод определения порядка реакции: Заключается в построении графика выражающего зависимость различных функций С от τ. Чтобы определить порядок необходимо получить прямую линию функции. В случае реакции 0 -го порядка линейная зависимость С от τ В случае реакции 1 -го порядка линейную зависимость от τ дает lg. C. В случае реакции 2 -го порядка линейную зависимость от τ дает 1/С от τ • для реакции 3 -го порядка 1/С 2 от τ.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОРЯДКА РЕАКЦИИ • • Метод подстановки: • Заключается в подстановке • экспериментальных данных ( τ, τ1, τ2, τ3; С 0, С 1, С 2, С 3) последовательно в уравнения кинетики реакции 0, 1, 2 и 3 порядков и определении, какое из них • приводит к постоянному значению k. Порядок будет • такой, какая формула дает лучшее постоянство k для • различного времени. Графический метод определения порядка реакции: Заключается в построении графика выражающего зависимость различных функций С от τ. Чтобы определить порядок необходимо получить прямую линию функции. В случае реакции 0 -го порядка линейная зависимость С от τ В случае реакции 1 -го порядка линейную зависимость от τ дает lg. C. В случае реакции 2 -го порядка линейную зависимость от τ дает 1/С от τ • для реакции 3 -го порядка 1/С 2 от τ.
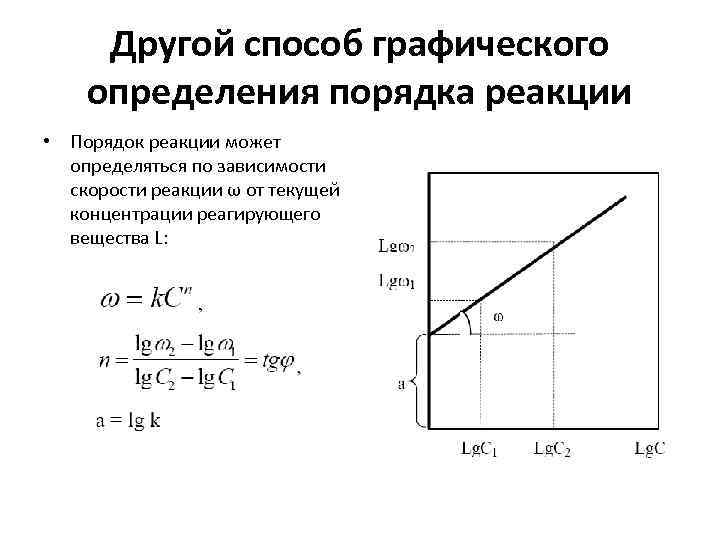 Другой способ графического определения порядка реакции • Порядок реакции может определяться по зависимости скорости реакции ω от текущей концентрации реагирующего вещества L:
Другой способ графического определения порядка реакции • Порядок реакции может определяться по зависимости скорости реакции ω от текущей концентрации реагирующего вещества L:
 Аналитические методы определения порядка реакции: А) Порядок реакции определяется по начальной скорости реакции (метод Вант-Гоффа): • Б) Порядок реакции определяется по времени ta’’ одинаковой степени превращения a при начальных концентрациях Co’ и Co’’:
Аналитические методы определения порядка реакции: А) Порядок реакции определяется по начальной скорости реакции (метод Вант-Гоффа): • Б) Порядок реакции определяется по времени ta’’ одинаковой степени превращения a при начальных концентрациях Co’ и Co’’:
 ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ • Температура сильно влияет на скорость химической реакции. Наблюдается несколько типов зависимости скорости реакции от температуры: • • • а – нормальный характер зависимости, когда с увеличением температуры происходит быстрое возрастание скорости; б – гетерогенные реакции в диффузионной области; в – зависимость характерная для взрывчатых процессов (скачек скорости реакции при достижении температуры воспламенения); г – каталитическая реакция, скорость которой определяется скоростью адсорбции (количество адсорбированного вещества уменьшается с возрастанием температуры); д – характерная кривая для реакций осложненных побочными процессами, скорость которых становиться значительной при высоких температурах; е – скорость реакции уменьшается с повышением температуры, например для O 2 + NO, при которой более полному равновесному превращению способствуют более низкие температуры.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ • Температура сильно влияет на скорость химической реакции. Наблюдается несколько типов зависимости скорости реакции от температуры: • • • а – нормальный характер зависимости, когда с увеличением температуры происходит быстрое возрастание скорости; б – гетерогенные реакции в диффузионной области; в – зависимость характерная для взрывчатых процессов (скачек скорости реакции при достижении температуры воспламенения); г – каталитическая реакция, скорость которой определяется скоростью адсорбции (количество адсорбированного вещества уменьшается с возрастанием температуры); д – характерная кривая для реакций осложненных побочными процессами, скорость которых становиться значительной при высоких температурах; е – скорость реакции уменьшается с повышением температуры, например для O 2 + NO, при которой более полному равновесному превращению способствуют более низкие температуры.
 ЭНЕРГИЯ АКТИВАЦИИ В 1884 г. Вант-Гофф установил , что lnk должен быть линейной функцией от 1/Т. Это основано на том, что хим. реакцию можно рассматривать состоящей из двух уравнений: для прямой и обратной реакций, протекающих в равновесной системе. • В 1889 г. Аррениус определил, что почти для всех реакций графики зависимости lnk от 1/T представляют собой прямые линии В 1909 г. Величина Е была названа Траутцем энергией активации.
ЭНЕРГИЯ АКТИВАЦИИ В 1884 г. Вант-Гофф установил , что lnk должен быть линейной функцией от 1/Т. Это основано на том, что хим. реакцию можно рассматривать состоящей из двух уравнений: для прямой и обратной реакций, протекающих в равновесной системе. • В 1889 г. Аррениус определил, что почти для всех реакций графики зависимости lnk от 1/T представляют собой прямые линии В 1909 г. Величина Е была названа Траутцем энергией активации.
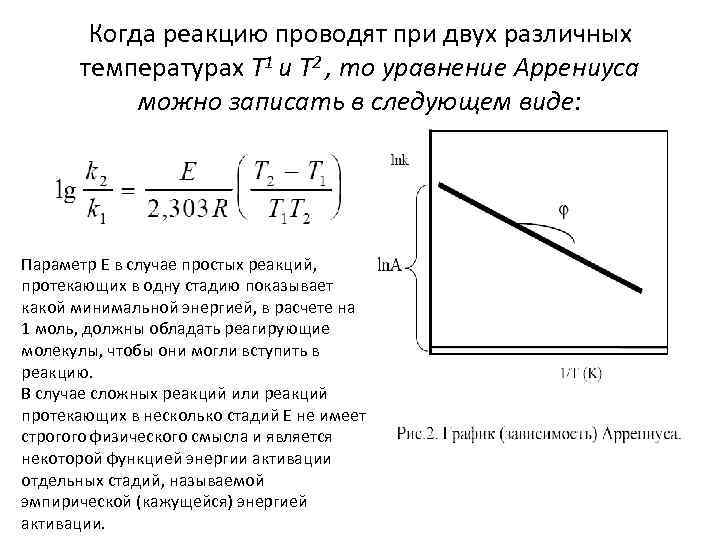 Когда реакцию проводят при двух различных температурах Т 1 и Т 2 , то уравнение Аррениуса можно записать в следующем виде: Параметр Е в случае простых реакций, протекающих в одну стадию показывает какой минимальной энергией, в расчете на 1 моль, должны обладать реагирующие молекулы, чтобы они могли вступить в реакцию. В случае сложных реакций или реакций протекающих в несколько стадий Е не имеет строгого физического смысла и является некоторой функцией энергии активации отдельных стадий, называемой эмпирической (кажущейся) энергией активации.
Когда реакцию проводят при двух различных температурах Т 1 и Т 2 , то уравнение Аррениуса можно записать в следующем виде: Параметр Е в случае простых реакций, протекающих в одну стадию показывает какой минимальной энергией, в расчете на 1 моль, должны обладать реагирующие молекулы, чтобы они могли вступить в реакцию. В случае сложных реакций или реакций протекающих в несколько стадий Е не имеет строгого физического смысла и является некоторой функцией энергии активации отдельных стадий, называемой эмпирической (кажущейся) энергией активации.
 Активация • Избыточная энергия может быть: • Повышенная энергия движения электронов может достигаться при поглощении света (или от воздействия • 1. Повышенная кинетическая электромагнитных полей). энергия вращательного или • Энергия электронов в атомах поступательного движения. может повышаться при разрыве валентной связи • 2. Повышенная энергия (диссоциации, образование взаимного колебания атомов свободных радикалов или атомных групп в других атомов с молекулах. ненасыщенной валентностью, при ударе молекул о стеку сосуда, • 3. Повышенная энергия электроразряд, ультразвук, движения электронов. излучения и т. д. ).
Активация • Избыточная энергия может быть: • Повышенная энергия движения электронов может достигаться при поглощении света (или от воздействия • 1. Повышенная кинетическая электромагнитных полей). энергия вращательного или • Энергия электронов в атомах поступательного движения. может повышаться при разрыве валентной связи • 2. Повышенная энергия (диссоциации, образование взаимного колебания атомов свободных радикалов или атомных групп в других атомов с молекулах. ненасыщенной валентностью, при ударе молекул о стеку сосуда, • 3. Повышенная энергия электроразряд, ультразвук, движения электронов. излучения и т. д. ).
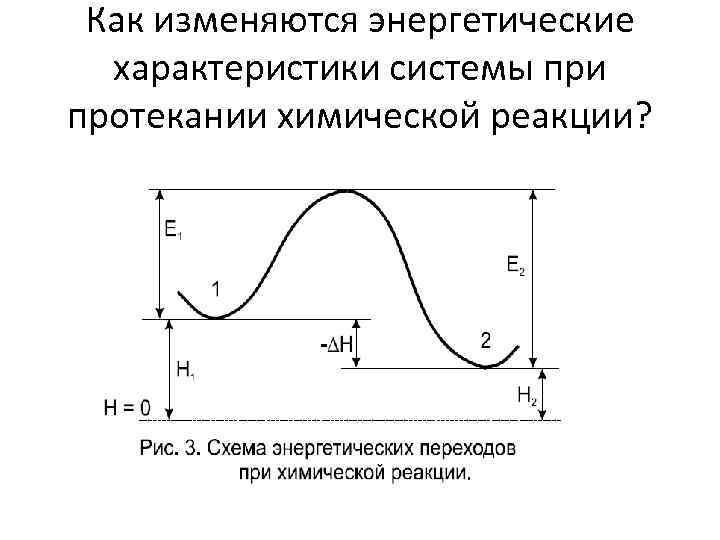 Как изменяются энергетические характеристики системы при протекании химической реакции?
Как изменяются энергетические характеристики системы при протекании химической реакции?
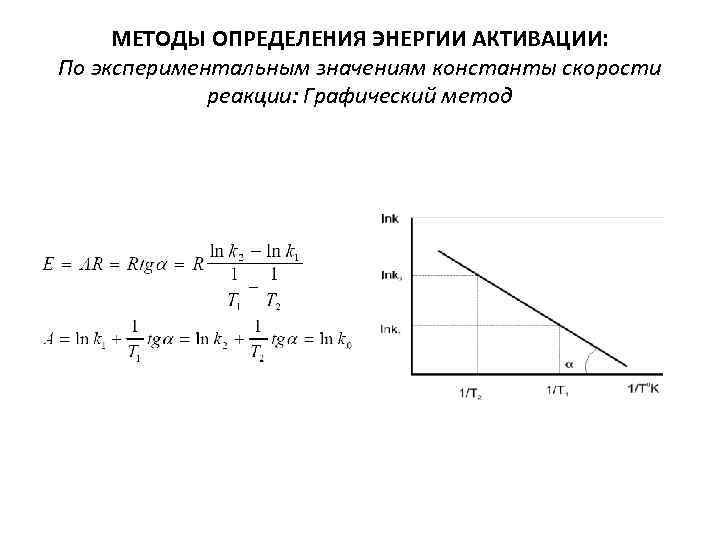 МЕТОДЫ ОПРЕДЕЛЕНИЯ ЭНЕРГИИ АКТИВАЦИИ: По экспериментальным значениям константы скорости реакции: Графический метод
МЕТОДЫ ОПРЕДЕЛЕНИЯ ЭНЕРГИИ АКТИВАЦИИ: По экспериментальным значениям константы скорости реакции: Графический метод
 ТЕМПЕРАТУРНЫЙ КОЭФФИЦИЕНТ СКОРОСТИ РЕАКЦИИ И ЕГО ОСОБЕННОСТИ ДЛЯ БИОХИМИЧЕСКИХ ПРОЦЕССОВ • • Теплота — основа кинетики химических • реакций, из которых складывается жизнедеятельность организма. Температурные условия оказываются одним из важнейших экологических факторов, влияющих на интенсивность обменных процессов. Температура относится к числу • постоянно действующих факторов; количественное ее выражение характеризуется широкими географическими, сезонными и • суточными различиями. Диапазон температур от + 50 до -500 С представляет собой фундаментальную характеристику температурных условий в биосфере, хотя имеются и отклонения от этих параметров Хорошо выражена разница тепловых режимов по климатическим зонам — от полярных пустынь Арктики и Антарктики с суровой и продолжительной зимой и прохладным коротким летом до экваториальной области, отличающейся высокими и относительно устойчивыми температурами. На температурные условия конкретной местности влияет близость моря, доступность для муссонных и пассатных перемещений воздушных масс, рельеф и ряд других факторов. В горах хорошо выражены вертикальный градиент температур, зависимость температурного режима от экспозиции склона, его изрезанности и т. п.
ТЕМПЕРАТУРНЫЙ КОЭФФИЦИЕНТ СКОРОСТИ РЕАКЦИИ И ЕГО ОСОБЕННОСТИ ДЛЯ БИОХИМИЧЕСКИХ ПРОЦЕССОВ • • Теплота — основа кинетики химических • реакций, из которых складывается жизнедеятельность организма. Температурные условия оказываются одним из важнейших экологических факторов, влияющих на интенсивность обменных процессов. Температура относится к числу • постоянно действующих факторов; количественное ее выражение характеризуется широкими географическими, сезонными и • суточными различиями. Диапазон температур от + 50 до -500 С представляет собой фундаментальную характеристику температурных условий в биосфере, хотя имеются и отклонения от этих параметров Хорошо выражена разница тепловых режимов по климатическим зонам — от полярных пустынь Арктики и Антарктики с суровой и продолжительной зимой и прохладным коротким летом до экваториальной области, отличающейся высокими и относительно устойчивыми температурами. На температурные условия конкретной местности влияет близость моря, доступность для муссонных и пассатных перемещений воздушных масс, рельеф и ряд других факторов. В горах хорошо выражены вертикальный градиент температур, зависимость температурного режима от экспозиции склона, его изрезанности и т. п.
 Влияние температуры на жизненные процессы • • Генеральная закономерность воздействия температуры на живые организмы выражается действием ее на скорость обменных процессов. Согласно общему для всех химических реакций правилу Вант-Гоффа, повышение температуры ведет к пропорциональному возрастанию скорости реакции. Разница заключается в том, что в живом организме химические процессы всегда идут с участием сложных ферментных систем, активность которых зависит от температуры. В результате ферментативного катализа возрастает скорость биохимических реакций и количественно меняется ее зависимость от внешней температуры. Величину температурного ускорения химических реакций удобно выражать коэффициентом Q 10, показывающим, во сколько раз увеличивается скорость реакции при повышении температуры на 10 0 С: Q 10 Kt+10/Kt, где Kt — скорость реакции при температуре t. • • Коэффициент температурного ускорения Q 10, для большинства химических реакций абиотического характера равный 2 , в реакциях живых систем колеблется в довольно широких пределах даже для одних и тех же процессов, протекающих в разных диапазонах температур. Это объясняется тем, что скорость ферментативных реакций не является линейной функцией температуры. Так, у тропических растений при температуре менее 10 0 С коэффициент Q 10 приблизительно равен 3, но существенно уменьшается при возрастании температуры выше 25 – 30 С. У колорадского жука потребление кислорода в диапазоне 10 – 30 0 С характеризуется величиной Q 10 2, 46, а при температуре 20 – 30 0 С Q 10 1, 8. Зависимость метаболизма рыб и многих других водных животных от температуры выражается в изменении величины Q 10 от 10, 9 до 2, 2 в диапазоне температур от 0 до 30'С. В одном и том же организме величина температурного ускорения биохимических реакций неодинакова для различных процессов.
Влияние температуры на жизненные процессы • • Генеральная закономерность воздействия температуры на живые организмы выражается действием ее на скорость обменных процессов. Согласно общему для всех химических реакций правилу Вант-Гоффа, повышение температуры ведет к пропорциональному возрастанию скорости реакции. Разница заключается в том, что в живом организме химические процессы всегда идут с участием сложных ферментных систем, активность которых зависит от температуры. В результате ферментативного катализа возрастает скорость биохимических реакций и количественно меняется ее зависимость от внешней температуры. Величину температурного ускорения химических реакций удобно выражать коэффициентом Q 10, показывающим, во сколько раз увеличивается скорость реакции при повышении температуры на 10 0 С: Q 10 Kt+10/Kt, где Kt — скорость реакции при температуре t. • • Коэффициент температурного ускорения Q 10, для большинства химических реакций абиотического характера равный 2 , в реакциях живых систем колеблется в довольно широких пределах даже для одних и тех же процессов, протекающих в разных диапазонах температур. Это объясняется тем, что скорость ферментативных реакций не является линейной функцией температуры. Так, у тропических растений при температуре менее 10 0 С коэффициент Q 10 приблизительно равен 3, но существенно уменьшается при возрастании температуры выше 25 – 30 С. У колорадского жука потребление кислорода в диапазоне 10 – 30 0 С характеризуется величиной Q 10 2, 46, а при температуре 20 – 30 0 С Q 10 1, 8. Зависимость метаболизма рыб и многих других водных животных от температуры выражается в изменении величины Q 10 от 10, 9 до 2, 2 в диапазоне температур от 0 до 30'С. В одном и том же организме величина температурного ускорения биохимических реакций неодинакова для различных процессов.
 Пойкилотермные организмы • • К пойкилотермным (от греч. poikilos — изменчивый, меняющийся) организмам относят все таксоны органического мира, кроме двух классов позвоночных животных — птиц и млекопитающих. • Название подчеркивает одно из • наиболее за заметных свойств представителей этой группы: неустойчивость, температуры их тела, меняющейся в широких пределах в зависимости от изменений температуры окружающей среды. Температура тела. Принципиальная особенность теплообмена пойкилотермных организмов заключается в том, что благодаря относительно низкому уровню метаболизма главным источником энергии у них является внешнее тепло. Именно этим объясняется прямая зависимость температуры тела пойкилотермных от температуры среды, точнее от притока теплоты извне, поскольку наземные пойкилотермные формы используют также и радиационный обогрев. Впрочем, полное соответствие температур тела и среды наблюдается редко и свойственно главным образом организмам очень мелких размеров. В большинстве случаев существует некоторое расхождение между этими показателями. В диапазоне низких и умеренных температур среды температура тела организмов, не находящихся в состоянии оцепенения, оказывается более высокой, а в очень жарких условиях — более низкой.
Пойкилотермные организмы • • К пойкилотермным (от греч. poikilos — изменчивый, меняющийся) организмам относят все таксоны органического мира, кроме двух классов позвоночных животных — птиц и млекопитающих. • Название подчеркивает одно из • наиболее за заметных свойств представителей этой группы: неустойчивость, температуры их тела, меняющейся в широких пределах в зависимости от изменений температуры окружающей среды. Температура тела. Принципиальная особенность теплообмена пойкилотермных организмов заключается в том, что благодаря относительно низкому уровню метаболизма главным источником энергии у них является внешнее тепло. Именно этим объясняется прямая зависимость температуры тела пойкилотермных от температуры среды, точнее от притока теплоты извне, поскольку наземные пойкилотермные формы используют также и радиационный обогрев. Впрочем, полное соответствие температур тела и среды наблюдается редко и свойственно главным образом организмам очень мелких размеров. В большинстве случаев существует некоторое расхождение между этими показателями. В диапазоне низких и умеренных температур среды температура тела организмов, не находящихся в состоянии оцепенения, оказывается более высокой, а в очень жарких условиях — более низкой.
 • • Скорость метаболизма Изменчивость температуры влечет за собой соответствующие изменения скорости обменных реакций. Поскольку динамика температуры тела пойкилотермных организмов определяется изменениями температуры среды, интенсивность метаболизма также оказывается в прямой зависимости от внешней температуры. Скорость потребления кислорода, в частности, при быстрых изменениях температуры следует за этими изменениями, увеличиваясь при повышении ее и уменьшаясь при снижении. То же относится и к другим физиологическим функциям: частота сердцебиений, интенсивность пищеварения и т. д. • • • У растений в зависимости от температуры изменяются темпы поступления воды и питательных веществ через корни: повышение температуры до определенного предела увеличивает проницаемость протоплазмы для воды. Как и у животных, повышение температуры вызывает у растений усиление дыхания. влияние температуры не монотонно: по достижении определенного порога стимуляция процесса сменяется его подавлением. Это общее правило, объясняющееся приближением к зоне порога нормальной жизни. У животных зависимость от температуры выражена в изменениях активности, и у пойкилотермных форм самым существенным образом зависит от температурных условий.
• • Скорость метаболизма Изменчивость температуры влечет за собой соответствующие изменения скорости обменных реакций. Поскольку динамика температуры тела пойкилотермных организмов определяется изменениями температуры среды, интенсивность метаболизма также оказывается в прямой зависимости от внешней температуры. Скорость потребления кислорода, в частности, при быстрых изменениях температуры следует за этими изменениями, увеличиваясь при повышении ее и уменьшаясь при снижении. То же относится и к другим физиологическим функциям: частота сердцебиений, интенсивность пищеварения и т. д. • • • У растений в зависимости от температуры изменяются темпы поступления воды и питательных веществ через корни: повышение температуры до определенного предела увеличивает проницаемость протоплазмы для воды. Как и у животных, повышение температуры вызывает у растений усиление дыхания. влияние температуры не монотонно: по достижении определенного порога стимуляция процесса сменяется его подавлением. Это общее правило, объясняющееся приближением к зоне порога нормальной жизни. У животных зависимость от температуры выражена в изменениях активности, и у пойкилотермных форм самым существенным образом зависит от температурных условий.
 Температура и развитие Влияние температуры на обменные процессы прослеживается при изучении онтогенетического развития пойкилотермных организмов. • Пассивная устойчивость • За границами благоприятного температурного диапазона, которые широко варьируют у разных видов и даже географических популяций одного вида, активные формы деятельности пойкилотермных организмов прекращаются, и они переходят в состояние оцепенения, характеризующееся резким снижением уровня обменных процессов, вплоть до полной потери видимых проявлений жизни. В таком пассивном состоянии пойкилотермные организмы могут переносить достаточно сильное повышение и еще более выраженное понижение температуры без патологических последствий. Основа такой температурной толерантности заключена в высокой степени тканевой устойчивости, свойственной всем видам пойкилотермных и часто поддерживаемой сильным обезвоживанием (семена, споры, некоторые мелкие животные). Оно протекает тем быстрее, чем выше температура окружающей среды. Длительность развития икры сельди при температуре 0, 5 0 С составляет 40 – 50 сут, а • при 16 0 С — всего 6 – 8; развитие икры форели при 2 0 С продолжается 205 сут, при 5 0 С — 82, при 10 0 С — 41 • Эффективными температурами называют температуры выше того минимального значения, при котором процессы развития вообще возможны; эту пороговую величину называют биологическим нулем развития.
Температура и развитие Влияние температуры на обменные процессы прослеживается при изучении онтогенетического развития пойкилотермных организмов. • Пассивная устойчивость • За границами благоприятного температурного диапазона, которые широко варьируют у разных видов и даже географических популяций одного вида, активные формы деятельности пойкилотермных организмов прекращаются, и они переходят в состояние оцепенения, характеризующееся резким снижением уровня обменных процессов, вплоть до полной потери видимых проявлений жизни. В таком пассивном состоянии пойкилотермные организмы могут переносить достаточно сильное повышение и еще более выраженное понижение температуры без патологических последствий. Основа такой температурной толерантности заключена в высокой степени тканевой устойчивости, свойственной всем видам пойкилотермных и часто поддерживаемой сильным обезвоживанием (семена, споры, некоторые мелкие животные). Оно протекает тем быстрее, чем выше температура окружающей среды. Длительность развития икры сельди при температуре 0, 5 0 С составляет 40 – 50 сут, а • при 16 0 С — всего 6 – 8; развитие икры форели при 2 0 С продолжается 205 сут, при 5 0 С — 82, при 10 0 С — 41 • Эффективными температурами называют температуры выше того минимального значения, при котором процессы развития вообще возможны; эту пороговую величину называют биологическим нулем развития.
 Гомойотермные организмы • К этой группе относят два класса высших позвоночных — птицы и млекопитающие. • Принципиальное отличие теплообмена гомойотермных животных от пойкилотермных заключается в том, что приспособления к меняющимся температурным условиям среды основаны у них на функционировании комплекса активных регуляторных механизмов поддержания теплового гомеостаза внутренней среды организма. • Благодаря этому биохимические и физиологические процессы всегда протекают в оптимальных температурных условиях. Гомойотермный тип теплообмена базируется на высоком уровне метаболизма, свойственном птицам и млекопитающим. Интенсивность обмена веществ у этих животных на один-два порядка выше, чем у всех других живых организмов при оптимальной температуре среды. Так, у мелких млекопитающих потребление кислорода при температуре среды 15 0 С составляет примерно 4 тыс. см 3 • кг -1 • ч -1 , а у беспозвоночных животных при такой же температуре — 10 0 см 3 • кг -1 • ч 1.
Гомойотермные организмы • К этой группе относят два класса высших позвоночных — птицы и млекопитающие. • Принципиальное отличие теплообмена гомойотермных животных от пойкилотермных заключается в том, что приспособления к меняющимся температурным условиям среды основаны у них на функционировании комплекса активных регуляторных механизмов поддержания теплового гомеостаза внутренней среды организма. • Благодаря этому биохимические и физиологические процессы всегда протекают в оптимальных температурных условиях. Гомойотермный тип теплообмена базируется на высоком уровне метаболизма, свойственном птицам и млекопитающим. Интенсивность обмена веществ у этих животных на один-два порядка выше, чем у всех других живых организмов при оптимальной температуре среды. Так, у мелких млекопитающих потребление кислорода при температуре среды 15 0 С составляет примерно 4 тыс. см 3 • кг -1 • ч -1 , а у беспозвоночных животных при такой же температуре — 10 0 см 3 • кг -1 • ч 1.
 Механизмы терморегуляции • Физиологические механизмы, обеспечивающие Один из наиболее обычных тепловой гомеостаз организма (его “ядра”), механизмов подразделяются на две функциональные группы: механизмы химической и физической специфического терморегуляторного терморегуляции. теплообразования в • Химическая терморегуляция представляет собой регуляцию теплопродукции организма. мышцах — так называемый Тепло постоянно вырабатывается в организме в терморегуляционный процессе окислительно-восстановительных тонус. реакций метаболизма. Он выражен • При этом часть его отдается во внешнюю среду микросокращениями тем больше, чем больше разница температуры фибрилл, регистрируемыми тела и среды. в виде повышения • Поэтому поддержание устойчивой электрической активности температуры тела при снижении температуры внешне неподвижной среды требует соответствующего усиления мышцы при ее охлаждении. процессов метаболизма и сопровождающего Терморегуляционный тонус их теплообразования, что компенсирует теплопотери и приводит к сохранению общего повышает потребление теплового баланса организма и поддержанию кислорода мышцей подчас более чем на 150%. постоянства внутренней температуры.
Механизмы терморегуляции • Физиологические механизмы, обеспечивающие Один из наиболее обычных тепловой гомеостаз организма (его “ядра”), механизмов подразделяются на две функциональные группы: механизмы химической и физической специфического терморегуляторного терморегуляции. теплообразования в • Химическая терморегуляция представляет собой регуляцию теплопродукции организма. мышцах — так называемый Тепло постоянно вырабатывается в организме в терморегуляционный процессе окислительно-восстановительных тонус. реакций метаболизма. Он выражен • При этом часть его отдается во внешнюю среду микросокращениями тем больше, чем больше разница температуры фибрилл, регистрируемыми тела и среды. в виде повышения • Поэтому поддержание устойчивой электрической активности температуры тела при снижении температуры внешне неподвижной среды требует соответствующего усиления мышцы при ее охлаждении. процессов метаболизма и сопровождающего Терморегуляционный тонус их теплообразования, что компенсирует теплопотери и приводит к сохранению общего повышает потребление теплового баланса организма и поддержанию кислорода мышцей подчас более чем на 150%. постоянства внутренней температуры.
 Спасибо за внимание!
Спасибо за внимание!


