Часть III Механизмы репарации ДНК Механизмы репарации














































mmtp_chast_3_rep_met_dnk.ppt
- Размер: 5.4 Mегабайта
- Количество слайдов: 69
Описание презентации Часть III Механизмы репарации ДНК Механизмы репарации по слайдам
 Часть III Механизмы репарации ДНК
Часть III Механизмы репарации ДНК
 Механизмы репарации ДНК
Механизмы репарации ДНК
 Объекты для изучения репарации • Escherichia coli • Saccharomyces cerevisiae • Caenorhabditis elegans • Arabidopsis Thaliana • Мыши, крысы • Клеточные культуры человека
Объекты для изучения репарации • Escherichia coli • Saccharomyces cerevisiae • Caenorhabditis elegans • Arabidopsis Thaliana • Мыши, крысы • Клеточные культуры человека
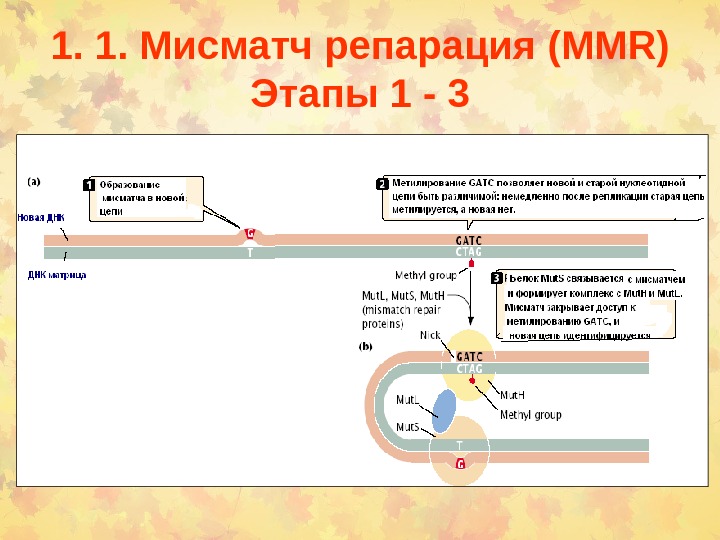
 1. 1. Мисматч репарация (MMR) Этапы 1 —
1. 1. Мисматч репарация (MMR) Этапы 1 —
 MMR. Этапы 4 —
MMR. Этапы 4 —
 А. Репарация мисматчей у бактерий 1. VSP- very short patch repair 2. Short patch repair 3. Long patch repair
А. Репарация мисматчей у бактерий 1. VSP- very short patch repair 2. Short patch repair 3. Long patch repair
 VSP- very short patch repair – 1 • В основном удаляется Т из мисматчей G/T и C/T. • Mut. S распознает следующие мисматчи:
VSP- very short patch repair – 1 • В основном удаляется Т из мисматчей G/T и C/T. • Mut. S распознает следующие мисматчи:
 VSP- very short patch repair – 2 • Mut. Y заменяет А из мисматчей C/A и G/A. Это адениновая гликозилаза, которая делает апуриновые сайты, распознаваемые эндонуклеазой. После чего запускается эксцизионная репарация.
VSP- very short patch repair – 2 • Mut. Y заменяет А из мисматчей C/A и G/A. Это адениновая гликозилаза, которая делает апуриновые сайты, распознаваемые эндонуклеазой. После чего запускается эксцизионная репарация.
 MMR млекопитающих • 9 генов: • MLH 1, MLH 3, PMS 1 -2, MSH 2 -6 MSH – гомолог Mut. S MLH – гомолог Mut. L MSH 2 -6 гетеродимер репарирует 1 bp инсерции-делеции MSH 2 — 3 гетеродимер репарирует 1 -4 bp инсерции-делеции
MMR млекопитающих • 9 генов: • MLH 1, MLH 3, PMS 1 -2, MSH 2 -6 MSH – гомолог Mut. S MLH – гомолог Mut. L MSH 2 -6 гетеродимер репарирует 1 bp инсерции-делеции MSH 2 — 3 гетеродимер репарирует 1 -4 bp инсерции-делеции
 MMR человека На примере болезни HNPCC (heredity non-polyposis colorectal cancer) в 1993 -1994 гг. У человека найдено 6 белков Mut. S и 4 – Mut. L.
MMR человека На примере болезни HNPCC (heredity non-polyposis colorectal cancer) в 1993 -1994 гг. У человека найдено 6 белков Mut. S и 4 – Mut. L.
 MMR человека На примере болезни HNPCC (heredity non-polyposis colorectal cancer) в 1993 -1994 гг. • Пациенты с HNPCC имеют дефектную репарацию мисматчей ( MMR ). • Наиболее часто мутируют человеческие гомологи Mut. S и Mut. L — h. MSH 2 и h. MLH 1. • Последний может инактивироваться гиперметилированием. • У человека MMR устроена сложнее и представлена, по крайней мере, 6 -ю Mut. S и 4 -я Mut. L гомологами
MMR человека На примере болезни HNPCC (heredity non-polyposis colorectal cancer) в 1993 -1994 гг. • Пациенты с HNPCC имеют дефектную репарацию мисматчей ( MMR ). • Наиболее часто мутируют человеческие гомологи Mut. S и Mut. L — h. MSH 2 и h. MLH 1. • Последний может инактивироваться гиперметилированием. • У человека MMR устроена сложнее и представлена, по крайней мере, 6 -ю Mut. S и 4 -я Mut. L гомологами
 Комбинация генов при репарации мисматчей
Комбинация генов при репарации мисматчей
 Показатели риска заболевания раком ( Standardized incidence ratios — SIRs ) на основании популяционных и клинических исследований дефекта MMR
Показатели риска заболевания раком ( Standardized incidence ratios — SIRs ) на основании популяционных и клинических исследований дефекта MMR
 Механизмы, осуществляющие вклад в специфичность клеточных типов, чувствительных к дефициту MMR
Механизмы, осуществляющие вклад в специфичность клеточных типов, чувствительных к дефициту MMR
 1. 2. UVR репарация A + B A B + A T P BA B C Н а д р е з с к а ж д о й с т о р о н ы+ A T P U V R D — г л и к о з и л а з а о с в о б о ж д а е т Д Н К м е ж д у 2 — м я р а з р ы в а м и , в ы р е з а е т п о в р е ж д е н н ы й у ч a с т о к. Д Н К п о л и м е р а з а 1 ( I I I , I I I ) з а в е р ш а е т с и н т е з.
1. 2. UVR репарация A + B A B + A T P BA B C Н а д р е з с к а ж д о й с т о р о н ы+ A T P U V R D — г л и к о з и л а з а о с в о б о ж д а е т Д Н К м е ж д у 2 — м я р а з р ы в а м и , в ы р е з а е т п о в р е ж д е н н ы й у ч a с т о к. Д Н К п о л и м е р а з а 1 ( I I I , I I I ) з а в е р ш а е т с и н т е з.
 SOS- мутагенез у бактерийumu. DC Rec A* Umu. D* Umu. CUmu. D* Umu. C Umu. D Umu. C Lex. A Ñòèìóë ÀêòèâíûéÍåàêòèâíûé Lex.
SOS- мутагенез у бактерийumu. DC Rec A* Umu. D* Umu. CUmu. D* Umu. C Umu. D Umu. C Lex. A Ñòèìóë ÀêòèâíûéÍåàêòèâíûé Lex.
 2. Прямая репарация Репарируются О 6 -метилгуанин и О 4 -метилгуанин ферментом МТаза ( MGMT). У Е. coli 2 фермента (гены ada и ogt ). Если нет активности, то О 6 -м. Г может спариваться с Т, тогда GC AT. В случае О 4 -м. Г транзиция – AT G
2. Прямая репарация Репарируются О 6 -метилгуанин и О 4 -метилгуанин ферментом МТаза ( MGMT). У Е. coli 2 фермента (гены ada и ogt ). Если нет активности, то О 6 -м. Г может спариваться с Т, тогда GC AT. В случае О 4 -м. Г транзиция – AT G
 Пример реакции
Пример реакции
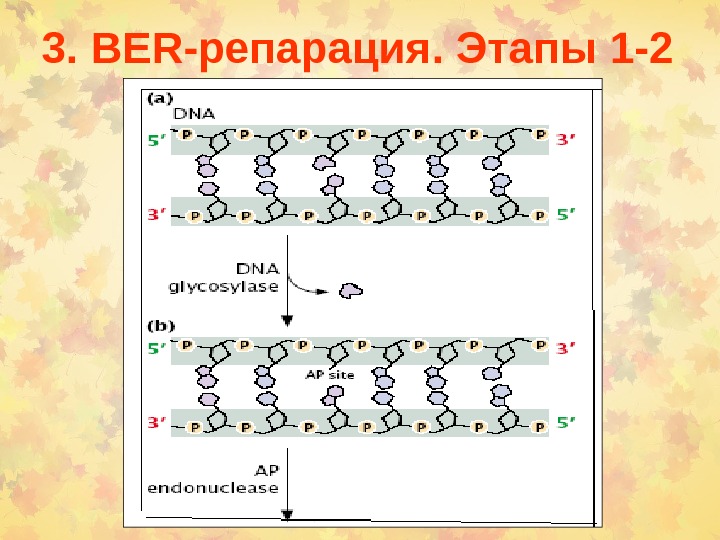
 3. BER -репарация. Этапы 1 —
3. BER -репарация. Этапы 1 —
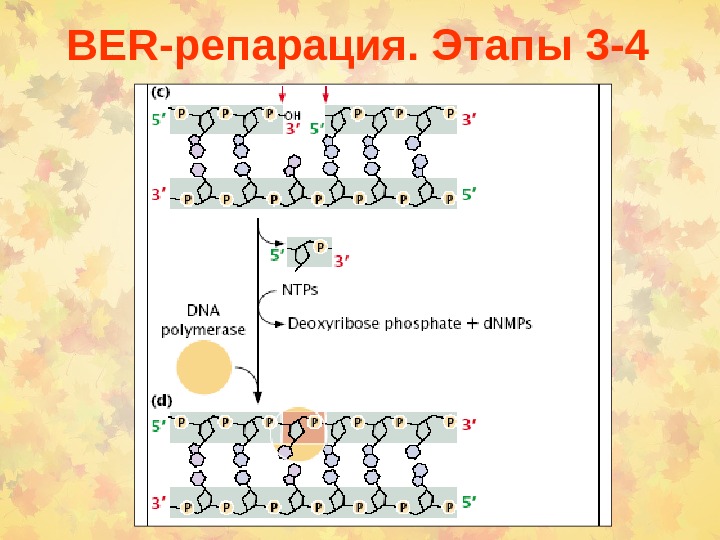
 BER -репарация. Этапы 3 —
BER -репарация. Этапы 3 —
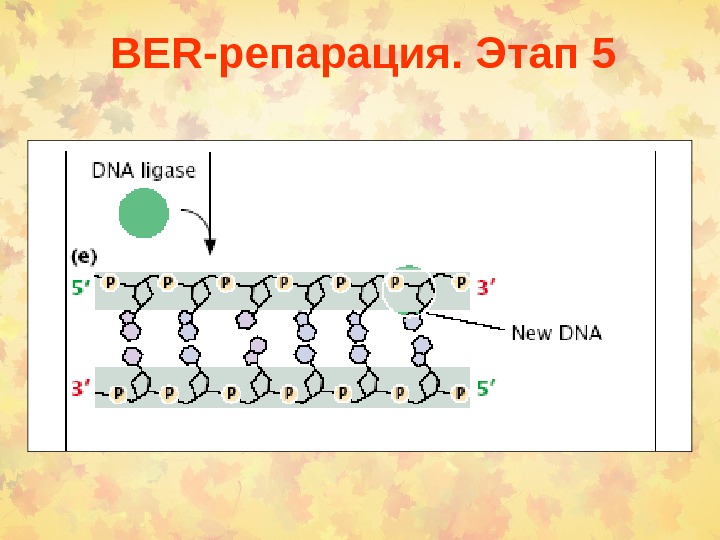
 BER -репарация. Этап
BER -репарация. Этап

 4. NER -репарация • 1. TCR – transcription coupled repair (преимущественная репарация траснкрибируемых цепей гена) • 2. GGR – global genome repair (оставшаяся часть генома) NER репарирует многочисленные повреждения ДНК. В процесс вовлечены продукты более 30 -ти генов.
4. NER -репарация • 1. TCR – transcription coupled repair (преимущественная репарация траснкрибируемых цепей гена) • 2. GGR – global genome repair (оставшаяся часть генома) NER репарирует многочисленные повреждения ДНК. В процесс вовлечены продукты более 30 -ти генов.
 Больные пигментной ксеродермой ( Выявлена в 1968 г. Дефект одного из 7 или более XP генов
Больные пигментной ксеродермой ( Выявлена в 1968 г. Дефект одного из 7 или более XP генов
 Больные TTD трихотиодистрофией (А) и CS кокаиновым синдромом ( В)
Больные TTD трихотиодистрофией (А) и CS кокаиновым синдромом ( В)
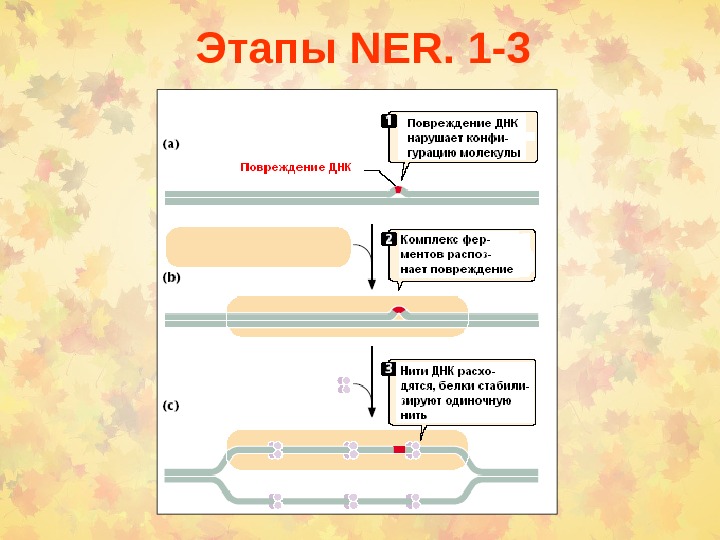
 Этапы NER. 1 —
Этапы NER. 1 —
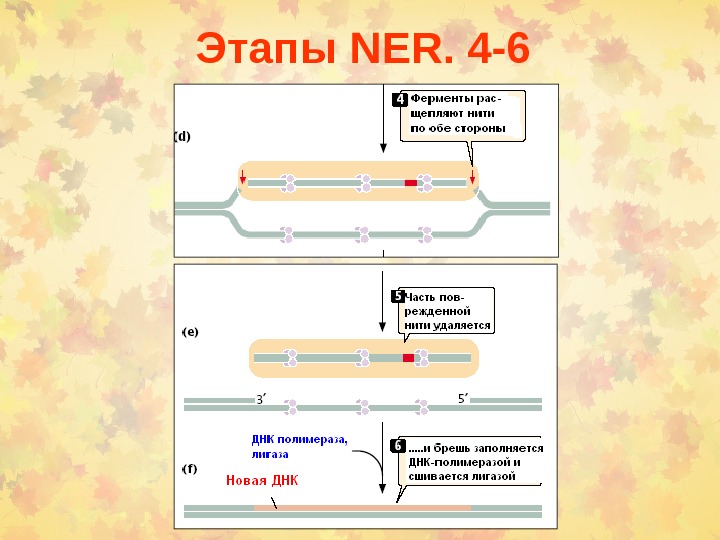
 Этапы NER. 4 —
Этапы NER. 4 —
 Биохимия NER (Этапы 1 -3)
Биохимия NER (Этапы 1 -3)
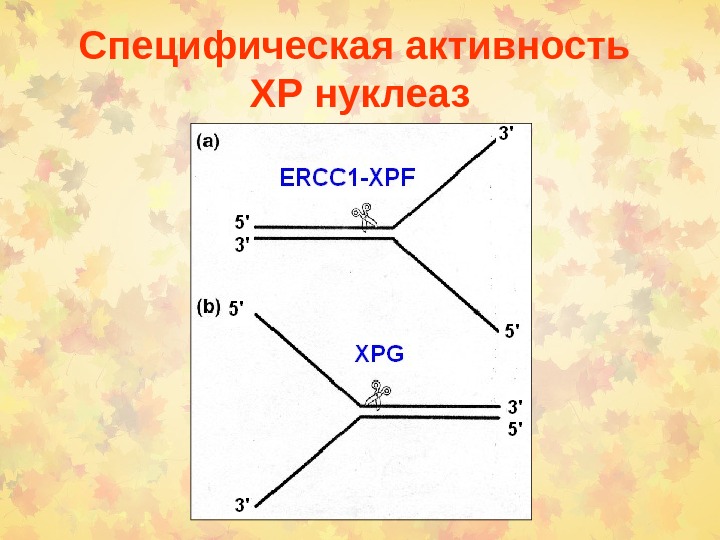
 Специфическая активность ХР нуклеаз
Специфическая активность ХР нуклеаз
 Биохимия NER (Этапы 4 -5)
Биохимия NER (Этапы 4 -5)
 Повреждение ХР при болезнях • ХР – мутации в генах XP A-D, F, G • TTD – серо-дефицитные хрупкие волосы, малый рост, задержка умственного развития, кожи напоминает рыбью чешую, чувствительны к солнцу, г. о. поврежден ген ХР D – нарушается функции TFIIH , выполняющего функции ФТ, возможно, участвующего в регуляции серосодержащих белков. • CS – карликовость, потеря жировой ткани, задержка умственного развития, катаракта ретины, кариес зубов, острая чувствительность к солнцу
Повреждение ХР при болезнях • ХР – мутации в генах XP A-D, F, G • TTD – серо-дефицитные хрупкие волосы, малый рост, задержка умственного развития, кожи напоминает рыбью чешую, чувствительны к солнцу, г. о. поврежден ген ХР D – нарушается функции TFIIH , выполняющего функции ФТ, возможно, участвующего в регуляции серосодержащих белков. • CS – карликовость, потеря жировой ткани, задержка умственного развития, катаракта ретины, кариес зубов, острая чувствительность к солнцу
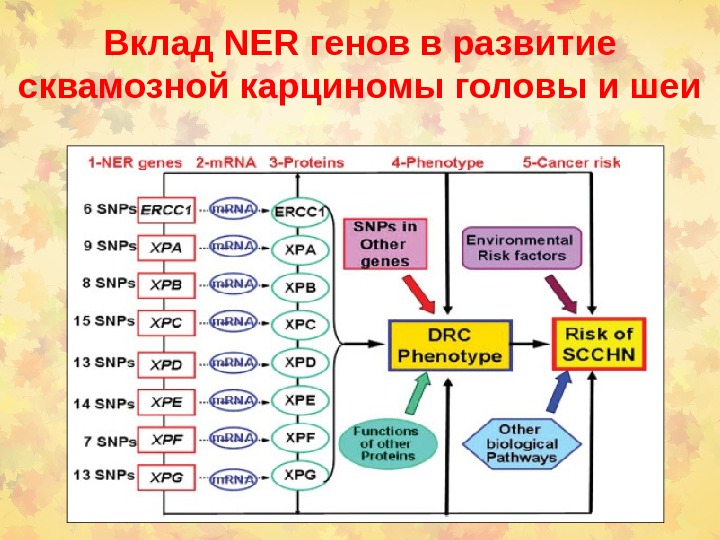
 Вклад NER генов в развитие сквамозной карциномы головы и шеи
Вклад NER генов в развитие сквамозной карциномы головы и шеи
 Роль pol l. I в репарации Когда pol II взаимодействует с промотором, она находится в гипофосфорилированном статусе (‘ 0’). В этом виде она не распознается Rsp 5 Ub-ligase. Инициация требует фосфорилирование 5 -го остатка серина (‘ 5’) в CTD повторах Rpb 1, что препятствует распознаванию Rsp 5. Так как pol II продолжает процесс элонгации , происходит последовательное фосфорилирование серинового остатка 2 (‘ 2’) в CTD, что конкурирует с образованием Rsp 5–Rpb 1. После элонгации pol II происходит остановка транскрипции при повреждении ДНК (красный ‘ X ’) или из-за компактного хроматина (красные цилиндры). ( B ) Прекращение 2 -фосфорилирования а pol II приводит к образованию Rad 26/Def 1 комплекса и, вероятно, Rsp 5.
Роль pol l. I в репарации Когда pol II взаимодействует с промотором, она находится в гипофосфорилированном статусе (‘ 0’). В этом виде она не распознается Rsp 5 Ub-ligase. Инициация требует фосфорилирование 5 -го остатка серина (‘ 5’) в CTD повторах Rpb 1, что препятствует распознаванию Rsp 5. Так как pol II продолжает процесс элонгации , происходит последовательное фосфорилирование серинового остатка 2 (‘ 2’) в CTD, что конкурирует с образованием Rsp 5–Rpb 1. После элонгации pol II происходит остановка транскрипции при повреждении ДНК (красный ‘ X ’) или из-за компактного хроматина (красные цилиндры). ( B ) Прекращение 2 -фосфорилирования а pol II приводит к образованию Rad 26/Def 1 комплекса и, вероятно, Rsp 5.
 Rad 26 создает NER комплекс в сайте повреждения. В то же время Rsp 5 ( и Ubc 5 , не показано ) начинают строить Ub- цепь на Rpb 1, инициируя ‘Ub clock’, действие которых может замедляться Ubp 3 деубиквитинилирующимферментом. Когда часы работают, факторы, такие как TFIIS— запускающие обратный механизм для pol II— и модулирующие хроматин комплексы, такие как FACT , делают попытку либо запустить NER, либо очистить нуклеосомный блок. (D) Если транскрипция регулируется часами, она начинается ( слева ). Если время действия Ub-clock истекает, комплекс pol II разрушается , разрешая доступ к ДНК GGR или хроматин ремодулирующую систему
Rad 26 создает NER комплекс в сайте повреждения. В то же время Rsp 5 ( и Ubc 5 , не показано ) начинают строить Ub- цепь на Rpb 1, инициируя ‘Ub clock’, действие которых может замедляться Ubp 3 деубиквитинилирующимферментом. Когда часы работают, факторы, такие как TFIIS— запускающие обратный механизм для pol II— и модулирующие хроматин комплексы, такие как FACT , делают попытку либо запустить NER, либо очистить нуклеосомный блок. (D) Если транскрипция регулируется часами, она начинается ( слева ). Если время действия Ub-clock истекает, комплекс pol II разрушается , разрешая доступ к ДНК GGR или хроматин ремодулирующую систему
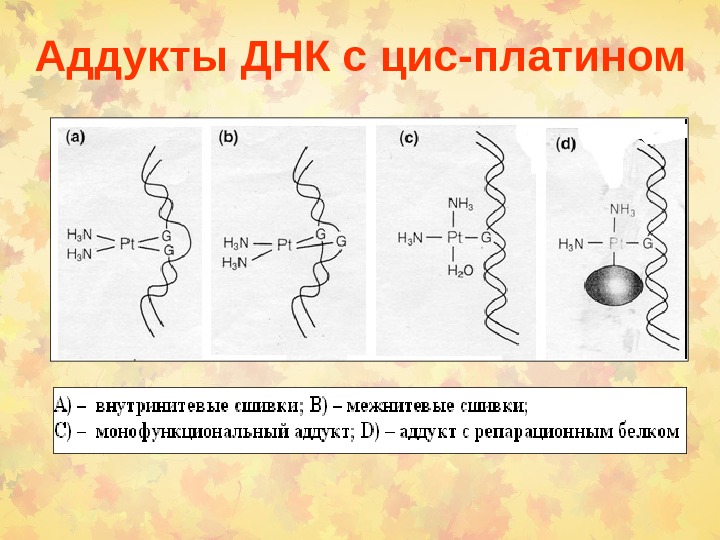
 Аддукты ДНК с цис-платином
Аддукты ДНК с цис-платином
 Репарация аддуктов ДНК с цис-платином
Репарация аддуктов ДНК с цис-платином
 5. Другие виды репарации ДНК
5. Другие виды репарации ДНК
 Альтернативный механизм репарации у дрожжей S. pombe
Альтернативный механизм репарации у дрожжей S. pombe
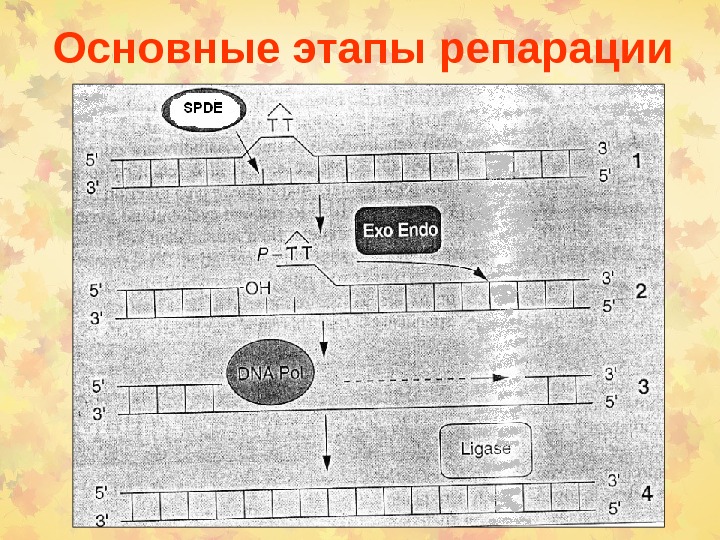
 Основные этапы репарации
Основные этапы репарации
 Белки ATM • ATM (=» a taxia t elangiectasia m utated «) получила название от болезни, пациенты, среди прочего, имеют высокий риск заболевания раком Белки АТМ : • — распознают повреждения ДНК, особенно двунитевые разрывы ( DSB ) • — выполняют функцию, подобную р53 • — поддерживают нормальную длину теломер
Белки ATM • ATM (=» a taxia t elangiectasia m utated «) получила название от болезни, пациенты, среди прочего, имеют высокий риск заболевания раком Белки АТМ : • — распознают повреждения ДНК, особенно двунитевые разрывы ( DSB ) • — выполняют функцию, подобную р53 • — поддерживают нормальную длину теломер
 Примеры ICL , вызванных антираковыми агентами
Примеры ICL , вызванных антираковыми агентами
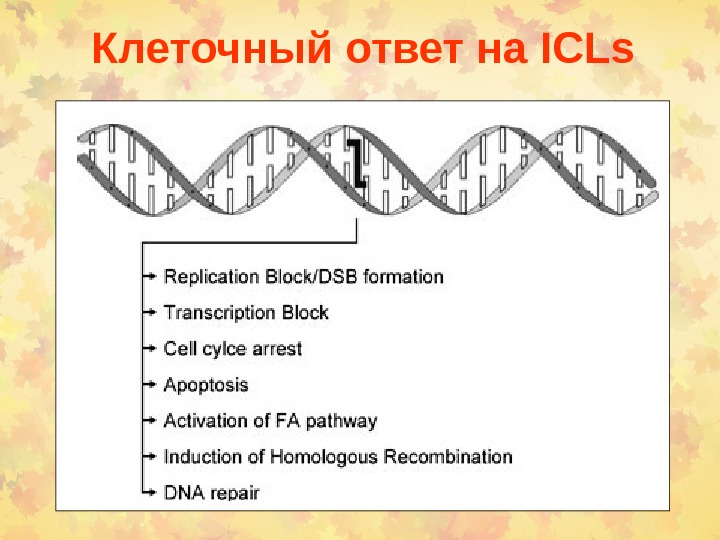
 Клеточный ответ на ICLs
Клеточный ответ на ICLs
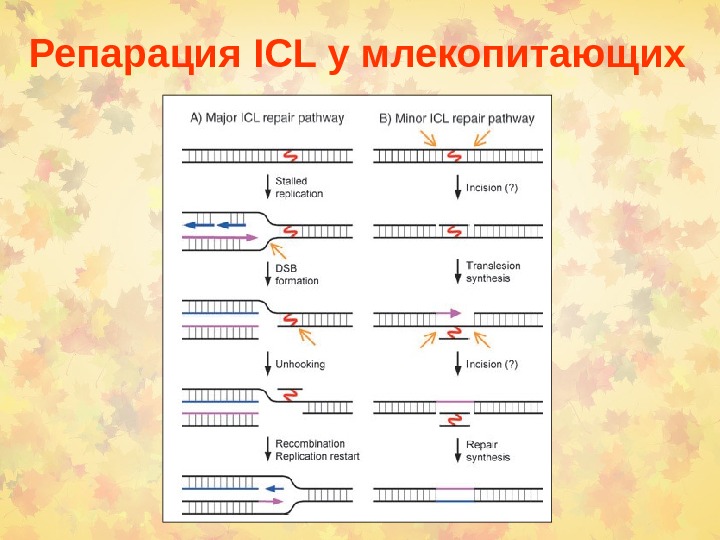
 Репарация ICL у млекопитающих
Репарация ICL у млекопитающих
 Fanconi Anemia (FA) путь репарации • У пациентов с FA повреждено, по крайней мере, 13 генов: FANCA, B, C, D 1/BRCA 2, D 2, E, F, G/XRCC 9, I, J/BRIP 1/BACH 1, L, M/Hef и N/PAL
Fanconi Anemia (FA) путь репарации • У пациентов с FA повреждено, по крайней мере, 13 генов: FANCA, B, C, D 1/BRCA 2, D 2, E, F, G/XRCC 9, I, J/BRIP 1/BACH 1, L, M/Hef и N/PAL
 Сравнение FA генов у человека , Drosophila, Dictyostelium and C. elegans
Сравнение FA генов у человека , Drosophila, Dictyostelium and C. elegans
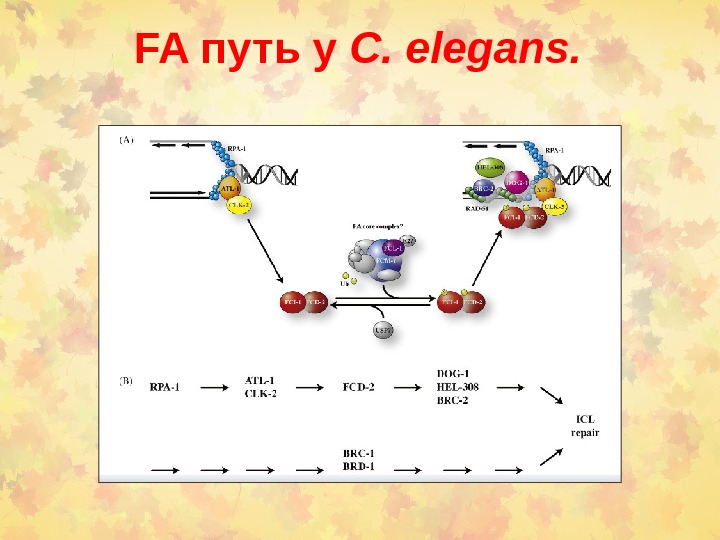
 FA путь у C. elegans.
FA путь у C. elegans.
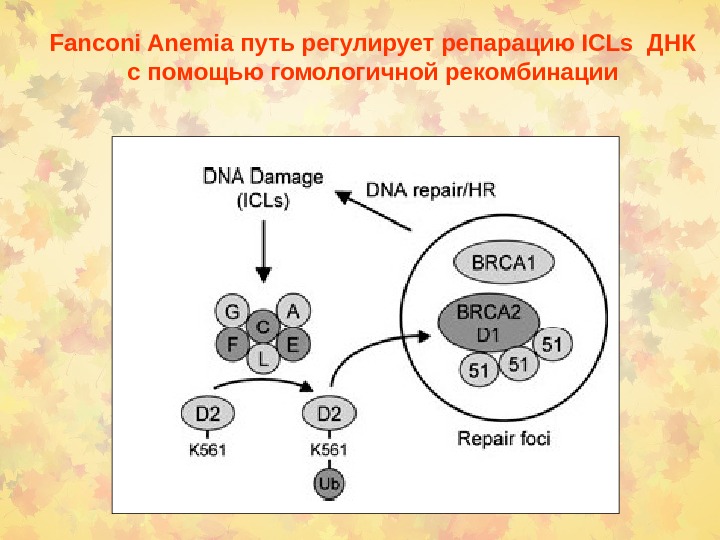
 Fanconi Anemia путь регулирует репарацию ICLs ДНК с помощью гомологичной рекомбинации
Fanconi Anemia путь регулирует репарацию ICLs ДНК с помощью гомологичной рекомбинации

 SUMO (small ubiquitin-related modifier) конъюгация Несколько SUMO E 3 лигаз выявлено : SP-RING (secretory protein with a RING finger domain) type, PIAS [protein inhibitor of activated STAT (signal transducer and activator of transcription)] и Nse 2/MMS 21 (methylmethane sulfonate 21), Ran. BP 2 (Ran-binding protein 2) в ядерных порах , Polycomb protein 2 и TOPORS (topoisomerase. I binding, arginine/serine-rich), a RING E 3 для обоих : SUMO и ubiquitin. SUMO формируется из пептидного предшественника и расщепляется одной или более из 6 — ти SUMO протеаз SENP [SUMO 1/ sentrin/SMT 3 (suppressor ofmif two 3 homologue 1)-specific peptidase 2.
SUMO (small ubiquitin-related modifier) конъюгация Несколько SUMO E 3 лигаз выявлено : SP-RING (secretory protein with a RING finger domain) type, PIAS [protein inhibitor of activated STAT (signal transducer and activator of transcription)] и Nse 2/MMS 21 (methylmethane sulfonate 21), Ran. BP 2 (Ran-binding protein 2) в ядерных порах , Polycomb protein 2 и TOPORS (topoisomerase. I binding, arginine/serine-rich), a RING E 3 для обоих : SUMO и ubiquitin. SUMO формируется из пептидного предшественника и расщепляется одной или более из 6 — ти SUMO протеаз SENP [SUMO 1/ sentrin/SMT 3 (suppressor ofmif two 3 homologue 1)-specific peptidase 2.
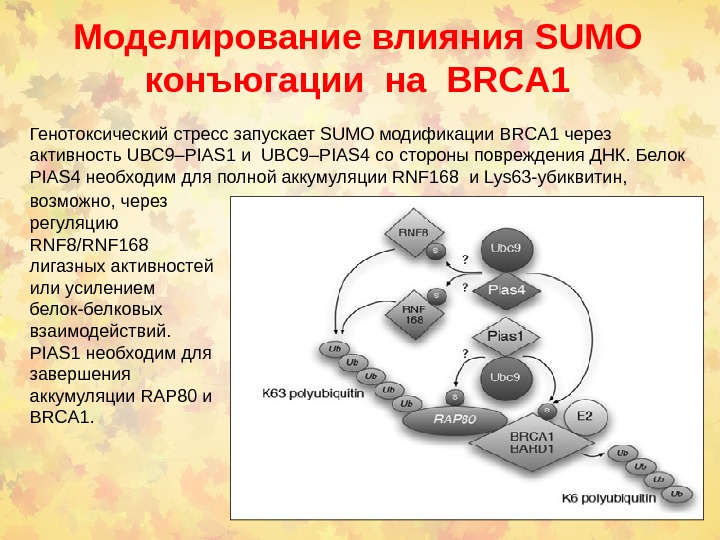
 Моделирование влияния SUMO конъюгации на BRCA 1 Генотоксический стресс запускает SUMO модификации BRCA 1 через активность UBC 9–PIAS 1 и UBC 9–PIAS 4 со стороны повреждения ДНК. Белок PIAS 4 необходим для полной аккумуляции RNF 168 и Lys 63 -убиквитин, возможно, через регуляцию RNF 8/RNF 168 лигазных активностей или усилением белок-белковых взаимодействий. PIAS 1 необходим для завершения аккумуляции RAP 80 и BRCA 1.
Моделирование влияния SUMO конъюгации на BRCA 1 Генотоксический стресс запускает SUMO модификации BRCA 1 через активность UBC 9–PIAS 1 и UBC 9–PIAS 4 со стороны повреждения ДНК. Белок PIAS 4 необходим для полной аккумуляции RNF 168 и Lys 63 -убиквитин, возможно, через регуляцию RNF 8/RNF 168 лигазных активностей или усилением белок-белковых взаимодействий. PIAS 1 необходим для завершения аккумуляции RAP 80 и BRCA 1.
 IY. Эпигенетические модификации ДНК • Модификации хроматина , • Метилирование ДНК , • Геномный импринтинг.
IY. Эпигенетические модификации ДНК • Модификации хроматина , • Метилирование ДНК , • Геномный импринтинг.
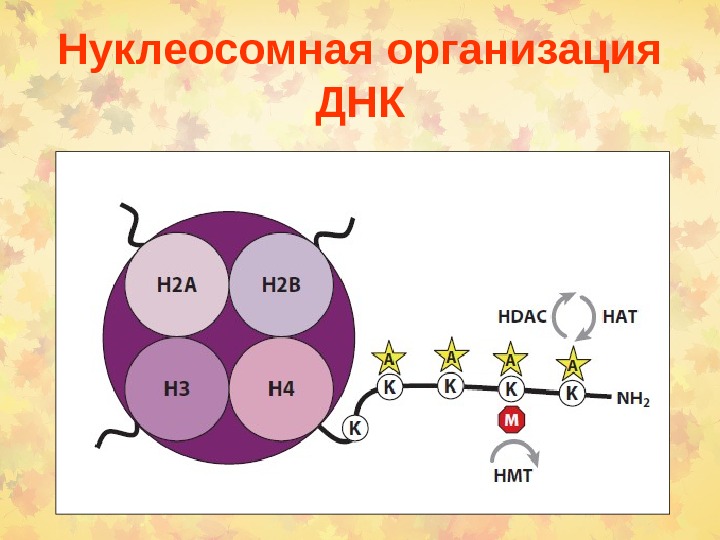
 Нуклеосомная организация ДНК
Нуклеосомная организация ДНК
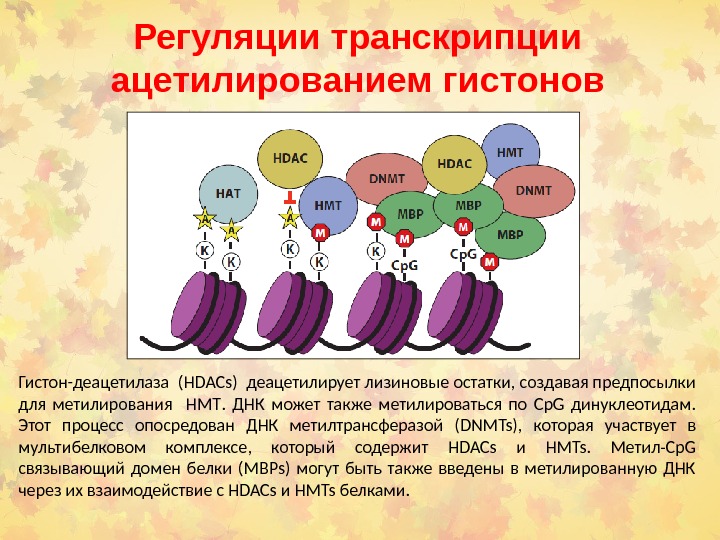
 Регуляции транскрипции ацетилированием гистонов Гистон-деацетилаза ( HDACs ) деацетилирует лизиновые остатки, создавая предпосылки для метилирования HMT. ДНК может также метилироваться по Cp. G динуклеотидам. Этот процесс опосредован ДНК метилтрансферазой ( DNMTs ), которая участвует в мультибелковом комплексе, который содержит HDACs и HMTs. Метил- Cp. G связывающий домен белки ( MBPs ) могут быть также введены в метилированную ДНК через их взаимодействие с HDACs и HMTs белками.
Регуляции транскрипции ацетилированием гистонов Гистон-деацетилаза ( HDACs ) деацетилирует лизиновые остатки, создавая предпосылки для метилирования HMT. ДНК может также метилироваться по Cp. G динуклеотидам. Этот процесс опосредован ДНК метилтрансферазой ( DNMTs ), которая участвует в мультибелковом комплексе, который содержит HDACs и HMTs. Метил- Cp. G связывающий домен белки ( MBPs ) могут быть также введены в метилированную ДНК через их взаимодействие с HDACs и HMTs белками.
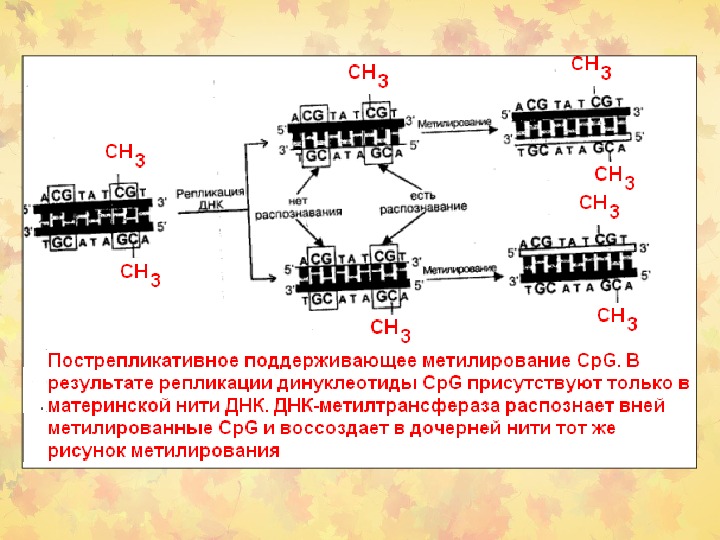
 Метилирование ДНК
Метилирование ДНК

 Распределение метилирования
Распределение метилирования
 Статус метилирования и функциональные особенности промоторов, содержащих Cp. G -островки
Статус метилирования и функциональные особенности промоторов, содержащих Cp. G -островки

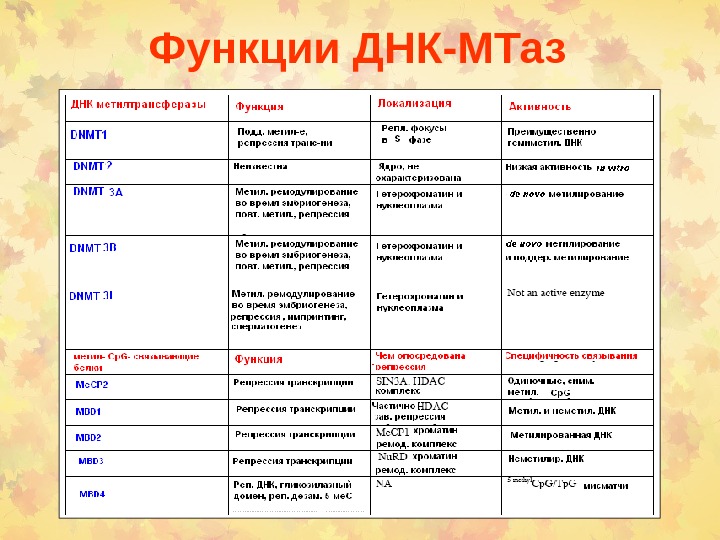
 Функции ДНК-МТаз
Функции ДНК-МТаз
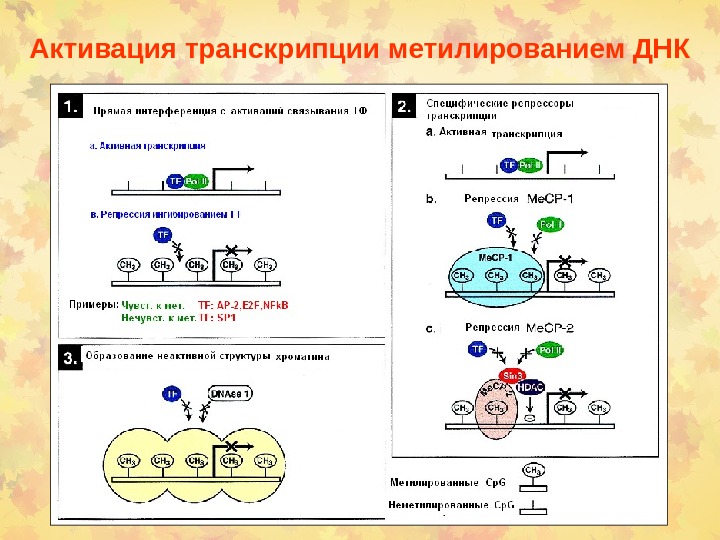
 Активация транскрипции метилированием ДНК
Активация транскрипции метилированием ДНК

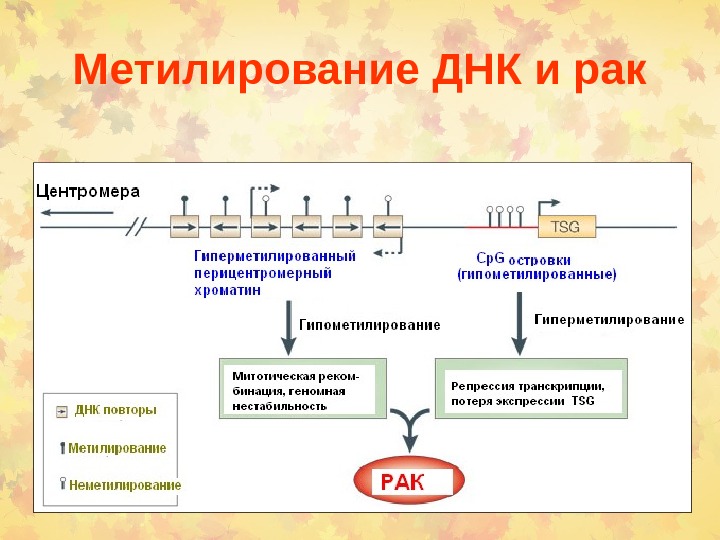
 Метилирование ДНК и рак
Метилирование ДНК и рак
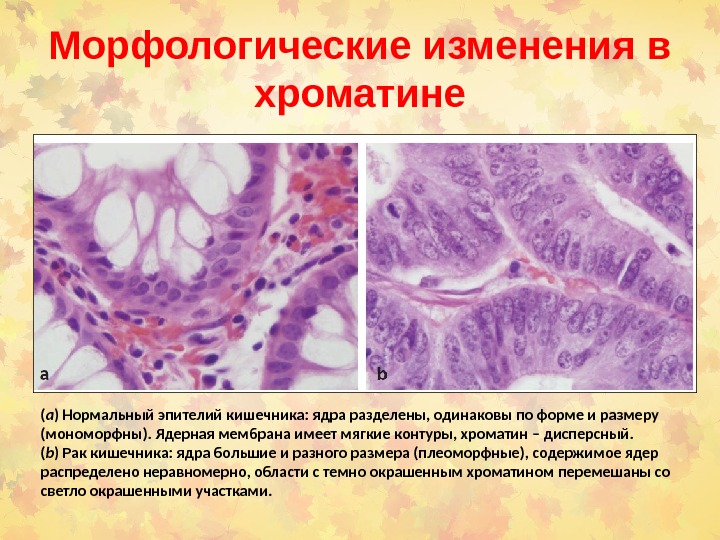
 Морфологические изменения в хроматине ( a ) Нормальный эпителий кишечника: ядра разделены, одинаковы по форме и размеру (мономорфны). Ядерная мембрана имеет мягкие контуры , хроматин – дисперсный. ( b ) Рак кишечника: ядра большие и разного размера (плеоморфные), содержимое ядер распределено неравномерно, области с темно окрашенным хроматином перемешаны со светло окрашенными участками.
Морфологические изменения в хроматине ( a ) Нормальный эпителий кишечника: ядра разделены, одинаковы по форме и размеру (мономорфны). Ядерная мембрана имеет мягкие контуры , хроматин – дисперсный. ( b ) Рак кишечника: ядра большие и разного размера (плеоморфные), содержимое ядер распределено неравномерно, области с темно окрашенным хроматином перемешаны со светло окрашенными участками.
 Общие эпигенетические изменения при раке
Общие эпигенетические изменения при раке
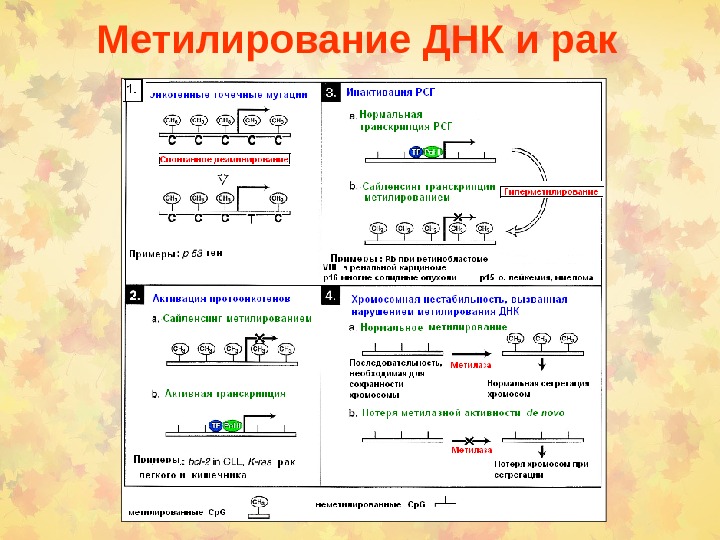
 Метилирование ДНК и рак
Метилирование ДНК и рак
 Эпигенетическая модель рака кишечника
Эпигенетическая модель рака кишечника
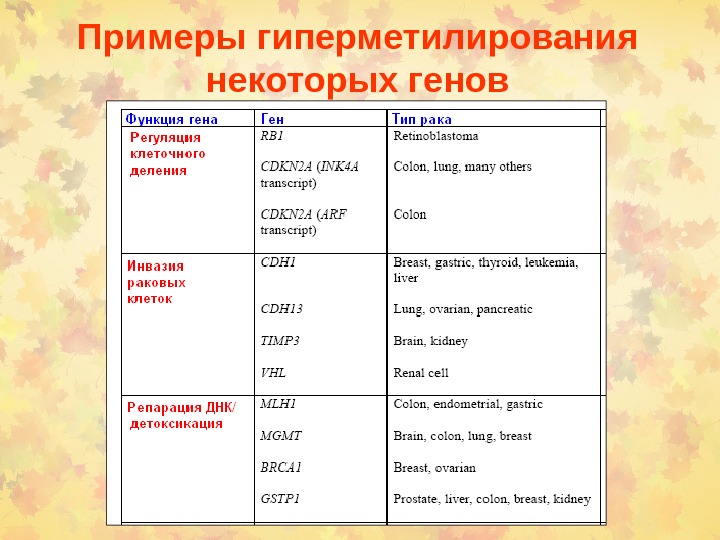
 Примеры гиперметилирования некоторых генов
Примеры гиперметилирования некоторых генов
 Примеры гиперметилирования некоторых генов
Примеры гиперметилирования некоторых генов
 Метод определения метилированного цитозина
Метод определения метилированного цитозина

