NEW-ММТП часть 6. Апоптоз.ppt
- Количество слайдов: 78
 Часть 6 Апоптоз
Часть 6 Апоптоз
 Сравнительная характеристика некроза и апоптоза Признак Апоптоз Некроз Распространенность Одиночная клетка Группа клеток Индукция Активируется физиологическими/или патологическими стимулами Различная в зависимости от повреждающего фактора Биохимические изменения Энергозависимая фрагментация ДНК эндогенными эндонуклеазами Лизосомы интактные Нарушение или прекращение ионного обмена. Из лизосом высвобождаются ферменты Распад ДНК Внутриядерная конденсация с расщеплением на фрагменты Диффузная локализация в некротизированной клетке Целостность клеточной мембраны Сохранена Нарушена Морфология Сморщивание клеток и фрагментация Набухание и лизис клеток Воспалительный ответ Нет Обычно есть Удаление погибших клеток Поглощение (фагоцитоз) соседними клетками Поглощение (фагоцитоз) нейтрофилами и макрофагами
Сравнительная характеристика некроза и апоптоза Признак Апоптоз Некроз Распространенность Одиночная клетка Группа клеток Индукция Активируется физиологическими/или патологическими стимулами Различная в зависимости от повреждающего фактора Биохимические изменения Энергозависимая фрагментация ДНК эндогенными эндонуклеазами Лизосомы интактные Нарушение или прекращение ионного обмена. Из лизосом высвобождаются ферменты Распад ДНК Внутриядерная конденсация с расщеплением на фрагменты Диффузная локализация в некротизированной клетке Целостность клеточной мембраны Сохранена Нарушена Морфология Сморщивание клеток и фрагментация Набухание и лизис клеток Воспалительный ответ Нет Обычно есть Удаление погибших клеток Поглощение (фагоцитоз) соседними клетками Поглощение (фагоцитоз) нейтрофилами и макрофагами
 Изменение ультраструктуры клеток при некрозе и апоптозе
Изменение ультраструктуры клеток при некрозе и апоптозе
 Последовательность событий при апоптозе (справа) и некрозе (слева)
Последовательность событий при апоптозе (справа) и некрозе (слева)
 Стадии реализации программы
Стадии реализации программы
 Функции апоптоза
Функции апоптоза
 Стадии апоптоза • 1. Индукция. Изменения в клеточном окружении, приводящие к активации апоптоза через R и СТ • 2. Исполнение. Клетка решает войти в апоптоз. • 3. Дегенерация. События, связанные с конечным развертыванием клеточных процессов, позволяющих подойти клетке к точке, откуда нет возврата.
Стадии апоптоза • 1. Индукция. Изменения в клеточном окружении, приводящие к активации апоптоза через R и СТ • 2. Исполнение. Клетка решает войти в апоптоз. • 3. Дегенерация. События, связанные с конечным развертыванием клеточных процессов, позволяющих подойти клетке к точке, откуда нет возврата.
 Индукторы и супрессоры апоптоза • Индукторы: дефицит ФР, глюкозы, УФ и гаммаизлучение, перекись, ПОЛ, ГК гормоны, ТХДД, ФНО, экспрессия проапоптотических генов сем. Bcl-2 цитолитические Т-лимфоциты, вирусы, химиотерапевтические лекарства и др. • Супрессоры: экспрессия антиапоптотических генов сем. Bcl-2, MDR, теломеразы, ингибиторы синтеза РНК и белков, мут. р53 и др.
Индукторы и супрессоры апоптоза • Индукторы: дефицит ФР, глюкозы, УФ и гаммаизлучение, перекись, ПОЛ, ГК гормоны, ТХДД, ФНО, экспрессия проапоптотических генов сем. Bcl-2 цитолитические Т-лимфоциты, вирусы, химиотерапевтические лекарства и др. • Супрессоры: экспрессия антиапоптотических генов сем. Bcl-2, MDR, теломеразы, ингибиторы синтеза РНК и белков, мут. р53 и др.
 Инициирующая точка клеточной гибели Стимул 1 Ядро Нестабильность хроматина (антрациклиновые антибиотики). Деградация теломеры 2 Митохондрия Нарушения в мтх. ДНК (мутации в комплексе I), ингибирование дыхания (антимицин). Индукция образования пор РТ (Са++), передислокация гексокиназы (клотримазол) 3 Эндоплазматический ретикулум Мутации в белке презенилин, накопление несобранных белков (туникамицин), деплеция Са++ 4 Цитоплазма Bcl 2 -белки – как мишени 5 Клеточная мембрана Рецепторы смерти (FAS, TNFa)
Инициирующая точка клеточной гибели Стимул 1 Ядро Нестабильность хроматина (антрациклиновые антибиотики). Деградация теломеры 2 Митохондрия Нарушения в мтх. ДНК (мутации в комплексе I), ингибирование дыхания (антимицин). Индукция образования пор РТ (Са++), передислокация гексокиназы (клотримазол) 3 Эндоплазматический ретикулум Мутации в белке презенилин, накопление несобранных белков (туникамицин), деплеция Са++ 4 Цитоплазма Bcl 2 -белки – как мишени 5 Клеточная мембрана Рецепторы смерти (FAS, TNFa)
 Сигналы к апоптозу
Сигналы к апоптозу
 Функциональные взаимодействия между каспазами
Функциональные взаимодействия между каспазами
 Сборка каспаз Общая структура прокаспаз и протеолитическое созревание расщеплением после остатков аспарагина. В результате генерируется большая с (р20) и малая (р10) субъединицы, в каждой из которых формируется активный центр (кружок). Два гетеродимера складываются в тетрамер.
Сборка каспаз Общая структура прокаспаз и протеолитическое созревание расщеплением после остатков аспарагина. В результате генерируется большая с (р20) и малая (р10) субъединицы, в каждой из которых формируется активный центр (кружок). Два гетеродимера складываются в тетрамер.
 Структурная организация каспаз Структура и доменная организация каспаз млекопитающих (a) Каталитический центр (петли L 1–L 4). Инициаторные каспазы имеют домены CARD (caspase recruitment domain) или DED (death effector domain_, тогда как у наказывающих каспаз короткий продомен. Активный сайт Cys - красный. Процессинг, который разделяет субъединицы p 20 и p 10 начинается в L 2. В результате большая порция L 2 петли одного мономера и небольшая L 2 соседнего мономера (L 20) вовлечение в процессинг (b и c). (b) Структура caspase 3, активный центр петли (L 1 -L 4, L 20), созданный на основе кристаллической структуры caspase-3 с ингибиторным пептидом (розовый) (c) Сайт активной конформации каспаз. Петли L 1 и L 3 – высоко консервативные, тогда как L 2 и L 4 отвечают за связывание с субстратом. CARD, ; DED,
Структурная организация каспаз Структура и доменная организация каспаз млекопитающих (a) Каталитический центр (петли L 1–L 4). Инициаторные каспазы имеют домены CARD (caspase recruitment domain) или DED (death effector domain_, тогда как у наказывающих каспаз короткий продомен. Активный сайт Cys - красный. Процессинг, который разделяет субъединицы p 20 и p 10 начинается в L 2. В результате большая порция L 2 петли одного мономера и небольшая L 2 соседнего мономера (L 20) вовлечение в процессинг (b и c). (b) Структура caspase 3, активный центр петли (L 1 -L 4, L 20), созданный на основе кристаллической структуры caspase-3 с ингибиторным пептидом (розовый) (c) Сайт активной конформации каспаз. Петли L 1 и L 3 – высоко консервативные, тогда как L 2 и L 4 отвечают за связывание с субстратом. CARD, ; DED,
 Лиганды и рецепторы • Лиганды: сем. гомотримерных лигандов TNF - Fas. L, TRAIL (Apo 2 L), TNF α и β, CD 40 L, CD 27 L, OX 40 L. • Рецепторы: FAS и др. рецепторы семейства TNF
Лиганды и рецепторы • Лиганды: сем. гомотримерных лигандов TNF - Fas. L, TRAIL (Apo 2 L), TNF α и β, CD 40 L, CD 27 L, OX 40 L. • Рецепторы: FAS и др. рецепторы семейства TNF
 Взаимодействие лиганда смерти TRAIL с рецептором
Взаимодействие лиганда смерти TRAIL с рецептором
 Зависимый от Fas-рецептора апоптоз при действии цитотоксического Т-лимфоцита
Зависимый от Fas-рецептора апоптоз при действии цитотоксического Т-лимфоцита
 два варианта рецептор-опосредованного апоптоза
два варианта рецептор-опосредованного апоптоза
 Передача КС при апоптозе
Передача КС при апоптозе
 Fas/FADD/pro-caspase комплекс образует Fas death-inducing signaling complex (DISC)
Fas/FADD/pro-caspase комплекс образует Fas death-inducing signaling complex (DISC)
 TNF-R 1 инициирует образование 2 -х комплексов Комплекс I (голубой) содержит TNF-R 1, адаптор TRADD, receptor interacting kinase (RIP), и TNF-receptor ssociated factor 2 (TRAF 2). TNF-α активирует NF-k. B путь, который индуцирует гены выживания c-FLIP. Позже из комплекса I диссоциируется и интернализируется TNF-R 1.
TNF-R 1 инициирует образование 2 -х комплексов Комплекс I (голубой) содержит TNF-R 1, адаптор TRADD, receptor interacting kinase (RIP), и TNF-receptor ssociated factor 2 (TRAF 2). TNF-α активирует NF-k. B путь, который индуцирует гены выживания c-FLIP. Позже из комплекса I диссоциируется и интернализируется TNF-R 1.
 Ключевая роль NF-k. B
Ключевая роль NF-k. B
 NF-k. B может блокировать апоптоз и некроз
NF-k. B может блокировать апоптоз и некроз
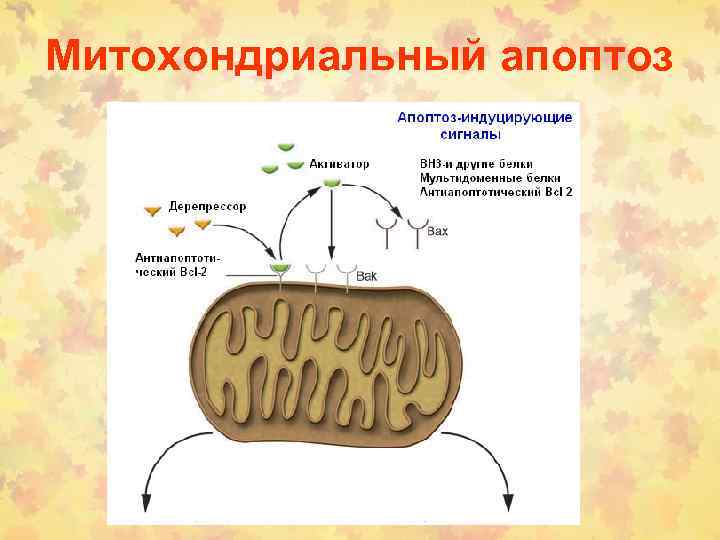 Митохондриальный апоптоз
Митохондриальный апоптоз

 Множество белков IMS (intermembrane space) высвобождается, когда активируются внутриклеточные сигналы индукции апоптоза Целостность OMM контролируется the Bcl-2 сем. BH-3 -белки активируются при стрессе. Bid, например, расщепляется многими протеазами (caspase-8, granzyme B и cathepsin B) в t. Bid, который взаимодействует с антиап. Bcl-2 белками и может напрямую активировать Bax. Другие BH-3 -белки ненапрямую активируют Bax, блокируя антиап. Bcl-2. Цитозольный cyt c запускает образование апоптосому через каскад каспаз. Для них много субстратов: ICAD, в результате активируется CAD, к. транслоцируется в ядро и начинает олигонуклеосомальную фрагментацию ДНК. IAPs предотвращает димеризацию caspase-9 и блокирует активные caspase-3 и -7. Smac/DIABLO (Smac) и Htr. A 2/OMI (Omi) нейтрализуют Ингибирующий эффект IAP связыванием с BIR 2 и BIR 3 доменами. Димерный Smac/DIABLO связывает BIR 1 и BIR 2, а Htr. A 2/ OMI преимущественно связывает BIR 2 белка XIAP. Кроме того, Omi может расщеплять IAPs благодаря серин-протеазной активности. Smac – субстрат для деградации УБ-протеосомами, находясь в C-terminal RING домене белка XIAP и c. IAP 1 и c. IAP 2. AIF и endonuclease G (endo G) переходят из мтх. В ядро, где расщепляют ДНК (независимо от каспаз).
Множество белков IMS (intermembrane space) высвобождается, когда активируются внутриклеточные сигналы индукции апоптоза Целостность OMM контролируется the Bcl-2 сем. BH-3 -белки активируются при стрессе. Bid, например, расщепляется многими протеазами (caspase-8, granzyme B и cathepsin B) в t. Bid, который взаимодействует с антиап. Bcl-2 белками и может напрямую активировать Bax. Другие BH-3 -белки ненапрямую активируют Bax, блокируя антиап. Bcl-2. Цитозольный cyt c запускает образование апоптосому через каскад каспаз. Для них много субстратов: ICAD, в результате активируется CAD, к. транслоцируется в ядро и начинает олигонуклеосомальную фрагментацию ДНК. IAPs предотвращает димеризацию caspase-9 и блокирует активные caspase-3 и -7. Smac/DIABLO (Smac) и Htr. A 2/OMI (Omi) нейтрализуют Ингибирующий эффект IAP связыванием с BIR 2 и BIR 3 доменами. Димерный Smac/DIABLO связывает BIR 1 и BIR 2, а Htr. A 2/ OMI преимущественно связывает BIR 2 белка XIAP. Кроме того, Omi может расщеплять IAPs благодаря серин-протеазной активности. Smac – субстрат для деградации УБ-протеосомами, находясь в C-terminal RING домене белка XIAP и c. IAP 1 и c. IAP 2. AIF и endonuclease G (endo G) переходят из мтх. В ядро, где расщепляют ДНК (независимо от каспаз).
 Модель образования протеосомы
Модель образования протеосомы
 Потеря экспрессии FADD дает раковой клетке преимущество выживание/рост
Потеря экспрессии FADD дает раковой клетке преимущество выживание/рост

 Активация каспаз
Активация каспаз
 CK-2 киназы – субстраты для каспаз
CK-2 киназы – субстраты для каспаз
 CK-2 киназы в митозе Схематическое изображение CK 2 a и CK 2 b с сайтами ф-я (треонины 344 и 360, серины 362 и 370 в CK 2 a, серин 209 в CK 2 b) черным. (B) Модель временной регуляции ф-я CK 2 a (C) Модель ф-ия CK 2 в митозе. После ф-ия CK 2 киназой Cdk 1, CK 2 a C-terminal ф. сайты могут связываться с пролил изомеразой Pin 1. Образование комплекса Pin 1, Topoisomerase II, и ф-ый CK 2 a вызывает снижение фия Topoisomerase II киназой CK 2. Митотическая киназа Plk 1 может также связаться с C-terminal CK 2 a по ф. сайту. Но функция этого взаимодействия неизвестна.
CK-2 киназы в митозе Схематическое изображение CK 2 a и CK 2 b с сайтами ф-я (треонины 344 и 360, серины 362 и 370 в CK 2 a, серин 209 в CK 2 b) черным. (B) Модель временной регуляции ф-я CK 2 a (C) Модель ф-ия CK 2 в митозе. После ф-ия CK 2 киназой Cdk 1, CK 2 a C-terminal ф. сайты могут связываться с пролил изомеразой Pin 1. Образование комплекса Pin 1, Topoisomerase II, и ф-ый CK 2 a вызывает снижение фия Topoisomerase II киназой CK 2. Митотическая киназа Plk 1 может также связаться с C-terminal CK 2 a по ф. сайту. Но функция этого взаимодействия неизвестна.
 Роль CK-2 в клеточных процессах
Роль CK-2 в клеточных процессах
 Состав семейства Bcl-2 генов
Состав семейства Bcl-2 генов
 Способы взаимодействия между белками Bcl-2
Способы взаимодействия между белками Bcl-2
 Meeting points Bcl-2
Meeting points Bcl-2
 Регуляция мтх. апоптоза (1)
Регуляция мтх. апоптоза (1)
 Регуляция мтх. апоптоза (2) (a) Модель реостата. Обычно в клетке равновесие. Дисбаланс белков bcl-2 семейства, например, повреждение ДНК, ведет к синтезу проапоптотических молекул и активации МОМР. Добавление GF может, напротив, увеличить синтез антиапоптотических белков. (b) Модель нейтрализации антиапоптотических белков. BH 3 only белки BID, BIM и PUMA вызывают mitochondrial outer membrane permeabilization, нейтрализуя анти-апоптотические белки.
Регуляция мтх. апоптоза (2) (a) Модель реостата. Обычно в клетке равновесие. Дисбаланс белков bcl-2 семейства, например, повреждение ДНК, ведет к синтезу проапоптотических молекул и активации МОМР. Добавление GF может, напротив, увеличить синтез антиапоптотических белков. (b) Модель нейтрализации антиапоптотических белков. BH 3 only белки BID, BIM и PUMA вызывают mitochondrial outer membrane permeabilization, нейтрализуя анти-апоптотические белки.
 Механизмы активации про-апоптотических белков (1) Модель прямой активации. (a) MOMP (mitochondrial outer membrane permeabilization) активируется через олигомеризацию BAX или BAK. Эти белки, один раз активируется BH 3 -only белком, образуют протеолипидные поры. (b) Прямой активатор BH 3 -only белков (e. g. BIM and BID) индуцирует олигомеризацию BAX или BAK при отсутствии других белков
Механизмы активации про-апоптотических белков (1) Модель прямой активации. (a) MOMP (mitochondrial outer membrane permeabilization) активируется через олигомеризацию BAX или BAK. Эти белки, один раз активируется BH 3 -only белком, образуют протеолипидные поры. (b) Прямой активатор BH 3 -only белков (e. g. BIM and BID) индуцирует олигомеризацию BAX или BAK при отсутствии других белков
 Механизмы активации про-апоптотических белков (2) (c) Подкласс белков BH 3 -only de-repressors/sensitizers, не могут сами активировать BAX или BAK. В этом случае прямой активатор белка BH 3 -only инактивируется анти-апоптотическим белком BCL-2. . Под действием стресса de-repressor/sensitizer BH 3 only белок индуцируется траснкрипционным механизмом или пост-тр. модифиукацией и этот белок связывается с анти-апоптотическим белком, ускоряя инактивацию direct activator BH 3 -only белка. В этом примере BIM секвестируется MCL-1 и индукция Noxa делает возможным взаимодействие BIM и MOMP. (d) MOMP активируются, когда de-repressor/sensitizer BH 3 -only белки конститутивно ингибируют antiapoptotic BCL-2 белки, и любая индукция BID или BIM не остается не вовлеченной в процесс. В этом сценарии лсуществляется ‘sensitized for death’. Белок BCL-x. L ингибируется BAD, в индукция BIM обеспечивает активацию MOMP. Если нет BAD, сигнал MOMP ингибируется BCL-x. L.
Механизмы активации про-апоптотических белков (2) (c) Подкласс белков BH 3 -only de-repressors/sensitizers, не могут сами активировать BAX или BAK. В этом случае прямой активатор белка BH 3 -only инактивируется анти-апоптотическим белком BCL-2. . Под действием стресса de-repressor/sensitizer BH 3 only белок индуцируется траснкрипционным механизмом или пост-тр. модифиукацией и этот белок связывается с анти-апоптотическим белком, ускоряя инактивацию direct activator BH 3 -only белка. В этом примере BIM секвестируется MCL-1 и индукция Noxa делает возможным взаимодействие BIM и MOMP. (d) MOMP активируются, когда de-repressor/sensitizer BH 3 -only белки конститутивно ингибируют antiapoptotic BCL-2 белки, и любая индукция BID или BIM не остается не вовлеченной в процесс. В этом сценарии лсуществляется ‘sensitized for death’. Белок BCL-x. L ингибируется BAD, в индукция BIM обеспечивает активацию MOMP. Если нет BAD, сигнал MOMP ингибируется BCL-x. L.
 Основные пути апоптоза (1)
Основные пути апоптоза (1)
 Основные пути апоптоза (2)
Основные пути апоптоза (2)
 Р 53 в регуляции апоптоза
Р 53 в регуляции апоптоза
 Интегральная схема регуляции
Интегральная схема регуляции
 Регуляция апоптоза ингибиторными белками (IAPs)
Регуляция апоптоза ингибиторными белками (IAPs)
 Различная организация BIR
Различная организация BIR
 Взаимодействие с каспазой 3 (а) и IPVA (b)
Взаимодействие с каспазой 3 (а) и IPVA (b)
 Взаимодействие с каспазой 9 (а) и Smac/DIABLO (b)
Взаимодействие с каспазой 9 (а) и Smac/DIABLO (b)
 Селективное связывание IAP белков
Селективное связывание IAP белков
 Баланс между убиквитиляцией и автоубиквитиляцией c. IAP 1 and c. IAP 2
Баланс между убиквитиляцией и автоубиквитиляцией c. IAP 1 and c. IAP 2
 Убиквитин-зависимый протеолиз Конъюгация Ub с белками-мишенями опосредована E 1, E 2 и E 3 белками. Ubactivating enzyme E 1 (ubiquitin-like modifier activating enzyme 1 [Uba-1] у млекопитающих) активирует Ub через ATP-зависимое образование тиолэфира. Ub-конъюгирующий фермент (E 2) получает Ub от E 1 и взаимодействует с E 3, транспортируя его к мишени. Обычно E 2 определяет связывание Ub, тогда как E 3 лигазы обеспечивают распознавание субстрата. Цепочки Ub синтезируются несколькими раундами присоединения Ub через остатки лизина (K 48 и K 63) как сайта конъюгации. Различные типы цепей используют различные с К 48, тогда как цепочки с К 63 линейные. В зависимости от типа модификации убиквитиляция имеет разный выход. Ub E 3 лигазы могут также быть предметом для авто-модификации для регуляции их количества.
Убиквитин-зависимый протеолиз Конъюгация Ub с белками-мишенями опосредована E 1, E 2 и E 3 белками. Ubactivating enzyme E 1 (ubiquitin-like modifier activating enzyme 1 [Uba-1] у млекопитающих) активирует Ub через ATP-зависимое образование тиолэфира. Ub-конъюгирующий фермент (E 2) получает Ub от E 1 и взаимодействует с E 3, транспортируя его к мишени. Обычно E 2 определяет связывание Ub, тогда как E 3 лигазы обеспечивают распознавание субстрата. Цепочки Ub синтезируются несколькими раундами присоединения Ub через остатки лизина (K 48 и K 63) как сайта конъюгации. Различные типы цепей используют различные с К 48, тогда как цепочки с К 63 линейные. В зависимости от типа модификации убиквитиляция имеет разный выход. Ub E 3 лигазы могут также быть предметом для авто-модификации для регуляции их количества.

 IAPs функция как E 3 лигаз и Ub рецепторы в TNF-signalling Доменная структура c. IAPs. BIR домены обеспечивают взаимодействие с субстратами, Ub связывающий UBA домен связывает poly. Ub. Домен CARD (caspase recruitment domain) – домен белок-белковых взаимодействий, не вовлечен в связывание с каспазами. С-домен RING необходим для E 3 лигазной активности, димеризации, это докинг сайт для E 2. Предсказанная структура 3 -х a-спиралей UBA-домена (зеленый) и а. к. остатки для формирования гидрофобной поверхности для Ub (содержит Met-Gly-Phe [MGF] и Leu-Leu [LL]). Структура димера c. IAP 2–RING показана справа.
IAPs функция как E 3 лигаз и Ub рецепторы в TNF-signalling Доменная структура c. IAPs. BIR домены обеспечивают взаимодействие с субстратами, Ub связывающий UBA домен связывает poly. Ub. Домен CARD (caspase recruitment domain) – домен белок-белковых взаимодействий, не вовлечен в связывание с каспазами. С-домен RING необходим для E 3 лигазной активности, димеризации, это докинг сайт для E 2. Предсказанная структура 3 -х a-спиралей UBA-домена (зеленый) и а. к. остатки для формирования гидрофобной поверхности для Ub (содержит Met-Gly-Phe [MGF] и Leu-Leu [LL]). Структура димера c. IAP 2–RING показана справа.
 Предполагаемые функции c. IAPs с. TNF-Rсигнальной пути. Стимуляция TNFa запускает образование «комплекса-I» на TNF-R, в котором c. IAP запускает K 63 убиквитилирование RIP 1. Эти линейные цепи Ub служат доккингом и активирующей платформой для IKK комплекса, который приводит к активации NF-k. B (p 65/p 50). c. IAPs также супрессирует death-inducing «комплекс-II’, который является активирующей платформой для каспазы-8, которая индуцирует смерть через свой собственный путь.
Предполагаемые функции c. IAPs с. TNF-Rсигнальной пути. Стимуляция TNFa запускает образование «комплекса-I» на TNF-R, в котором c. IAP запускает K 63 убиквитилирование RIP 1. Эти линейные цепи Ub служат доккингом и активирующей платформой для IKK комплекса, который приводит к активации NF-k. B (p 65/p 50). c. IAPs также супрессирует death-inducing «комплекс-II’, который является активирующей платформой для каспазы-8, которая индуцирует смерть через свой собственный путь.
 Интегральная схема СТ
Интегральная схема СТ
 Методы определения фрагментации ДНК
Методы определения фрагментации ДНК
 Детекция апоптоза
Детекция апоптоза
 Электрофореграмма ДНК при апоптозе
Электрофореграмма ДНК при апоптозе
 Олигонуклеосомная фрагментация ДНК при апоптозе
Олигонуклеосомная фрагментация ДНК при апоптозе
 Молекулярный имидж клеточной гибели
Молекулярный имидж клеточной гибели
 Гистологическое окрашивание срезов печени мыши (контрольных и обработанных anti-Fas) H&E staining of normal (A) and anti -Fas treated livers (B). TUNEL of normal (C) and anti-Fas treated livers (D) with clearly more positively stained cells. Caspase-3 shows a clear increase of positively stained cells in an anti-Fas treated liver (F) compared to a normal liver (E). Autoradiography images are shown for liver slices of mice injected with 99 m. Tc-HYNIC-cysanx. V before (G) and after treatment of the animals with anti-Fas (H).
Гистологическое окрашивание срезов печени мыши (контрольных и обработанных anti-Fas) H&E staining of normal (A) and anti -Fas treated livers (B). TUNEL of normal (C) and anti-Fas treated livers (D) with clearly more positively stained cells. Caspase-3 shows a clear increase of positively stained cells in an anti-Fas treated liver (F) compared to a normal liver (E). Autoradiography images are shown for liver slices of mice injected with 99 m. Tc-HYNIC-cysanx. V before (G) and after treatment of the animals with anti-Fas (H).
 In vivo planar image of a control rat and a rat with reperfused hepatic infarction at 7 h post injection of 99 m. Tc(CO)3 -bis-DTPA pamoate (A). Autoradiographs of 30 -μm liver slices of the necrotic liver (B, top row) and viable liver (B, bottom row) and scanned photographs of the same slices after H&E staining (C) staining show good correlation with the in vivo planar image.
In vivo planar image of a control rat and a rat with reperfused hepatic infarction at 7 h post injection of 99 m. Tc(CO)3 -bis-DTPA pamoate (A). Autoradiographs of 30 -μm liver slices of the necrotic liver (B, top row) and viable liver (B, bottom row) and scanned photographs of the same slices after H&E staining (C) staining show good correlation with the in vivo planar image.
 Апоптоз в опухоли после химиотерапии (А, В – не леченные, H&E и TUNEL окрашивание)
Апоптоз в опухоли после химиотерапии (А, В – не леченные, H&E и TUNEL окрашивание)
 Определение активности каспаз
Определение активности каспаз
 Определение каспаз
Определение каспаз
 Проточная цитометрия в определении апоптоза
Проточная цитометрия в определении апоптоза
 Определение мит. апоптоза
Определение мит. апоптоза
 Апоптоз в нейронах
Апоптоз в нейронах
 Апоптоз в нейронах
Апоптоз в нейронах
 Макрофаги в определении апоптоза
Макрофаги в определении апоптоза
 Взаимодействие макрофагов с апоптотическими клетками
Взаимодействие макрофагов с апоптотическими клетками
 Терапевтические мишени для ингибирования апоптоза (доклиническая стадия)
Терапевтические мишени для ингибирования апоптоза (доклиническая стадия)









