27893f8592113dc6f1bebf855ef20a02.ppt
- Количество слайдов: 26
 ЦЕНТЪР ПО МОЛЕКУЛНА МЕДИЦИНА Медицински Университет - София СБАЛАГ "МАй. ЧИН ДОМ" Теоретичен и практически курс на тема: „Съвременни молекулярно- генетични методи” High resolution melting analysis – високо ефективен и бърз метод за генотипиране на единични нуклеотидни замени и ДНК – метилиране в къси ампликони Рени Цвеова Стоян Бичев Stefano Pierini
ЦЕНТЪР ПО МОЛЕКУЛНА МЕДИЦИНА Медицински Университет - София СБАЛАГ "МАй. ЧИН ДОМ" Теоретичен и практически курс на тема: „Съвременни молекулярно- генетични методи” High resolution melting analysis – високо ефективен и бърз метод за генотипиране на единични нуклеотидни замени и ДНК – метилиране в къси ампликони Рени Цвеова Стоян Бичев Stefano Pierini
 1953 1983 2013 http: //www. nature. com/nature/dna 50/watsoncrick. pdf
1953 1983 2013 http: //www. nature. com/nature/dna 50/watsoncrick. pdf
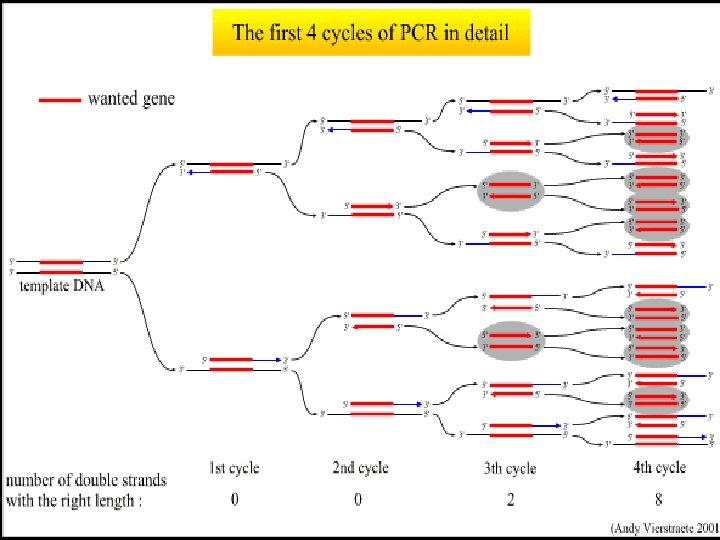
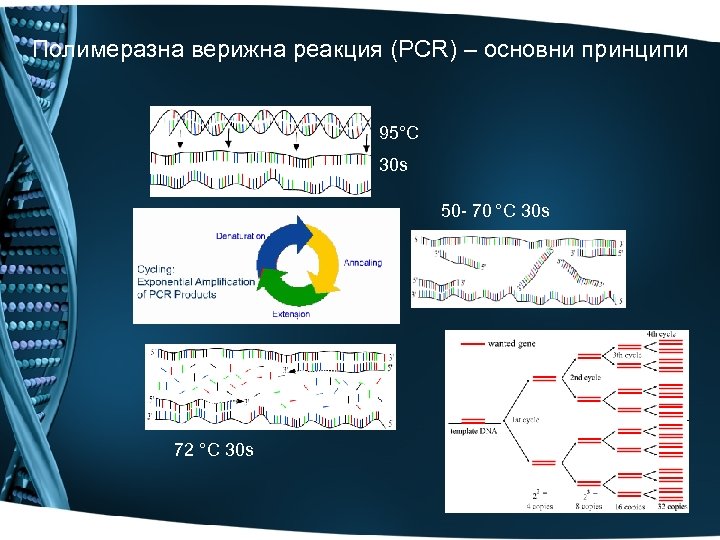 Полимеразна верижна реакция (PCR) – основни принципи 95°C 30 s 50 - 70 °C 30 s 72 °C 30 s
Полимеразна верижна реакция (PCR) – основни принципи 95°C 30 s 50 - 70 °C 30 s 72 °C 30 s
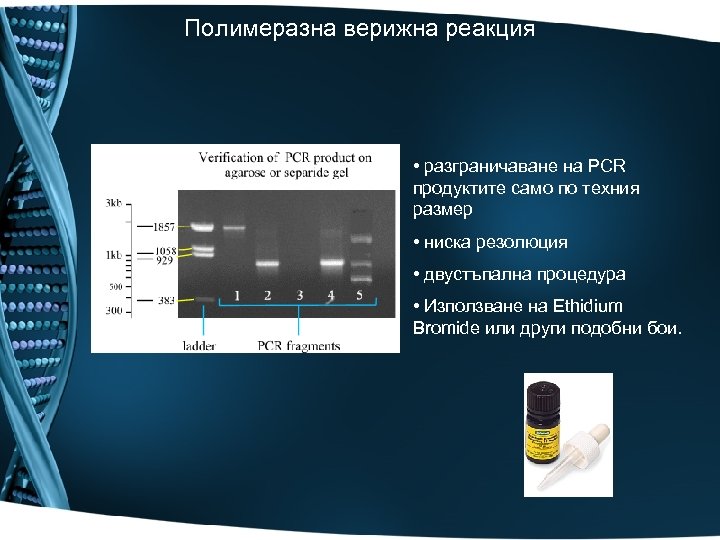 Полимеразна верижна реакция • разграничаване на PCR продуктите само по техния размер • ниска резолюция • двустъпална процедура • Използване на Ethidium Bromide или други подобни бои.
Полимеразна верижна реакция • разграничаване на PCR продуктите само по техния размер • ниска резолюция • двустъпална процедура • Използване на Ethidium Bromide или други подобни бои.
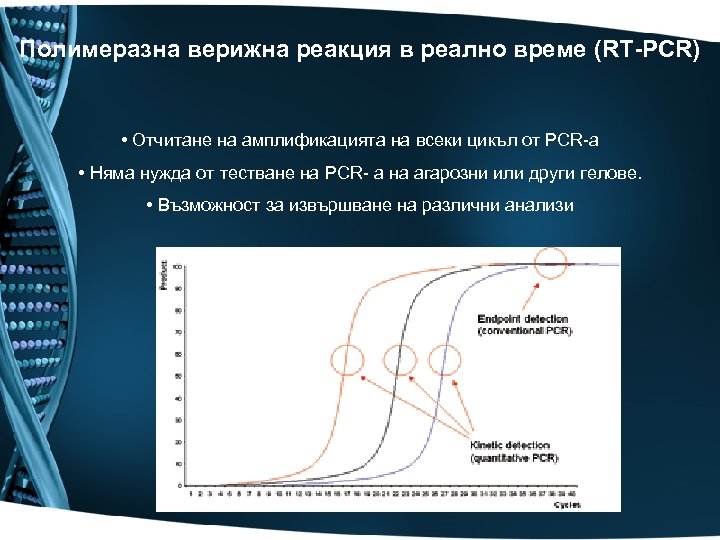 Полимеразна верижна реакция в реално време (RT-PCR) • Отчитане на амплификацията на всеки цикъл от PCR-a • Няма нужда от тестване на PCR- a на агарозни или други гелове. • Възможност за извършване на различни анализи
Полимеразна верижна реакция в реално време (RT-PCR) • Отчитане на амплификацията на всеки цикъл от PCR-a • Няма нужда от тестване на PCR- a на агарозни или други гелове. • Възможност за извършване на различни анализи
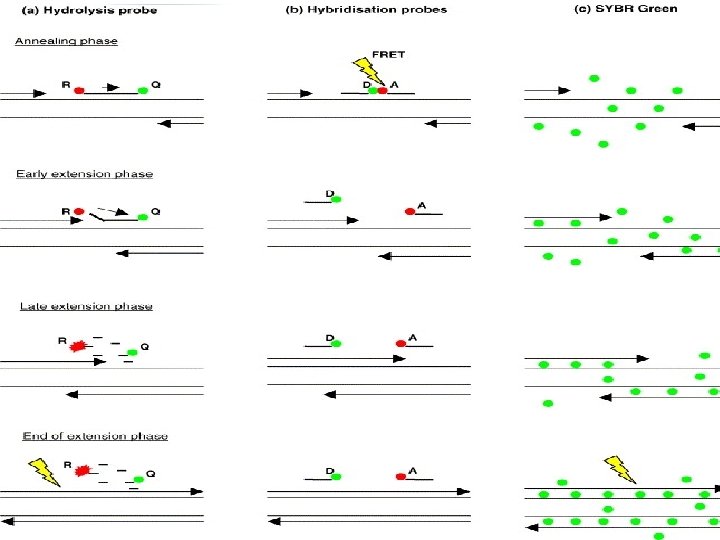 Видове полимеразна верижна реакция в реално време (RT-PCR)
Видове полимеразна верижна реакция в реално време (RT-PCR)
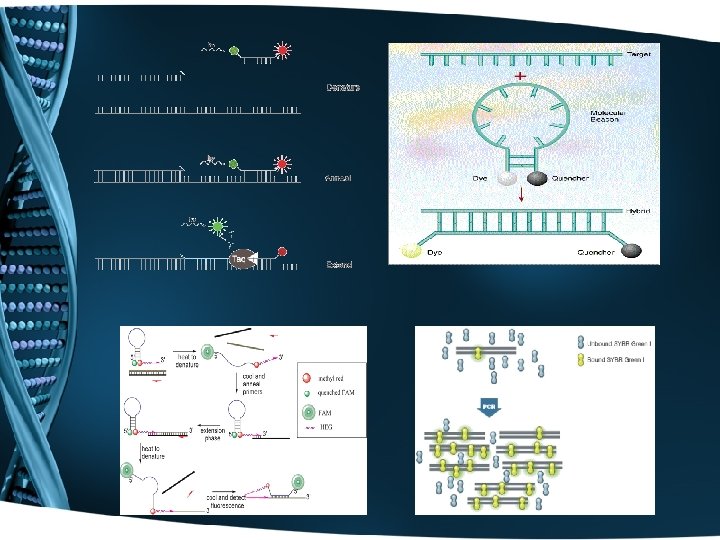
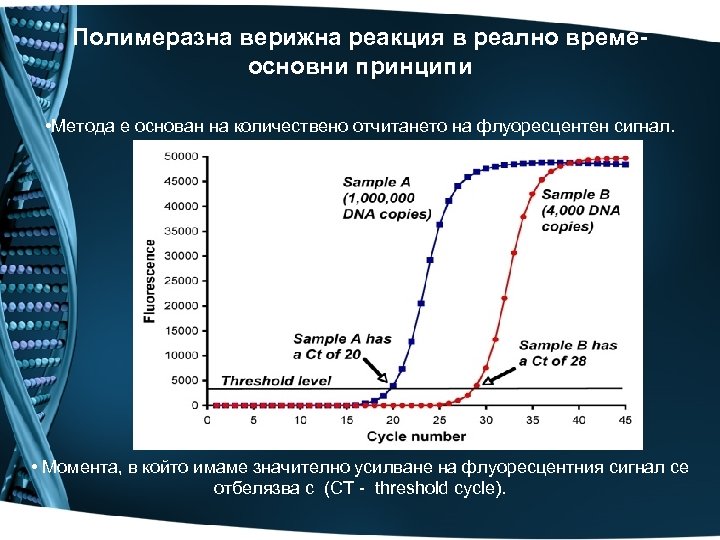 Полимеразна верижна реакция в реално времеосновни принципи • Метода е основан на количествено отчитането на флуоресцентен сигнал. • Момента, в който имаме значително усилване на флуоресцентния сигнал се отбелязва с (CT - threshold cycle).
Полимеразна верижна реакция в реално времеосновни принципи • Метода е основан на количествено отчитането на флуоресцентен сигнал. • Момента, в който имаме значително усилване на флуоресцентния сигнал се отбелязва с (CT - threshold cycle).
 Основни етапи на HRM анализа Всичко, което Ви е необходимо е PCR апарат спосбен да измерва много малки нива на промяна на флуоресценция. 1. PCR в реално време Позволява ни да наблюдаваме промяната на флуоресценцията при всеки цикъл в реално време 2. HRM Отчитане на спада на флуресцентния сигнал в резултат на топенето на PCR продуктите, като различните по секвенция ампликони се топят при различна температура.
Основни етапи на HRM анализа Всичко, което Ви е необходимо е PCR апарат спосбен да измерва много малки нива на промяна на флуоресценция. 1. PCR в реално време Позволява ни да наблюдаваме промяната на флуоресценцията при всеки цикъл в реално време 2. HRM Отчитане на спада на флуресцентния сигнал в резултат на топенето на PCR продуктите, като различните по секвенция ампликони се топят при различна температура.
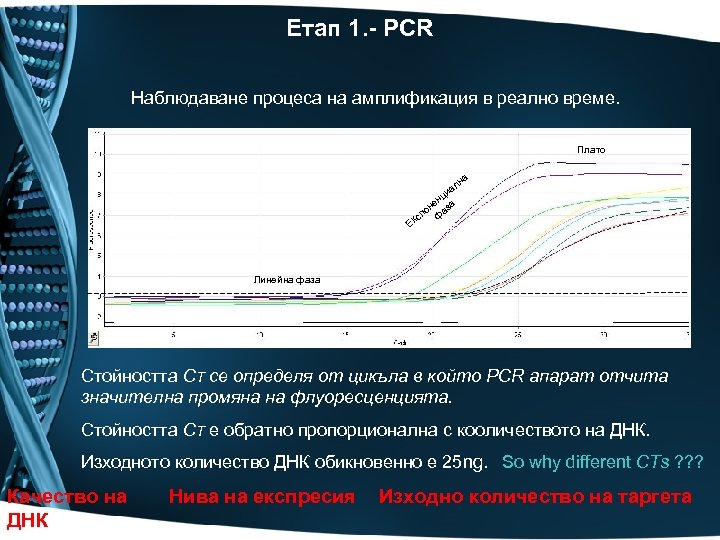 Етап 1. - PCR Наблюдаване процеса на амплификация в реално време. Плато на ал и нц не аза по ф кс Е Линейна фаза Стойността CT се определя от цикъла в който PCR апарат отчита значителна промяна на флуоресценцията. Стойността CT е обратно пропорционална с кооличеството на ДНК. Изходното количество ДНК обикновенно е 25 ng. So why different CTs ? ? ? Качество на ДНК Нива на експресия Изходно количество на таргета
Етап 1. - PCR Наблюдаване процеса на амплификация в реално време. Плато на ал и нц не аза по ф кс Е Линейна фаза Стойността CT се определя от цикъла в който PCR апарат отчита значителна промяна на флуоресценцията. Стойността CT е обратно пропорционална с кооличеството на ДНК. Изходното количество ДНК обикновенно е 25 ng. So why different CTs ? ? ? Качество на ДНК Нива на експресия Изходно количество на таргета
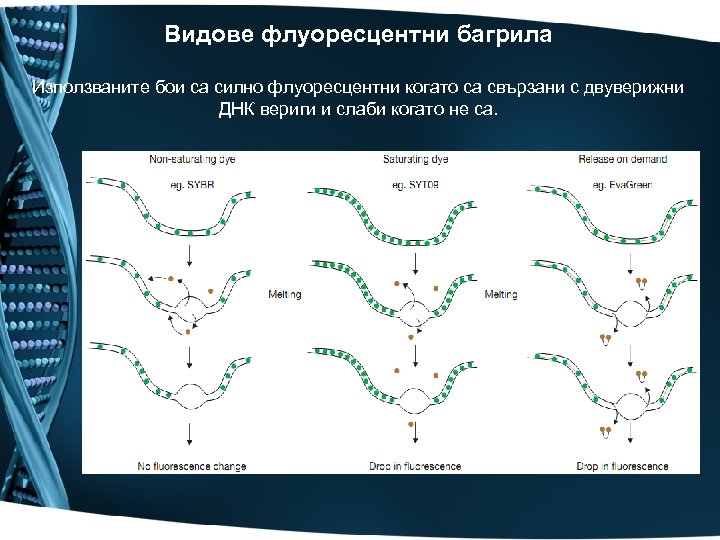 Видове флуоресцентни багрила Използваните бои са силно флуоресцентни когато са свързани с двуверижни ДНК вериги и слаби когато не са.
Видове флуоресцентни багрила Използваните бои са силно флуоресцентни когато са свързани с двуверижни ДНК вериги и слаби когато не са.
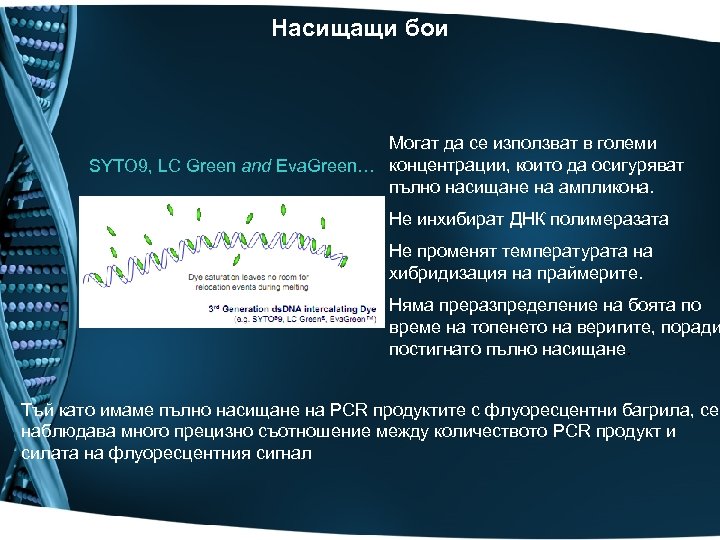 Насищащи бои Могат да се използват в големи SYTO 9, LC Green and Eva. Green… концентрации, които да осигуряват пълно насищане на ампликона. Не инхибират ДНК полимеразата Не променят температурата на хибридизация на праймерите. Няма преразпределение на боята по време на топенето на веригите, поради постигнато пълно насищане. Тъй като имаме пълно насищане на PCR продуктите с флуоресцентни багрила, се наблюдава много прецизно съотношение между количеството PCR продукт и силата на флуоресцентния сигнал
Насищащи бои Могат да се използват в големи SYTO 9, LC Green and Eva. Green… концентрации, които да осигуряват пълно насищане на ампликона. Не инхибират ДНК полимеразата Не променят температурата на хибридизация на праймерите. Няма преразпределение на боята по време на топенето на веригите, поради постигнато пълно насищане. Тъй като имаме пълно насищане на PCR продуктите с флуоресцентни багрила, се наблюдава много прецизно съотношение между количеството PCR продукт и силата на флуоресцентния сигнал
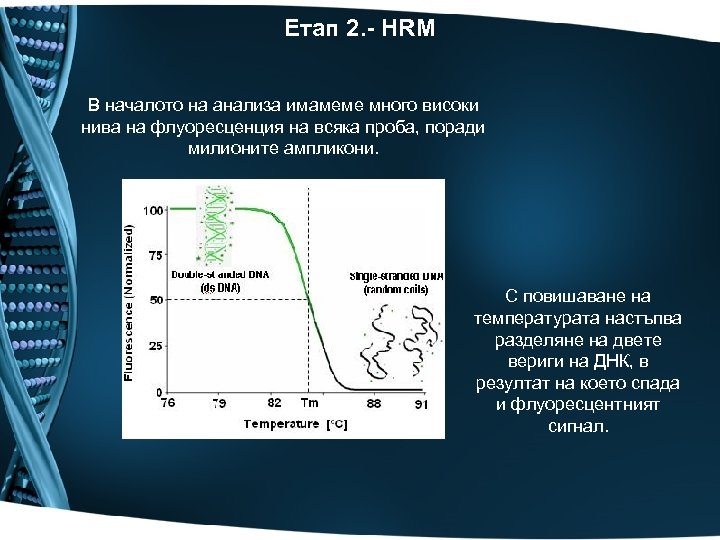 Етап 2. - HRM В началото на анализа имамеме много високи нива на флуоресценция на всяка проба, поради милионите ампликони. С повишаване на температурата настъпва разделяне на двете вериги на ДНК, в резултат на което спада и флуоресцентният сигнал.
Етап 2. - HRM В началото на анализа имамеме много високи нива на флуоресценция на всяка проба, поради милионите ампликони. С повишаване на температурата настъпва разделяне на двете вериги на ДНК, в резултат на което спада и флуоресцентният сигнал.
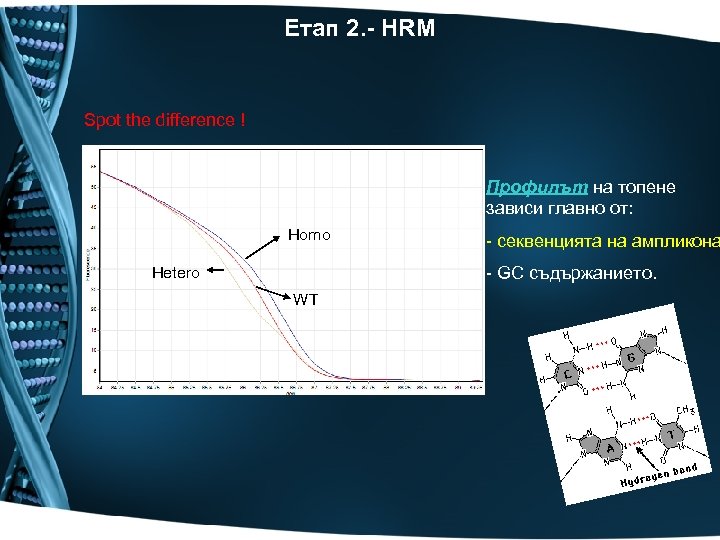 Етап 2. - HRM Spot the difference ! Профилът на топене зависи главно от: Homo - секвенцията на ампликона - GC съдържанието. Hetero WT
Етап 2. - HRM Spot the difference ! Профилът на топене зависи главно от: Homo - секвенцията на ампликона - GC съдържанието. Hetero WT
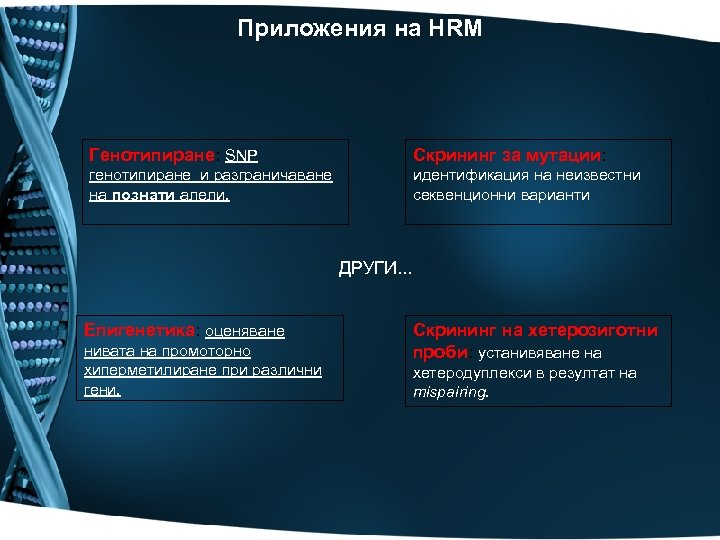 Приложения на HRM Генотипиране: SNP Скрининг за мутации: генотипиране и разграничаване на познати алели. идентификация на неизвестни секвенционни варианти ДРУГИ. . . Епигенетика: оценяване нивата на промоторно хиперметилиране при различни гени. Скрининг на хетерозиготни проби: устанивяване на хетеродуплекси в резултат на mispairing.
Приложения на HRM Генотипиране: SNP Скрининг за мутации: генотипиране и разграничаване на познати алели. идентификация на неизвестни секвенционни варианти ДРУГИ. . . Епигенетика: оценяване нивата на промоторно хиперметилиране при различни гени. Скрининг на хетерозиготни проби: устанивяване на хетеродуплекси в резултат на mispairing.
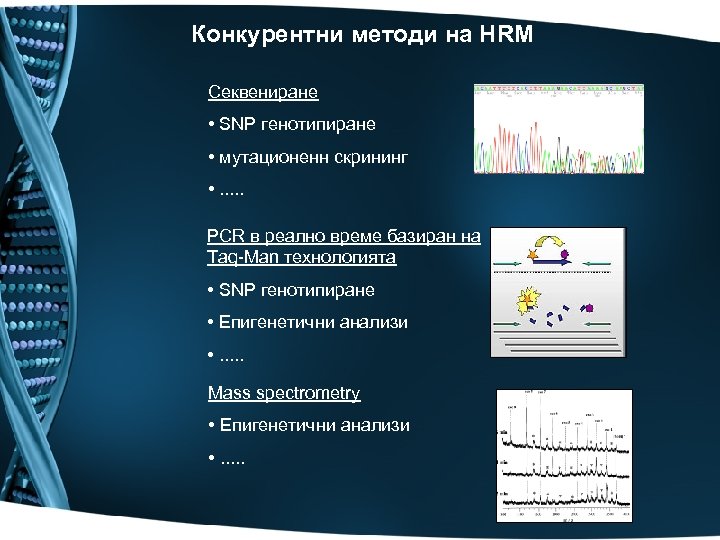 Конкурентни методи на HRM Секвениране • SNP генотипиране • мутационенн скрининг • . . . PCR в реално време базиран на Taq-Man технологията • SNP генотипиране • Епигенетични анализи • . . . Mass spectrometry • Епигенетични анализи • . . .
Конкурентни методи на HRM Секвениране • SNP генотипиране • мутационенн скрининг • . . . PCR в реално време базиран на Taq-Man технологията • SNP генотипиране • Епигенетични анализи • . . . Mass spectrometry • Епигенетични анализи • . . .
 Конкурентни методи на HRM Метил специфичен PCR – MSP • Епигенетични анализи ДНК чипове • Епигенетични анализи • . . . Рестрикционни анализи • Епигенетични анализи • SNP генотипиране • . . .
Конкурентни методи на HRM Метил специфичен PCR – MSP • Епигенетични анализи ДНК чипове • Епигенетични анализи • . . . Рестрикционни анализи • Епигенетични анализи • SNP генотипиране • . . .
 Предимства на HRM пред другите методи • сравнително по- евтин спрямо методи като секвениране и Taq. Man генотипиране. • идеален за големи проекти за SNP генотипиране. • бърз и надежден. • лесенo изпълним. Неодостатъци на HRM пред другите методи • Труден за оптимизация • не е толкова специфичен колкото Taq. Man технологията • необходимост от високо- квалифициран специалист. • необходима е прецизна оптимизация на PCR условията.
Предимства на HRM пред другите методи • сравнително по- евтин спрямо методи като секвениране и Taq. Man генотипиране. • идеален за големи проекти за SNP генотипиране. • бърз и надежден. • лесенo изпълним. Неодостатъци на HRM пред другите методи • Труден за оптимизация • не е толкова специфичен колкото Taq. Man технологията • необходимост от високо- квалифициран специалист. • необходима е прецизна оптимизация на PCR условията.
 Rotor Gene 6000 by QIAGEN • PCR апарат с ротор: Иновативна технология с въртящ се ротор със скорост 400 rpm.
Rotor Gene 6000 by QIAGEN • PCR апарат с ротор: Иновативна технология с въртящ се ротор със скорост 400 rpm.
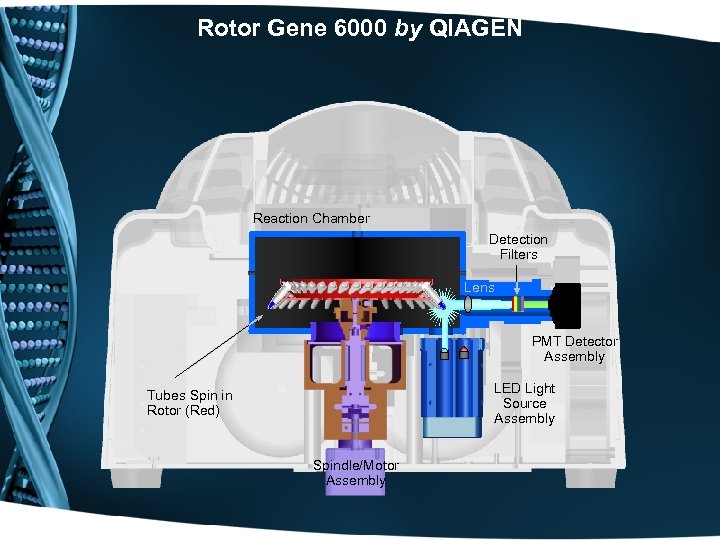 Rotor Gene 6000 by QIAGEN Reaction Chamber Detection Filters Lens PMT Detector Assembly LED Light Source Assembly Tubes Spin in Rotor (Red) Spindle/Motor Assembly
Rotor Gene 6000 by QIAGEN Reaction Chamber Detection Filters Lens PMT Detector Assembly LED Light Source Assembly Tubes Spin in Rotor (Red) Spindle/Motor Assembly
 Предимства на роторния формат – Не е необходима оптична нормализация – Не се използва парафин или нагряващ капак – Не остават мехурчета, които да пречат на отчитането на сигнала – Няма нужда от референтна боя – Оптичният източник е LED
Предимства на роторния формат – Не е необходима оптична нормализация – Не се използва парафин или нагряващ капак – Не остават мехурчета, които да пречат на отчитането на сигнала – Няма нужда от референтна боя – Оптичният източник е LED
 От… - До… Дизайн PCR 1. Селектиране на таргетната секвенция 4. Приготвяне на PCR реакцията 2. Дизайн на праймери 5. Програмиране на PCR апарата 3. Проверка на праймерите 6. Тест на PCR продукта * Анализ
От… - До… Дизайн PCR 1. Селектиране на таргетната секвенция 4. Приготвяне на PCR реакцията 2. Дизайн на праймери 5. Програмиране на PCR апарата 3. Проверка на праймерите 6. Тест на PCR продукта * Анализ
 Дизайн За постигането на максимална специфичност най- подходчщи са ампликони с големина до 200 б. дв. Дизайнирането на праймери отговарящи на тези критерии може да е трудна задача, тъй като късите ампликони подходящи за HRM ограничават избора на праймери. Една от най- често използваните програми за дизайн на праймери е Primer 3 На какво да обърнем внимание? • Позиция на праймерите • GC съдържанието на праймерите в 3’ края им (GC clamp) • При метил-специфичен HRM (MS- HRM) e удачно използването на GC free primers • Специфичност на праймерите • Наличие на вторични структури (primer dimer)
Дизайн За постигането на максимална специфичност най- подходчщи са ампликони с големина до 200 б. дв. Дизайнирането на праймери отговарящи на тези критерии може да е трудна задача, тъй като късите ампликони подходящи за HRM ограничават избора на праймери. Една от най- често използваните програми за дизайн на праймери е Primer 3 На какво да обърнем внимание? • Позиция на праймерите • GC съдържанието на праймерите в 3’ края им (GC clamp) • При метил-специфичен HRM (MS- HRM) e удачно използването на GC free primers • Специфичност на праймерите • Наличие на вторични структури (primer dimer)
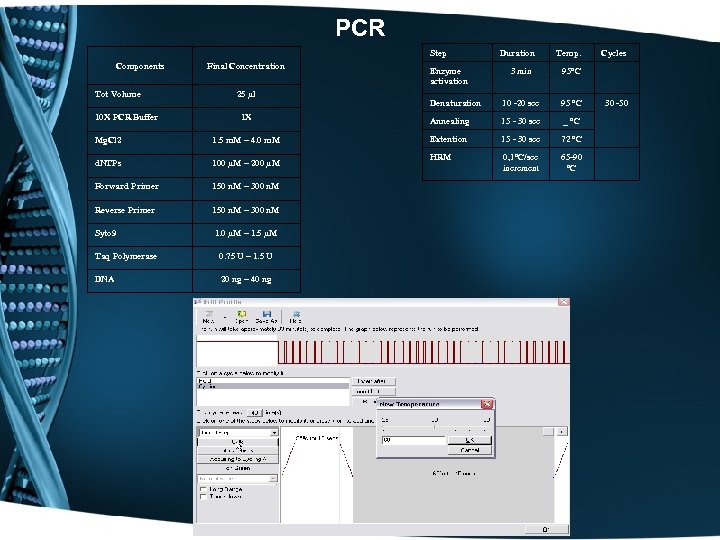 PCR Step Components Final Concentration Temp. 3 min Denaturation 10 -20 sec 95 °C 1 X Annealing 15 - 30 sec _ °C Mg. Cl 2 1. 5 m. M – 4. 0 m. M Extention 15 - 30 sec 72 °C d. NTPs 100 µM – 200 µM HRM 0, 1°C/sec increment 65 -90 °C Forward Primer 150 n. M – 300 n. M Reverse Primer 150 n. M – 300 n. M Syto 9 1. 0 µM – 1. 5 µM Cycles 95°C Tot Volume 10 X PCR Buffer 25 µl Taq Polymerase 0. 75 U – 1. 5 U DNA 20 ng – 40 ng Enzyme activation Duration 30 -50
PCR Step Components Final Concentration Temp. 3 min Denaturation 10 -20 sec 95 °C 1 X Annealing 15 - 30 sec _ °C Mg. Cl 2 1. 5 m. M – 4. 0 m. M Extention 15 - 30 sec 72 °C d. NTPs 100 µM – 200 µM HRM 0, 1°C/sec increment 65 -90 °C Forward Primer 150 n. M – 300 n. M Reverse Primer 150 n. M – 300 n. M Syto 9 1. 0 µM – 1. 5 µM Cycles 95°C Tot Volume 10 X PCR Buffer 25 µl Taq Polymerase 0. 75 U – 1. 5 U DNA 20 ng – 40 ng Enzyme activation Duration 30 -50
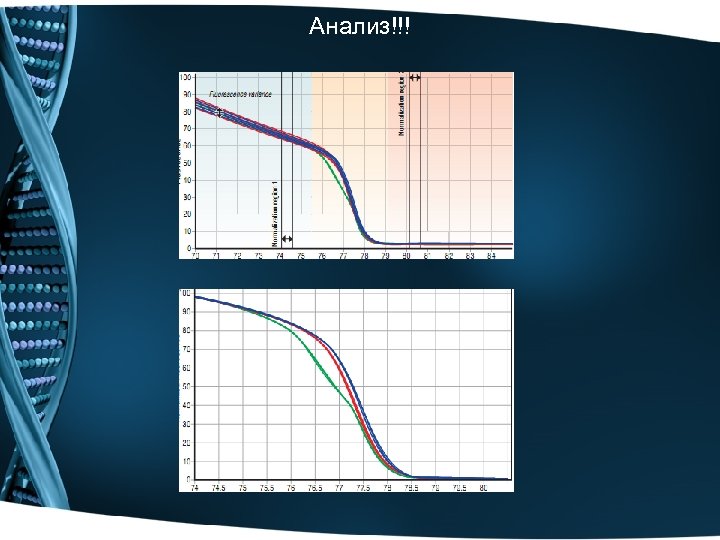 Анализ!!!
Анализ!!!


