алканы хор.ppt
- Количество слайдов: 30
 Цели и задачи Цели темы: ознакомиться с одним из классов органической веществ, а при изучении их строения и свойств снова подтвердить основные положения теории Бутлеров; продолжить формирование мировоззренческих представлений о познаваемости природы, причинно-следственной зависимости между составом, строением, свойствами и применением алканов. Задачи темы: углубить понятия о строении, взаимном влиянии атомом в молекулах и свойствах органических соединений на примере алканов; расширить знание о многообразии соединений углерода (гомология, изомерия); использование различной номенклатуры при изучении алканов; углубить понятия о зависимости применения веществ от их свойств, о способах получения веществ. научить приемам называния веществ.
Цели и задачи Цели темы: ознакомиться с одним из классов органической веществ, а при изучении их строения и свойств снова подтвердить основные положения теории Бутлеров; продолжить формирование мировоззренческих представлений о познаваемости природы, причинно-следственной зависимости между составом, строением, свойствами и применением алканов. Задачи темы: углубить понятия о строении, взаимном влиянии атомом в молекулах и свойствах органических соединений на примере алканов; расширить знание о многообразии соединений углерода (гомология, изомерия); использование различной номенклатуры при изучении алканов; углубить понятия о зависимости применения веществ от их свойств, о способах получения веществ. научить приемам называния веществ.
 Основные положения теории Бутлерова А. М. Все атомы, образующие молекулы органических веществ, связаны в определенной последовательности согласно их валентности. Свойства веществ зависят не только от того, какие атомы и сколько их входит в состав молекулы, но и от порядка соединений в атоме (изомерия). По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы предвидеть свойства. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
Основные положения теории Бутлерова А. М. Все атомы, образующие молекулы органических веществ, связаны в определенной последовательности согласно их валентности. Свойства веществ зависят не только от того, какие атомы и сколько их входит в состав молекулы, но и от порядка соединений в атоме (изомерия). По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы предвидеть свойства. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
 АЛКАНЫ Дмитриенко К. Е. , учитель химии МОУ Кайгородская СОШ Новосибирской области
АЛКАНЫ Дмитриенко К. Е. , учитель химии МОУ Кайгородская СОШ Новосибирской области
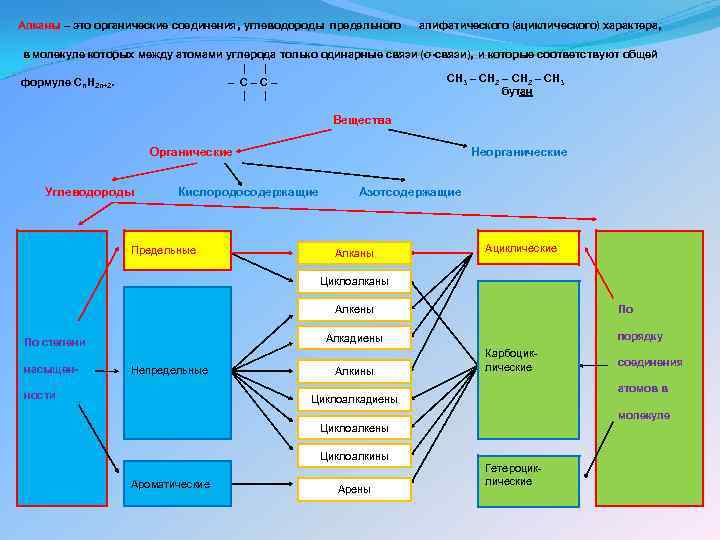 Алканы – это органические соединения, углеводороды предельного алифатического (ациклического) характера, в молекуле которых между атомами углерода только одинарные связи (σ-связи), и которые соответствуют общей | | CH 3 – CH 2 – CH 3 – C–C– формуле Cn. H 2 n+2. бутан | | Вещества Органические Неорганические Углеводороды Кислородосодержащие Предельные Азотсодержащие Алканы Ациклические Циклоалканы По Алкены насыщен- порядку Алкадиены По степени Непредельные ности Алкины Карбоциклические соединения атомов в Циклоалкадиены молекуле Циклоалкены Циклоалкины Ароматические Арены Гетероциклические
Алканы – это органические соединения, углеводороды предельного алифатического (ациклического) характера, в молекуле которых между атомами углерода только одинарные связи (σ-связи), и которые соответствуют общей | | CH 3 – CH 2 – CH 3 – C–C– формуле Cn. H 2 n+2. бутан | | Вещества Органические Неорганические Углеводороды Кислородосодержащие Предельные Азотсодержащие Алканы Ациклические Циклоалканы По Алкены насыщен- порядку Алкадиены По степени Непредельные ности Алкины Карбоциклические соединения атомов в Циклоалкадиены молекуле Циклоалкены Циклоалкины Ароматические Арены Гетероциклические
 Строение молекулы Все атомы углерода в молекулах алканов находятся в состоянии sp 3 -гибридизации, т. е. все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены к вершинам равносторонней треугольной пирамиды – тетраэдра. Угол между направлениями связейсоставляет 109° 28´, поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг), хотя молекулы алканов могут приобретать самую разнообразную форму, потому что вокруг одинарной углеродной связи возможно практически свободное вращение. Связи углерод-углерод являются неполярными и плохо поляризуемыми, длина связи C–C равна 0, 154 нм. Связи C–H несколько короче и являются слабополярными. s 1 Отсутствие в молекулах алканов полярных связей приводит к тому, что они плохо растворимы в воде, не вступают во взаимодействие с ионами. Наиболее характерными для алканов являются реакции, протекающие по свободнорадикальному механизму. С* ↑ p 3 ↑ ↑ ↑
Строение молекулы Все атомы углерода в молекулах алканов находятся в состоянии sp 3 -гибридизации, т. е. все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены к вершинам равносторонней треугольной пирамиды – тетраэдра. Угол между направлениями связейсоставляет 109° 28´, поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг), хотя молекулы алканов могут приобретать самую разнообразную форму, потому что вокруг одинарной углеродной связи возможно практически свободное вращение. Связи углерод-углерод являются неполярными и плохо поляризуемыми, длина связи C–C равна 0, 154 нм. Связи C–H несколько короче и являются слабополярными. s 1 Отсутствие в молекулах алканов полярных связей приводит к тому, что они плохо растворимы в воде, не вступают во взаимодействие с ионами. Наиболее характерными для алканов являются реакции, протекающие по свободнорадикальному механизму. С* ↑ p 3 ↑ ↑ ↑
 Изомерия алканов Для алканов характерна структурная изомерия: C 5 H 12 1 2 3 4 5 4 3 2 1 CH 3 – CH 2 – CH 3 | CH 3 – CH 2 – CH 3 пентан 2 -метилбутан CH 3 | 1 2 3 CH 3 – CH 3 | CH 3 2, 2 -диметилпропан
Изомерия алканов Для алканов характерна структурная изомерия: C 5 H 12 1 2 3 4 5 4 3 2 1 CH 3 – CH 2 – CH 3 | CH 3 – CH 2 – CH 3 пентан 2 -метилбутан CH 3 | 1 2 3 CH 3 – CH 3 | CH 3 2, 2 -диметилпропан
 Изомерия производных алканов Для производных алканов характерна еще и изомерия положения заместителей: C 4 H 9 Cl Cl | 1 2 3 4 CH 3 – CH 2 – CH 3 2 -хлорбутан Cl | 4 3 2 1 CH 3 – CH 2 1 -хлорбутан
Изомерия производных алканов Для производных алканов характерна еще и изомерия положения заместителей: C 4 H 9 Cl Cl | 1 2 3 4 CH 3 – CH 2 – CH 3 2 -хлорбутан Cl | 4 3 2 1 CH 3 – CH 2 1 -хлорбутан
 Физические свойства CH 4…C 4 H 10 Газы (без запаха) C 5 H 12…C 15 H 32 Жидкости (имеют запах) C 16 H 34… Твердые вещества (без запаха) t° кипения и t° плавления увеличиваются Алканы – бесцветные вещества, легче воды, плохо растворяются в воде.
Физические свойства CH 4…C 4 H 10 Газы (без запаха) C 5 H 12…C 15 H 32 Жидкости (имеют запах) C 16 H 34… Твердые вещества (без запаха) t° кипения и t° плавления увеличиваются Алканы – бесцветные вещества, легче воды, плохо растворяются в воде.
 Химические свойства H H | | H–C–C–H | | H H Реакции присоединения – Реакции замещения + Реакции элиминирования (отщепления) + Реакции изомеризации + V. Реакции окисления + I. III. IV.
Химические свойства H H | | H–C–C–H | | H H Реакции присоединения – Реакции замещения + Реакции элиминирования (отщепления) + Реакции изомеризации + V. Реакции окисления + I. III. IV.
 I. Реакции замещения (по свободнорадикальному механизму) разрыв связей C – H и замещение атомов водорода 1. Галогенирование CH 4 + Cl 2 CH 3 Cl + HCl Алканы очень активно реагируют с фтором; хлорирование протекает под действием света и является фотохимической цепной реакцией. Низшие алканы (CH 4, C 2 H 6, C 3 H 8) можно прохлорировать полностью. CH 4 метан + Cl 2, hν - HCl CH 3 Cl хлорметан + Cl 2 - HCl CH 2 Cl 2 дихлорметан + Cl 2 - HCl CHCl 3 + Cl 2 - HCl трихлорметан (хлороформ) CCl 4 тетрахлорметан
I. Реакции замещения (по свободнорадикальному механизму) разрыв связей C – H и замещение атомов водорода 1. Галогенирование CH 4 + Cl 2 CH 3 Cl + HCl Алканы очень активно реагируют с фтором; хлорирование протекает под действием света и является фотохимической цепной реакцией. Низшие алканы (CH 4, C 2 H 6, C 3 H 8) можно прохлорировать полностью. CH 4 метан + Cl 2, hν - HCl CH 3 Cl хлорметан + Cl 2 - HCl CH 2 Cl 2 дихлорметан + Cl 2 - HCl CHCl 3 + Cl 2 - HCl трихлорметан (хлороформ) CCl 4 тетрахлорметан
 Механизм (реакция осуществляется в три стадии) Первая стадия – инициирование hν hν + Cl--Cl Cl-Cl Вторая стадия – развитие цепи (для метана – в четыре ступени) H │ H – C – H + – Cl │ H │ H – C – + Cl – Cl │ H │ H – C – H │ H – C – │ H хлорметан + – Cl + Cl – Cl Первая ступень
Механизм (реакция осуществляется в три стадии) Первая стадия – инициирование hν hν + Cl--Cl Cl-Cl Вторая стадия – развитие цепи (для метана – в четыре ступени) H │ H – C – H + – Cl │ H │ H – C – + Cl – Cl │ H │ H – C – H │ H – C – │ H хлорметан + – Cl + Cl – Cl Первая ступень
 Механизм (реакция осуществляется в три стадии) Каждый последующий атом водорода в молекуле алкана замещается легче, чем предыдущий Cl │ H – C – H + – Cl │ H Cl │ H – C – H │ H + – Cl хлорметан Cl │ H – C – + Cl – Cl │ H Cl │ H – C – │ H + дихлорметан Cl – Cl Вторая ступень
Механизм (реакция осуществляется в три стадии) Каждый последующий атом водорода в молекуле алкана замещается легче, чем предыдущий Cl │ H – C – H + – Cl │ H Cl │ H – C – H │ H + – Cl хлорметан Cl │ H – C – + Cl – Cl │ H Cl │ H – C – │ H + дихлорметан Cl – Cl Вторая ступень
 Механизм (реакция осуществляется в три стадии) Каждый последующий атом водорода в молекуле алкана замещается легче, чем предыдущий Cl │ Cl – C – H + – Cl │ H Cl │ Cl – C – H │ H + – Cl дихлорметан Cl │ Cl – C – + Cl – Cl │ H Cl │ Cl – C – │ H + трихлорметан (хлороформ) Cl – Cl Третьяступень
Механизм (реакция осуществляется в три стадии) Каждый последующий атом водорода в молекуле алкана замещается легче, чем предыдущий Cl │ Cl – C – H + – Cl │ H Cl │ Cl – C – H │ H + – Cl дихлорметан Cl │ Cl – C – + Cl – Cl │ H Cl │ Cl – C – │ H + трихлорметан (хлороформ) Cl – Cl Третьяступень
 Механизм (реакция осуществляется в три стадии) Каждый последующий атом водорода в молекуле алкана замещается легче, чем предыдущий Cl │ Cl – C – H + – Cl │ Cl – C – H │ Cl + – Cl трихлорметан Cl │ Cl – C – + Cl – Cl │ Cl – C – │ Cl + тетрахлорметан Cl – Cl Четвертая ступень
Механизм (реакция осуществляется в три стадии) Каждый последующий атом водорода в молекуле алкана замещается легче, чем предыдущий Cl │ Cl – C – H + – Cl │ Cl – C – H │ Cl + – Cl трихлорметан Cl │ Cl – C – + Cl – Cl │ Cl – C – │ Cl + тетрахлорметан Cl – Cl Четвертая ступень
 Механизм (реакция осуществляется в три стадии) Третья стадия – обрыв цепи Cl – + – Cl H │ H – C – + │ H H │ – C –H │ H Cl – – Cl H H │ │ H – C –H │ │ H H этан H │ H – C – │ H + – Cl H │ – Cl H – C – │ H хлорметан
Механизм (реакция осуществляется в три стадии) Третья стадия – обрыв цепи Cl – + – Cl H │ H – C – + │ H H │ – C –H │ H Cl – – Cl H H │ │ H – C –H │ │ H H этан H │ H – C – │ H + – Cl H │ – Cl H – C – │ H хлорметан
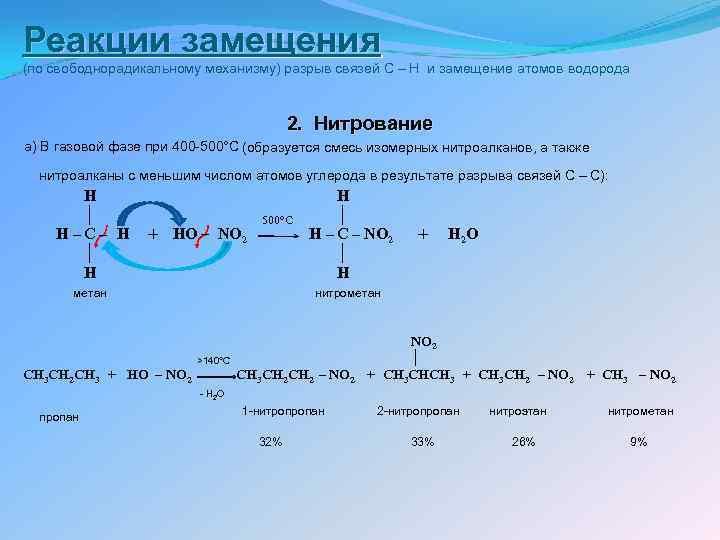 Реакции замещения (по свободнорадикальному механизму) разрыв связей C – H и замещение атомов водорода 2. Нитрование а) В газовой фазе при 400 -500°С (образуется смесь изомерных нитроалканов, а также нитроалканы с меньшим числом атомов углерода в результате разрыва связей С – С): H H │ 500°С │ H – C – H + HO – NO 2 H – C – NO 2 + H 2 O │ │ H метан нитрометан >140°C CH 3 CH 2 CH 3 + HO – NO 2 CH 3 CH 2 – NO 2 │ + CH 3 CHCH 3 + CH 3 CH 2 – NO 2 + CH 3 – NO 2 - H 2 O пропан 1 -нитропропан 32% 2 -нитропропан 33% нитроэтан 26% нитрометан 9%
Реакции замещения (по свободнорадикальному механизму) разрыв связей C – H и замещение атомов водорода 2. Нитрование а) В газовой фазе при 400 -500°С (образуется смесь изомерных нитроалканов, а также нитроалканы с меньшим числом атомов углерода в результате разрыва связей С – С): H H │ 500°С │ H – C – H + HO – NO 2 H – C – NO 2 + H 2 O │ │ H метан нитрометан >140°C CH 3 CH 2 CH 3 + HO – NO 2 CH 3 CH 2 – NO 2 │ + CH 3 CHCH 3 + CH 3 CH 2 – NO 2 + CH 3 – NO 2 - H 2 O пропан 1 -нитропропан 32% 2 -нитропропан 33% нитроэтан 26% нитрометан 9%
 Реакции замещения (по свободнорадикальному механизму) разрыв связей C – H и замещение атомов водорода б) Реакция Коновалова М. И. : взаимодействие с разбавленной азотной кислотой при 140°С и при повышенном или нормальном давлении – образуется смесь изомерных нитросоединений (легче всего замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного). CH 3 │ 4 3 2 1 CH 3 – CH 2 – CH 3 + HO – NO 2 │ H 2 -метилбутан 140°C (разб. ) CH 3 │ 4 3 2 1 CH 3 – CH 2 – CH 3 + H 2 O │ NO 2 2 -метил-2 -нитробутан
Реакции замещения (по свободнорадикальному механизму) разрыв связей C – H и замещение атомов водорода б) Реакция Коновалова М. И. : взаимодействие с разбавленной азотной кислотой при 140°С и при повышенном или нормальном давлении – образуется смесь изомерных нитросоединений (легче всего замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного). CH 3 │ 4 3 2 1 CH 3 – CH 2 – CH 3 + HO – NO 2 │ H 2 -метилбутан 140°C (разб. ) CH 3 │ 4 3 2 1 CH 3 – CH 2 – CH 3 + H 2 O │ NO 2 2 -метил-2 -нитробутан
 Реакции замещения (по свободнорадикальному механизму) разрыв связей C – H и замещение атомов водорода 3. Сульфирование CH 3 4 3 2 1 │ CH 3 – CH 2 – CH 3 + HO – SO 3 H (конц. ) │ H t°C CH 3 │ 4 3 2 1 CH 3 – CH 2 – CH 3 + H 2 O │ SO 3 H 2 -метил-2 -сульфобутан 2 -метилбутан
Реакции замещения (по свободнорадикальному механизму) разрыв связей C – H и замещение атомов водорода 3. Сульфирование CH 3 4 3 2 1 │ CH 3 – CH 2 – CH 3 + HO – SO 3 H (конц. ) │ H t°C CH 3 │ 4 3 2 1 CH 3 – CH 2 – CH 3 + H 2 O │ SO 3 H 2 -метил-2 -сульфобутан 2 -метилбутан
 II. Реакции отщепления (элиминирования) 1. Дегидрирование: H – H │ │ – а) H – C – H │ │ H H 4 OO-600°C H – C = C – H │ │ H H этан этен (этилен) 1000°C б) 2 CH 4 CH ≡ CH + 3 H 2 метан в) этин (ацетилен) Пиролиз 1200°C CH 4 метан C + 2 H 2 + H – H
II. Реакции отщепления (элиминирования) 1. Дегидрирование: H – H │ │ – а) H – C – H │ │ H H 4 OO-600°C H – C = C – H │ │ H H этан этен (этилен) 1000°C б) 2 CH 4 CH ≡ CH + 3 H 2 метан в) этин (ацетилен) Пиролиз 1200°C CH 4 метан C + 2 H 2 + H – H
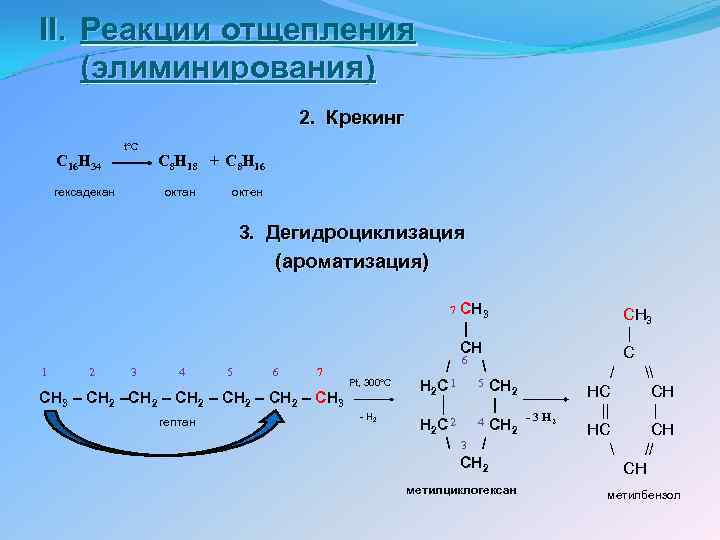 II. Реакции отщепления (элиминирования) 2. Крекинг C 16 H 34 гексадекан t°C C 8 H 18 + C 8 H 16 октан октен 3. Дегидроциклизация (ароматизация) CH 3 | CH / 6 H 2 C 1 5 CH 2 │ | H 2 C 2 4 CH 2 3 / CH 2 7 1 2 3 4 5 6 7 CH 3 – CH 2 – CH 2 – CH 3 гептан Pt, 300°C - H 2 метилциклогексан - 3 H 2 CH 3 | C / \ HC CH || | HC CH // CH метилбензол
II. Реакции отщепления (элиминирования) 2. Крекинг C 16 H 34 гексадекан t°C C 8 H 18 + C 8 H 16 октан октен 3. Дегидроциклизация (ароматизация) CH 3 | CH / 6 H 2 C 1 5 CH 2 │ | H 2 C 2 4 CH 2 3 / CH 2 7 1 2 3 4 5 6 7 CH 3 – CH 2 – CH 2 – CH 3 гептан Pt, 300°C - H 2 метилциклогексан - 3 H 2 CH 3 | C / \ HC CH || | HC CH // CH метилбензол
 III. Реакции окисления 1. Горение CH 4 + 2 O 2 CO 2 + 2 H 2 O 2 CO + 4 H 2 O 2 CH 4 + 3 O 2 (при недостатке кислорода) CH 4 2. + O 2 C + 2 H 2 O (при сильном недостатке кислорода) При обычных условиях устойчивы к действию окислителей (KMn. O 4, K 2 Cr 2 O 7)
III. Реакции окисления 1. Горение CH 4 + 2 O 2 CO 2 + 2 H 2 O 2 CO + 4 H 2 O 2 CH 4 + 3 O 2 (при недостатке кислорода) CH 4 2. + O 2 C + 2 H 2 O (при сильном недостатке кислорода) При обычных условиях устойчивы к действию окислителей (KMn. O 4, K 2 Cr 2 O 7)
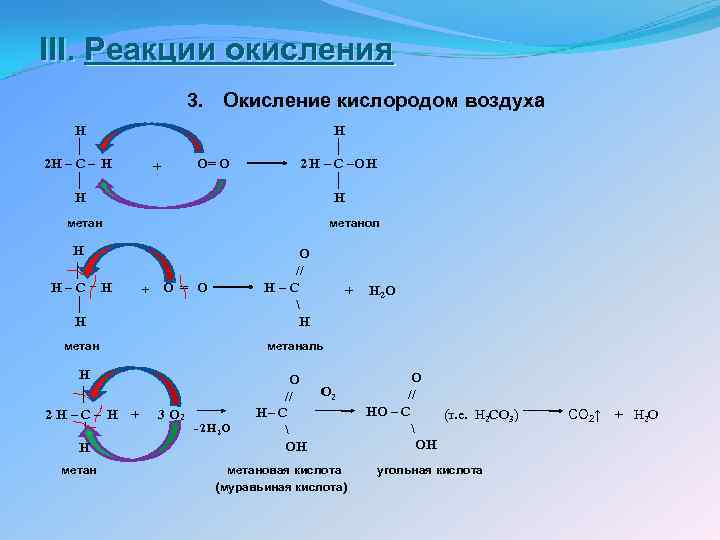 III. Реакции окисления 3. H │ 2 H – C – H │ H Окисление кислородом воздуха O= O + H │ 2 H – C –OH │ H метан H │ // H – C H │ H метанол + O // H – C H O = O метан H │ // 2 H – C – H + │ H метан + H 2 O метаналь 3 O 2 2 - H 2 O O O 2 // H – C OH метановая кислота (муравьиная кислота) O // HO – C (т. е. H 2 CO 3) OH угольная кислота CO 2↑ + H 2 O
III. Реакции окисления 3. H │ 2 H – C – H │ H Окисление кислородом воздуха O= O + H │ 2 H – C –OH │ H метан H │ // H – C H │ H метанол + O // H – C H O = O метан H │ // 2 H – C – H + │ H метан + H 2 O метаналь 3 O 2 2 - H 2 O O O 2 // H – C OH метановая кислота (муравьиная кислота) O // HO – C (т. е. H 2 CO 3) OH угольная кислота CO 2↑ + H 2 O
 IV. Реакции изомеризации CH 3 – CH 2 – CH 3 бутан V. CH 3 | CH 3 – CH 3 метилпропан Образование синтез-газа t°C, Kt CH 4 + H 2 O CO + 3 H 2
IV. Реакции изомеризации CH 3 – CH 2 – CH 3 бутан V. CH 3 | CH 3 – CH 3 метилпропан Образование синтез-газа t°C, Kt CH 4 + H 2 O CO + 3 H 2
 Получение метана 1. В промышленности: а) из природного газа; б) синтез из оксида углерода (II) и водорода (из синтез-газа): Ni, 300°C CO + 3 H 2 CH 4↑ + H 2 O 2. В лаборатории: а) гидролиз карбида алюминия: Al 4 C 3 + 12 H 2 O 3 CH 4↑ + 4 Al(OH)3 б) сплавление солей уксусной кислоты (ацетатов) со щелочами: t° CH 3 COONa + Na. OH CH 4↑ + Na 2 CO 3 ацетат натрия (твердый)
Получение метана 1. В промышленности: а) из природного газа; б) синтез из оксида углерода (II) и водорода (из синтез-газа): Ni, 300°C CO + 3 H 2 CH 4↑ + H 2 O 2. В лаборатории: а) гидролиз карбида алюминия: Al 4 C 3 + 12 H 2 O 3 CH 4↑ + 4 Al(OH)3 б) сплавление солей уксусной кислоты (ацетатов) со щелочами: t° CH 3 COONa + Na. OH CH 4↑ + Na 2 CO 3 ацетат натрия (твердый)
 Получение гомологов метана 1. В промышленности: а) из природного сырья (нефть, газ, горный воск); б) синтез из оксида углерода (II) и водорода (из синтез-газа): n CO + (2 n + 1) H 2 Ni, 300°C Cn. H 2 n+2 + n H 2 O 2. В лаборатории: а) каталитическое гидрирование (+H 2) непредельных углеводородов: Ni, 150°C Cn. H 2 n + H 2 алкен Cn. H(2 n-2) алкин + 2 H 2 Pt Cn. H(2 n+2) алкан
Получение гомологов метана 1. В промышленности: а) из природного сырья (нефть, газ, горный воск); б) синтез из оксида углерода (II) и водорода (из синтез-газа): n CO + (2 n + 1) H 2 Ni, 300°C Cn. H 2 n+2 + n H 2 O 2. В лаборатории: а) каталитическое гидрирование (+H 2) непредельных углеводородов: Ni, 150°C Cn. H 2 n + H 2 алкен Cn. H(2 n-2) алкин + 2 H 2 Pt Cn. H(2 n+2) алкан
 Получение гомологов метана б) взаимодействие галогеналканов с активными металлами (реакция А. Вюрца): происходит димеризация углеродной цепи исходного галогеналкана с образованием алкана с четным числом атомов углерода в цепи: R – Br – Na + │ – R – Br R │ Na Na – Br + R Na – Br CH – Br 2 3 + 2 Na CH 3 – CH 3 + 2 Na – Br Если в реакции участвуют разные галогеналканы, то образуется смесь алканов: 3 R – Br + 3 R′ – Br + 6 Na 3 CH 3 – Br + 3 C 2 H 5 – Br + 6 Na бромметан бромэтан R – R + R – R′ + R′ – R′ + 6 Na – Br CH 3 – CH 3 + CH 3 – C 2 H 5 + C 2 H 5 – C 2 H 5 + 6 Na – Br этан пропан бутан
Получение гомологов метана б) взаимодействие галогеналканов с активными металлами (реакция А. Вюрца): происходит димеризация углеродной цепи исходного галогеналкана с образованием алкана с четным числом атомов углерода в цепи: R – Br – Na + │ – R – Br R │ Na Na – Br + R Na – Br CH – Br 2 3 + 2 Na CH 3 – CH 3 + 2 Na – Br Если в реакции участвуют разные галогеналканы, то образуется смесь алканов: 3 R – Br + 3 R′ – Br + 6 Na 3 CH 3 – Br + 3 C 2 H 5 – Br + 6 Na бромметан бромэтан R – R + R – R′ + R′ – R′ + 6 Na – Br CH 3 – CH 3 + CH 3 – C 2 H 5 + C 2 H 5 – C 2 H 5 + 6 Na – Br этан пропан бутан
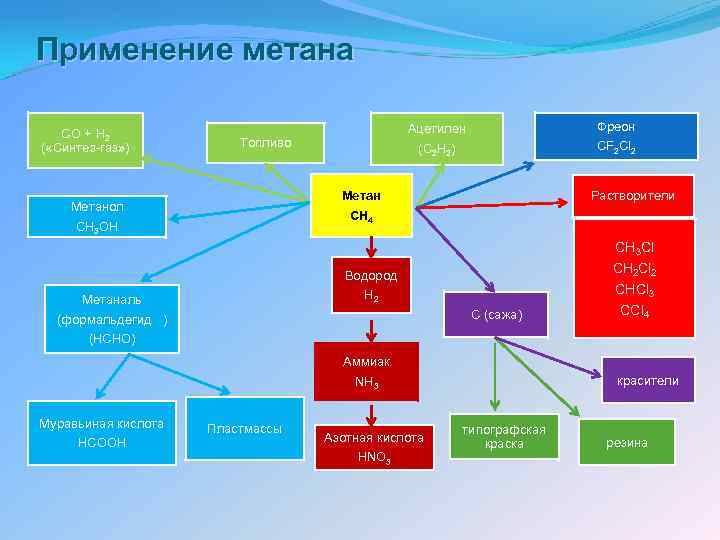 Применение метана CO + H 2 ( «Синтез-газ» ) Ацетилен (C 2 H 2) Топливо Метан CH 4 Метанол CH 3 OH Фреон CF 2 Cl 2 Растворители CH 3 Cl Водород H 2 Метаналь (формальдегид ) (HCHO) C (сажа) Аммиак NH 3 Муравьиная кислота HCOOH Пластмассы Азотная кислота HNO 3 CH 2 Cl 2 CHCl 3 CCl 4 красители типографская краска резина
Применение метана CO + H 2 ( «Синтез-газ» ) Ацетилен (C 2 H 2) Топливо Метан CH 4 Метанол CH 3 OH Фреон CF 2 Cl 2 Растворители CH 3 Cl Водород H 2 Метаналь (формальдегид ) (HCHO) C (сажа) Аммиак NH 3 Муравьиная кислота HCOOH Пластмассы Азотная кислота HNO 3 CH 2 Cl 2 CHCl 3 CCl 4 красители типографская краска резина
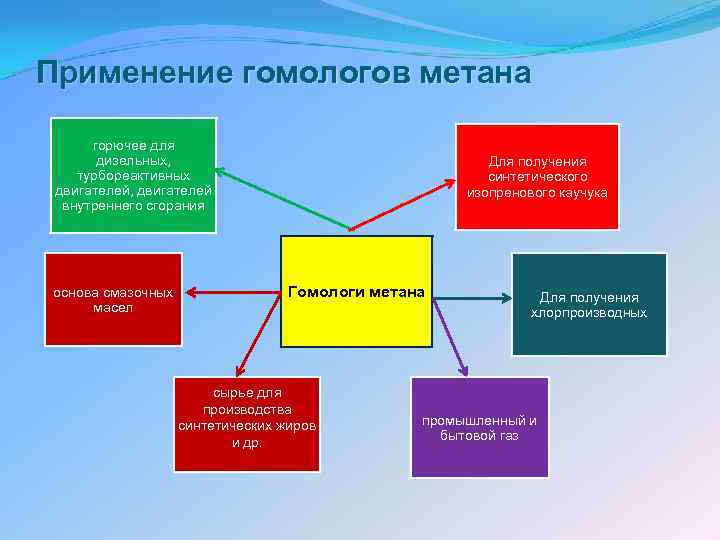 Применение гомологов метана горючее для дизельных, турбореактивных двигателей, двигателей внутреннего сгорания основа смазочных масел Для получения синтетического изопренового каучука Гомологи метана сырье для производства синтетических жиров и др. Для получения хлорпроизводных промышленный и бытовой газ
Применение гомологов метана горючее для дизельных, турбореактивных двигателей, двигателей внутреннего сгорания основа смазочных масел Для получения синтетического изопренового каучука Гомологи метана сырье для производства синтетических жиров и др. Для получения хлорпроизводных промышленный и бытовой газ
 Домашнее задание По учебнику О. С. Габриеляна и др. «Химия-10: профильный уровень» : § 11 (с. 69 -83); записи в тетради; упражнения 2 и 5 (с. 83) – письменно; задачи 7 -12 (с. 84).
Домашнее задание По учебнику О. С. Габриеляна и др. «Химия-10: профильный уровень» : § 11 (с. 69 -83); записи в тетради; упражнения 2 и 5 (с. 83) – письменно; задачи 7 -12 (с. 84).
 Используемая литература 1. «Репетитор по химии (издание 15 -ое)» , под редакцией Егорова А. С. , Феникс – Ростов-на-Дону, 2006 2. Габриелян О. С. , Маскаев Ф. Н. , Пономарев С. Ю. , Теренин В. И. « Химия 10 класс: профильный уровень» . (Учебник для общеобразовательных учреждений), Дрофа – Москва, 2005 3. Рудзитис Г. Е. , Фельдман Ф. Г. «Химия 10: органическая химия (Учебник для 10 класса средней школы)» , Просвещение – Москва, 1991 4. Перекалин В. В. , Зонис С. А. «Органическая химия (учебное пособие для студентов педагогических институтов по химическим и биологическим специальностям)» , Просвещение – Москва, 1982 5. «Органическая химия. Том 1 (Основной курс)» под редакцией Н. А. Тюкавкиной (учебник для студентов вузов по специальности «Фармация» ), Дрофа – Москва, 2004
Используемая литература 1. «Репетитор по химии (издание 15 -ое)» , под редакцией Егорова А. С. , Феникс – Ростов-на-Дону, 2006 2. Габриелян О. С. , Маскаев Ф. Н. , Пономарев С. Ю. , Теренин В. И. « Химия 10 класс: профильный уровень» . (Учебник для общеобразовательных учреждений), Дрофа – Москва, 2005 3. Рудзитис Г. Е. , Фельдман Ф. Г. «Химия 10: органическая химия (Учебник для 10 класса средней школы)» , Просвещение – Москва, 1991 4. Перекалин В. В. , Зонис С. А. «Органическая химия (учебное пособие для студентов педагогических институтов по химическим и биологическим специальностям)» , Просвещение – Москва, 1982 5. «Органическая химия. Том 1 (Основной курс)» под редакцией Н. А. Тюкавкиной (учебник для студентов вузов по специальности «Фармация» ), Дрофа – Москва, 2004


