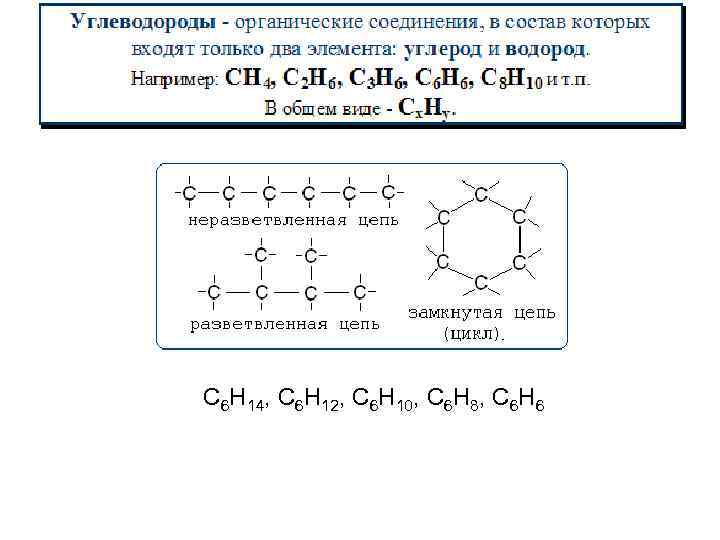
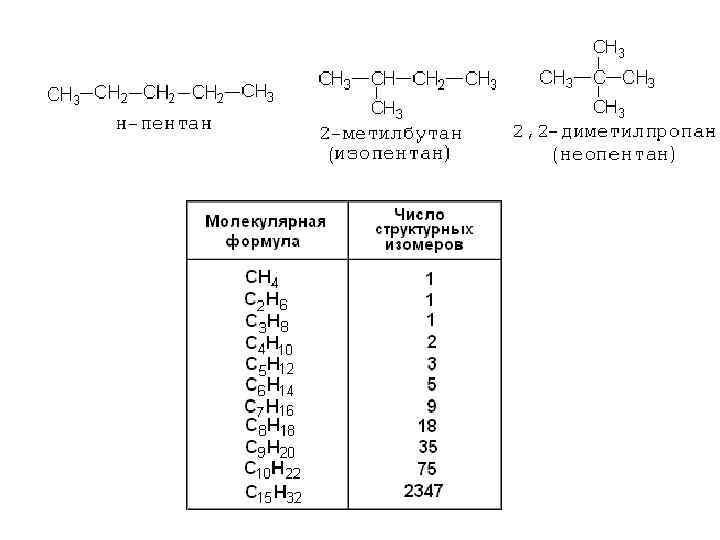
 C 6 H 14, C 6 H 12, C 6 H 10, C 6 H 8, C 6 H 6
C 6 H 14, C 6 H 12, C 6 H 10, C 6 H 8, C 6 H 6

 Основные компоненты нефти - углеводороды (до 98%) - подразделяются на 4 класса: Парафины (алканы) - (до 90% от общего состава) Циклопарафины (нафтены) - ( 30 - 60% от общего состава) Ароматические углеводороды (арены) - (20 - 40% от общего состава) Олефины (алкены) - (до 10% от общего состава) Состав природного газа До 98% природного газа составляет метан, также в его состав входят гомологи метана - этан, пропан и бутан. Иногда могут присутствовать углекислый газ, сероводород и гелий.
Основные компоненты нефти - углеводороды (до 98%) - подразделяются на 4 класса: Парафины (алканы) - (до 90% от общего состава) Циклопарафины (нафтены) - ( 30 - 60% от общего состава) Ароматические углеводороды (арены) - (20 - 40% от общего состава) Олефины (алкены) - (до 10% от общего состава) Состав природного газа До 98% природного газа составляет метан, также в его состав входят гомологи метана - этан, пропан и бутан. Иногда могут присутствовать углекислый газ, сероводород и гелий.
 Попутный нефтяной газ (ПНГ) – это природный углеводородный газ, растворенный в нефти или находящийся в «шапках» нефтяных и газоконденсатных месторождений. Содержит в своем составе кроме метана и этана большую долю пропанов, бутанов и паров более тяжелых углеводородов. Во многих попутных газах, в зависимости от месторождения, содержатся также неуглеводородные компоненты: сероводород и меркаптаны, углекислый газ, азот, гелий и аргон.
Попутный нефтяной газ (ПНГ) – это природный углеводородный газ, растворенный в нефти или находящийся в «шапках» нефтяных и газоконденсатных месторождений. Содержит в своем составе кроме метана и этана большую долю пропанов, бутанов и паров более тяжелых углеводородов. Во многих попутных газах, в зависимости от месторождения, содержатся также неуглеводородные компоненты: сероводород и меркаптаны, углекислый газ, азот, гелий и аргон.
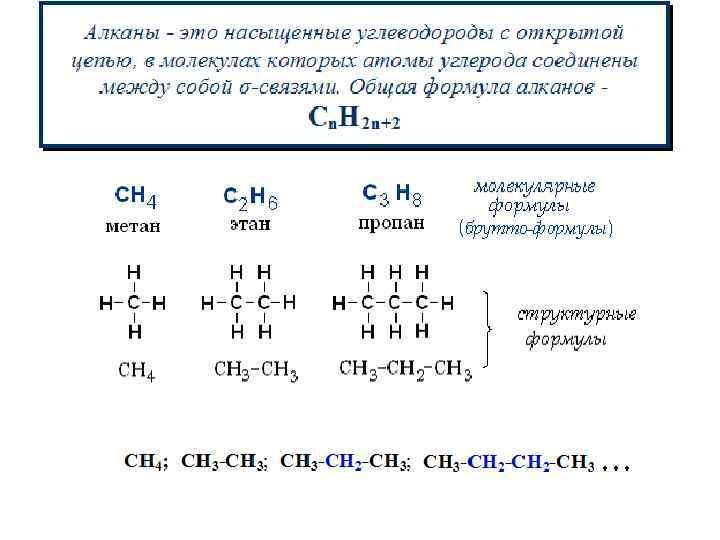

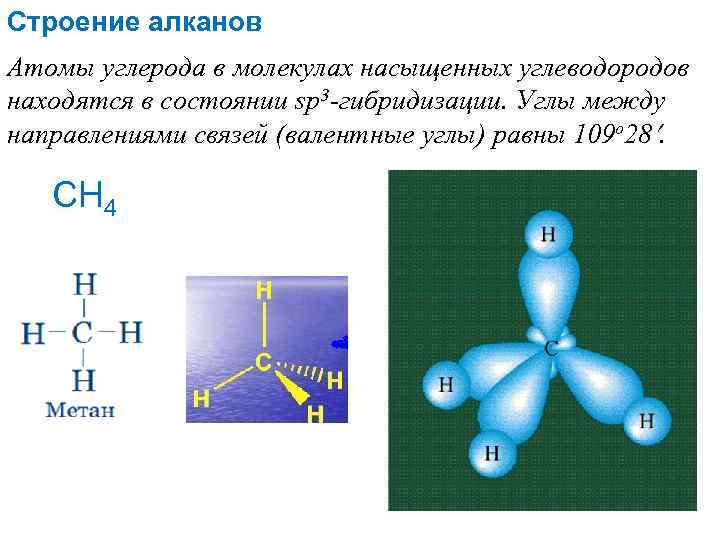 Строение алканов Атомы углерода в молекулах насыщенных углеводородов находятся в состоянии sp 3 -гибридизации. Углы между направлениями связей (валентные углы) равны 109 о 28. СН 4
Строение алканов Атомы углерода в молекулах насыщенных углеводородов находятся в состоянии sp 3 -гибридизации. Углы между направлениями связей (валентные углы) равны 109 о 28. СН 4
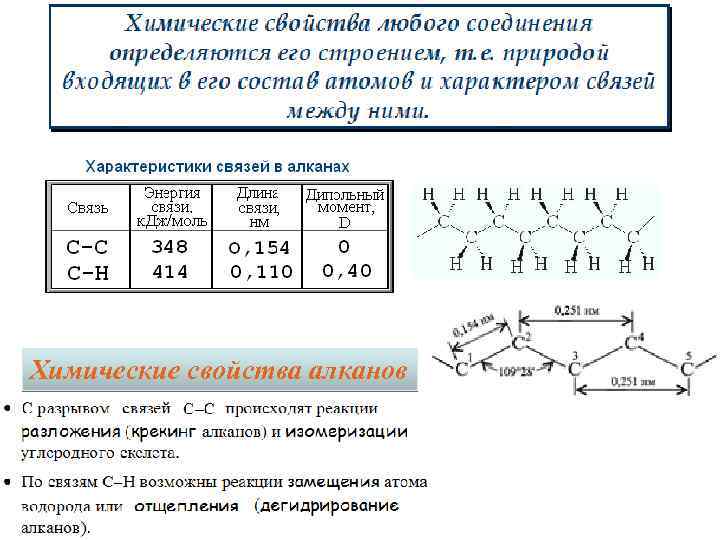 Химические свойства алканов
Химические свойства алканов
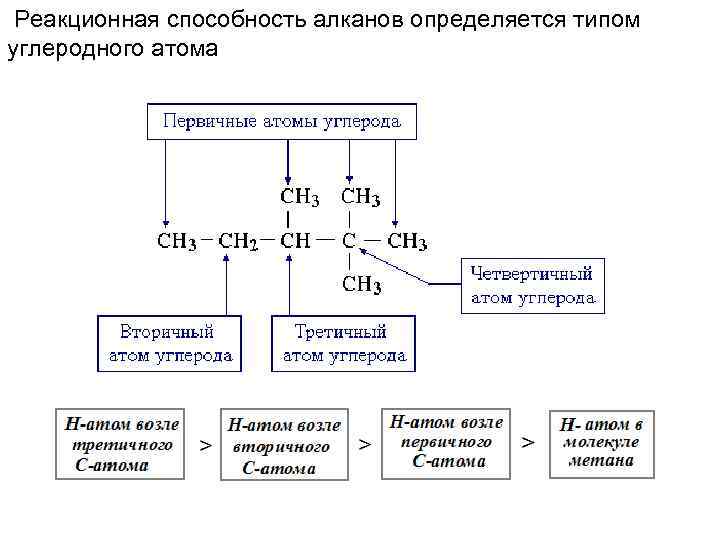 Реакционная способность алканов определяется типом углеродного атома
Реакционная способность алканов определяется типом углеродного атома
 Вследствие симметричности неполярных С–С и слабополярных С–Н ковалентных связей их разрыв происходит гомолитически с образованием свободных радикалов, т. е. механизм реакций свободнорадикальный Реакции радикального замещения - SR 1. Галогенирование Реакция с фтором очень экзотермична и сопровождается разрушением молекулы алкана, а продуктами реакции являются углерод и фтористый углерод. Хлорирование осуществляют при комнатной температуре, бромирование - при нагревании, прямое йодирование осуществить не удается.
Вследствие симметричности неполярных С–С и слабополярных С–Н ковалентных связей их разрыв происходит гомолитически с образованием свободных радикалов, т. е. механизм реакций свободнорадикальный Реакции радикального замещения - SR 1. Галогенирование Реакция с фтором очень экзотермична и сопровождается разрушением молекулы алкана, а продуктами реакции являются углерод и фтористый углерод. Хлорирование осуществляют при комнатной температуре, бромирование - при нагревании, прямое йодирование осуществить не удается.
 Хлорирование метана: При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2 -х, 3 -х и 4 -х атомов водорода:
Хлорирование метана: При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2 -х, 3 -х и 4 -х атомов водорода:

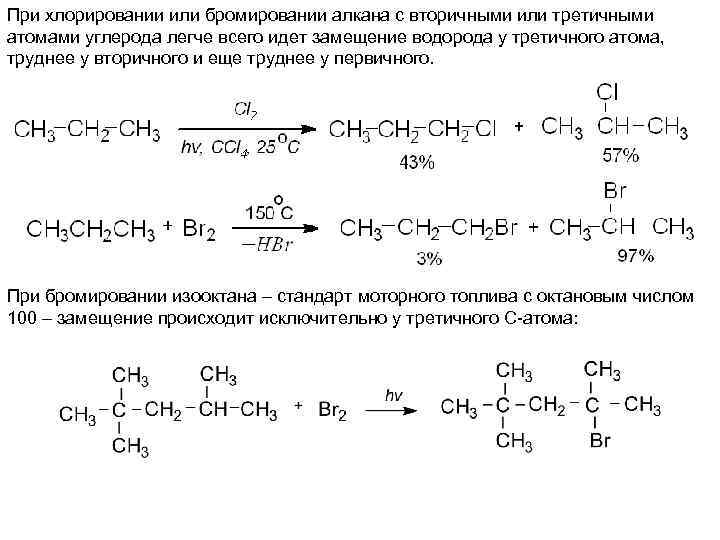 При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. При бромировании изооктана – стандарт моторного топлива с октановым числом 100 – замещение происходит исключительно у третичного С-атома:
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. При бромировании изооктана – стандарт моторного топлива с октановым числом 100 – замещение происходит исключительно у третичного С-атома:
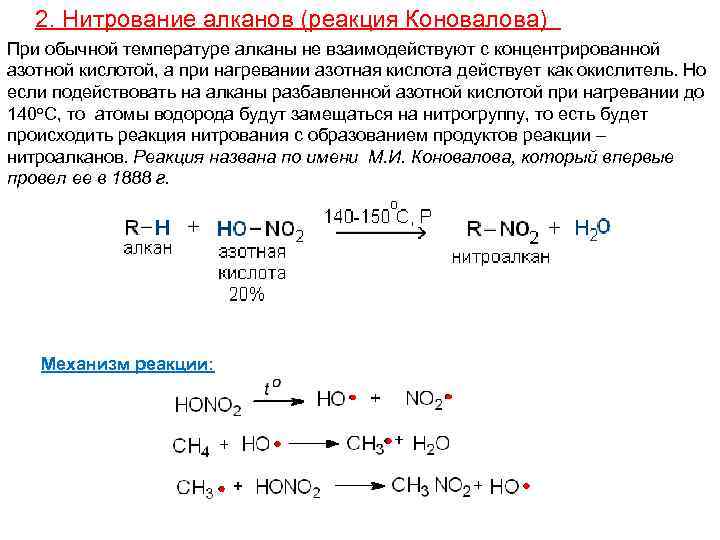 2. Нитрование алканов (реакция Коновалова) При обычной температуре алканы не взаимодействуют с концентрированной азотной кислотой, а при нагревании азотная кислота действует как окислитель. Но если подействовать на алканы разбавленной азотной кислотой при нагревании до 140 о. С, то атомы водорода будут замещаться на нитрогруппу, то есть будет происходить реакция нитрования с образованием продуктов реакции – нитроалканов. Реакция названа по имени М. И. Коновалова, который впервые провел ее в 1888 г. Механизм реакции:
2. Нитрование алканов (реакция Коновалова) При обычной температуре алканы не взаимодействуют с концентрированной азотной кислотой, а при нагревании азотная кислота действует как окислитель. Но если подействовать на алканы разбавленной азотной кислотой при нагревании до 140 о. С, то атомы водорода будут замещаться на нитрогруппу, то есть будет происходить реакция нитрования с образованием продуктов реакции – нитроалканов. Реакция названа по имени М. И. Коновалова, который впервые провел ее в 1888 г. Механизм реакции:
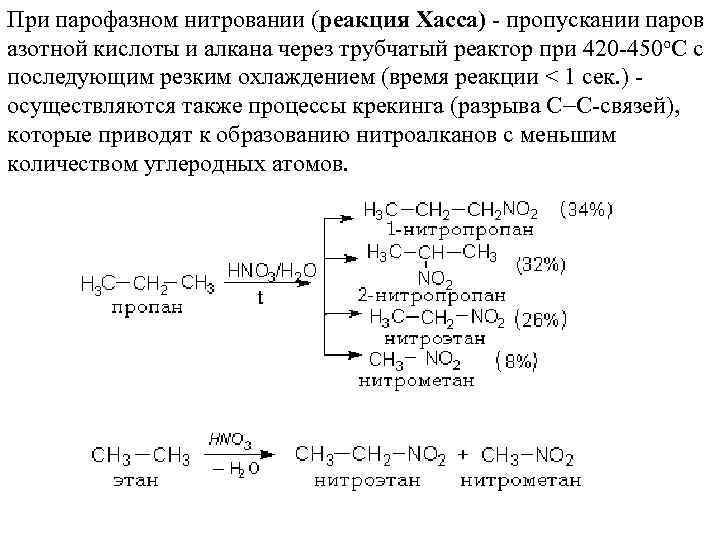 При парофазном нитровании (реакция Хасса) - пропускании паров азотной кислоты и алкана через трубчатый реактор при 420 -450 о. С с последующим резким охлаждением (время реакции < 1 сек. ) осуществляются также процессы крекинга (разрыва С С-связей), которые приводят к образованию нитроалканов с меньшим количеством углеродных атомов.
При парофазном нитровании (реакция Хасса) - пропускании паров азотной кислоты и алкана через трубчатый реактор при 420 -450 о. С с последующим резким охлаждением (время реакции < 1 сек. ) осуществляются также процессы крекинга (разрыва С С-связей), которые приводят к образованию нитроалканов с меньшим количеством углеродных атомов.
 Серная кислота в обычных условиях не взаимодействует с алканами. Однако смесь диоксида серы с кислородом в условиях фотохимической реакции приводит к замещению водородных атомов. 3. Сульфокисление 4. Сульфохлорирование Реакция сульфохлорирования имеет широкое практическое использование. Алкансульфохлориды легко взаимодействуют со щелочами или содой с образованием солей сульфокислот, большое количество которых (С 12 - С 18) используют для производства синтетических моющих средств (СМС): RSO 2 Cl + 2 Na. OH RSO 2 ONa + Na. Cl + H 2 O Алкилсульфонаты с числом углеродных атомов от 14 до 18 обладают поверхностно-активными свойствами и моющим действием (способны эмульгировать в воде жиры и масла). Синтетические детергенты в большом количестве получают при сульфохлорировании керосиновой фракции нефти и применяют в производстве жидких и
Серная кислота в обычных условиях не взаимодействует с алканами. Однако смесь диоксида серы с кислородом в условиях фотохимической реакции приводит к замещению водородных атомов. 3. Сульфокисление 4. Сульфохлорирование Реакция сульфохлорирования имеет широкое практическое использование. Алкансульфохлориды легко взаимодействуют со щелочами или содой с образованием солей сульфокислот, большое количество которых (С 12 - С 18) используют для производства синтетических моющих средств (СМС): RSO 2 Cl + 2 Na. OH RSO 2 ONa + Na. Cl + H 2 O Алкилсульфонаты с числом углеродных атомов от 14 до 18 обладают поверхностно-активными свойствами и моющим действием (способны эмульгировать в воде жиры и масла). Синтетические детергенты в большом количестве получают при сульфохлорировании керосиновой фракции нефти и применяют в производстве жидких и
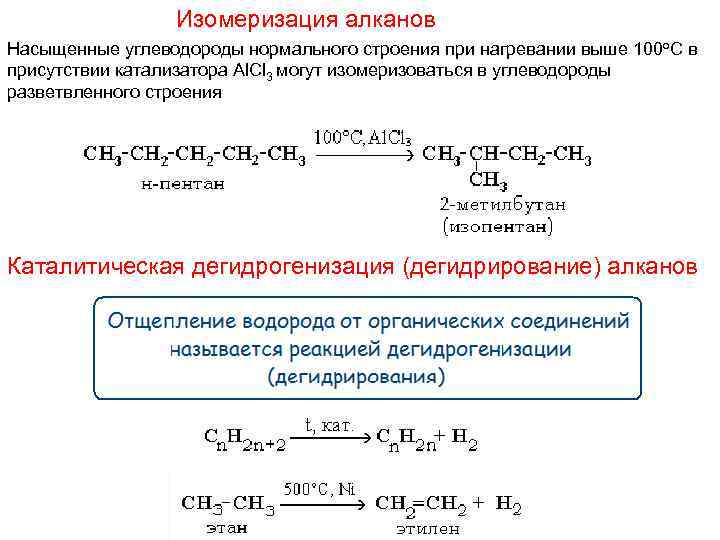 Изомеризация алканов Насыщенные углеводороды нормального строения при нагревании выше 100 о. С в присутствии катализатора Al. Cl 3 могут изомеризоваться в углеводороды разветвленного строения Каталитическая дегидрогенизация (дегидрирование) алканов
Изомеризация алканов Насыщенные углеводороды нормального строения при нагревании выше 100 о. С в присутствии катализатора Al. Cl 3 могут изомеризоваться в углеводороды разветвленного строения Каталитическая дегидрогенизация (дегидрирование) алканов
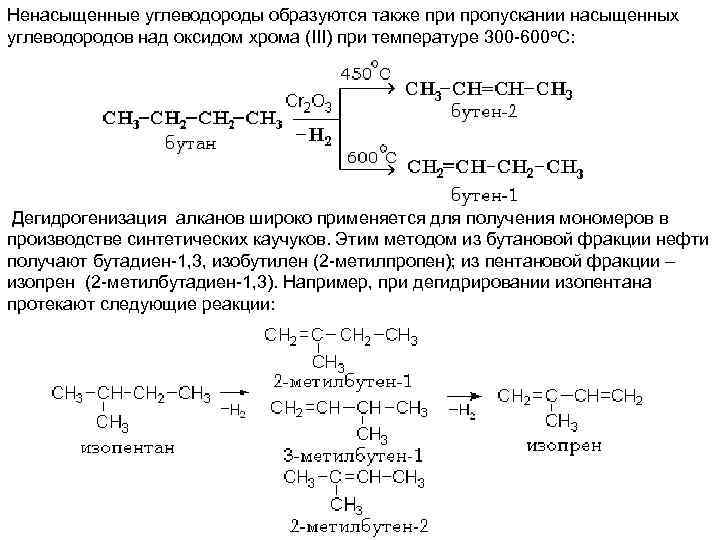 Ненасыщенные углеводороды образуются также при пропускании насыщенных углеводородов над оксидом хрома (III) при температуре 300 -600 о. С: Дегидрогенизация алканов широко применяется для получения мономеров в производстве синтетических каучуков. Этим методом из бутановой фракции нефти получают бутадиен-1, 3, изобутилен (2 -метилпропен); из пентановой фракции – изопрен (2 -метилбутадиен-1, 3). Например, при дегидрировании изопентана протекают следующие реакции:
Ненасыщенные углеводороды образуются также при пропускании насыщенных углеводородов над оксидом хрома (III) при температуре 300 -600 о. С: Дегидрогенизация алканов широко применяется для получения мономеров в производстве синтетических каучуков. Этим методом из бутановой фракции нефти получают бутадиен-1, 3, изобутилен (2 -метилпропен); из пентановой фракции – изопрен (2 -метилбутадиен-1, 3). Например, при дегидрировании изопентана протекают следующие реакции:
 При нагревании метана до температуры 1500°С (пиролиз метана) происходит межмолекулярное дегидрирование с образованием ацетилена: Эта реакция используется для промышленного получения ацетилена. Реакции расщепления. Крекинг алканов При нагревании насыщенных углеводородов свыше 400 о. С происходит разрыв С С связей в молекулах (термический крекинг) с образованием сложной смеси продуктов, строение и содержание которых зависят от температуры и времени протекании реакции.
При нагревании метана до температуры 1500°С (пиролиз метана) происходит межмолекулярное дегидрирование с образованием ацетилена: Эта реакция используется для промышленного получения ацетилена. Реакции расщепления. Крекинг алканов При нагревании насыщенных углеводородов свыше 400 о. С происходит разрыв С С связей в молекулах (термический крекинг) с образованием сложной смеси продуктов, строение и содержание которых зависят от температуры и времени протекании реакции.
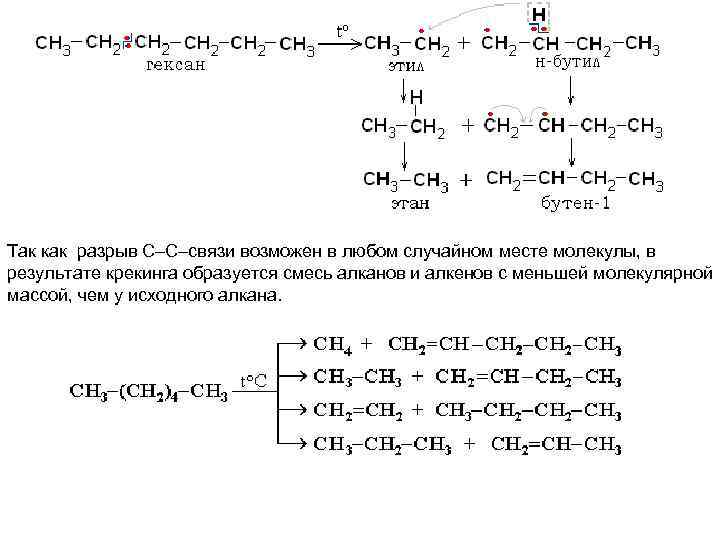 Так как разрыв С–С–связи возможен в любом случайном месте молекулы, в результате крекинга образуется смесь алканов и алкенов с меньшей молекулярной массой, чем у исходного алкана.
Так как разрыв С–С–связи возможен в любом случайном месте молекулы, в результате крекинга образуется смесь алканов и алкенов с меньшей молекулярной массой, чем у исходного алкана.
 Пиролиз Если проводить термическое разложение алканов без катализатора при температуре 700 -800 о. С, то такой процесс называется пиролизом. При этом в молекулах происходят более глубокие изменения с образованием смеси газообразных продуктов. Основной целью процесса является получение максимально возможного количества этилена. В настоящее время пиролиз является базовым процессом нефтехимии, на его основе получают около 75% нефтехимических продуктов. При более высокой температуре (свыше 1000°С) происходит разрыв не только связей С–С, но и более прочных связей С–Н. Например, пиролиз метана используется для получения сажи (чистый углерод) и водорода: СН 4 C + 2 H 2
Пиролиз Если проводить термическое разложение алканов без катализатора при температуре 700 -800 о. С, то такой процесс называется пиролизом. При этом в молекулах происходят более глубокие изменения с образованием смеси газообразных продуктов. Основной целью процесса является получение максимально возможного количества этилена. В настоящее время пиролиз является базовым процессом нефтехимии, на его основе получают около 75% нефтехимических продуктов. При более высокой температуре (свыше 1000°С) происходит разрыв не только связей С–С, но и более прочных связей С–Н. Например, пиролиз метана используется для получения сажи (чистый углерод) и водорода: СН 4 C + 2 H 2
 Реакции окисления Алканы стойки к действию всевозможных окислителей. При обычной температуре насыщенные углеводороды не окисляются кислородом воздуха и такими сильными окислителями, как КМn. O 4 и K 2 Cr 2 O 7, но при повышении температуры до 150 о. С и в присутствии катализаторов (например, солей марганца) они окисляются кислородом с образованием различных кислородсодержащих соединений: спиртов, кислот, гидрокси- и оксикислот и др. Каталитическим окислением высших парафинов нормального строения (С 12 -С 25) в промышленности получают высшие жирные кислоты: Окисление метана кислородом воздуха при нормальном давлении приводит к образованию формальдегида, но если окисление проводить при повышенном давлении и температуре 400 о. С, то основным продуктом такого процесса будет метиловый спирт.
Реакции окисления Алканы стойки к действию всевозможных окислителей. При обычной температуре насыщенные углеводороды не окисляются кислородом воздуха и такими сильными окислителями, как КМn. O 4 и K 2 Cr 2 O 7, но при повышении температуры до 150 о. С и в присутствии катализаторов (например, солей марганца) они окисляются кислородом с образованием различных кислородсодержащих соединений: спиртов, кислот, гидрокси- и оксикислот и др. Каталитическим окислением высших парафинов нормального строения (С 12 -С 25) в промышленности получают высшие жирные кислоты: Окисление метана кислородом воздуха при нормальном давлении приводит к образованию формальдегида, но если окисление проводить при повышенном давлении и температуре 400 о. С, то основным продуктом такого процесса будет метиловый спирт.
 Способы получения алканов: 1. Гидрирование ненасыщенных соединений 2. Газификация твердого топлива С + 0, 5 О 2 СО С + СО 2 2 СО С + Н 2 О СО + Н 2 n CO + (2 n+1)H 2 Cn. H 2 n+2 + n H 2 O 3. Восстановление галогеналканов 4. Реакция Вюрца
Способы получения алканов: 1. Гидрирование ненасыщенных соединений 2. Газификация твердого топлива С + 0, 5 О 2 СО С + СО 2 2 СО С + Н 2 О СО + Н 2 n CO + (2 n+1)H 2 Cn. H 2 n+2 + n H 2 O 3. Восстановление галогеналканов 4. Реакция Вюрца
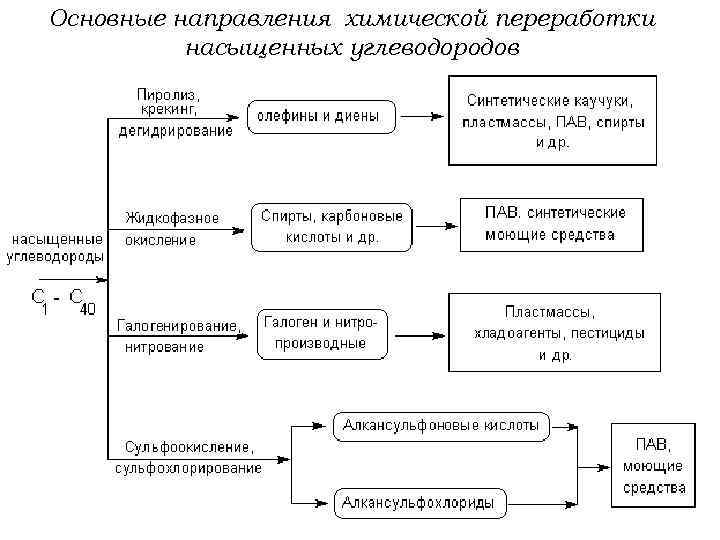 Основные направления химической переработки насыщенных углеводородов
Основные направления химической переработки насыщенных углеводородов
 Применение алканов Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива. Жидкие углеводоpоды (бензин, керосин, соляровое масло) составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей. Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике. Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
Применение алканов Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива. Жидкие углеводоpоды (бензин, керосин, соляровое масло) составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей. Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике. Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
 Паpафин (смесь твеpдых алканов С 19 -С 35) - белая твеpдая масса без запаха и вкуса (т. пл. 50 -70 °C) - пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине. Служит сырьём при получении органических кислот и спиртов, моющих средств и поверхностно-активных веществ. В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
Паpафин (смесь твеpдых алканов С 19 -С 35) - белая твеpдая масса без запаха и вкуса (т. пл. 50 -70 °C) - пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине. Служит сырьём при получении органических кислот и спиртов, моющих средств и поверхностно-активных веществ. В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
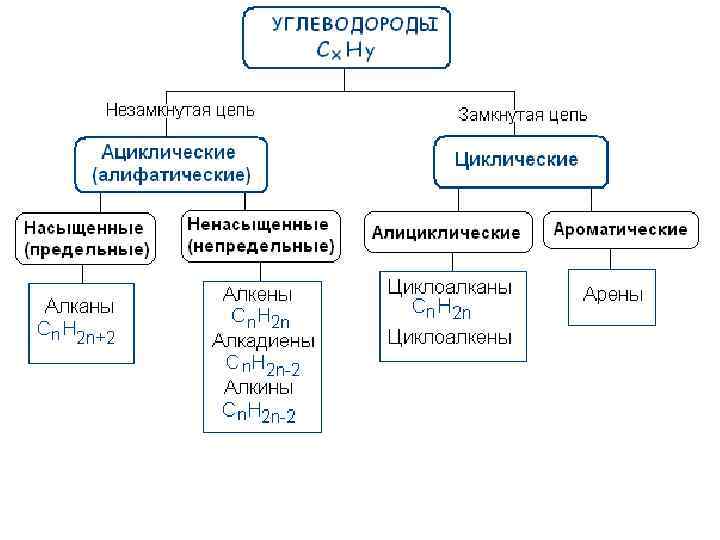
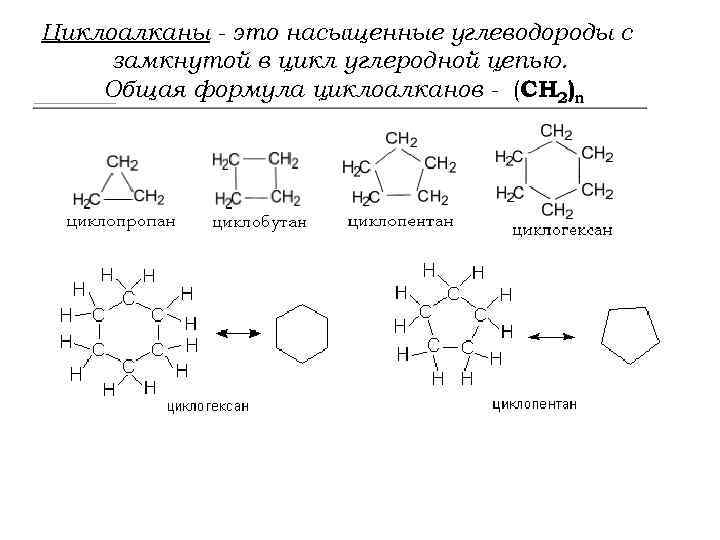 Циклоалканы - это насыщенные углеводороды с замкнутой в цикл углеродной цепью. Общая формула циклоалканов - (СH 2)n
Циклоалканы - это насыщенные углеводороды с замкнутой в цикл углеродной цепью. Общая формула циклоалканов - (СH 2)n
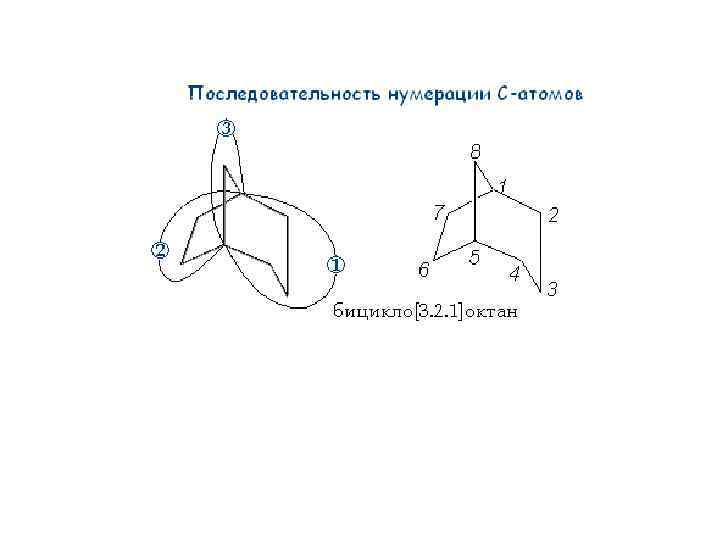
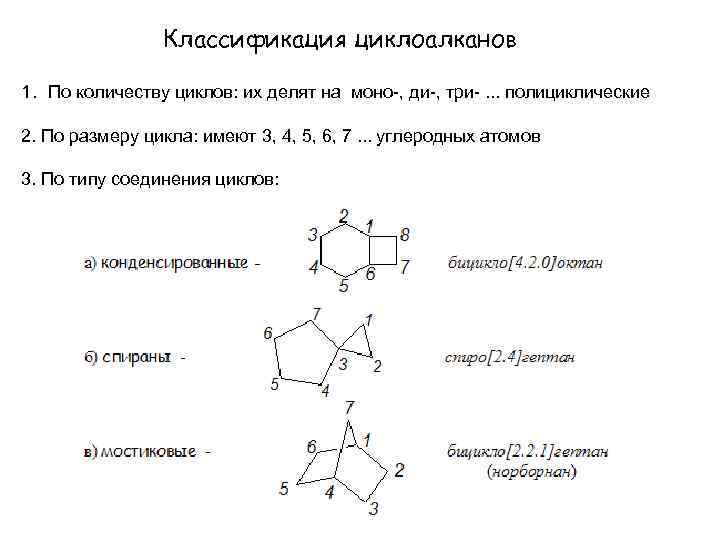 Классификация циклоалканов 1. По количеству циклов: их делят на моно-, ди-, три-. . . полициклические 2. По размеру цикла: имеют 3, 4, 5, 6, 7. . . углеродных атомов 3. По типу соединения циклов:
Классификация циклоалканов 1. По количеству циклов: их делят на моно-, ди-, три-. . . полициклические 2. По размеру цикла: имеют 3, 4, 5, 6, 7. . . углеродных атомов 3. По типу соединения циклов:
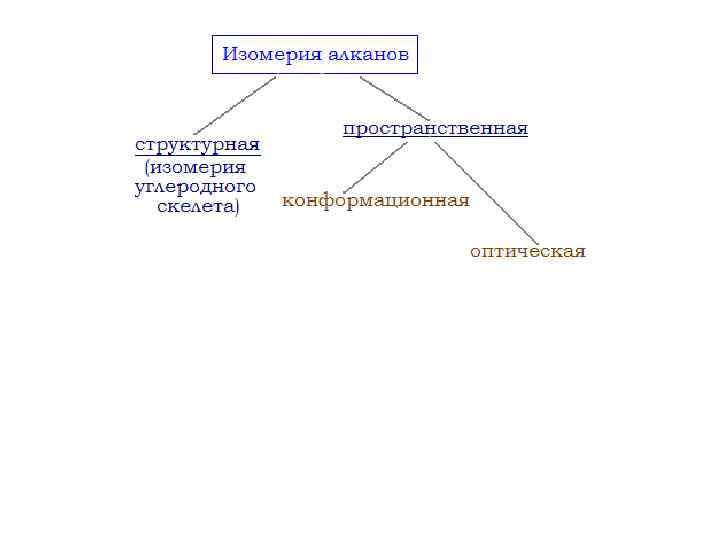
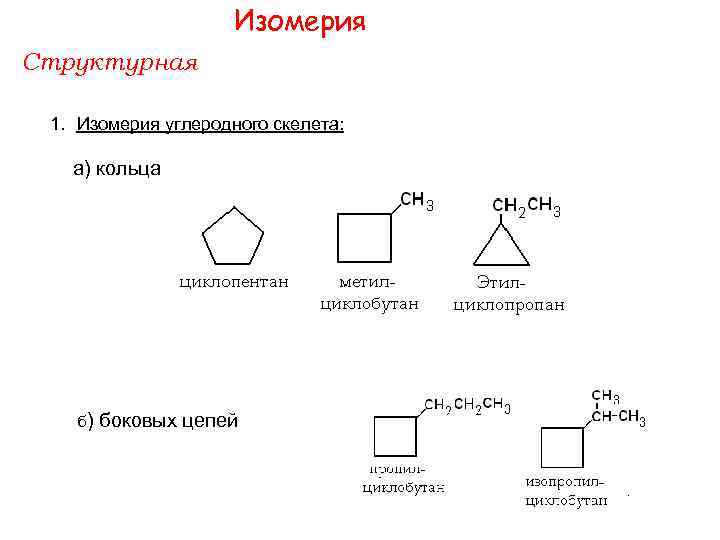 Изомерия Структурная 1. Изомерия углеродного скелета: а) кольца б) боковых цепей
Изомерия Структурная 1. Изомерия углеродного скелета: а) кольца б) боковых цепей
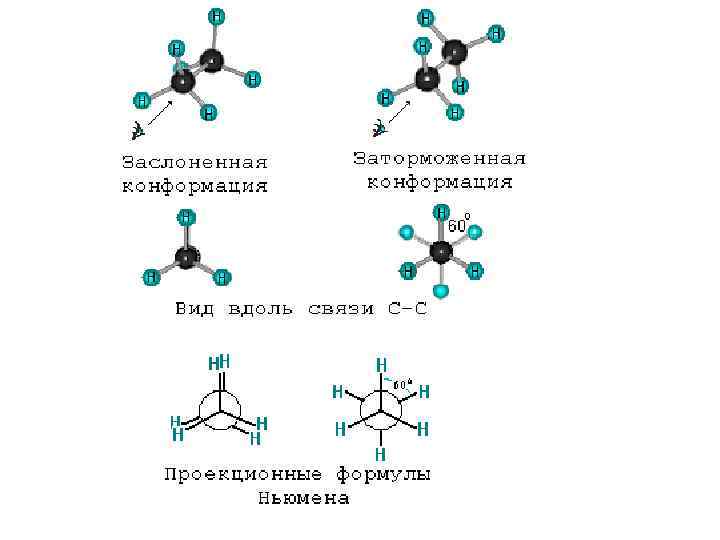
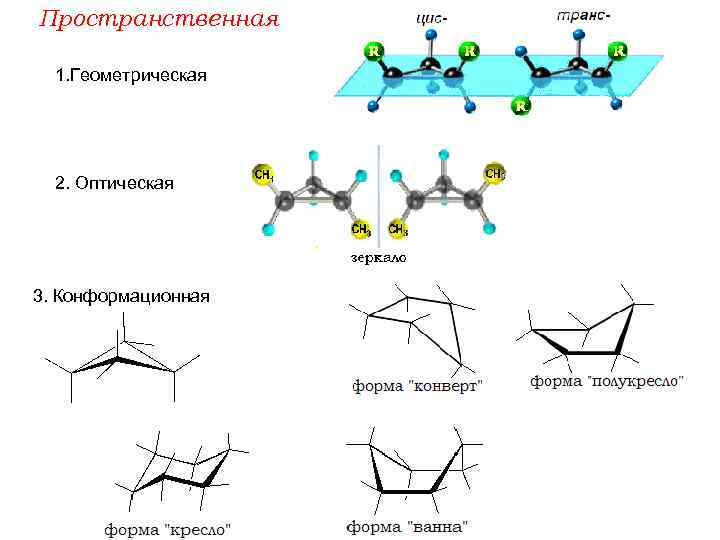 Пространственная 1. Геометрическая 2. Оптическая 3. Конформационная
Пространственная 1. Геометрическая 2. Оптическая 3. Конформационная
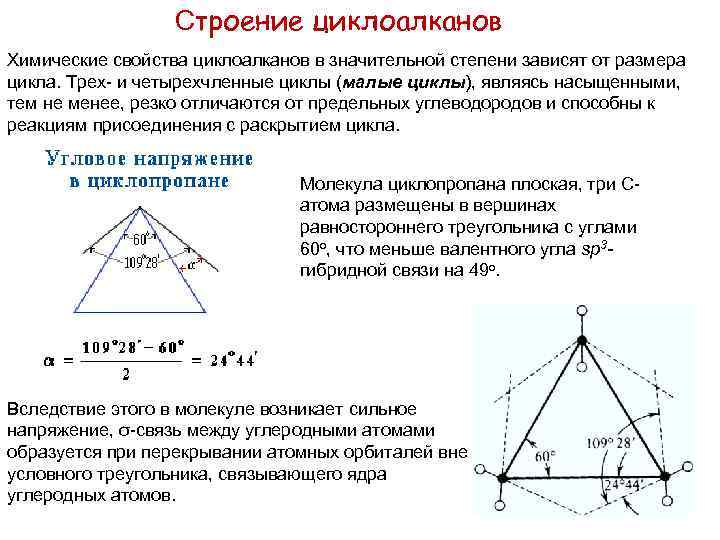 Строение циклоалканов Химические свойства циклоалканов в значительной степени зависят от размера цикла. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от предельных углеводородов и способны к реакциям присоединения с раскрытием цикла. Молекула циклопропана плоская, три Сатома размещены в вершинах равностороннего треугольника с углами 60 о, что меньше валентного угла sp 3 гибридной связи на 49 о. Вследствие этого в молекуле возникает сильное напряжение, σ-связь между углеродными атомами образуется при перекрывании атомных орбиталей вне условного треугольника, связывающего ядра углеродных атомов.
Строение циклоалканов Химические свойства циклоалканов в значительной степени зависят от размера цикла. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от предельных углеводородов и способны к реакциям присоединения с раскрытием цикла. Молекула циклопропана плоская, три Сатома размещены в вершинах равностороннего треугольника с углами 60 о, что меньше валентного угла sp 3 гибридной связи на 49 о. Вследствие этого в молекуле возникает сильное напряжение, σ-связь между углеродными атомами образуется при перекрывании атомных орбиталей вне условного треугольника, связывающего ядра углеродных атомов.
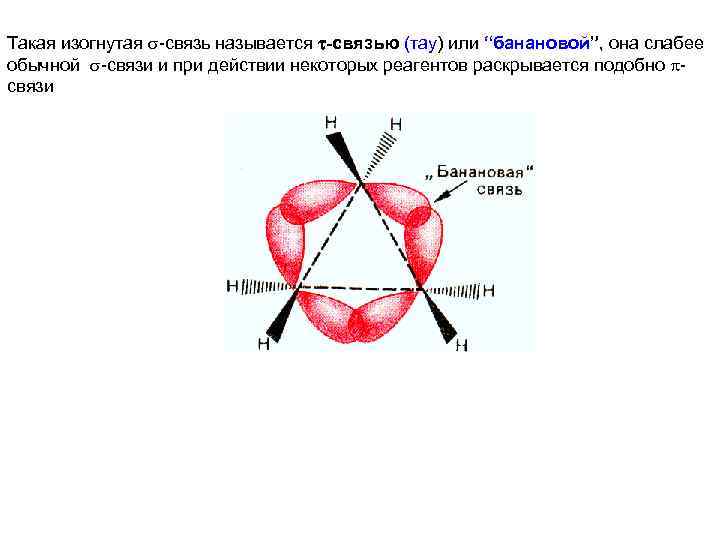 Такая изогнутая -связь называется -связью (тау) или “банановой”, она слабее обычной -связи и при действии некоторых реагентов раскрывается подобно связи
Такая изогнутая -связь называется -связью (тау) или “банановой”, она слабее обычной -связи и при действии некоторых реагентов раскрывается подобно связи
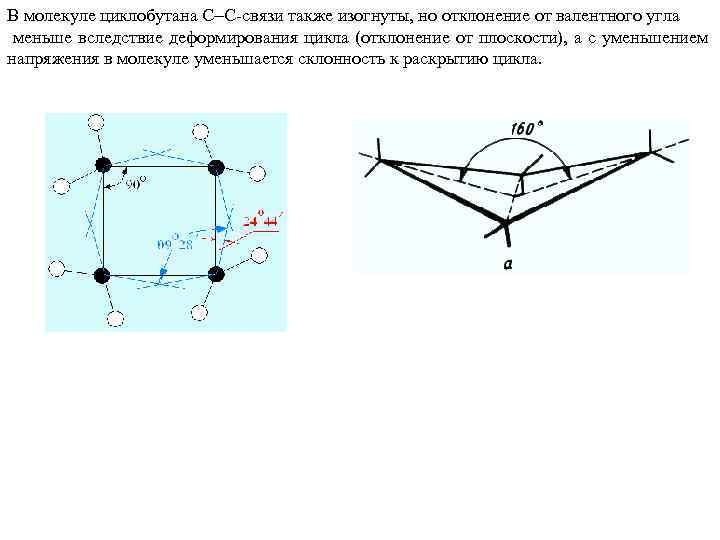 В молекуле циклобутана С С-связи также изогнуты, но отклонение от валентного угла меньше вследствие деформирования цикла (отклонение от плоскости), а с уменьшением напряжения в молекуле уменьшается склонность к раскрытию цикла.
В молекуле циклобутана С С-связи также изогнуты, но отклонение от валентного угла меньше вследствие деформирования цикла (отклонение от плоскости), а с уменьшением напряжения в молекуле уменьшается склонность к раскрытию цикла.
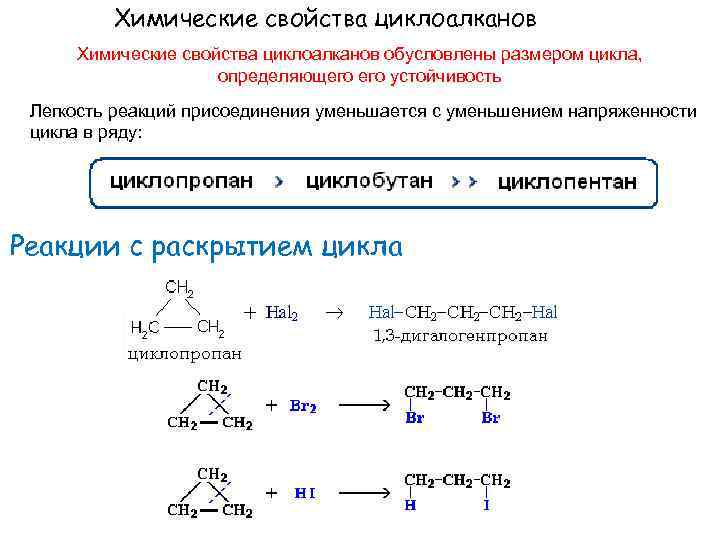 Химические свойства циклоалканов обусловлены размером цикла, определяющего устойчивость Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду: Реакции с раскрытием цикла
Химические свойства циклоалканов обусловлены размером цикла, определяющего устойчивость Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду: Реакции с раскрытием цикла
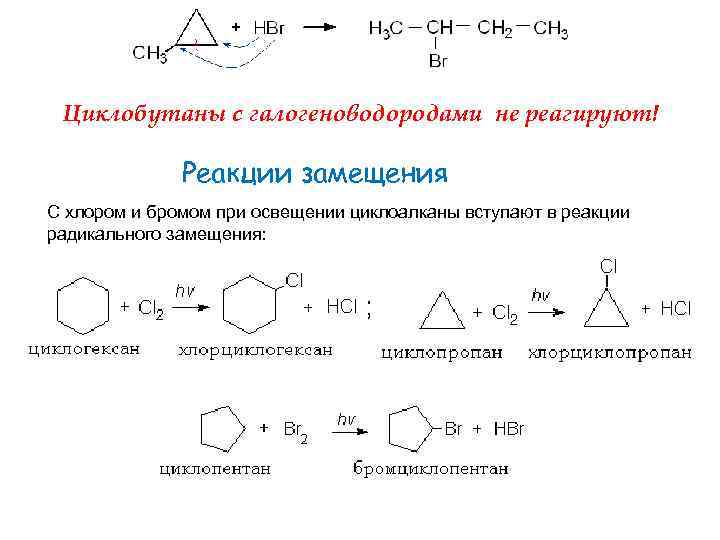 Циклобутаны с галогеноводородами не реагируют! Реакции замещения С хлором и бромом при освещении циклоалканы вступают в реакции радикального замещения:
Циклобутаны с галогеноводородами не реагируют! Реакции замещения С хлором и бромом при освещении циклоалканы вступают в реакции радикального замещения:
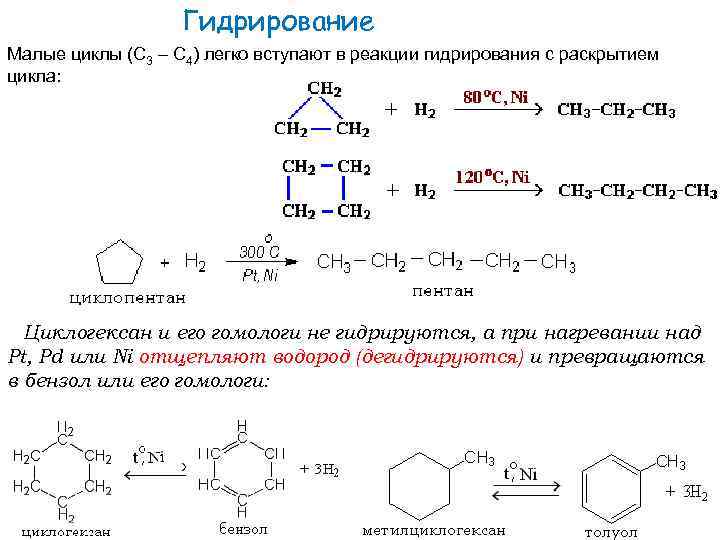 Гидрирование Малые циклы (С 3 – С 4) легко вступают в реакции гидрирования с раскрытием цикла: Циклогексан и его гомологи не гидрируются, а при нагревании над Pt, Pd или Ni отщепляют водород (дегидрируются) и превращаются в бензол или его гомологи:
Гидрирование Малые циклы (С 3 – С 4) легко вступают в реакции гидрирования с раскрытием цикла: Циклогексан и его гомологи не гидрируются, а при нагревании над Pt, Pd или Ni отщепляют водород (дегидрируются) и превращаются в бензол или его гомологи:
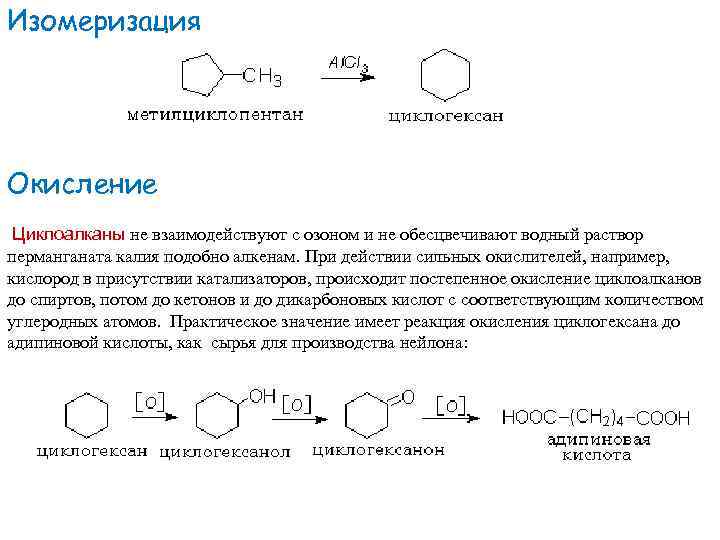 Изомеризация Окисление Циклоалканы не взаимодействуют с озоном и не обесцвечивают водный раствор перманганата калия подобно алкенам. При действии сильных окислителей, например, кислород в присутствии катализаторов, происходит постепенное окисление циклоалканов до спиртов, потом до кетонов и до дикарбоновых кислот с соответствующим количеством углеродных атомов. Практическое значение имеет реакция окисления циклогексана до адипиновой кислоты, как сырья для производства нейлона:
Изомеризация Окисление Циклоалканы не взаимодействуют с озоном и не обесцвечивают водный раствор перманганата калия подобно алкенам. При действии сильных окислителей, например, кислород в присутствии катализаторов, происходит постепенное окисление циклоалканов до спиртов, потом до кетонов и до дикарбоновых кислот с соответствующим количеством углеродных атомов. Практическое значение имеет реакция окисления циклогексана до адипиновой кислоты, как сырья для производства нейлона:
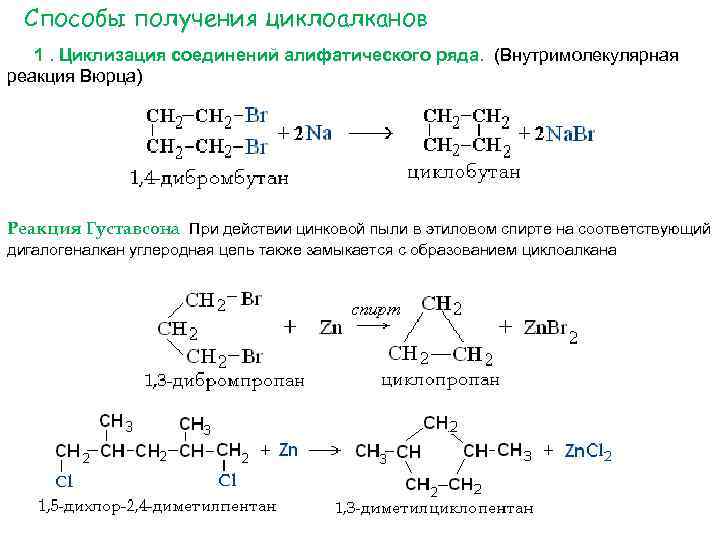 Способы получения циклоалканов 1. Циклизация соединений алифатического ряда. (Внутримолекулярная реакция Вюрца) Реакция Густавсона При действии цинковой пыли в этиловом спирте на соответствующий дигалогеналкан углеродная цепь также замыкается с образованием циклоалкана
Способы получения циклоалканов 1. Циклизация соединений алифатического ряда. (Внутримолекулярная реакция Вюрца) Реакция Густавсона При действии цинковой пыли в этиловом спирте на соответствующий дигалогеналкан углеродная цепь также замыкается с образованием циклоалкана
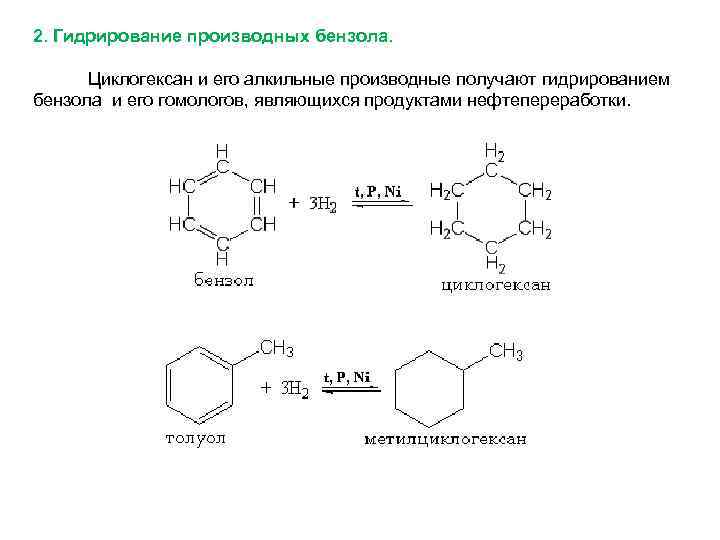 2. Гидрирование производных бензола. Циклогексан и его алкильные производные получают гидрированием бензола и его гомологов, являющихся продуктами нефтепереработки.
2. Гидрирование производных бензола. Циклогексан и его алкильные производные получают гидрированием бензола и его гомологов, являющихся продуктами нефтепереработки.
![3. Реакция Дильса-Альдера (диеновый синтез) [4+2] Присоединение сопряженной диеновой системы к этиленовым соединениям приводит 3. Реакция Дильса-Альдера (диеновый синтез) [4+2] Присоединение сопряженной диеновой системы к этиленовым соединениям приводит](https://present5.com/presentation/26608401_289320088/image-47.jpg) 3. Реакция Дильса-Альдера (диеновый синтез) [4+2] Присоединение сопряженной диеновой системы к этиленовым соединениям приводит к образованию шестичленного ненасыщенного цикла и называется реакцией диенового синтеза. Компонент диенового синтеза, содержащий сопряженную систему, называют диеном, а в структуре другого компонента – диенофила – всегда присутствует кратная связь.
3. Реакция Дильса-Альдера (диеновый синтез) [4+2] Присоединение сопряженной диеновой системы к этиленовым соединениям приводит к образованию шестичленного ненасыщенного цикла и называется реакцией диенового синтеза. Компонент диенового синтеза, содержащий сопряженную систему, называют диеном, а в структуре другого компонента – диенофила – всегда присутствует кратная связь.


