буферные системы 2.ppt
- Количество слайдов: 11

БУФЕРНЫЕ СИСТЕМЫ В ЖИВЫХ ОРГАНИЗМАХ Лектор – к. б. н. , Ph. D, доцент кафедры мед. Химии Вишницкая И. А.
![Ионное произведение воды. Водородный показатель. Константа диссоциации воды [ Н+ ] • [ ОН- Ионное произведение воды. Водородный показатель. Константа диссоциации воды [ Н+ ] • [ ОН-](https://present5.com/presentation/117287753_344158459/image-2.jpg)
Ионное произведение воды. Водородный показатель. Константа диссоциации воды [ Н+ ] • [ ОН- ] К= = 1, 8 • 10 -16 [ Н 2 О ] Н 2 О Н+ + ОН- , где [ Н+ ], [ ОН- ] – равновесные концентрации ионов Н+ и ОН- (г-ион/л), [ Н 2 О ] – равновесная кон-ция недиссоциированных молекул воды, моль/л Молярная концентрация воды = 55, 56 моль/л, т. о. КН 2 О = [ Н+ ] • [ ОН- ] = 10 -14 = const [ Н+ ] • [ ОН- ] = Кдиссоц. • [ Н 2 О ] = 1, 8*10 -16 • 55, 56 = 10 -14 КН 2 О = [ Н+ ] • [ ОН- ] = 10 -14 - ионное произведение воды [ Н+ ] = [ ОН- ] = 10 -7 – среда нейтральная – р. Н = 7 [ Н+ ] > 10 -7 – среда кислая – р. Н < 7 [ Н+ ] < 10 -7 – среда щелочная – р. Н > 7 р. Н – это отрицательный десятичный логарифм концентрации ионов водорода. р. Н = - lg [ H+ ] р. OН = - lg [ OH- ] р. Н + р. ОН = 14

Значения р. Н различных систем организма Сыворотка крови 7, 35 – 7, 45 Спинно-мозговая жидкость 7, 35 – 7, 45 Слюна 6, 35 – 6, 85 Желудочный сок 0, 9 – 1, 3 Моча 4, 8 – 7, 5 Слезная жидкость 7, 2 – 7, 4 Желчь в пузыре 5, 4 – 6, 9

БУФЕРНЫЕ СИСТЕМЫ КРОВИ Буферными системами (буферами) называют растворы, обладающие свойством достаточно стойко сохранять постоянство концентрации ионов водорода как при добавлении кислот или щелочей, так и при разведении. Классификация буферных систем Кислотные – состоят из слабой кислоты и соли этой кислоты, образованной сильным основанием. Ацетатный буфер: Основные – состоят из слабого основания и соли этого основания, образованной сильной кислотой. Аммиачный буфер: NH 4 OH NH 4 Cl Солевые – состоят из гидрофосфата и дигидрофосфата Na или К. Фосфатный буфер: Na. H 2 PO 4 Na 2 HPO 4 Гидрокарбонатный буфер: роль слабой к-ты СН 3 СООН СН 3 СООNa Н 2 СО 3 Na. HCO 3
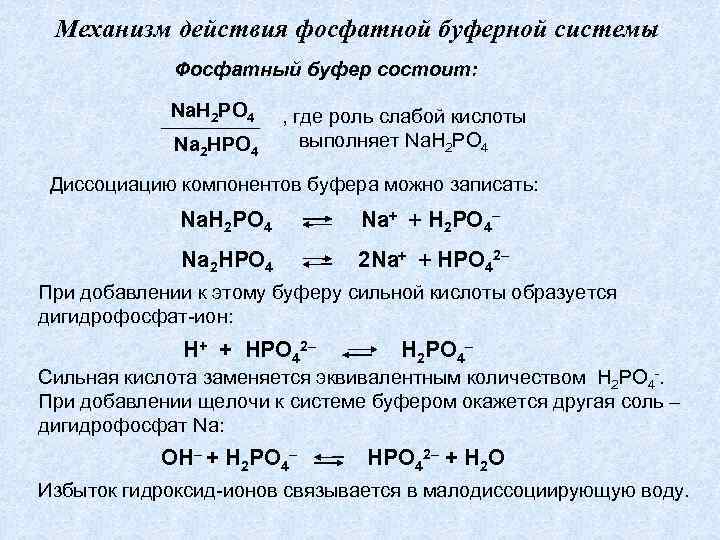
Механизм действия фосфатной буферной системы Фосфатный буфер состоит: Na. H 2 PO 4 Na 2 HPO 4 , где роль слабой кислоты выполняет Na. H 2 PO 4 Диссоциацию компонентов буфера можно записать: Na. H 2 PO 4 Na H 2 PO 4– Na 2 HPO 4 2 Na HPO 42– При добавлении к этому буферу сильной кислоты образуется дигидрофосфат-ион: H+ + HPO 42– H 2 PO 4– Сильная кислота заменяется эквивалентным количеством H 2 PO 4 -. При добавлении щелочи к системе буфером окажется другая соль – дигидрофосфат Na: ОH– + Н 2 PO 4– НРО 42– + Н 2 О Избыток гидроксид-ионов связывается в малодиссоциирующую воду.

Уравнение буферных систем ( Гендерсона – Гассельбаха ) Н 2 СО 3 Н+ + НСО 3 - [ Н+] • [ НСО 3 - ] КН 2 СО 3 = [ Н 2 СО 3 ] Из уравнения константы диссоциации кислоты концентрацию ионов Н+ можно записать: [ Н +] =КН 2 СО 3 [ Н 2 СО 3 ] [ НСО 3 - ] Прологорифмировав это уравнение, получим уравнение буферных систем: [ НСО 3 - ] р. Н = р. К + lg [ Н 2 СО 3 ] р. К = - lg КН 2 СО 3 = 6, 1 Для решения задач уравнение следующего вида: р. Н = р. К + lg CC • V C CK • V K
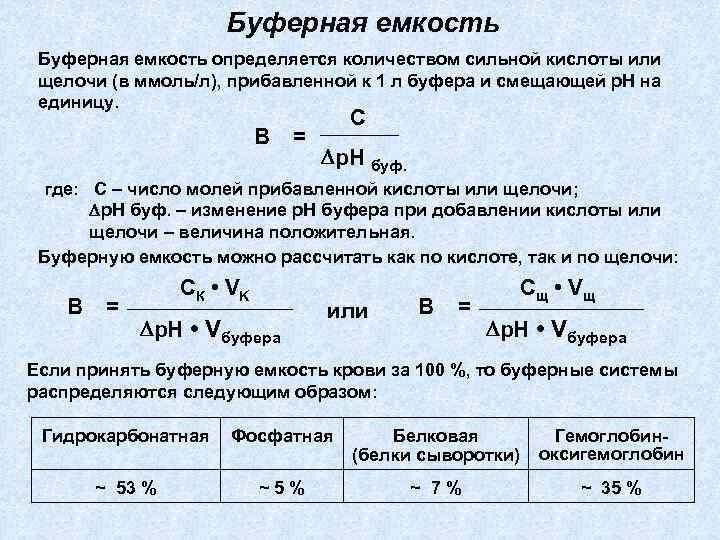
Буферная емкость определяется количеством сильной кислоты или щелочи (в ммоль/л), прибавленной к 1 л буфера и смещающей р. Н на единицу. В = С р. Н буф. где: С – число молей прибавленной кислоты или щелочи; р. Н буф. – изменение р. Н буфера при добавлении кислоты или щелочи – величина положительная. Буферную емкость можно рассчитать как по кислоте, так и по щелочи: В = СК • V K р. Н • Vбуфера или В = Сщ • V щ р. Н • Vбуфера Если принять буферную емкость крови за 100 %, то буферные системы распределяются следующим образом: Гидрокарбонатная Фосфатная Белковая (белки сыворотки) Гемоглобиноксигемоглобин ~ 53 % ~5% ~ 7% ~ 35 %
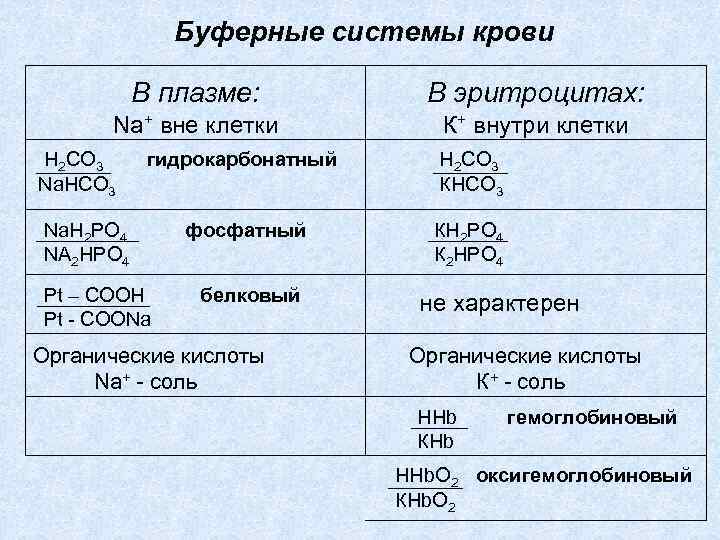
Буферные системы крови В плазме: В эритроцитах: Na+ вне клетки К+ внутри клетки H 2 CO 3 Na. HCO 3 гидрокарбонатный Н 2 СО 3 КНСО 3 фосфатный КН 2 РО 4 К 2 НРО 4 Na. H 2 PO 4 NA 2 HPO 4 Pt – COOH Pt - COONa белковый Органические кислоты Na+ - соль не характерен Органические кислоты К+ - соль ННb КНb гемоглобиновый ННb. О 2 оксигемоглобиновый КНb. О 2

Механизм действия гидрокарбонатной буферной системы Действие гидрокарбонатного буфера при попадании в него сильной кислоты или щелочи можно записать реакциями: HCl + Na. HCO 3 Na. OH + H 2 CO 3 Na. Cl + H 2 CO 3 H 2 O CO 2 Na. HCO 3 + H 2 O При добавлении к системе сильной кислоты ионы Н+ взаимодействуют с анионами соли, образуя слабодиссоциирующую Н 2 СО 3. Сильная кислота заменяется эквивалентным количеством слабой кислоты, диссоциация которой подавлена. При добавлении щелочи гидроксил-ионы (ОН-) взаимодействуют с ионами Н+ карбонатной кислоты. Щелочь заменяется эквивалентным количеством соли, почти не изменяющей величину р. Н раствора.
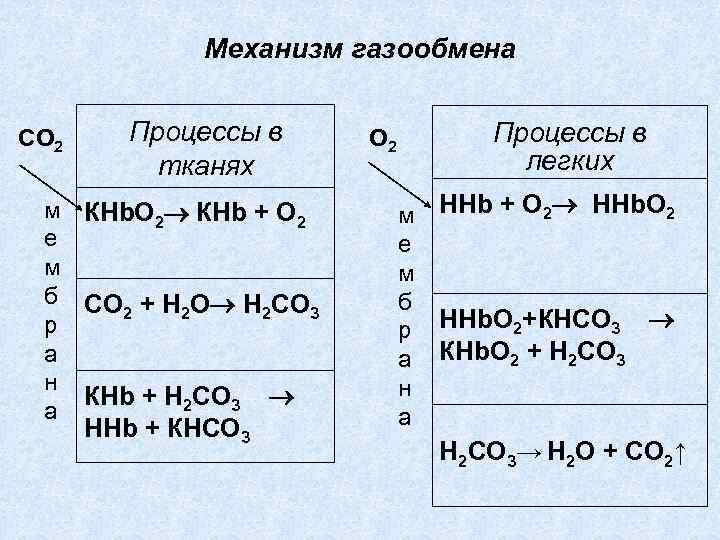
Механизм газообмена СО 2 Процессы в тканях м КНb. О 2 КНb + О 2 е м б СО + Н О Н СО 2 2 2 3 р а н КНb + Н 2 СО 3 а ННb + КНСО 3 Процессы в легких О 2 м е м б р а н а ННb + О 2 ННb. О 2 НHb. О 2+КНСО 3 КНb. О 2 + Н 2 СО 3→ Н 2 О + СО 2↑

Кислотно-основное состояние (КОС) крови КОС (или КЩР) крови в норме характеризуется следующими метаболическими показателями: р. Н плазмы 7, 4± 0, 05; [бикарбонатов]=(24, 4± 3) моль/л ― щелочной резерв крови; р. СО 2=40 мм рт. ст. - парциальное давление СО 2 над кровью. Смещение КОС крови в сторону повышения концентрации ионов водорода (снижение р. Н до 7, 0) и уменьшения резервной щелочности ― ацидоз. Наблюдается при диабете, нарушении почечной деятельности, кислородном голодании тканей, заболеваниях органов дыхания (гиповентилляция легких), диарее, отравлении алкоголем. Смещение КОС крови в сторону понижения концентрации ионов водорода (повышение р. Н до 7, 8) и увеличения резервной щелочности крови ―алкалоз. (Неукротимая рвота, длительные приемы щелочных вод, запоры, гипервентиляция легких, тепловая одышка, в горах. ) Для коррекции КОС при ацидозе в качестве экстренной меры используют внутривенное вливание 4%- ного гидрокарбоната натрия, 3, 66%ного раствора трисамина или 11%-ного раствора лактата натрия. Коррекция КОС при алкалозе сложная и требует учета многих обстоятельств. В качестве одной из временных мер используют 5%- ный раствор аскорбиновой кислоты, нейтрализованный гидрокарбонатом натрия до р. Н=6, 0 -7, 0.
буферные системы 2.ppt