Лекция 2.Растворы+Комплексы.pptx
- Количество слайдов: 27

Буферные растворы Растворы, обладающие способностью поддерживать определенное значение р. Н при разбавлении и при введении в раствор небольших количеств сильных кислот или оснований, называют буферными Слабая кислота + её соль: СН 3 СООН + СН 3 СООNa Буферные растворы Слабое основание + его соль: NH 3 + NH 4 Cl Две соли одной кислоты: KH 2 PO 4 + K 2 HPO 4 Ацетатный буферный раствор СН 3 СООН + СН 3 СООNa → СН 3 СОО– + Na+ СН 3 СООН СН 3 СОО– + H+ γ ≈ 1 При добавлении сильной кислоты Н+ + СН 3 СООН При добавлении сильного основания ОН– + СН 3 СООН = СН 3 СОО– + Н 2 О

Равновесие в системе раствор – осадок В насыщенном растворе сильного электролита тв. фаза раствор В насыщенном растворе электролита произведение активностей ионов, взятых в степенях, равных их стехиометрическим коэффициентам, при данной Т есть величина постоянная Для малорастворимого электролита γ = 1 Величины ПР – табулированы при 25 0 С Условия выпадения осадка Ag. Cl(т) Ag+ + Cl– C(Ag+) ∙ C(Cl–) > ПР Условия растворения осадка +) ∙ C(Cl–) < ПР ΔG < 0 C(Ag ПР = f(Т)

Равновесие в системе раствор – осадок В насыщенном растворе сильного электролита тв. фаза раствор В насыщенном растворе электролита произведение активностей ионов, взятых в степенях, равных их стехиометрическим коэффициентам, при данной Т есть величина постоянная Для малорастворимого электролита γ = 1 Величины ПР – табулированы при 25 0 С Условия выпадения осадка Ag. Cl(т) Ag+ + Cl– C(Ag+) ∙ C(Cl–) > ПР Условия растворения осадка +) ∙ C(Cl–) < ПР ΔG < 0 C(Ag ПР = f(Т)

Гидролиз Взаимодействие веществ с водой в результате которого образуются малодиссоциирующие, труднорастворимые или газообразные частицы и, как правило, меняется р. Н раствора Гидролиз – частный случай сольволиза Гидролиз солей – с водой взаимодействуют ионы – соли сильных кислот и сильных оснований – соли слабых кислот и сильных оснований – соли сильных кислот и слабых оснований – соли слабых кислот и слабых оснований 1. Соли, образованные сильными основаниями и сильной кислотой Na. Cl → Na+ + Cl– гидролизу не подвергается. р. Н = 7 Н 2 О Н+ + ОН– Анионы сильных кислот: Cl–, Br–, I–, NO 3–, Cl. O 4– и др. Катионы сильных оснований: K+, Na+, Ca 2+ и др.

Гидролиз Взаимодействие веществ с водой в результате которого образуются малодиссоциирующие, труднорастворимые или газообразные частицы и, как правило, меняется р. Н раствора Гидролиз – частный случай сольволиза Гидролиз солей – с водой взаимодействуют ионы – соли сильных кислот и сильных оснований – соли слабых кислот и сильных оснований – соли сильных кислот и слабых оснований – соли слабых кислот и слабых оснований 1. Соли, образованные сильными основаниями и сильной кислотой Na. Cl → Na+ + Cl– гидролизу не подвергается. р. Н = 7 Н 2 О Н+ + ОН– Анионы сильных кислот: Cl–, Br–, I–, NO 3–, Cl. O 4– и др. Катионы сильных оснований: K+, Na+, Ca 2+ и др.

2. Соль образована сильным основанием и слабой кислотой Na. CN → Na+ + CN– гидролиз аниона. CN– + H 2 O HCN + OH– р. Н > 7 Если γ ≈ 1, a ≈ C (константа гидролиза) αг – степень гидролиза – доля частиц, подвергшихся гидролизу при αг << 1 КГ ≈ С как правило: αг, Кг если Т αг, Кг = const если С(Na. CN)
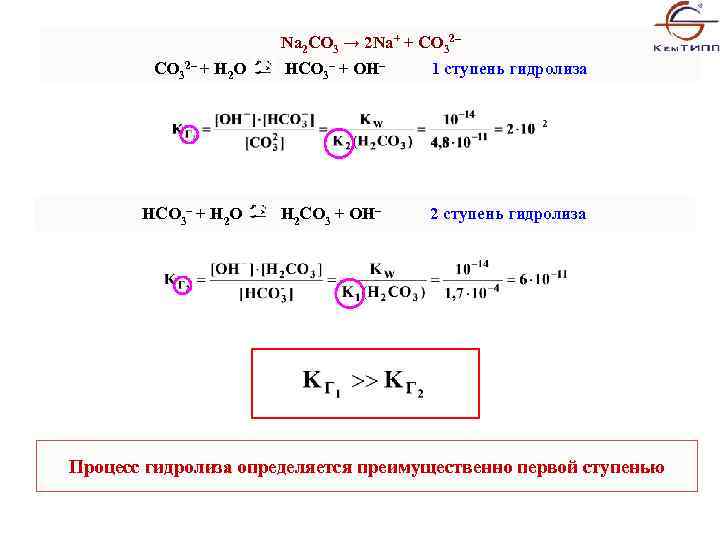
Na 2 CO 3 → 2 Na+ + CO 32– + H 2 O HCO 3– + OH– 1 ступень гидролиза HCO 3– + H 2 O Н 2 CO 3 + OH– 2 ступень гидролиза Процесс гидролиза определяется преимущественно первой ступенью

3. Соль образована слабым основанием и сильной кислотой Al. Cl 3 → Al 3+ + 3 Cl– гидролиз катиона р. Н < 7 Al 3+ + H 2 O Al(OH)2+ + H+ ( ), Al(OH)2+ + H 2 O Al(OH)2+ + H+( ) Al(OH)2+ + H 2 O Al(OH)3 + H+ ( ) Гидролиз с точки зрения теории поляризации Al 3+ + 6 H 2 O → [Al(H 2 O)6]3+ [Al. OH–(H 2 O)5]2– + H+ (1 ступень) КД(Н 2 О) ≈ 10– 17, КД(Н 2 О гидр) ≈ 10– 5 Чем больше заряд катиона и меньше его размер, тем значительнее поляризующее действие катиона [Al(H 2 O)5 OH–]2– [Al(OH–)2(H 2 O)4]+ + H+ (2 ступень) [Al(OH–)2(H 2 O)4]+ Al(OH)3 + H+ (3 ступень)

4. Соль образована слабым основанием и слабой кислотой NH 4 CN → NH 4+ + CN– Гидролиз катиона и аниона р. Н = ? NH 4+ + H 2 O NH 3 ∙ H 2 O + H+ KГ(NH 4+) = 5, 6 ∙ 10– 10 CN– + H 2 O HCN + OH– KГ(CN–) = 1, 6 ∙ 10– 3 NH 4+ + CN– + H 2 O = NH 3 ∙ H 2 O + HCN KГ(CN–) > KГ(NH 4+) p. H > 7

4. Соль образована слабым основанием и слабой кислотой NH 4 CN → NH 4+ + CN– Гидролиз катиона и аниона р. Н = ? NH 4+ + H 2 O NH 3 ∙ H 2 O + H+ KГ(NH 4+) = 5, 6 ∙ 10– 10 CN– + H 2 O HCN + OH– KГ(CN–) = 1, 6 ∙ 10– 3 NH 4+ + CN– + H 2 O = NH 3 ∙ H 2 O + HCN KГ(CN–) > KГ(NH 4+) p. H > 7 CH 3 COONH 4 → CH 3 COO– + NH 4+ + H 2 O = CH 3 COOH + NH 3 ∙ H 2 O KГ(CH 3 COO–) = 5, 6 ∙ 10– 10 KГ(NH 4+) = 5, 6 ∙ 10– 10 KГ(CH 3 COO–) = KГ(NH 4+) p. H = 7

Необратимый гидролиз • Соли, образованные амфотерными гидроксидами и слабыми многоосновными кислотами (сульфиды и карбонаты алюминия, хрома (III) и железа (III)) Al 2 S 3(т) + H 2 O → Al(OH)3↓ + H 2 S↑ • Смешивание растворов двух солей, гидролизирующихся по-разному 3 Na 2 CO 3 + 2 Fe. Cl 3 + 3 H 2 O → 2 Fe(OH)3↓ + 3 CO 2↑ + 6 Na. Cl 3 CO 32– + 2 Fe 3+ + 3 H 2 O → 2 Fe(OH)3↓+ 3 CO 2↑ Выводы 1. Равновесие при гидролизе обычно (но не всегда) смещено в сторону исходных веществ 2. Чем слабее кислота или основание, образующие соль, тем больше значение КГ и тем сильнее р. Н раствора отличается от 7 3. Гидролиз определяется преимущественно первой ступенью 4. р. Н раствора солей образованных слабым основанием и слабой кислотой, определяется соотношением КД(основания) и КД(кислоты) 5. Гидролиз усиливается при разбавлении и нагревании

Необратимый гидролиз • Соли, образованные амфотерными гидроксидами и слабыми многоосновными кислотами (сульфиды и карбонаты алюминия, хрома (III) и железа (III)) Al 2 S 3(т) + H 2 O → Al(OH)3↓ + H 2 S↑ • Смешивание растворов двух солей, гидролизирующихся по-разному 3 Na 2 CO 3 + 2 Fe. Cl 3 + 3 H 2 O → 2 Fe(OH)3↓ + 3 CO 2↑ + 6 Na. Cl 3 CO 32– + 2 Fe 3+ + 3 H 2 O → 2 Fe(OH)3↓+ 3 CO 2↑ Выводы 1. Равновесие при гидролизе обычно (но не всегда) смещено в сторону исходных веществ 2. Чем слабее кислота или основание, образующие соль, тем больше значение КГ и тем сильнее р. Н раствора отличается от 7 3. Гидролиз определяется преимущественно первой ступенью 4. р. Н раствора солей образованных слабым основанием и слабой кислотой, определяется соотношением КД(основания) и КД(кислоты) 5. Гидролиз усиливается при разбавлении и нагревании

Теории кислот и оснований Ионная теория Первая теория, предложенная С. Аррениусом в 1887 г. Кислота – водородосодержащее соединение, которое в растворе подвергается диссоциации с образованием гидратированных катионов водорода HNO 3 = H+ + NO 3– Основание – соединение, содержащее гидроксогруппу и диссоциирующее в растворе с образованием гидроксид – анионов Na. OH = Na+ + OH– Амфотерные H+ + [Hn-1 ROn]– [R(OH)n-1]+ + OH– Недостатки Применима только к описанию водных растворов Не объясняла кислотно-основные свойства веществ не содержащих Н и ОН
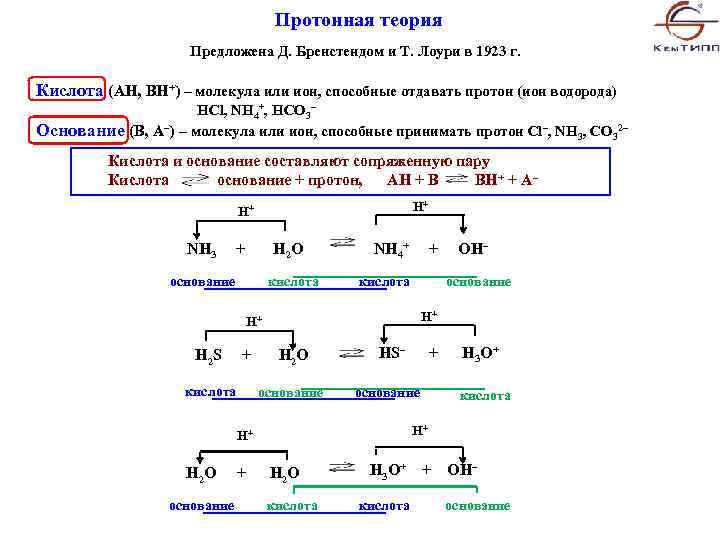
Протонная теория Предложена Д. Бренстендом и Т. Лоури в 1923 г. Кислота (AH, BH+) – молекула или ион, способные отдавать протон (ион водорода) HCl, NH 4+, HCO 3– Основание (В, А–) – молекула или ион, способные принимать протон Cl–, NH 3, CO 32– Кислота и основание составляют сопряженную пару Кислота основание + протон, АН + В ВН+ + А– Н+ Н+ NH 3 + H 2 O основание кислота NH 4+ + OH– кислота основание Н+ Н+ H 2 S + H 2 O кислота основание HS– + H 3 O+ основание кислота Н+ Н+ H 2 O H 3 O+ + OH– основание кислота основание
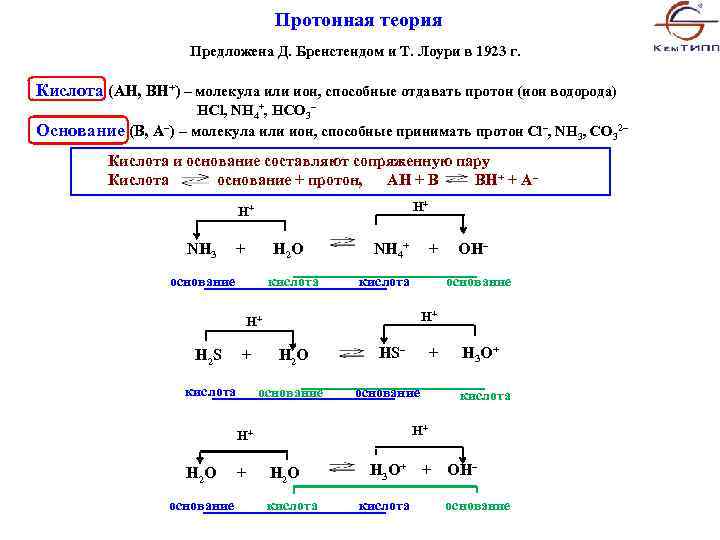
Протонная теория Предложена Д. Бренстендом и Т. Лоури в 1923 г. Кислота (AH, BH+) – молекула или ион, способные отдавать протон (ион водорода) HCl, NH 4+, HCO 3– Основание (В, А–) – молекула или ион, способные принимать протон Cl–, NH 3, CO 32– Кислота и основание составляют сопряженную пару Кислота основание + протон, АН + В ВН+ + А– Н+ Н+ NH 3 + H 2 O основание кислота NH 4+ + OH– кислота основание Н+ Н+ H 2 S + H 2 O кислота основание HS– + H 3 O+ основание кислота Н+ Н+ H 2 O H 3 O+ + OH– основание кислота основание
![Комплексные соединения Cu. SO 4 + 4 KCl K 2[Cu. Cl 4] + K Комплексные соединения Cu. SO 4 + 4 KCl K 2[Cu. Cl 4] + K](https://present5.com/presentation/-76660488_365635256/image-16.jpg)
Комплексные соединения Cu. SO 4 + 4 KCl K 2[Cu. Cl 4] + K 2 SO 4 голубой зеленый Комплексные соединения – сложные вещества в которых валентность (число химических связей) центрального атома больше абсолютного значения его степени окисления В K 2[Cu. Cl 4] валентность Cu равна 4, а степень окисления – +2 Структура комплексных соединений Комплексообразователь. Типичные комплексообразователи - ионы и атомы переходных металлов (Cu 2+, Ag+, Au 3+, Cr 3+ и др. ) Координационное число комплексообразователя (КЧ) – число его химических связей с лигандами Лиганды – расположены вокруг комплексообразователя. Это атомы, молекулы или ионы. Координационная емкость лиганда (дентатность) – число химических связей лиганда с комплексообразователем Внутренняя координационная сфера. В нее входят комплексообразователь и лиганды. Внешняя сфера. Имеется если внутренняя сфера заряжена. Внутреннюю сферу отделяют от внешней квадратными скобками.
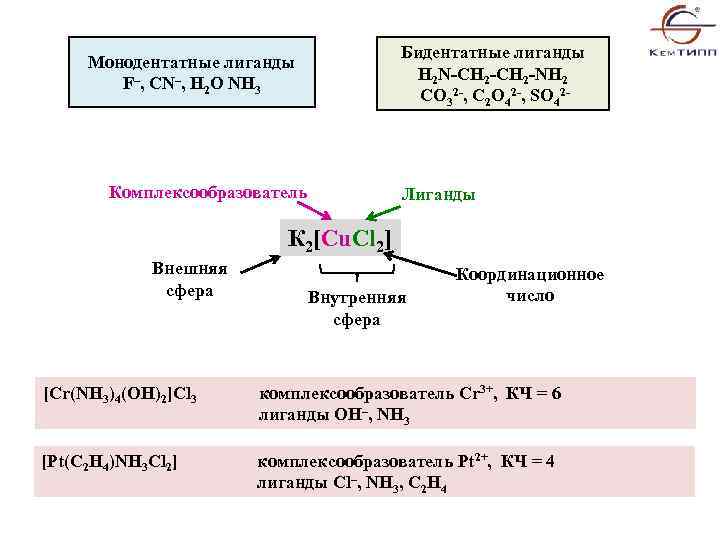
Бидентатные лиганды H 2 N-CH 2 -NH 2 222 СО 3 , С 2 O 4 , SO 4 Монодентатные лиганды F–, CN–, H 2 O NH 3 Комплексообразователь Лиганды К 2[Cu. Cl 2] Внешняя сфера Внутренняя cфера Координационное число [Cr(NH 3)4(OH)2]Cl 3 комплексообразователь Cr 3+, КЧ = 6 лиганды OH–, NH 3 [Pt(C 2 H 4)NH 3 Cl 2] комплексообразователь Pt 2+, КЧ = 4 лиганды Cl–, NH 3, C 2 H 4

Номенклатура комплексных соединений Первым в именительном падеже называют анионы, а затем в родительном падеже – катионы В названии внутренней координационной сферы в русской химической литературе принято перечислять сначала лиганды – анионные, нейтральные и катионные, затем комплексообразователь с указанием его степени окисления. Число лигандов обозначают греческими числительными: ди-, тетра-, гекса-, пента и т. д. – Отрицательные лиганды называют добавляя к их латинскому названию окончания – о. F– – фторо, СN– – циано и т. д. – Нейтральные лиганды называют, как и соответствующие молекулы. (исключение Н 2 О – аква, NH 3 – аммин, СО – карбонил, NO – нитрозил). – Положительные лиганды называют добавляя к их названию окончание – ий (N 2 H 5+ – гидрозиний). – Комплексообразователь. Если входит в состав комплексного катиона – русское название в родительном падеже и в скобках римскими цифрами степень его окисления. Если входит в состав комплексного аниона – латинское название с окончанием – ат. Если координационная сфера имеет нулевой заряд, комплексообразователь называют по-русски в именительном падеже.
![Примеры Формулы комплексных соединений читают справа налево Катионные комплексы [Cu(NH 3)4]Cl 2 – хлорид Примеры Формулы комплексных соединений читают справа налево Катионные комплексы [Cu(NH 3)4]Cl 2 – хлорид](https://present5.com/presentation/-76660488_365635256/image-19.jpg)
Примеры Формулы комплексных соединений читают справа налево Катионные комплексы [Cu(NH 3)4]Cl 2 – хлорид тетраамминмеди(II) [Pt(H 2 О)(NH 3)2 OH]NO 3 – нитрат гидроксодиамминакваплатины (II) Анионные комплексы NH 4[Cr(NH 3)2(CN)4] – тетрацианодиамминхромат(III) аммония K 3[Fe(SCN)6] - гексатиоцианато феррат(III) калия Нейтральные комплексы [Pt(NH 3)Br 2] – дибромодиамминплатина [Pt. H 2 O(C 6 H 5 N)2(OH)3] – тригидроксодипиридинакваплатина [Pd(NH 3)4][Pd. Cl 6]
![Аквакомплексы [Cr(H 2 O)6]Cl 3 [Co(H 2 O)6]Cl 3 Кристаллогидраты Cu. SO 4 ∙ Аквакомплексы [Cr(H 2 O)6]Cl 3 [Co(H 2 O)6]Cl 3 Кристаллогидраты Cu. SO 4 ∙](https://present5.com/presentation/-76660488_365635256/image-20.jpg)
Аквакомплексы [Cr(H 2 O)6]Cl 3 [Co(H 2 O)6]Cl 3 Кристаллогидраты Cu. SO 4 ∙ 5 H 2 O, Na 2 CO 3 ∙ 10 H 2 O Амминокомплексы [Ag(NH 3)2]Cl [Cu(NH 3)2]NO 3 [Co(CO)6] [Fe(CO)5] Карбонилы [Ti(CO)7] [(CO)5 – Mn – (CO)5] – многоядерное соединение в котором хим. связи между атомами переходных металлов ( КЛАСТЕРЫ ) Гидроксокомплексы Na 3[Co(OH)6] K 2[Zn(OH)4] Ацидокомплексы K 2[Pt. Cl 6] K 3[Fe(CN)6] Комплексы смешанного типа [Co(NH 3)4 Cl 2]Cl [Pt(H 2 O)(NH 3)4]Cl 4
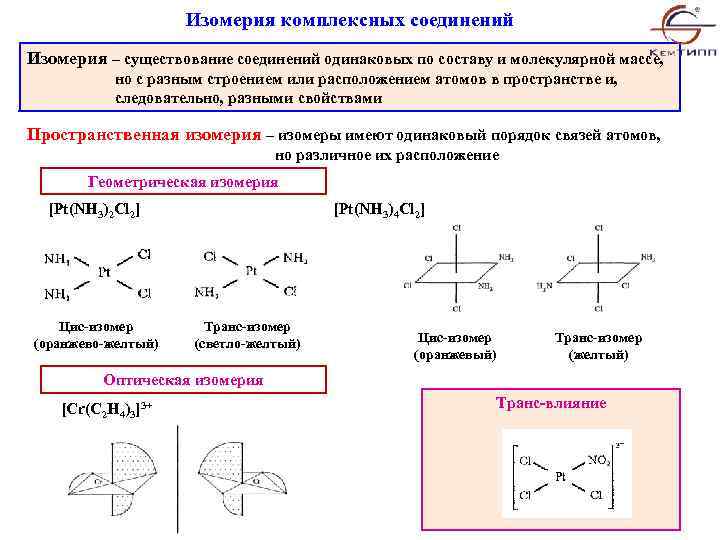
Изомерия комплексных соединений Изомерия – существование соединений одинаковых по составу и молекулярной массе, но с разным строением или расположением атомов в пространстве и, следовательно, разными свойствами Пространственная изомерия – изомеры имеют одинаковый порядок связей атомов, но различное их расположение Геометрическая изомерия [Pt(NH 3)2 Cl 2] Цис-изомер (оранжево-желтый) [Pt(NH 3)4 Cl 2] Транс-изомер (светло-желтый) Цис-изомер (оранжевый) Транс-изомер (желтый) Оптическая изомерия [Cr(C 2 H 4)3]3+ Транс-влияние
![Равновесие в растворах комплексных соединений [Ag(NH 3)2]Cl Первичная диссоциация [Ag(NH 3)2]Cl → [Ag(NH 3)2]+ Равновесие в растворах комплексных соединений [Ag(NH 3)2]Cl Первичная диссоциация [Ag(NH 3)2]Cl → [Ag(NH 3)2]+](https://present5.com/presentation/-76660488_365635256/image-22.jpg)
Равновесие в растворах комплексных соединений [Ag(NH 3)2]Cl Первичная диссоциация [Ag(NH 3)2]Cl → [Ag(NH 3)2]+ + Cl– Вторичная диссоциация [Ag(NH 3)2]+ + Н 2 О [Ag. H 2 ONH 3]+ + NH 3 [Ag. H 2 ONH 3]+ + Н 2 О [Ag(H 2 O)2]+ + NH 3 В упрощенном виде [Ag(NH 3)2]+ [Ag. NH 3]+ + NH 3 [Ag. NH 3]+ Ag+ + NH 3 Общая константа нестойкости
![Показатель константы нестойкости Константа устойчивости [Ag(H 2 O)2]+ + 2 NH 3 [Ag(NH 3)2]+ Показатель константы нестойкости Константа устойчивости [Ag(H 2 O)2]+ + 2 NH 3 [Ag(NH 3)2]+](https://present5.com/presentation/-76660488_365635256/image-23.jpg)
Показатель константы нестойкости Константа устойчивости [Ag(H 2 O)2]+ + 2 NH 3 [Ag(NH 3)2]+ + 2 H 2 O Ag+ + 2 NH 3 [Ag(NH 3)2]+ ΔG < 0 ΔG 0 = –RTln. К уст –RTln. Kуст = ΔH 0 – TΔS 0
![Показатель константы нестойкости Константа устойчивости [Ag(H 2 O)2]+ + 2 NH 3 [Ag(NH 3)2]+ Показатель константы нестойкости Константа устойчивости [Ag(H 2 O)2]+ + 2 NH 3 [Ag(NH 3)2]+](https://present5.com/presentation/-76660488_365635256/image-24.jpg)
Показатель константы нестойкости Константа устойчивости [Ag(H 2 O)2]+ + 2 NH 3 [Ag(NH 3)2]+ + 2 H 2 O Ag+ + 2 NH 3 [Ag(NH 3)2]+ ΔG < 0 ΔG 0 = –RTln. К уст –RTln. Kуст = ΔH 0 – TΔS 0
![Разрушение комплексных соединений [Ag(NH 3)2]Cl, K 2 S 2[Ag(NH 3)2]+ + S 2– → Разрушение комплексных соединений [Ag(NH 3)2]Cl, K 2 S 2[Ag(NH 3)2]+ + S 2– →](https://present5.com/presentation/-76660488_365635256/image-25.jpg)
Разрушение комплексных соединений [Ag(NH 3)2]Cl, K 2 S 2[Ag(NH 3)2]+ + S 2– → Ag 2 S↓ + 4 NH 3 Kнест = 5, 7 ∙ 10– 8 Пр = 6. 3 ∙ 10– 50 [Ag(NH 3)2]Cl, KCN [Ag(NH 3)2]+ + 2 CN- [Ag(CN)2]– + 2 NH 3 Kнест = 1, 4 ∙ 10– 20
![Кислотно-основные равновесия Растворы амминокомплексов [Pt(NH 3)6]4+ + 4 H 2 O [Pt(NH 3)5 NH Кислотно-основные равновесия Растворы амминокомплексов [Pt(NH 3)6]4+ + 4 H 2 O [Pt(NH 3)5 NH](https://present5.com/presentation/-76660488_365635256/image-26.jpg)
Кислотно-основные равновесия Растворы амминокомплексов [Pt(NH 3)6]4+ + 4 H 2 O [Pt(NH 3)5 NH 2]3+ + H+ · 4 H 2 O кислота основание кислота Растворы гидроксокомплексов [Co(OH)6]3 - +4 H 2 O [Co. H 2 O(OH)5]2 - + OH- · 3 H 2 O Растворы аквакомплексов [Al(H 2 O)6]3+ + 4 H 2 O [Al(H 2 O)5 OH]2+ + H+ · 4 H 2 O Кислотно-основные свойства комплексов определяются Комплексообразователем (размером, зарядом, поляризационными свойствами) Лигандами (степенью диссоциации) Комплексным ионом (устойчивостью и величиной заряда) Взаимным влиянием координированных лигандов
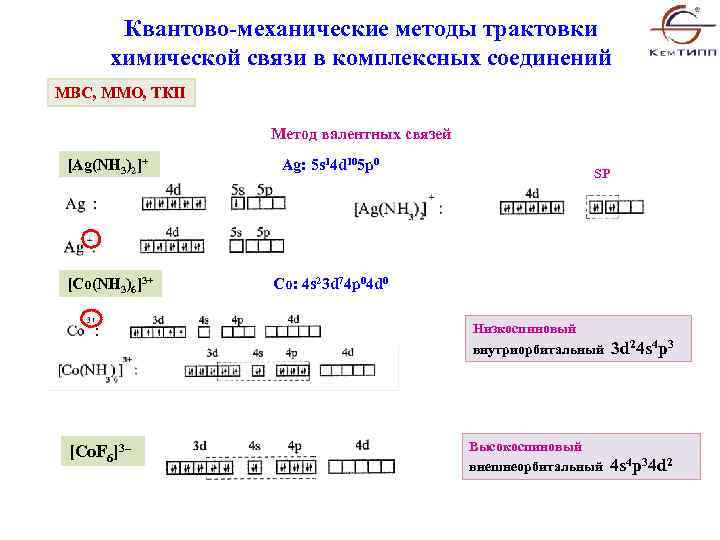
Квантово-механические методы трактовки химической связи в комплексных соединений МВС, ММО, ТКП Метод валентных связей [Ag(NH 3)2]+ Ag: 5 s 14 d 105 p 0 [Co(NH 3)6]3+ Co: 4 s 23 d 74 p 04 d 0 SP Низкоспиновый внутриорбитальный 3 d 24 s 4 p 3 [Co. F 6]3– Высокоспиновый внешнеорбитальный 4 s 4 p 34 d 2
Лекция 2.Растворы+Комплексы.pptx