ОБЩАЯ 5 БС.pptx
- Количество слайдов: 15

Буферные растворы Лекция 6
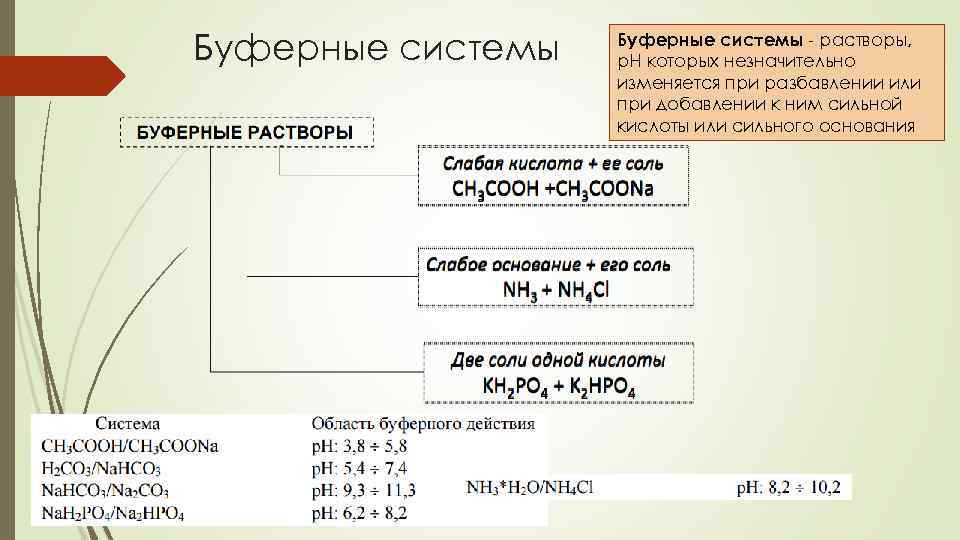
Буферные системы - растворы, р. Н которых незначительно изменяется при разбавлении или при добавлении к ним сильной кислоты или сильного основания

р. Н буферных систем А в общем виде для систем первого типа HA/A- величина p. H определяется по уравнениям 1 или 1 а: Для буферных систем второго типа B/BH+ гидроксильный и водородный показатели рассчитываются по уравнениям 2, 2 а, 3, 3 а. Уравнения 1 -3 объединены именем авторов – уравнением Гендерсона – Гассельбаха. (Henderson, Lawrence Joseph, 1848 -1942, биохимик, США. Hasselbalch, Karl Albert, 18741962, биохимик, Дания).

Механизм действия буферных систем I типа донором протона является кислота, акцептором – ацетат-ион.

Механизм действия буферных систем II типа

Буферная емкость буферная ёмкость - способность буферных растворов противостоять изменению р. Н при добавлении сильных кислот или щелочей По предложению Ван – Слейка (Van Slyke D. 1883— 1971) буферная ёмкость измеряется количеством эквивалентов кислоты или щёлочи (моль, ммоль), которое нужно добавить к 1 литру буферного раствора, чтобы изменить р. Н на единицу: n(1/z. HA) – число молей химического эквивалента сильной кислоты (основания) , добавленное к 1 литру буферной системы; р. Н 1 – водородный показатель системы до добавления сильной кислоты р. Н 2 – водородный показатель системы после добавления сильной кислоты. С(1/z. НА) – молярная концентрация химического эквивалента сильной кислоты основания в добавляемом растворе; V(НА) – объем (л) добавленного раствора сильной кислоты; V(буферной системы) – объем буферного раствора, к которому добавляют раствор кислоты / основания

Факторы, влияющие на буферную емкость Концентрация кислотно-основной пары – чем выше концентрация кислотноосновной пары, тем выше буферная ёмкость. Соотношением концентраций компонентов. наибольшей буферной ёмкостью обладают растворы с соотношением концентраций или количеств компонентов 1 : 1. При отклонении от этого соотношения буферная ёмкость заметно снижается и практически падает до 0, если соотношение С(соль)/С(кисл) или С(соль)/С(осн) станет меньше 0. 1 или больше 10. интервал значений р. Н, в котором буферная система активно проявляет свои свойства, составляет приблизительно 2 единицы р. Н, т. е. p. H = р. Ка ± 1 – зона буферного действия На практике готовят: р. Н = р. Ка 1 р. Н = 14 – р. Кb 1 Скисл : Ссоли или Сосн : Ссоли от 10: 1 до 1: 10 график зависимости буферной ёмкости от р. Н для системы CH 3 COOH/CH 3 COO-.
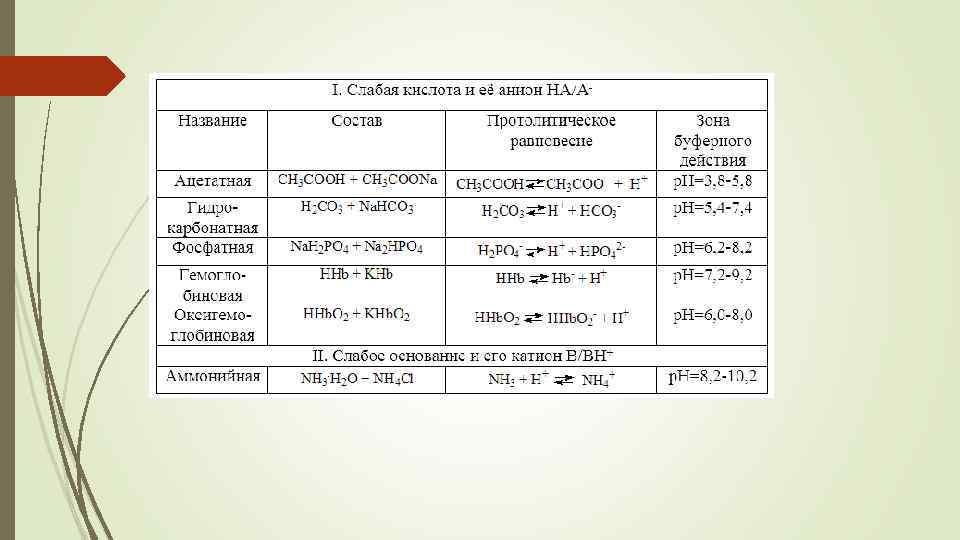

Буферные системы организма

Гидрокарбонатная буферная система Основной внеклеточный буфер Состоит из угольной кислоты (Н 2 СО 3) и гидрокарбоната натрия (Na. HCO 3) или калия (KHCO 3) Образуется почками и является самой мощной буферной системой крови: ей принадлежит 53 % общего буферного действия крови При нормальном значении р. Н крови. Равном 7, 4, соотношение компонентов системы Н 2 СО 3/Na. HCO 3 составляет 1 : 20 Особенность этой системы состоит в том, что один из компонентов системы – H 2 CO 3 образуется при взаимодействии CO 2 с H 2 O. В свою очередь концентрация СО 2 определяется равновесием которое описывается законом Генри O Т. о. в крови устанавливается равновесие

Гидрокарбонатная буферная система значение р. Н гидрокарбонатного буфера в конечном счёте определяется концентрацией НСО 3 - и парциальным давлением СО 2: Между СО 2 в альвеолах и гидрокарбонатным буфером в плазме крови устанавливается равновесие: При поступлении в кровь доноров протонов равновесие 3 смещается в сторону Н 2 СО 3. При этом концентрация Н 2 СО 3 возрастает, а концентрация НСО 3 - снижается. Это приводит к смещению равновесия 2 влево, в результате чего равновесие 1 смещается в сторону образования газообразного СО 2 , что приводит к повышению давления СО 2 в лёгких и выведению его за счёт увеличения лёгочной вентиляции. При поступлении акцепторов протонов равновесие смещается в обратном направлении, что приводит к растворению в плазме крови дополнительного количества СО 2, содержащегося в лёгких.

Фосфатная буферная система Имеет значение для внутриклеточного пространства Представляет собой смесь однозамещенного фосфата (Na. Н 2 PО 4) –слабой кислоты и соли этой кислоты двузамещенного фосфата (Na 2 HPO 4), обладающего основными свойствами Составляет основу буферной системы тканей и некоторых биологических жидкостей (моча, пищеварительные соки и т. д. )

Буферная система белков крови Белки крови обладают свойствами слабых кислот и поэтому в смеси с солью сильного основания могут образовывать БС. В общем виде ее можно представить так: В белковые БС крови входят белки плазмы, гемоглобин (Hb) и оксигемоглобин (Hb. O 2) эритроцитов Белки в изоэлектрическом состоянии практически не проявляют буферных свойств. Но если к белкам добавить некоторое количество кислоты или щёлочи, они начинают проявлять буферное действие. Часть белка переходит в форму «белок – кислота» или в форму «белок – основание» .
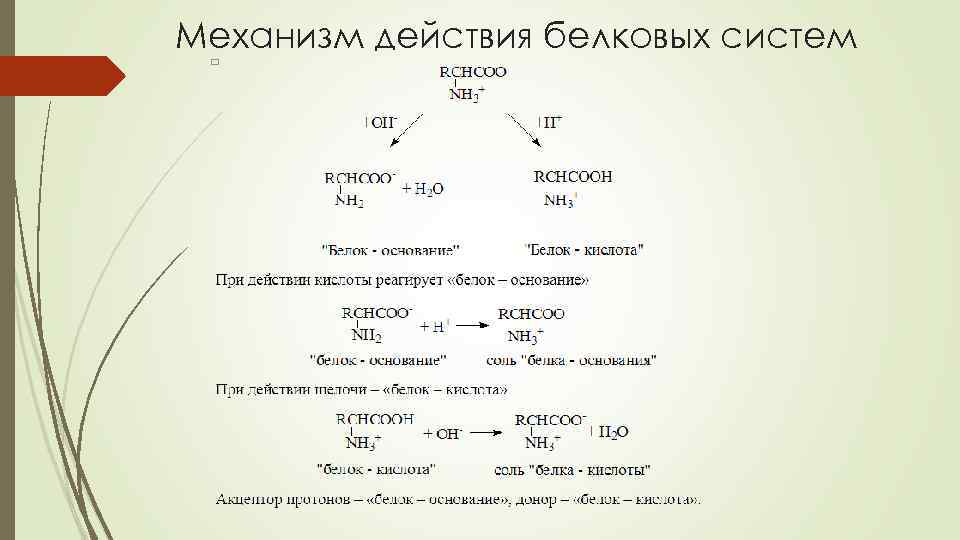
Механизм действия белковых систем

БС гемоглобин-оксигемоглобин На её долю приходится около 75 % буферной ёмкости крови Характеризуется равновесием между ионами гемоглобина (Hb-) и самим гемоглобином (H 2 b) – очень слабой кислотой (KH 2 b = 6, 3 10 -9; p. KH 2 b = 8, 2), а также между ионами оксигемоглобина Hb. O 2 - и самим оксигемоглобином H 2 b. O 2, который является несколько более сильной, чем гемоглобин, кислотой (KH 2 b. О 2 = 1, 12 10 -7; p. KH 2 b. О 2 = 6, 95): гемоглобин H 2 b, присоединяя кислород, образует оксигемоглобин H 2 b. O 2 и, таким образом, первые два равновесия взаимосвязаны со следующими двумя
ОБЩАЯ 5 БС.pptx