Лекция 6 Буферные растворы.ppt
- Количество слайдов: 44

Буферные растворы Лекция 6 1
![План лекции 1. Буферные системы. Механизм действия буферных растворов. 2. Вычисление [H+] и р. План лекции 1. Буферные системы. Механизм действия буферных растворов. 2. Вычисление [H+] и р.](https://present5.com/presentation/82137600_179745819/image-2.jpg)
План лекции 1. Буферные системы. Механизм действия буферных растворов. 2. Вычисление [H+] и р. Н в буферных системах 3. Характеристики буферных растворов (буферная сила, буферная емкость) 4. Применение буферных растворов в аналитической химии 2

Буферные системы • Для успешного проведения реакции необходимо не только создать нужное значение р. Н среды, но и поддерживать его постоянным в течение реакции. • Для этого применяются буферные растворы – смеси, состоящие из слабой кислоты и ее соли или слабого основания и его соли. • Буферные системы – это растворы, способные сохранять приблизительно постоянное значение р. Н при добавлении к ним небольших количеств сильных кислот или оснований. • Буферные системы содержат в соизмеряемых количествах два компонента сопряженной пары кислота-основание. 3

Таблица 1. Примеры буферных систем Вид буферной смеси Название буферной системы Состав буфера Буферные Растворы индивидуальных веществ Гидротартратный буфер KHC 4 H 4 O 6 р. Н при 25 ºС р. Н = 3, 57 Буферные системы из смесей веществ Слабая кислота и ее соль Ацетатный буфер Слабое основание и его соль Аммиачный буфер Смесь солей многоосновных кислот Фосфатный буфер СН 3 СООН СН 3 СООNa NH 4 OH NH 4 Cl KH 2 PO 4 Na 2 HPO 4 р. Н = 4, 7 р. Н = 9, 25 р. Н = 6, 6 4

Буферные растворы индивидуальное вещество смесь веществ К буферным растворам индивидуальных веществ относятся: • насыщенный водный раствор гидротартрата калия KHC 4 H 4 O 6 (р. Н = 3, 57 при 25 ºС), • водный раствор 0, 05 моль/л гидрофталата калия KHC 8 H 4 O 4 (р. Н = 4, 008 при 25 ºС), • водный раствор 0, 05 моль/л тетрабората натрия (буры) Na 2 B 4 O 7 ∙ 10 H 2 O (р. Н = 9, 18 при 25 ºС, р. Н = 9, 07 при 38 ºС) и др. 5

Буферные растворы, содержащие смесь слабого электролита (слабой кислоты или слабого основания) и его соли: • Ацетатный буфер – водный раствор уксусной кислоты и ацетата натрия СН 3 СООН + СН 3 СООNa (р. Н ≈ 4, 76); • Формиатный буфер – смесь растворов муравьиной кислоты и формиата натрия HCOOH + HCOONa (р. Н ≈ 3, 75); • Аммиачный буфер – смесь растворов аммиака и хлорида аммония NH 3∙H 2 O + NH 4 Cl (р. Н ≈ 9, 24). • Универсальная буферная смесь – растворы ортофосфорной, уксусной и борной кислот с раствором гидроксида натрия (Δр. Н = 2 – 12). 6

Буферные системы из смеси различных веществ: • Фосфатный буфер – водный раствор однозамещенного ортофосфата калия и двузамещенного ортофосфата натрия KH 2 PO 4 + Na 2 HPO 4 (постоянство р. Н можно поддерживать при заданном значении в интервале Δр. Н = 4, 80 – 8, 00); • водный раствор, содержащий хлороводородную кислоту и глицин HCl + NH 2 COOH (Δр. Н = 1, 10 – 3, 50); • водный раствор, содержащий гидроксид натрия и гидрофталат калия Na. OH + KHC 8 H 4 O 4 (р. Н = 4, 00 – 6, 20); 7

Механизм действия буферных растворов Рассмотрим подробнее два типа буферных систем: • систему, содержащую слабую кислоту и ее соль, • систему, содержащую слабое основание и его соль. I. Слабая кислота и ее соль – кислотный буфер Ацетатный буфер – водный раствор уксусной кислоты и ацетата натрия СН 3 СООН + СН 3 СООNa. 1) СН 3 СООNa = СН 3 СОО– + Na+ 2) СН 3 СООН = СН 3 СОО– + H+ или (СН 3 СООН + H 2 O = СН 3 СОО– + H 3 O+) 8

Механизм действия ацетатного буфера • При добавлении сильной кислоты к буферной смеси кислота реагирует с солью, в результате этой реакции образуется другая соль и слабая уксусная кислота: СН 3 СООNa + HCl = CH 3 COOH + Na. Cl СН 3 СОО– + Na+ + H+ + Cl– = CH 3 COOH + Na+ + Cl– СН 3 СОО– + H+ = СН 3 СООН • При добавлении сильного основания к буферной смеси между молекулами сильного основания и слабой кислоты протекает реакция нейтрализации: СН 3 СООН + Na. OH = CH 3 COONa + H 2 O СН 3 СООН + Na+ + OH– = CH 3 COO– + Na+ + H 2 O СН 3 СООН + OH– = СН 3 СОО– + H 2 O 9

II. Слабое основание и его соль – основный буфер Аммиачный буфер – смесь растворов аммиака и хлорида аммония NH 3∙H 2 O + NH 4 Cl. • Хлорид аммония NH 4 Cl – сильный электролит, в водном растворе распадается на ионы нацело: NH 4 Cl = NH 4+ + Cl– • Аммиак NH 3 – слабое основание и диссоциирует лишь в незначительной степени: NH 3∙H 2 O = NH 4 OH = NH 4+ + ОH– • Равновесие смещено влево, так как в растворе накапливается избыток ионов аммония NH 4+ из-за полной диссоциации NH 4 Cl. 10

Механизм действия аммиачного буфера • При добавлении сильной кислоты к буферной смеси кислота реагирует со слабым основанием – гидроксидом аммония NH 4 OH по реакции нейтрализации: NH 4 OH + HCl → NH 4 Сl + H 2 O NH 4 OH + H+ + Cl– → NH 4+ + Сl– + H 2 O NH 4 OH + H+ → NH 4+ + H 2 O • При добавлении сильного основания к буферной смеси основание реагирует с солью, в результате этой реакции образуется другая соль и слабое основание – гидроксид аммония NH 4 OH : NH 4 Сl + Na. OH = Na. Cl + NH 4 OH NH 4+ + Сl– + Na+ + OH– = Na+ + Cl– + NH 4 OH NH 4+ + ОH– = NH 4 OH 11
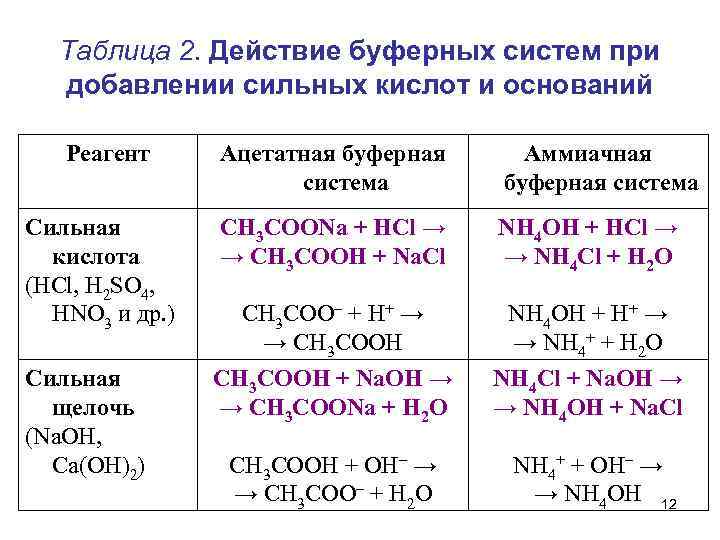
Таблица 2. Действие буферных систем при добавлении сильных кислот и оснований Реагент Ацетатная буферная система Аммиачная буферная система Сильная кислота (HCl, H 2 SO 4, HNO 3 и др. ) СН 3 СООNa + HCl → → CH 3 COOH + Na. Cl NH 4 OH + HCl → → NH 4 Сl + H 2 O СН 3 СОО– + H+ → → CH 3 COOH NH 4 OH + H+ → → NH 4+ + H 2 O Cильная щелочь (Na. OH, Ca(OH)2) СН 3 СООН + Na. OH → → CH 3 COONa + H 2 O NH 4 Сl + Na. OH → → NH 4 OH + Na. Cl СН 3 СООН + OH– → → СН 3 СОО– + H 2 O NH 4+ + OH– → → NH 4 OH 12

Примеры действия буферных растворов Буферным действием обладают: – буферные растворы, – растворы сильных кислот и оснований Задача 1. В трех литровых стаканах налиты следующие растворы: • Стакан 1. Дистиллированная вода (р. Н = 7). • Стакан 2. 0, 1 М раствор HNO 3. • Стакан 3. Ацетатный буферный раствор СН 3 СООН + СН 3 СООNa, содержащий 0, 1 моль этих веществ в 1 л. А) Во все стаканы добавили 0, 01 моль HCl. Б) Во все стаканы добавили 0, 01 моль Na. OH. Определить, как изменилось значение р. Н в каждом стакане в случае А и Б. 13

Решение: Стакан 1. A) При добавлении 0, 01 моль HCl к дистиллированной воде р. Н раствора резко изменилось с р. Н = 7 до р. Н = 2. [H+] = СHCl = 10– 2 моль/л, р. Н = −lg 10− 2 = 2. Б) При добавлении 0, 01 моль Na. OH к дистиллированной воде р. Н резко изменилось с р. Н = 7 до р. Н = 12. р. Н = −lg 10− 12 = 12. 14

Стакан 2. A) При добавлении 0, 01 моль HCl к 0, 1 М раствор HNO 3 р. Н раствора изменилось с р. Н = 1 до р. Н = 0, 96. Было: [H+] = СHNO 3 = 10– 1 моль/л, р. Н = −lg 10− 1 = 1. После добавления HCl [H+] = СHNO 3 + СHCl = (0, 1 + 0, 01) моль/л = 0, 11 моль/л, р. Н = −lg 0, 11 = 0, 96. Б) При добавлении 0, 01 моль Na. OH к 0, 1 М раствор HNO 3 р. Н раствора изменилось с р. Н = 1 до р. Н = 1, 05. Было: [H+] = СHNO 3 = 10– 1 моль/л, р. Н = −lg 10− 1 = 1. После добавления Na. OH протекает химическая реакция: HNO 3 + Na. OH = Na. NO 3 + H 2 O. СHNO 3 = (0, 1 − 0, 01) моль/л = 0, 09 моль/л. [H+] = СHNO 3 = 0, 09 моль/л, р. Н = −lg 0, 09 = 1, 05. 15

Стакан 3. А) При добавлении 0, 01 моль соляной кислоты HCl к ацетатному буферному раствору р. Н раствора изменилось незначительно. По экспериментальным данным с р. Н = 4, 74 до р. Н = 4, 73. СН 3 СООNa + HCl → CH 3 COOH + Na. Cl Б) При добавлении 0, 01 моль гидроксида натрия Na. OH к ацетатному буферному раствору р. Н раствора изменилось незначительно. По экспериментальным данным с р. Н = 4, 74 до р. Н = 4, 84. СН 3 СООН + Na. OH → CH 3 COONa + H 2 O 16
![Вычисление [H+] и р. Н в буферных системах I. Вычисление [H+] и р. Н Вычисление [H+] и р. Н в буферных системах I. Вычисление [H+] и р. Н](https://present5.com/presentation/82137600_179745819/image-17.jpg)
Вычисление [H+] и р. Н в буферных системах I. Вычисление [H+] и р. Н буферного раствора, образованного слабой кислотой и ее солью Рассчитаем величину р. Н ацетатного буфера, состоящего из равных количеств уксусной кислоты СН 3 СООН и ацетата натрия СН 3 СООNa = СН 3 СОО− + Na+ СН 3 СООН = СН 3 СОО− + Н+ Ка – константа кислотности уксусной кислоты; [H+] – равновесная концентрация протонов Н+; [СН 3 СОО−] – равновесная концентрация ацетат-анионов; [СН 3 СООН] – равновесная концентрация недиссоциированных молекул уксусной кислоты. 17
![Концентрация протонов [H+] из уравнения для константы кислотности: (1) Пусть в реакцию диссоциации вступило Концентрация протонов [H+] из уравнения для константы кислотности: (1) Пусть в реакцию диссоциации вступило](https://present5.com/presentation/82137600_179745819/image-18.jpg)
Концентрация протонов [H+] из уравнения для константы кислотности: (1) Пусть в реакцию диссоциации вступило х моль молекул уксусной кислоты СН 3 СООН в 1 литре раствора, тогда: [СН 3 СООН] = Скисл – х [СН 3 СОО−] = Ссоли + х [СН 3 СООН] = Скисл – х ≈ Скисл [СН 3 СОО−] = Ссоли + х ≈ Ссоли (2) 18
![• Концентрация протонов [H+] не зависит от абсолютных концентраций кислоты и ее соли, • Концентрация протонов [H+] не зависит от абсолютных концентраций кислоты и ее соли,](https://present5.com/presentation/82137600_179745819/image-19.jpg)
• Концентрация протонов [H+] не зависит от абсолютных концентраций кислоты и ее соли, а зависит от их соотношения в растворе. При разбавлении буферных растворов водой [H+] в них не меняется. • Для вычисления р. Н буферного раствора логарифмируем уравнение (2): 19
![II. Вычисление [H+] и р. Н буферного раствора, образованного слабым основанием и его солью II. Вычисление [H+] и р. Н буферного раствора, образованного слабым основанием и его солью](https://present5.com/presentation/82137600_179745819/image-20.jpg)
II. Вычисление [H+] и р. Н буферного раствора, образованного слабым основанием и его солью • Рассчитаем величину р. Н аммиачного буфера, состоящего из равных количеств гидроксида аммония NН 4 ОН и хлорида аммония NН 4 Cl. NН 4 Сl = NH 4+ + Сl− NН 4 ОН = NН 4+ + ОН− Кb – константа основности гидроксида аммония; [ОН−] – равновесная концентрация гидроксид-ионов; [NH 4+] – равновесная концентрация катионов аммония; [NН 4 ОН] – равновесная концентрация недиссоциированных молекул гидроксида аммония. [NH 4+] = [Cl−] = Cсоли 20
![• Выразим концентрацию гидроксид-ионов уравнения для константы основности: [ОН−] из (4) • Пусть • Выразим концентрацию гидроксид-ионов уравнения для константы основности: [ОН−] из (4) • Пусть](https://present5.com/presentation/82137600_179745819/image-21.jpg)
• Выразим концентрацию гидроксид-ионов уравнения для константы основности: [ОН−] из (4) • Пусть х моль молекул гидроксида аммония NН 4 ОН вступило в реакцию диссоциации, тогда: [NН 4 ОН] = Сосн – х [NH 4+] = Ссоли + х • Подставим полученные значения в уравнение (4) для нахождения концентрации [ОН−]: [NН 4 ОН] = Сосн – х ≈ Сосн [NH 4+] = Ссоли + х ≈ Ссоли 21
![• Концентрация гидроксид-ионов [ОН−] связана с концентрацией ионов [H+] уравнением ионного произведения воды: • Концентрация гидроксид-ионов [ОН−] связана с концентрацией ионов [H+] уравнением ионного произведения воды:](https://present5.com/presentation/82137600_179745819/image-22.jpg)
• Концентрация гидроксид-ионов [ОН−] связана с концентрацией ионов [H+] уравнением ионного произведения воды: Kw = [H+][ОН−]. • Концентрация ионов [H+] из этого уравнения равна: (6) • Для вычисления р. Н прологарифмируем полученное уравнение (6): 22

• Введем следующие упрощения: • Формула для расчета р. Н буферного раствора, образованного слабым основанием и его соли 23
![Таблица 3. Формулы для расчета концентрации [H+], [ОН−], р. Н и р. ОН буферных Таблица 3. Формулы для расчета концентрации [H+], [ОН−], р. Н и р. ОН буферных](https://present5.com/presentation/82137600_179745819/image-24.jpg)
Таблица 3. Формулы для расчета концентрации [H+], [ОН−], р. Н и р. ОН буферных систем Буферная система, образованная слабой кислотой и ее солью слабым основанием и его солью [H+] [OH−] p. H p. OH 24
![• Задача 2. Вычислить [H+] и р. Н ацетатного буфера c концентрацией эквивалентов • Задача 2. Вычислить [H+] и р. Н ацетатного буфера c концентрацией эквивалентов](https://present5.com/presentation/82137600_179745819/image-25.jpg)
• Задача 2. Вычислить [H+] и р. Н ацетатного буфера c концентрацией эквивалентов 0, 01 моль/л CH 3 COOH и 0, 01 моль/л CH 3 COONa. Ккисл (CH 3 COOH) = 1, 74 ∙ 10– 5 моль/л. • Решение: • Ответ: 25

• Задача 3. Как изменится значение р. Н ацетатного буфера, состоящего из 0, 01 моль/л эквивалентов CH 3 COOH и 0, 01 моль/л эквивалентов CH 3 COONa, если к 100 мл буферного раствора добавить: A) 1 мл 0, 1 М раствора сильной кислоты HCl. B) 1 мл 0, 1 М раствора сильного основания Na. OH. C) 100 мл дистиллированной воды. • Решение: Случай A. 1) Вычислим р. Н ацетатного буфера до прибавления сильной кислоты: 26

2) При добавлении 1 мл 0, 1 М раствора сильной кислоты HCl протекает реакция: HCl + СН 3 СООNa = CH 3 COOH + Na. Cl В результате реакции концентрация СН 3 СООNa уменьшается, а концентрация CH 3 COOH увеличивается. 27

3) Вычислим р. Н ацетатного буфера после прибавления сильной кислоты: 4) Таким образом, при добавлении сильной кислоты значение р. Н раствора уменьшилось на величину: Δр. Н = 4, 76 – 4, 673 = 0, 087. • Случай B. 1) При добавлении к ацетатному буферу 1 мл 0, 1 М раствора сильного основания Na. OH протекает реакция: Na. OH + СН 3 СООH = CH 3 COONa + H 2 O В результате реакции концентрация уксусной кислоты CH 3 COOH уменьшается, а концентрация ацетата натрия СН 3 СООNa увеличивается. 28

2) Вычислим р. Н после прибавления Na. OH: 3) Значение р. Н ацетатного буферного раствора увеличилось на величину: Δр. Н = 4, 847 – 4, 76 = 0, 087. 29

• Случай С. 1) При добавлении к 100 мл буферного раствора 100 мл дистиллированной воды не протекает никакой химической реакции, а происходит лишь разбавление раствора в 2 раза. Объем системы увеличивается в 2 раза, концентрации компонентов буферной системы уменьшаются в 2 раза. 2) Вычислим р. Н после прибавления дист. воды: 3) При разбавлении р. Н буферного раствора не меняется. 30

• Ответ: A) При добавлении 1 мл 0, 1 М сильной кислоты HCl к 100 мл ацетатного буфера р. Н уменьшится на 0, 087. B) При добавлении 1 мл 0, 1 М сильного основания Na. OH к 100 мл ацетатного буфера р. Н увеличится на 0, 087. С) При добавлении 100 мл дистиллированной воды к 100 мл ацетатного буфера р. Н не изменится. • Сравним: A) При добавлении 1 мл 0, 1 М сильной кислоты HCl к 100 мл дистиллированной воды р. Н уменьшится на 4. [H+] = 0, 1/100 = 10– 3; р. Н = –lg[H+] = 3; Δр. Н = 7 – 3 = 4. B) При добавлении 1 мл 0, 1 М сильного основания Na. OH к 100 мл ацетатного буфера р. Н увеличится на 4. [H+] = Kw/[OH–] = 10– 14/10– 3 = 10– 11; р. Н = –lg[H+] = 11; Δр. Н = 11 – 7 = 4. 31

Количественные характеристики буферных растворов • Буферная сила – сопротивление буферного раствора сдвигу р. Н под действием кислот и щелочей. • Если при добавлении одного и того же количества сильной кислоты или сильного основания к двум различным буферным растворам, p. H одного буферного раствора изменится меньше, чем другого, то первая смесь обладает большей буферной силой. • Буферная емкость β определяется количеством сильной кислоты или сильного основания, которые необходимо добавить к 1 л буферного раствора для изменения его р. Н на единицу. 32

• Для буферной системы, состоящей из раствора слабой кислоты и ее соли, буферную емкость можно приближенно рассчитать по формуле: β – буферная емкость, Ka – константа кислотности слабой кислоты, [H+] – концентрация ионов водорода в буферном растворе до прибавления сильной кислоты или сильного основания. • Например, Буферная емкость ацетатного буфера в нормальных условиях составляет: β = 0, 08 моль/л HCl (или Na. OH). 33
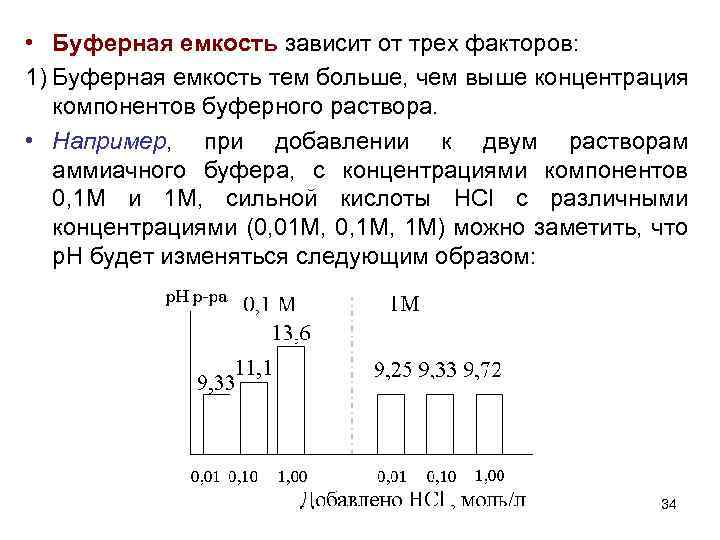
• Буферная емкость зависит от трех факторов: 1) Буферная емкость тем больше, чем выше концентрация компонентов буферного раствора. • Например, при добавлении к двум растворам аммиачного буфера, с концентрациями компонентов 0, 1 М и 1 М, сильной кислоты HCl с различными концентрациями (0, 01 М, 0, 1 М) можно заметить, что р. Н будет изменяться следующим образом: 34

2) Максимальная буферная емкость наблюдается у растворов, содержащих равные концентрации слабых электролитов и их солей. При этом р. Н буферного раствора равен р. Ка (или р. Кb), так как Скисл/Ссоли = 1. 3) По мере добавления к буферным растворам сильных кислот или щелочей устойчивость их растворов к изменению р. Н постепенно снижается. • Например, При добавлении к 1 л буферного раствора: – 0, 01 моль HCl (или Na. OH) р. Н изменяется на 0, 085 единиц; – 0, 02– 0, 05 моль р. Н изменяется на 0, 1 единиц; – 0, 05– 0, 1 моль р. Н изменяется на 0, 28 единиц. • Интервал р. Н, в котором данная буферная смесь может поддерживать постоянное значение р. Н, называется областью буферирования. • В справочной литературе имеются подробные методики приготовления кислотно-основных буферных растворов для различных значений р. Н. 35

• Задача 4. Имеется два буферных раствора следующего состава: 1) Ацетатный буфер: 1 М СН 3 СООН + 1 М СН 3 СООNa, р. Ка(СН 3 СООН) = 4, 76. 2) Формиатный буфер: 0, 1 М НСООН + 0, 02 М НСООNa, р. Ка(НСООН) = 3, 75. К буферным растворам был добавлен одинаковый объем 0, 01 M HCl. Определить какой из растворов обладает большей буферной силой. • Решение: 1) Определим р. Н буферных растворов до прибавления HCl: 36

2) При добавлении 0, 01 M HCl протекают реакции: CH 3 COONa + HCl ↔ СН 3 СООН + Na. Cl; НСООNa + HCl ↔ НСООН + Na. Cl; В результате реакций концентрации слабых кислот увеличились на 0, 01 моль, а концентрации сопряженных солей уменьшились на 0, 01 моль. 3) Рассчитаем р. Н буферных растворов после добавления 0, 01 M соляной кислоты HCl: 37

4) Сравним изменение р. Н до и после прибавления 0, 01 M соляной кислоты HCl в обоих случаях: Для ацетатного буфера Δр. Н = 4, 76 − 4, 7514 = 0, 0086. Для формиатного буфера Δр. Н = 3, 05 − 2, 71 = 0, 34. • Ответ: Ацетатный буфер обладает большей буферной силой, чем формиатный буфер, так как при добавлении одинакового количества сильной кислоты HCl значение р. Н ацетатного буфера изменилось существенно меньше, чем в случае формиатного буфера. CH 3 COOН CH 3 COONa HCOOН HCOONa 38

Применение буферных растворов в аналитической химии • Буферные системы играют значительную роль в регуляции жизнедеятельности живых организмов, в которых должно сохраняться постоянство р. Н крови, лимфы и других жидкостей. • Например, • Δр. Н крови в организме человека = 7, 35 – 7, 45. • Действующими буферами крови являются: фосфатный буфер, гидрокарбонатный буфер и белковый буфер. • Буферы, состоящие из белков, поддерживают р. Н слез равным 7, 4. • Буферные растворы используют в бактериологических исследованиях для поддержания постоянства р. Н 39 культурных сред для выращивания бактерий.

Таблица 4. Значения р. Н для некоторых биологических систем и других растворов № Система (раствор) р. H 1 Желудочный сок 1, 6– 1, 8 2 Апельсиновый сок 2, 6– 4, 4 3 Столовый уксус 3, 0 4 Томатный сок 4, 3 5 Моча 4, 8– 7, 5 6 Слюна 6, 35– 6, 85 7 Молоко коровье 6, 6– 6, 9 8 Кровь человека 7, 35– 7, 45 9 Слезы 7, 4 10 Белок куриного яйца 8, 0 11 Морская вода 8, 0 40

• Буферные растворы играют важную роль во многих технологических процессах. Буферные растворы используются: • – – – • 1. 2. при электрохимическом нанесении защитных покрытий, в производстве красителей, фотоматериалов и кожи. в химическом анализе и для калибровки р. Н-метров. В качественном анализе буферные растворы используют, когда необходимо соблюдать постоянство р. Н растворов при разбавлении или добавлении в реакционную смесь других реагентов. При проведении ОВР, реакций осаждении сульфидов, гидроксидов, карбонатов, фосфатов и др. При действии групповых реагентов для осаждения катионов III и IV аналитических групп. Например, для осаждения катионов с помощью (NH 4)2 СО 3 и (NН 4)2 S используют основный буферный 41 раствор (NH 4 ОН+ NH 4 Cl) р. Н ≈ 9.

3. 4. 5. При определении ионов Zn 2+ в виде Zn. S в присутствии других катионов берут формиатный буфер, р. Н ≈ 3. Характерной реакцией ионов Ва 2+ является реакция образования хромата бария: K 2 Cr 2 O 7 + 2 Ba. Cl 2 + H 2 O ↔ Ba. Cr. O 4↓ + 2 KCl + 2 HCl К раствору добавляют ацетат натрия СН 3 СOONa, который связывает ионы Н+ в молекулы СН 3 СOOН: HCl + CH 3 COONa = CH 3 COOH + Na. Cl Образуется ацетатная буферная смесь (р. Н 4, 74), и осадок Ba. Cr. O 4↓ не растворяется. При использовании буферных растворов в сильнокислых (сильнощелочных) растворах предварительно нейтрализуют бόльшую часть кислоты или щелочи. Для этого к сильнокислым растворам добавляют сухую соль слабой кислоты CH 3 COONa; к сильнощелочным растворам – сухую соль NH 4 Cl. 42
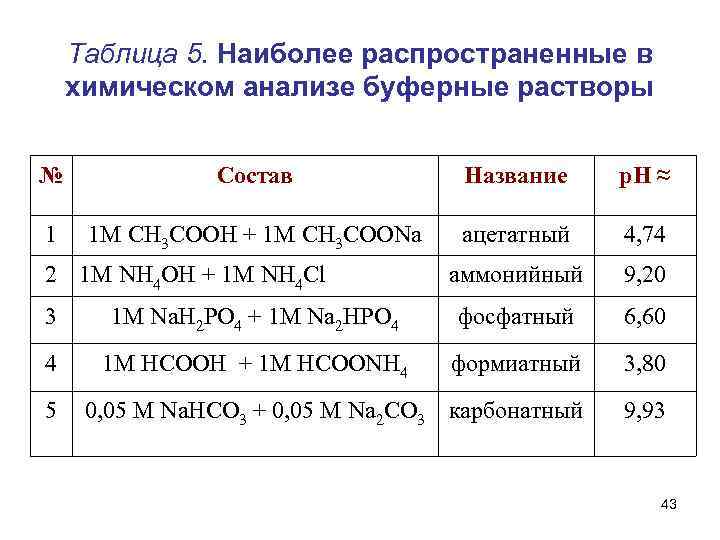
Таблица 5. Наиболее распространенные в химическом анализе буферные растворы № Состав Название р. Н ≈ 1 1 М СН 3 СООН + 1 М СН 3 СООNa ацетатный 4, 74 аммонийный 9, 20 2 1 М NH 4 OH + 1 М NH 4 Cl 3 1 М Na. Н 2 РО 4 + 1 М Na 2 НРО 4 фосфатный 6, 60 4 1 М HCOOH + 1 М HCOONH 4 формиатный 3, 80 0, 05 М Na. HСО 3 + 0, 05 M Na 2 СО 3 карбонатный 9, 93 5 43

44
Лекция 6 Буферные растворы.ppt