Prezentatsia1.pptx
- Количество слайдов: 5

Будова атома та його електронних оболонок. Періодичний закон Д. І. Мендєлєєва та його тлумачення на основі теорії електронної будови атома Експериментальні досліди в галузі фізики що підтверджують складну будову атома: - Катодне випромінювання(потік електронів, що утворюються внаслідок проходження електричного струму крізь розріджені гази); - Радіоактивність – здатність деяких елементів випромінювати елементарні частинки (α – потік двохзарядних позитивних іонів гелію Не 2+; β потік електронів; ɤ- електромагнітні коливання дуже малими довжинами хвиль); - , , Рентгенівські” промені, а також: - явище електролізу; - Періодичний закон. Перші моделі атома. Дж. Томсон , 1903 р. . : , , Атом має вигляд позитивно зарядженої сфери, в якій розміщуються пошарово негативно заряджені електрони, які лише мають коливальний рух ’’( статична модель). Але ця модель не могла пояснити досліди Е. Резерфорда по , , розсіювання l частинок ’’. Е. Резерфорд у 1911 р. запропонував ядерну( планетарну, динаміку) модель атома. , , В центрі атома міститься позитивно заряджене ядро дуже малого розміру (r ядра ~ 10 -13 см, r атома ~ 10 -8 см, тобто ядро в 100 000 раз менше атома). Уся маса атома зосереджена у ядрі. Навколо ядра по коловим орбітам рухаються електрони, число яких дорівнює позитивному заряду ядра. Між ядрами і електронами взаємодіють електростатичні(кулонівські) сили, зрівноважені відцентровою силою, що виникає внаслідок руху електронів ’’. Модель атома Резерфорда не змогла пояснити ні існування стійких атомів, ні наявності лінійчастих атомів спектрів. У 1900 р німецький фізик М. Планк , вивчаючи природу випромінювання нагрітих тіл, висловив припущення, що енергія випромінюється і поглинається не безперервно, а дискретно, певними порціями – квантами. Величину кванта енергії можна обчислити із співвідношення, яке називається рівнянням Планка: H= h* V , де Е- кількість енергії з частотою коливання v ; h- універсальна стала Планка, що дорівнює 6, 626 *10 -34 Дж. с. Враховуючи квантову теорію світла, лінійчастий характер атомних спектрів і ядерну модель Резерфорда, датський фізик Н. Бор у 1913 р сформулював основні положення своєї теорії будови атома Гідрогену у вигляді постулатів;

• Електрон обертається навколо ядра не випромінюючи енергії , тільки по певних коловим орбіталям , які називаються стаціонарними. • Електрон може переходити з однієї стаціонарної орбіталі на іншу; при цьому поглинається або випромінюється квант електромагнітного випромінювання, енергія якого дорівнює різниці енергії атома в кінцевому і вихідному станах: Е= Екінц – Е поч. = h*V • Кожному переходу електрона на певну орбіталь відповідає певна секторна лінія • ( і тому атомні спектри лінійчасті, а не суцільні). Вивчаючи тонку структуру спектральних ліній(явище їх розщеплення), А. Заммерфельд у 1916 р обґрунтував можливості руху електронів і по еліптичних орбіталях, що по різному розташовані у просторі. • Сучасна квантово-механічна модель будови атома розроблена на основі уявлень квантової( хвильової) механіки про квантування енергії, хвильовий характер руху мікрочастинок і ймовірний метод описання мікрооб’єктів. Завдяки роботам де Бройля , Шредінгера , В. Гейзенберга були розроблені основи хвильової теорії про двоїсту корпускулярнохвильову природу електрона. • Електрон, як усяка мікрочастинка, поводить себе як частинка або як хвиля. З рівняння планка (E=hv) і Ейнштейна (Е=mc 2) випливає, що hv= mc 2 . Враховуючи, що і v=c дістанемо основне рівняння хвильової механіки – рівняння де Бройля. • Воно є математичним виразом корпускулярно-хвильової двоїстості електрона, згідно з яким частинці яка має масу m і рухається із швидкістю v, відповідає довжина хвилі . • У 1927 р В. Гейзенберг вивів принцип невизначеності згідно з яким не можна одночасно встановити точне місце перебування електрона у просторі і його швидкість, або імпульс. Тобто електрон, як і хвиля немає одночасно точних значень координати та імпульса. • Закономірність руху мікрочастинок(електрона) у квантовій механіці описує рівняння Шредінгера: • + + + (E – U) Ψ = 0 • Де ψ хвильова функція; u- потенціальна енергія частинки, Е-повна енергія; x, y, z – координати. Або спрощено: Е=f(ψ x, y, z)- енергія електрона в атомі є функцією від ψ, x, y, z. • Квадрат хвильової функції ψ2 виражає імовірність перебування електрона в певній точці атомного простору. Тому як модель стану електрона в атомі у квантовій механіці прийнято уявлення про електронну хмару, густина • відповідних ділянок якої пропорційна імовірності перебування там електрона. • Навколоядерний простір, в якому імовірність знаходження електрона максимальна • (- 90%) називається атомною орбіталлю. • Основні характеристики, які визначають рух електрона навколо ядра –це його енергія і • просторові особливості відповідної йому орбіталі. •

• • Квантові числа. Внаслідок розв’язання рівняння Шредінгера обчислюють хвильові функції або атомні орбіталі, кожну у яких характеризують набором певних квантових чисел. Згідно з квантово-механічною теорією, енергійний стан електрона в атомі характеризується значеннями чотирьох квантових чисел: n- головного l-орбітального (побічне, азимутальне); m – магнітного s- спінового. У реальних атомах енергія електронів квантова, тобто вона набуває не будь-яких, а певних дискретних значень. Перехід електрона з одного квантового стану в інший пов'язаний з стрибкоподібною зміною його енергії. Електрони в атомі розподіляються по енергетичним рівням, які складаються із підрівней , а останні – із орбіталей. Головне квантове число (n) визначає загальний запас енергії електрона на енергетичному рівні, а також радіус рівня. Воно може мати додатні цілочислові значення: 1, 2, 3і до ∞(практично від 1 до 7 відповідно номеру періода, в якому знаходиться елемент (фізичний зміст номеру періода). Орбітальне квантове число (l) характеризує енергетичний стан електрона на підрівні і форму електронних орбіталей. Воно може мати значення від 0 до (n-1). Можлива кількість підрівней для кожного енергетичного рівня дорівнює номеру цього рівня, тобто величині головного кватового числа. Відповідно до квантово-механічних розрахунків s-орбіталі мають форму кулі( сферичну симетрію), р- орбіталі – форму гантелі (об’ємна вісімка), d- та f- орбіталі мають більш складну форму. Магнітне квантове число (mе) характеризує орієнтацію орбіталі у просторі відносно напрямку зовнішнього магнітного поля. Воно може мати цілочислові значення ( додатні і від’ємні) від + l до – l. Число значень mе =(2 l +1), що відповідає числу можливих розміщень орбіталі певної форми у просторі відносно системи координат. Число значень mе дорівнює числу атомних орбіталей на енергетичному підрівні, які є виродженими: Графічн зображення орбіталі
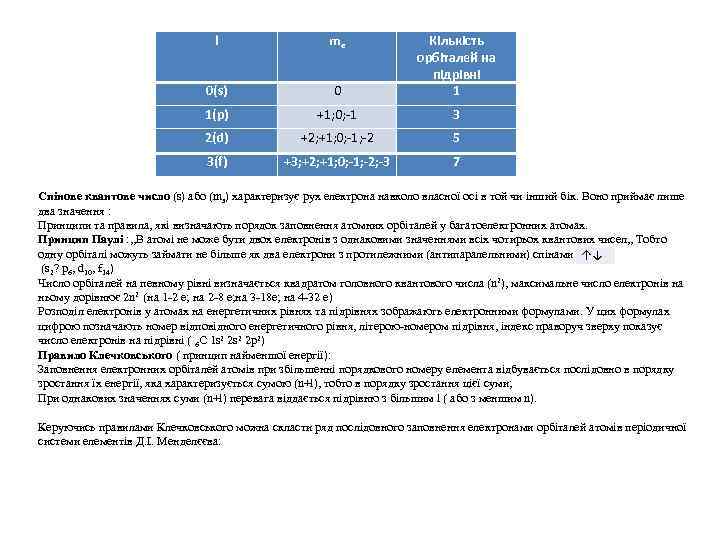
l mе 0(s) 0 Кількість орбіталей на підрівні 1 1(p) +1; 0; -1 3 2(d) +2; +1; 0; -1; -2 5 3(f) +3; +2; +1; 0; -1; -2; -3 7 Спінове квантове число (s) або (ms) характеризує рух електрона навколо власної осі в той чи інший бік. Воно приймає лише два значення : Принципи та правила, які визначають порядок заповнення атомних орбіталей у багатоелектронних атомах. Принцип Паулі : , , В атомі не може бути двох електронів з однаковими значеннями всіх чотирьох квантових чисел, , Тобто одну орбіталі можуть займати не більше як два електрони з протилежними (антипаралельними) спінами. ↑↓ (s 2? p 6, d 10, f 14) Число орбіталей на певному рівні визначається квадратом головного квантового числа (n 2), максимальне число електронів на ньому дорівнює 2 n 2 (на 1 -2 е; на 2 -8 е; на 3 -18 е; на 4 -32 е) Розподіл електронів у атомах на енергетичних рівнях та підрівнях зображають електронними формулами. У цих формулах цифрою позначають номер відповідного енергетичного рівня, літерою-номером підрівня, індекс праворуч зверху показує число електронів на підрівні ( 6 С 1 s 2 2 p 2) Правило Клечковського ( принцип найменшої енергії): Заповнення електронних орбіталей атомів при збільшенні порядкового номеру елемента відбувається послідовно в порядку зростання їх енергії, яка характеризується сумою (n+l), тобто в порядку зростання цієї суми; При однакових значеннях суми (n+l) перевага віддається підрівню з більшим l ( або з меншим n). Керуючись правилами Клечковського можна скласти ряд послідовного заповнення електронами орбіталей атомів періодичної системи елементів Д. І. Менделєєва:
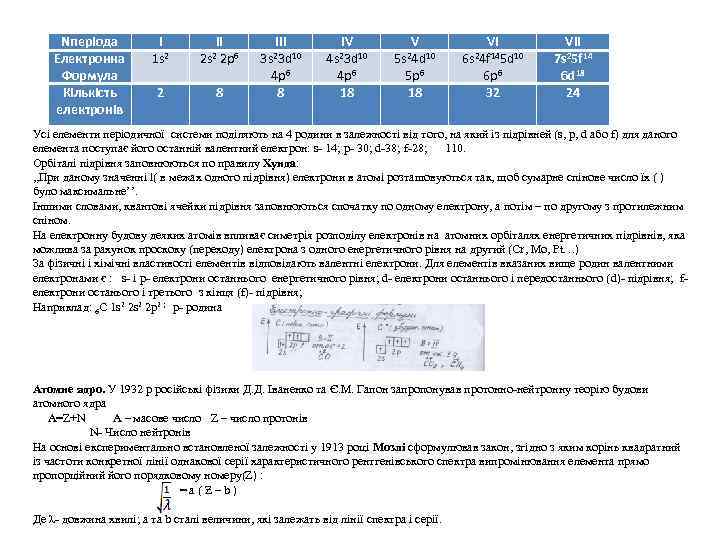
Nперіода Електронна Формула Кількість електронів I 1 s 2 2 II 2 p 6 2 s 2 8 III 3 s 23 d 10 4 p 6 8 IV 4 s 23 d 10 4 p 6 18 V 5 s 24 d 10 5 p 6 18 VI 6 s 24 f 145 d 10 6 p 6 32 VII 7 s 25 f 14 6 d 18 24 Усі елементи періодичної системи поділяють на 4 родини в залежності від того, на який із підрівней (s, p, d або f) для даного елемента поступає його останній валентний електрон: s- 14; p- 30; d-38; f-28; 110. Орбіталі підрівня заповнюються по правилу Хунда: , , При даному значенні l( в межах одного підрівня) електрони в атомі розташовуються так, щоб сумарне спінове число їх ( ) було максимальне’’. Іншими словами, квантові ячейки підрівня заповнюються спочатку по одному електрону, а потім – по другому з протилежним спіном. На електронну будову деяких атомів впливає симетрія розподілу електронів на атомних орбіталях енергетичних підрівнів, яка можлива за рахунок проскоку (переходу) електрона з одного енергетичного рівня на другий (Cr, Mo, Pt…) За фізичні і хімічні властивості елементів відповідають валентні електрони. Для елементів вказаних вище родин валентними електронами є : s- і p- електрони останнього енергетичного рівня; d- електрони останнього і передостаннього (d)- підрівня; f- електрони останього і третього з кінця (f)- підрівня; Наприклад: 6 С 1 s 2 2 p 2 ; р- родина Атомне ядро. У 1932 р російські фізики Д. Д. Іваненко та Є. М. Гапон запропонував протонно-нейтронну теорію будови атомного ядра A=Z+N A – масове число Z – число протонів N- Число нейтронів На основі експериментально встановленої залежності у 1913 році Мозлі сформулював закон, згідно з яким корінь квадратний із частоти конкретної лінії однакової серії характеристичного рентгенівського спектра випромінювання елемента прямо пропорційний його порядковому номеру(Z) : = a ( Ƶ – b ) Де λ- довжина хвилі; а та b сталі величини, які залежать від лінії спектра і серії.
Prezentatsia1.pptx