ZH_LK_2.ppt
- Количество слайдов: 25

Будова атома. Моделі будови атома. Квантово-механічна теорія. Хвильове рівняння Шредінгера.

Історія вчення про будову атома • вивчення явища проходження електричного струму через розчини електролітів (закони Фарадея, 1832 р. ); • вивчення електричних розрядів у розріджених газах (катодне випромінювання Крукса, 1879 р. ); • відкриття Х-променів (І. Пулюй, В. Рентген, 1895 р. ) • відкриття радіоактивності та радіоактивних елементів (А. Беккерель, М. Склодовська-Кюрі, П. Кюрі, 1896 р. ); • відкриття електрона (Дж. Томсон, 1897 р. ); • модель будови атома Томсона (1903 р. ). 2

• Катодне випромінювання – потік негативно заряджених частинок • Назву електрон запропонував Стоні. • Існування електрона доказали Дж. Томсон і Віхерт 1897 р. , які визначили відношення заряду електрона до його маси: е m = 1, 759∙ 108 Кл г • Експериментально заряд електрона визначив англійський фізик Роберт Міллікен 1910 р. . • m = = 9, 109∙ 10 -28 г маса електрона

Вільгельм Конрад Рентген 1845 -1923 Ø 1895 р. німецький фізик Вільгельм Рентген відкрив рентгенівське проміння Х-проміння. Ø Природа і механізм виникнення X-променів описані українським вченим Іваном Пулюєм 1880 -1882 р. Ø Рентгенівське проміння не відхиляється в електричному та магнітному полях і є короткохвильовим випромінюванням, має велику проникну здатність

Ø Явище природної радіоактивності (1896 р. ). Французький хімік Беккерель виявив самодовільне випромінювання ураном нового виду проміння в солі урану K 2 UO 2(SO 4)2∙ 2 H 2 O. Ø 1888 р. подружжя Кюрі виділили з уранових руд два нових радіоактивних елементи – Полоній і Радій. • Радіоактивність – здатність деяких елементів випромінювати невидиме проміння, яке проникає крізь речовини, іонізує гази, засвічує фотоплівку.

Досліди Резерфорда Розділення радіоактивного випромінювання в електричному полі (1899 р. ): α-промені – потік позитивно заряджених частинок, маса яких дорівнює масі атома Гелію, заряд – вдвічі більший, ніж заряд електрона. -промені – потік електронів, швидкість руху яких близька до швидкості світла. γ-промені – електромагнітні коливання, подібні до рентгенівських променів, мають дуже велику проникну здатність. 6

Перші моделі будови атома • Модель Джозефа Джона Томсона (1904 р. ) суть: електрони всередині позитивно зарядженої сфери розміщені в одній площині • Модель Хантаро Нагаока (1904 р. ). суть: атом уподібнювався планеті Сатурн (позитивно заряджена сфера – основна частина атома, навколо якої по кільцевих орбітах рухаються електрони).
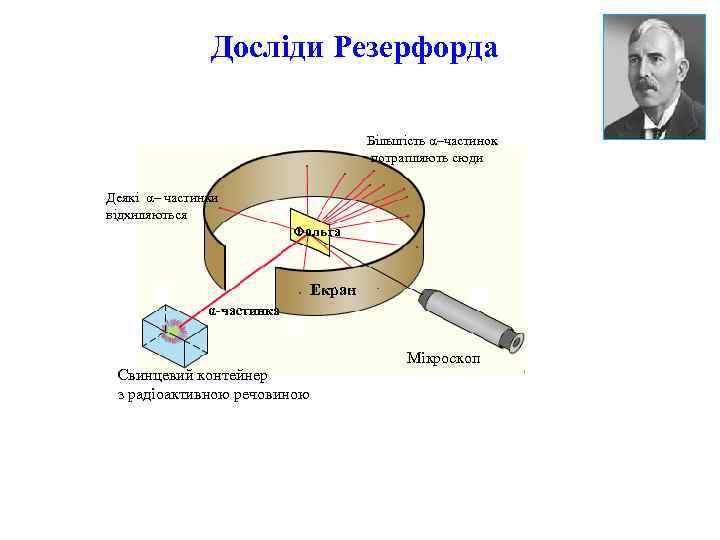
Досліди Резерфорда Більшість α–частинок потрапляють сюди Деякі α– частинки відхиляються Фольга Екран α-частинка Свинцевий контейнер з радіоактивною речовиною Мікроскоп

Основні положення планетарної моделі атома • в центрі атома міститься невелике ядро, навколо якого на значній відстані по орбітах рухаються електрони, сумарний негативний заряд яких чисельно дорівнює позитивному заряду ядра. • відцентрова сила руху електронів урівноважується силою електростатичного притягання їх до протилежно зарядженого ядра; • розміри ядра дуже малі порівняно з розмірами атома: діаметр атома ~10– 8 см, діаметр ядра ~10– 12 – 10– 13 см. 9

• Резерфорд кількісно оцінив заряд ядра: Z = , де Z – заряд ядра; А – атомна маса; е – заряд електрона.

Недоліки ядерної моделі Резерфорда ü суперечила теорії руху електричних зарядів ü не могла пояснити атомних спектрів Спектр атома Гідрогену Формула С. Бальмера для розрахунку частоти кожної з спектральних ліній атома Гідрогену: – частота спектральної лінії; К – константа; n = 3, 4, 5 – цілі числа, більші ніж 2.

Закон Мозлі Генрі Мозлі 1887 -1915 • Квадратний корінь із частоти певних ліній однакових серій характеристичного рентгенівського спектра пропорційний атомному номеру елемента. = а (Z - b). Z – атомний номер елемента; а – коефіцієнт пропорційності, особливий для кожної лінії спектра; b – поправка на екранування; залежить від лінії і не змінюється від елемента до елемента.

Теорія будови атома Н. Бора • Постулати Бора 1. Електрон в атомі може перебувати, не випромінюючи енергії, тільки на стаціонарних або квантових орбіталях, з певним значенням енергії Еn (умова квантування орбіт). У стаціонарному стані атом енергію не випромінює. 2. Перехід електрона з одного стаціонарного стану в інший супроводжується випромінюванням або поглинанням кванта електромагнітної енергії (умова частот). ΔЕ = Е 2 – Е 1 = hν h – стала Планка (h = 6, 626· 10 -34 Дж·с); Е 1 – енергія електрона в основному стані; Е 2 – енергія електрона на віддаленій орбіті; ΔЕ – енергія, яка випромінюється при переході з однієї орбіти на іншу. якщо E 2 > E 1 – квант випромінюється, якщо E 2 < E 1 – поглинається.

Ø Стан, що відповідає найменшому запасу енергії називається основним. Ø Енергія атома при переході електрона на іншу орбіту збільшується і він переходить у збуджений стан. Ø Перехід електрона у вихідний стан зумовлює зменшення енергії атома, при цьому енергія виділяється у вигляді кванта світла hν.

Позитивні сторони теорії Бора: • пояснила фізичну природу атомних спектрів; • дала змогу розрахувати їх для атома Гідрогену; • пояснила природу рентгенівських спектрів. Недоліки теорії Бора: Ø Ø Ø не пояснювала деяких спектральних характеристик багатоелектронних атомів; не пояснювала причину різної інтенсивності ліній в спектрі атома Гідрогену; не давала відповіді на питання, де перебуває електрон під час переходу з однієї орбіти на іншу. 15

Квантово-механічна модель будови атома • Згідно цій моделі електрон можна розглядати як частинку і як хвилю. ü Кожна частинка характеризується: масою, швидкістю руху, імпульсом. ü Кожна хвиля характеризується: довжиною, амплітудою, частотою. Комбінуючи рівняння Планка Е = h і Ейнштейна Е = mс2, враховуючи, що c = , одержуємо mc 2 = h , а = c/. Отже, справедлива рівність mc = h/ , звідки отримуємо вираз для довжини хвилі (рівняння Луї де Бройля): = h/mc – для фотона або = h/m – для інших частинок. Кожній частинці із масою m, яка рухається зі швидкістю v, відповідає певна довжина хвилі .

Принцип невизначеності Гейзенберга 1927 р. Неможливо одночасно точно визначити місце перебування електрона мікрочастинки у просторі та його швидкість або імпульс. Чим точніше визначено координату тим більш невизначеним стає імпульс. Добуток невизначеностей координати та швидкості або імпульсу електрона не може бути меншим від певного значення. Δx ∙Δv ≥ ћ / m, де ΔX – координата; Δ υ – швидкість; – стала Дірака; Р – імпульс. Δx ∙Δp ≥ ћ
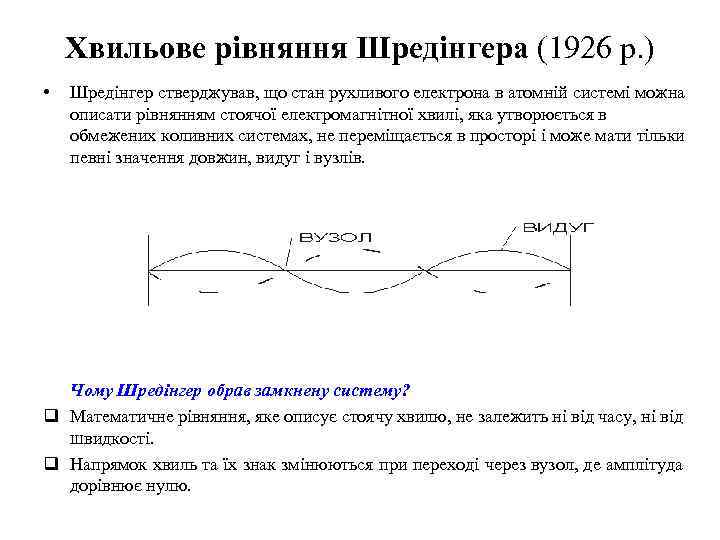
Хвильове рівняння Шредінгера (1926 р. ) • Шредінгер стверджував, що стан рухливого електрона в атомній системі можна описати рівнянням стоячої електромагнітної хвилі, яка утворюється в обмежених коливних системах, не переміщається в просторі і може мати тільки певні значення довжин, видуг і вузлів. Чому Шредінгер обрав замкнену систему? q Математичне рівняння, яке описує стоячу хвилю, не залежить ні від часу, ні від швидкості. q Напрямок хвиль та їх знак змінюються при переході через вузол, де амплітуда дорівнює нулю.

Хвильова функція Нехай дана точка з координатами x, y, z значення хвильової функції дорівнює x, y, z. Хвильова функція – це амплітуда трьохмірної електронної хмари, або амплітуда ймовірності перебування електрона в даній точці простору. Добуток 2 d. V є імовірністю знаходження електрона в елементарному об’ємі простору d. V. 2 густина імовірності або “електронна густинаˮ – область навколо ядра атома дозволена для електрона. Рівняння Шредінгера для електрона в атомі Гідрогену та подібних одноелектронних систем: h – стала Планка; m – маса електрона; x, y, z – координати електрона; Е – повна енергія електрона; U – потенціальна енергія електрона.

Вимоги до хвильової функції 1. Хвильва функція повинна бути скінченною, тобто не перетворюватись на нескінченність за будь-яких значень аргументів. 2. Однозначною – в будь-якій точці мати лише одне значення, бо за змістом є амплітудою імовірності, а тому для будь-якої точки може мати одне значення. 3. Неперервною, оскільки стан квантової системи в просторі змінюється неперервно. 4. Граничною, тобто перетворюватись в нуль у нескінченності ( =0 на нескінченно великій відстані від ядра електрона r ). 5. Нормованою − ймовірність знаходження електрона в усьому об’ємі атома дорівнює одиниці.

(r, , φ) = R(r)∙Ѳ( )∙Ф(φ), радіус-вектор r, кут широти , кут довготи φ. R(r) – радіальна складова (амплітуда ймовірності); Ѳ( ) і Ф(φ) сферичні (кутові) складові функції . • Загальним розв'язком рівняння є повна власна функція n, l, ml (r, , φ) = Rn, l (r)∙ Ѳl, ml( )∙ Фml (φ) • Радіальна складова R(r) залежить від чисел n та l, сферичні Ѳ( ) – від l та ml, а Ф(φ) – від числа ml.

Поняття про атомну орбіталь • Одноелектронну хвильову функцію із заданими значеннями трьох квантових чисел називають атомною орбіталлю (АО). • Орбіталь (електронна хмара) даного електрона - це область навколоядерного простору, обмежена умовною поверхнею, що охоплює 90% електронної густини (тобто заряду і маси електрона). • Орбіталь – це простір навколо ядра, в якому ймовірність перебування електрона є найбільшою.
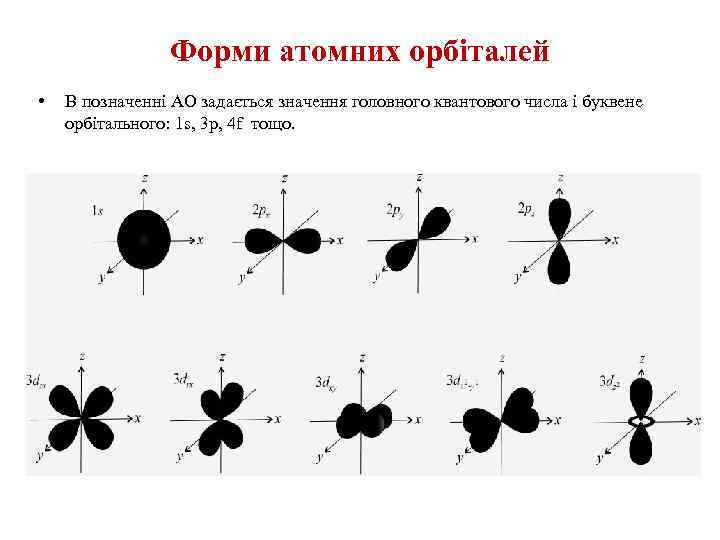
Форми атомних орбіталей • В позначенні АО задається значення головного квантового числа і буквене орбітального: 1 s, 3 p, 4 f тощо.


Дякую за увагу!
ZH_LK_2.ppt