БРОМАТОМЕТРИЯ Титрант – 0,


БРОМАТОМЕТРИЯ Титрант – 0, 1 моль/л раствор KBr. O 3 Можно приготовить по точной навеске Br. O 3 + 6 H+ + 6ē Br + 3 H 2 O М(1/6 KBr. O 3) = М(KBr. O 3)/6

Стандартизация иодометрическим методом KBr. O 3 + 6 KI + 3 H 2 SO 4 3 I 2 + 3 K 2 SO 4 + +KBr + 3 H 2 O I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 С(Na 2 S 2 O 3)пр V(Na 2 S 2 O 3) С(1/6 KBr. O 3)пр = V(1/6 KBr. O 3) С(1/6 KBr. O 3)пр K = С(1/6 KBr. O 3)тр Хранят в темном месте, в склянках темного стекла

Прямая броматометрия применяется для к. о. оксида мышьяка (III): 3 As 2 O 3 + 2 KBr. O 3 3 As 2 O 5 + 2 KBr В т. э. KBr. O 3 +5 KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O Изб. капля изб. капля Ind – метиловый красный (обесцвечивается)

БРОМОМЕТРИЯ Титрант – раствор брома, получают из бромат- бромидной смеси KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O Из бюретки добавляют стандартный раствор бромата калия (бромометрию часто называют броматометрией). В фарманализе прямая бромометрия применя- ется для к. о. тимола, стрептоцида (реакция электрофильного замещения) и др. препаратов.
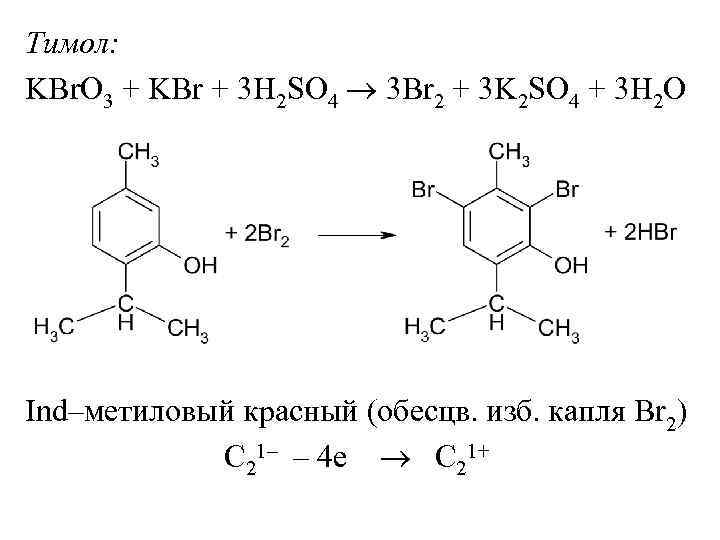
Тимол: KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O Ind–метиловый красный (обесцв. изб. капля Br 2) C 21– – 4 е C 21+
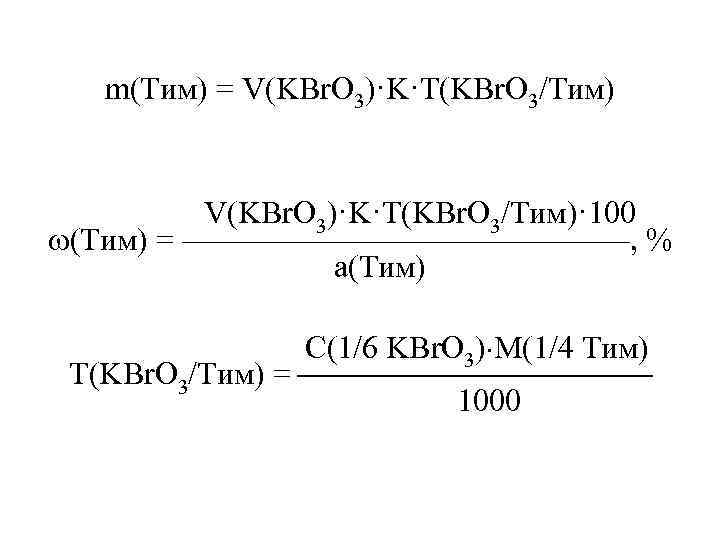
m(Тим) = V(KBr. O 3)·K·T(KBr. O 3/Тим) V(KBr. O 3)·K·T(KBr. O 3/Тим)· 100 (Тим) = ———————, % а(Тим) С(1/6 KBr. O 3) М(1/4 Тим) Т(KBr. O 3/Тим) = 1000
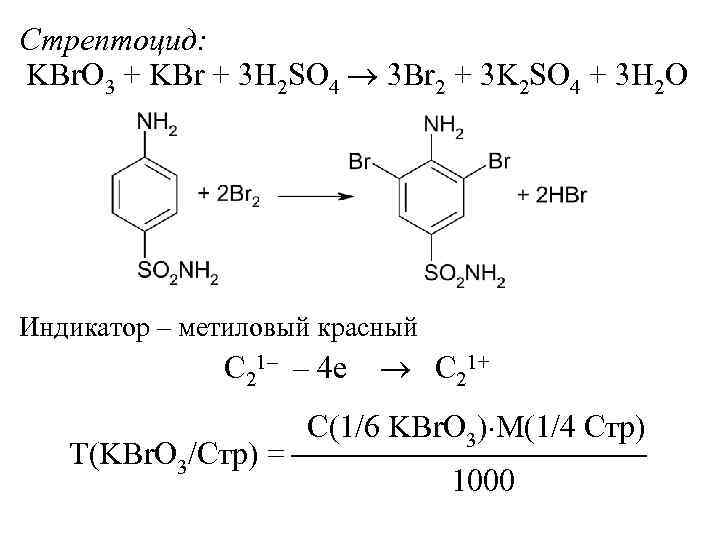
Стрептоцид: KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O Индикатор – метиловый красный C 21– – 4 е C 21+ С(1/6 KBr. O 3) М(1/4 Стр) Т(KBr. O 3/Стр) = 1000

Обратная бромометрия с иодометрическим окончанием применяется для количественного определения фенола, резорцина, кислоты салициловой, новокаина (реакция электрофильного замещения), изониазида (реакция окисления) и др. препаратов
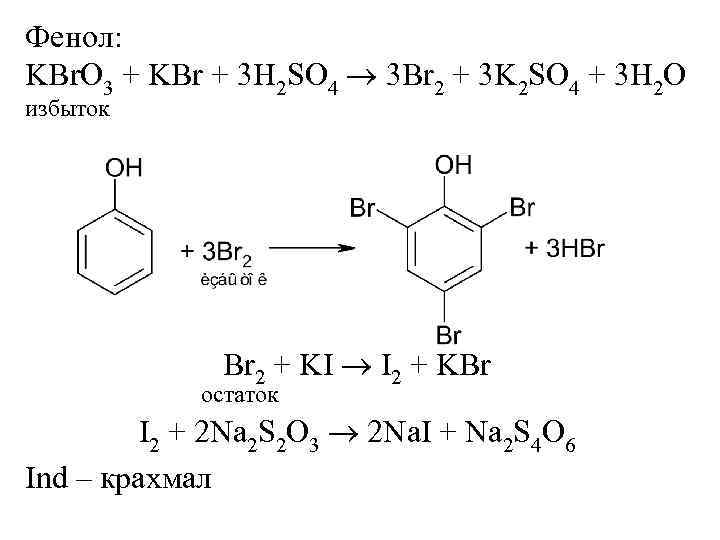
Фенол: KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O избыток Br 2 + KI I 2 + KBr остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 Ind – крахмал
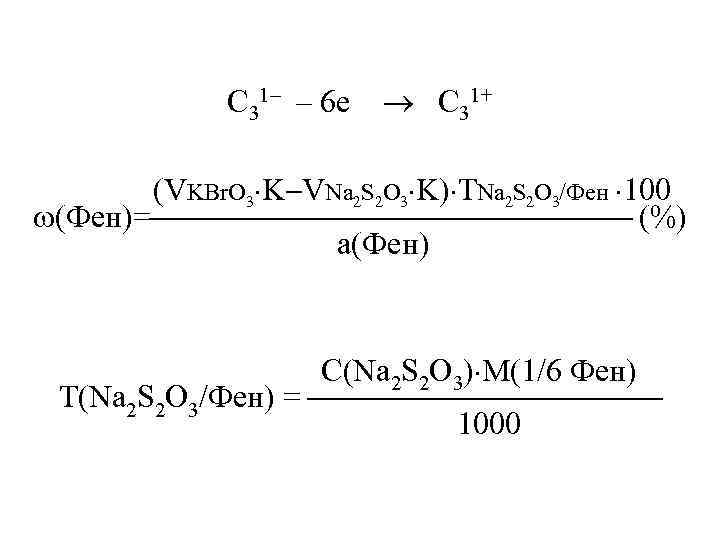
C 31– – 6 е C 31+ (VKBr. O 3 K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Фен 100 (Фен)= (%) а(Фен) С(Na 2 S 2 O 3) М(1/6 Фен) Т(Na 2 S 2 O 3/Фен) = 1000

Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3 К. О. K VNa 2 S 2 O 3 ОП K) ТNa 2 S 2 O 3/Фен 100 (Фен)= (%) а(Фен)
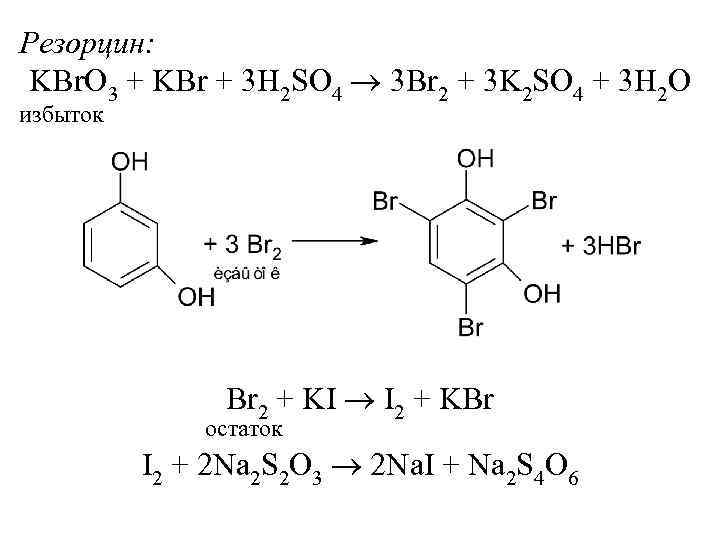
Резорцин: KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O избыток Br 2 + KI I 2 + KBr остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6

(VKBr. O 3 K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Рез 100 (Рез)= (%) а(Рез) С(Na 2 S 2 O 3) М(1/6 Рез) Т(Na 2 S 2 O 3/Рез) = 1000 Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3 К. О. K VNa 2 S 2 O 3 ОП K) ТNa 2 S 2 O 3/Рез 100 (Рез)= (%) а(Рез)
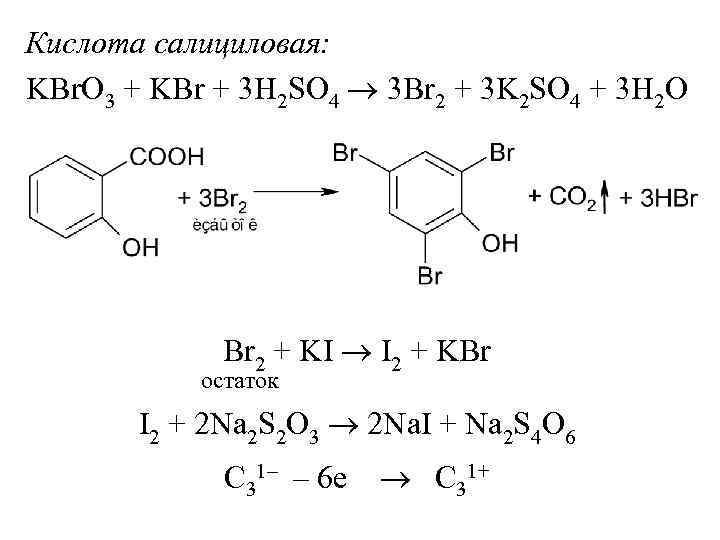
Кислота салициловая: KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O Br 2 + KI I 2 + KBr остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 C 31– – 6 е C 31+

(VKBr. O 3 K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Сал 100 (Сал)= (%) а(Сал) С(Na 2 S 2 O 3) М(1/6 Сал) Т(Na 2 S 2 O 3/Сал) = 1000 Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3 К. О. K VNa 2 S 2 O 3 ОП K) ТNa 2 S 2 O 3/Сал 100 (Сал)= (%) а(Сал)
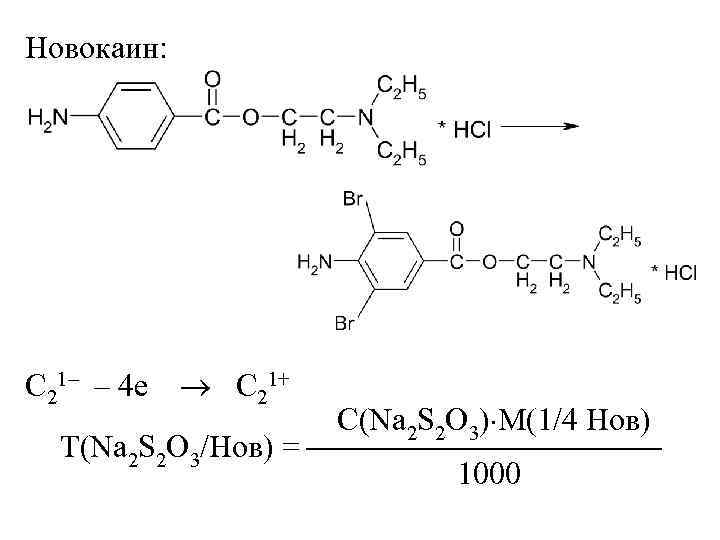
Новокаин: C 21– – 4 е C 21+ С(Na 2 S 2 O 3) М(1/4 Нов) Т(Na 2 S 2 O 3/Нов) = 1000
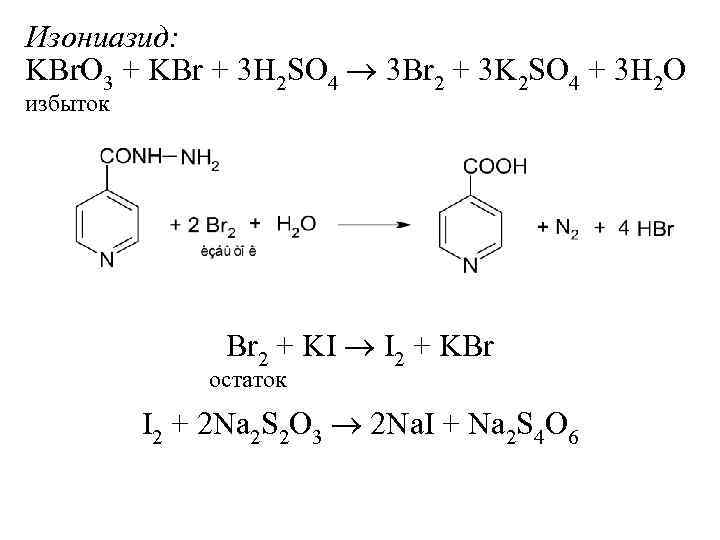
Изониазид: KBr. O 3 + KBr + 3 H 2 SO 4 3 Br 2 + 3 K 2 SO 4 + 3 H 2 O избыток Br 2 + KI I 2 + KBr остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6

N 22– – 4 е N 20 С(Na 2 S 2 O 3)·M(1/4 Изн) Т(Na 2 S 2 O 3/Изн) = ————— 1000 m(Изн) = (VKBr. O 3 K VNa 2 S 2 O 3 K) Т(Na 2 S 2 O 3/ Изн) (VKBr. O 3 K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Изн 100 (Изн)= (%) а (Изн)

Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3 К. О. K VNa 2 S 2 O 3 ОП K) ТNa 2 S 2 O 3/Изн 100 (Изн)= (%) а(Изн)

ИОДХЛОРМЕТРИЯ Титрант – 0, 1 М раствор йодмонохлорида ICl + 2 е I– + Cl– М(1/2 ICl) = М(ICl)/2 Приготовление: смешивают рассчитанное количество KI и KIO 3 в солянокислой среде и добавляют хлороформ 2 KI + KIO 3 + 6 HCl 3 ICl + 3 KCl + 3 H 2 O

Если хлф. слой – фиолетовый избыток I– KI + ICl I 2 + KCl по каплям добавляют KIO 3 до обесцвечивания хлф. слоя Если хлф. слой – бесцветный м. б. избыток IO 3– по каплям добавляют KI до слабо-розовой окраски хлф. слоя

Стандартизацию раствора ICl проводят по стандартному раствору тиосульфата натрия: ICl + KI I 2 + KCl I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 С(Na 2 S 2 O 3)пр V(Na 2 S 2 O 3) С(1/2 ICl)практ = V(ICl) С(1/2 ICl)пр K = С(1/2 ICl)теор

Прямая иодхлорметрия применяется для количественного анализа восстановителей: кислоты аскорбиновой, гидразина и его производных и т. д.
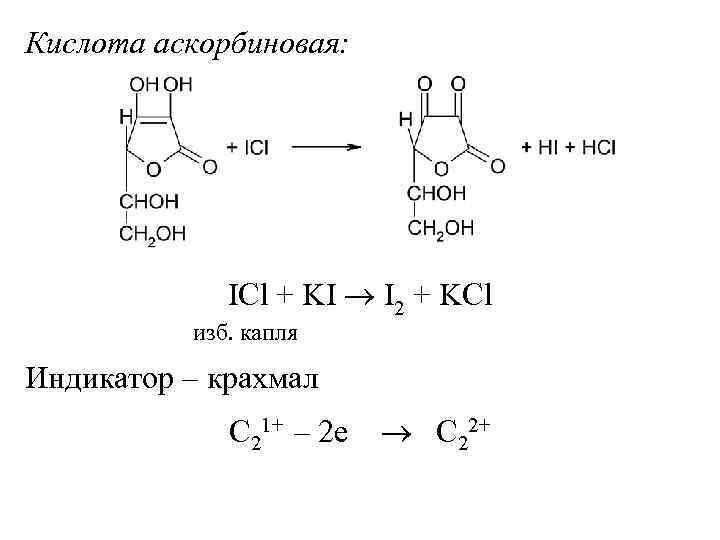
Кислота аскорбиновая: ICl + KI I 2 + KCl изб. капля Индикатор – крахмал C 21+ – 2 е C 22+

m(Аск) = V(ICl)·K·T(ICl /Аск) V(ICl)·K·T(ICl /Аск)· 100 (Аск) = ——————, % а(Аск) С(1/2 ICl)·M(1/2 Аск) Т(ICl /Аск) = ————— 1000

Обратная иодхлорметрия применяется для количественного определения антипирина , фенола, резорцина, кислоты салициловой, стрептоцида и др.

Антипирин: ICl + KI I 2 + KCl остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 C 1– – 2 е C 1+

(VICl K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Ант 100 (Ант)= (%) а(Ант) С(Na 2 S 2 O 3) М(1/2 Ант) Т(Na 2 S 2 O 3/Ант) = 1000

Фенол: ICl + KI I 2 + KCl остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 C 31– – 6 е C 31+
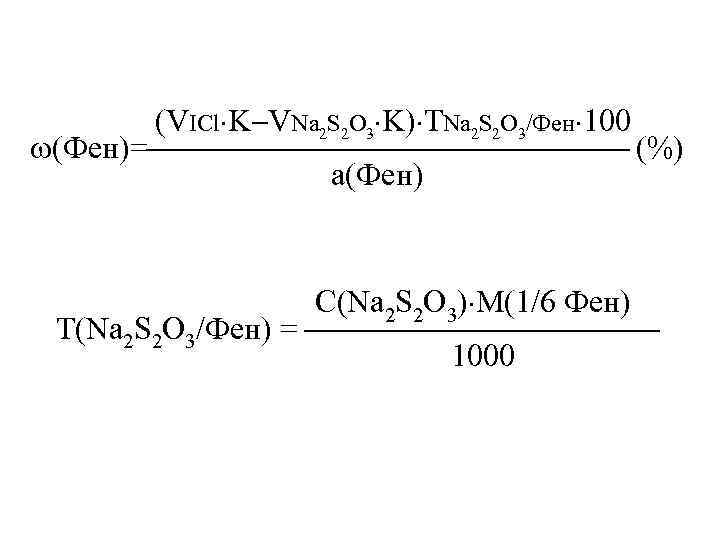
(VICl K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Фен 100 (Фен)= (%) а(Фен) С(Na 2 S 2 O 3) М(1/6 Фен) Т(Na 2 S 2 O 3/Фен) = 1000
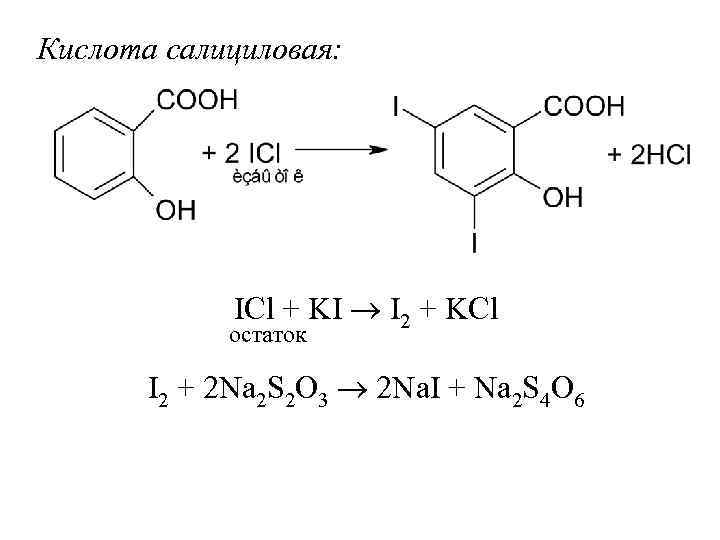
Кислота салициловая: ICl + KI I 2 + KCl остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6

(VICl K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Сал 100 (Сал)= (%) а(Сал) С(Na 2 S 2 O 3) М(1/4 Сал) Т(Na 2 S 2 O 3/Сал) = 1000 Если параллельно проводится контрольный опыт: (VNa 2 S 2 O 3 К. О. K VNa 2 S 2 O 3 ОП K) ТNa 2 S 2 O 3/Сал 100 (Сал)= (%) а(Сал)
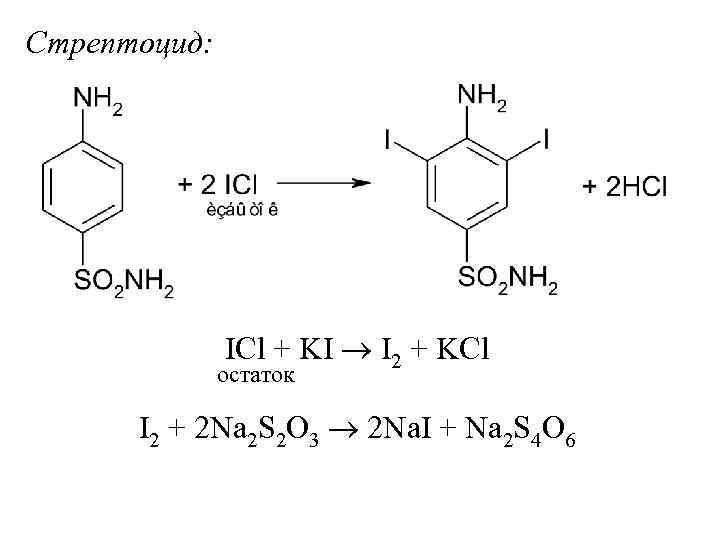
Стрептоцид: ICl + KI I 2 + KCl остаток I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6
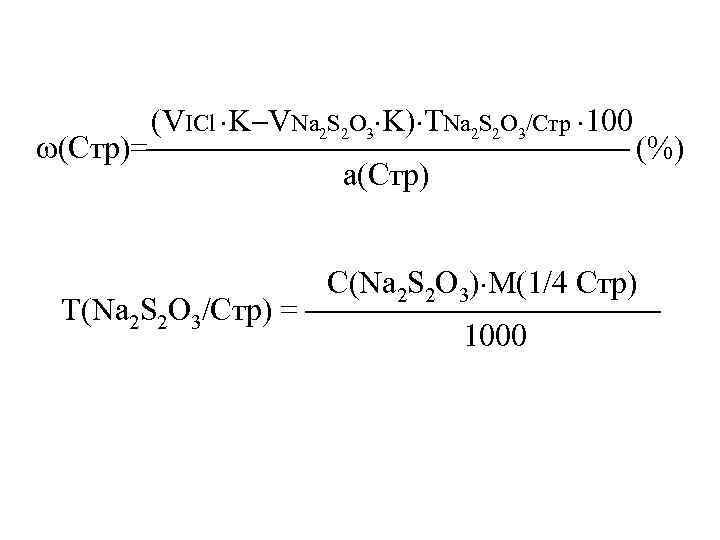
(VICl K VNa 2 S 2 O 3 K) ТNa 2 S 2 O 3/Стр 100 (Стр)= (%) а(Стр) С(Na 2 S 2 O 3) М(1/4 Стр) Т(Na 2 S 2 O 3/Стр) = 1000

ИОДАТОМЕТРИЯ Титрант – 0, 1 М раствор иодата калия KIO 3 Можно приготовить по точной навеске IO 3 + 6 H+ + 6ē I + 3 H 2 O М(1/6 KIO 3) = М(KIO 3)/6 Прямая иодатометрия применяется для к. о. кислоты аскорбиновой:
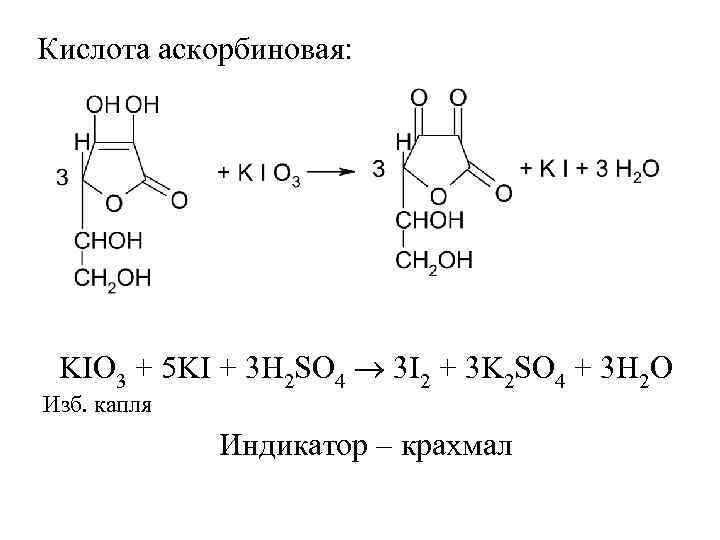
Кислота аскорбиновая: KIO 3 + 5 KI + 3 H 2 SO 4 3 I 2 + 3 K 2 SO 4 + 3 H 2 O Изб. капля Индикатор – крахмал
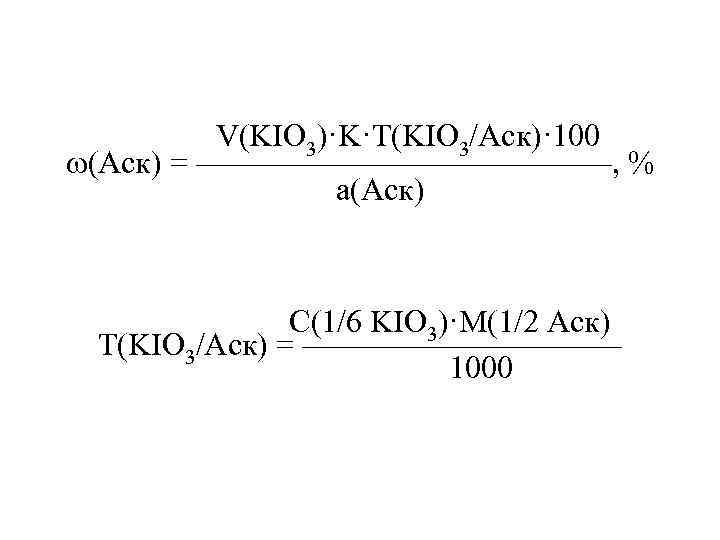
V(KIO 3)·K·T(KIO 3/Аск)· 100 (Аск) = ———————, % а(Аск) С(1/6 KIO 3)·M(1/2 Аск) Т(KIO 3/Аск) = ————— 1000

ЦЕРИМЕТРИЯ Титрант – 0, 1 М и 0, 01 М сернокислые растворы Ce(SO 4)2 Ce 4+ + ē Ce 3+ Готовят титрант приблизительно нужной концентрации Стандартизация по тиосульфату натрия: 2 Ce(SO 4)2 + 2 KI I 2 + Ce 2(SO 4)3 + K 2 SO 4 I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6

В фарманализе прямая цериметрия применяется для к. . железа ( II ), аскорбиновой кислоты о викасола , токоферола ацетата и др. лекарственных препаратов. Железа(II) сульфат: 2 Fe. SO 4 + 2 Ce(SO 4)2 Fe 2(SO 4)3 + Ce 2(SO 4)3 С(Ce(SO 4)2)·M(Fe. SO 4) Т(Ce(SO 4)2/Fe. SO 4) = ————— 1000

Кислые растворы Ce(IV) окрашены в желто- оранжевый цвет Кислые растворы Ce(III) бесцветны Ind – ферроин, о-фенантролин, дифениламин и др.
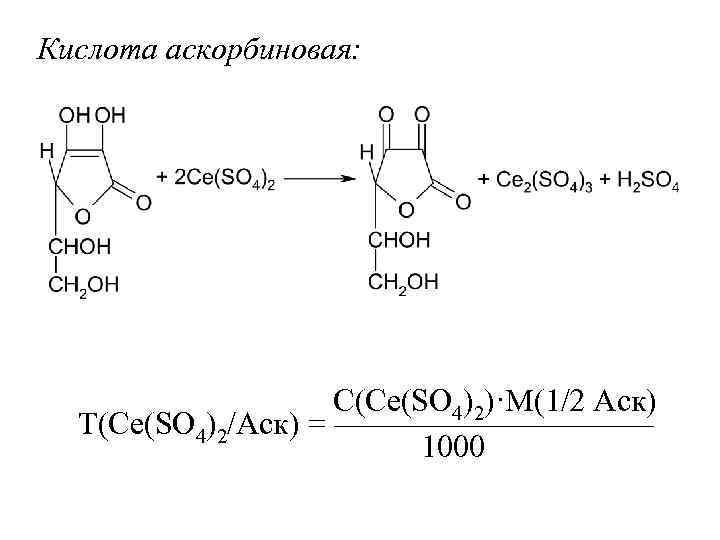
Кислота аскорбиновая: С(Ce(SO 4)2)·M(1/2 Аск) Т(Ce(SO 4)2/Аск) = ————— 1000

НИТРИТОМЕТРИЯ Титрант – 0, 1 М или 0, 05 М раствор Na. NO 2 + 2 H+ + ē NO + H 2 O М(Na. NO 2) = М(Na. NO 2)/1 Титрант готовят приблизительно нужной концентрации Стандартизация по сульфаниловой кислоте:

С(Слф)пр V(Слф) С(Na. NO 2)пр = V(Na. NO 2) С(Na. NO 2)пр K = С(Na. NO 2)теор

В фарманализе прямая нитритометрия применяется для к. . лек. препаратов, содер - о жащих первичную или вторичную аминогруп- п ы , для определения гидразидов , ароматичес - ких нитросоединений после предварительного восстановления нитрогруппы до аминогруп - пы.
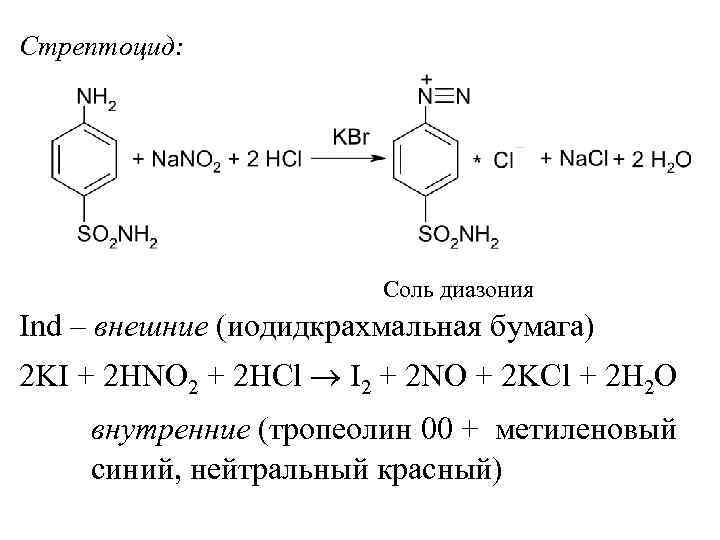
Стрептоцид: Соль диазония Ind – внешние (иодидкрахмальная бумага) 2 KI + 2 HNO 2 + 2 HCl I 2 + 2 NO + 2 KCl + 2 H 2 O внутренние (тропеолин 00 + метиленовый синий, нейтральный красный)

Особенности титрования: * KBr – катализатор * t < 15 -20 0 C (для предотвращения разложения соли диазония) • Титрование ведут медленно, при тщательном перемешивании, предварительно рассчитав теоретическую точку эквивалентности * Параллельно проводят контрольный опыт
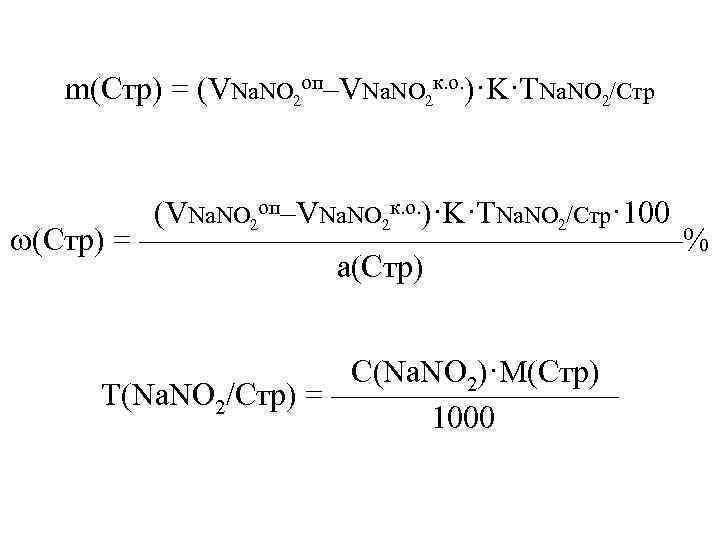
m(Стр) = (VNa. NO 2 оп–VNa. NO 2 к. о. )·K·TNa. NO 2/Стр (VNa. NO 2 оп–VNa. NO 2 к. о. )·K·TNa. NO 2/Стр· 100 (Стр) = —————————% а(Стр) С(Na. NO 2)·M(Стр) Т(Na. NO 2/Стр) = ————— 1000
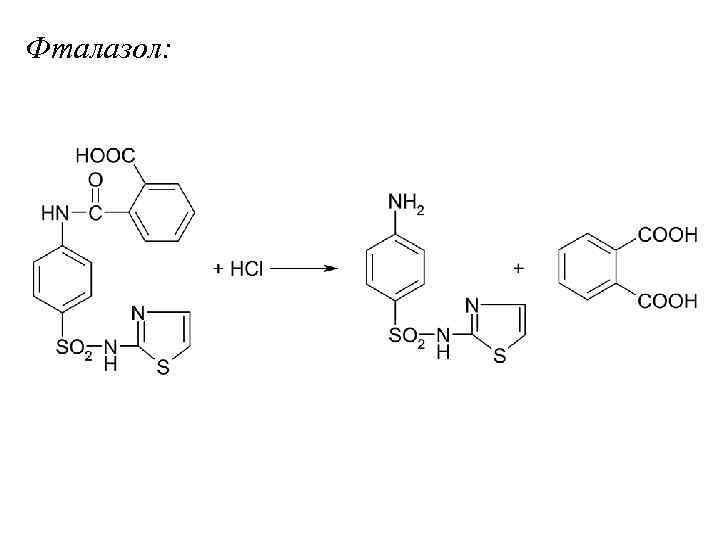
Фталазол:
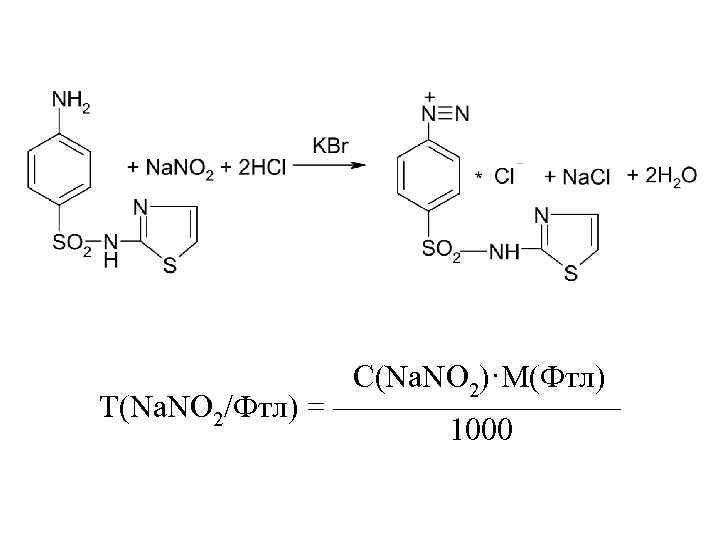
С(Na. NO 2)·M(Фтл) Т(Na. NO 2/Фтл) = ————— 1000

Левомицетин:
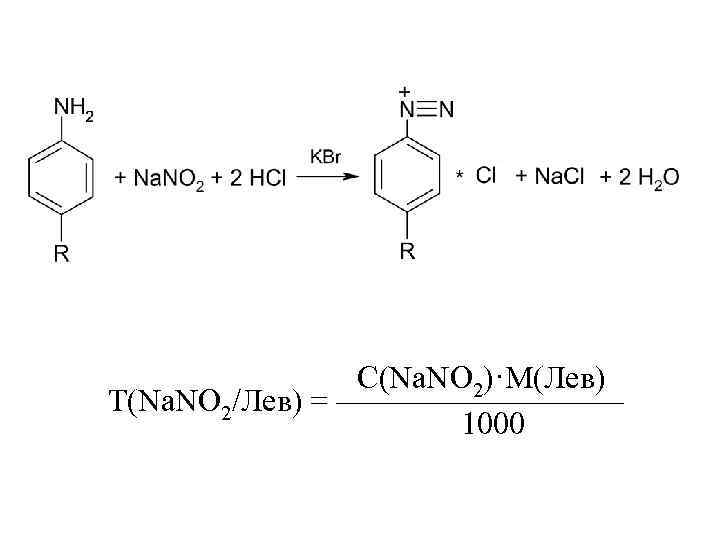
С(Na. NO 2)·M(Лев) Т(Na. NO 2/Лев) = ————— 1000

Дикаин: нитрозосоединение С(Na. NO 2)·M(Дик) Т(Na. NO 2/Дик) = ————— 1000
21. Другие виды ОВ титрования.ppt
- Количество слайдов: 52

