Лекция_15_Атом Бора.ppt
- Количество слайдов: 36

БОРОВСКАЯ ТЕОРИЯ АТОМА 1
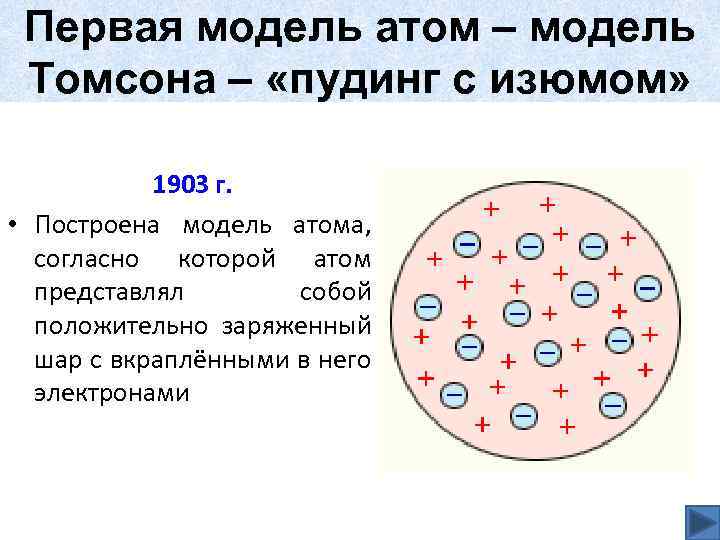
Первая модель атом – модель Томсона – «пудинг с изюмом» 1903 г. • Построена модель атома, согласно которой атом представлял собой положительно заряженный шар с вкраплёнными в него электронами
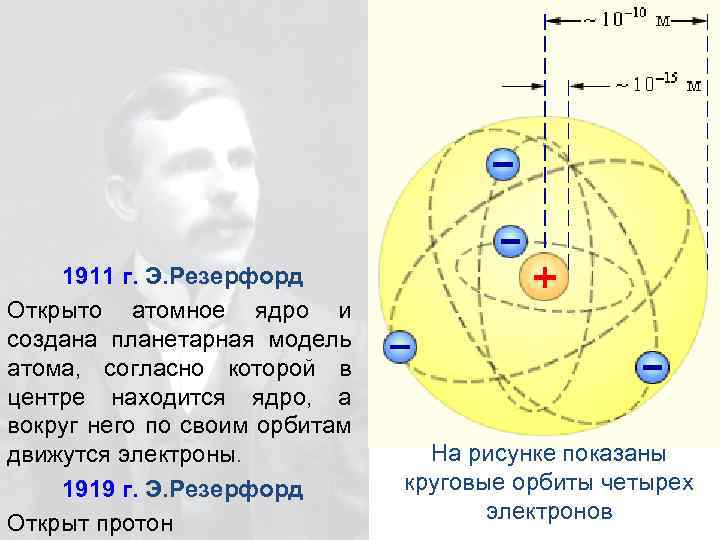
1911 г. Э. Резерфорд Открыто атомное ядро и создана планетарная модель атома, согласно которой в центре находится ядро, а вокруг него по своим орбитам движутся электроны. 1919 г. Э. Резерфорд Открыт протон На рисунке показаны круговые орбиты четырех электронов
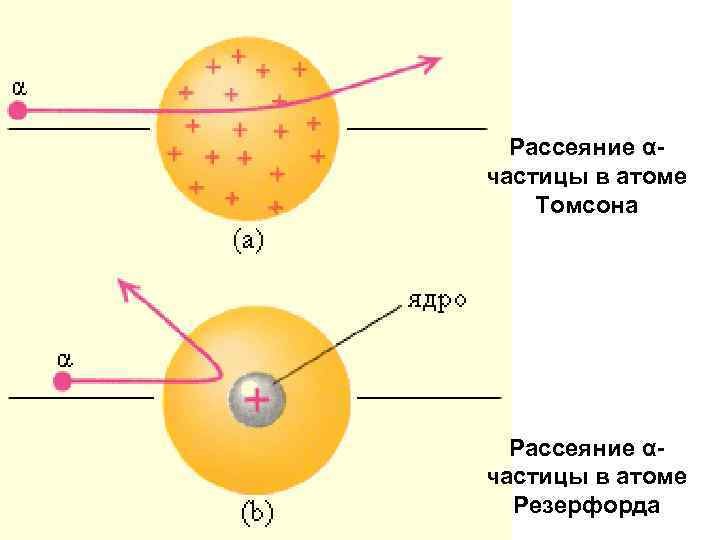
Рассеяние αчастицы в атоме Томсона Рассеяние αчастицы в атоме Резерфорда

Нильс Бор (1885 -1962) 1913 Усовершенствована планетарная модель атома водорода на основании постулатов Бора: • Электрон в атоме может двигаться по некоторым устойчивым орбитам без излучения. • Излучение (поглощение) энергии происходит при переходе электрона с одной стационарной орбиты на другую • Нобелевская премия 1922 г. hν e

Иллюстрация идеи де Бройля возникновения стоячих волн на стационарной орбите в боровской модели атома водорода для случая n = 4

Постулаты Бора • Из бесконечного множества электронных орбит осуществляются только некоторые, находясь на которых электрон, несмотря на то, что движется с ускорением, не излучает энергии • Излучение испускается и поглощается в виде светового кванта только при переходе электрона из одного стационарного состояния в другое: • Момент импульса электрона на стационарных орбитах может приобретать только значения, кратные постоянной Планка:

Радиус орбиты электрона в водородоподобном ионе Электрон на орбите движется в поле силы Кулона, созданном ядром атома. Согласно второму закону Ньютона Подставим выражение для силы Кулона и центростремительного ускорения

Радиус орбиты электрона в водородоподобном ионе Получаем: Из постулата о квантовании момента импульса выразим скорость электрона и подставим его в выражение:

Радиус орбиты электрона в водородоподобном ионе Сокращая, получаем: Откуда радиус орбиты с номером n:

Энергия электрона в водородоподобном ионе Энергия электрона слагается из его кинетической энергии движения по орбите и потенциальной энергии в поле ядра
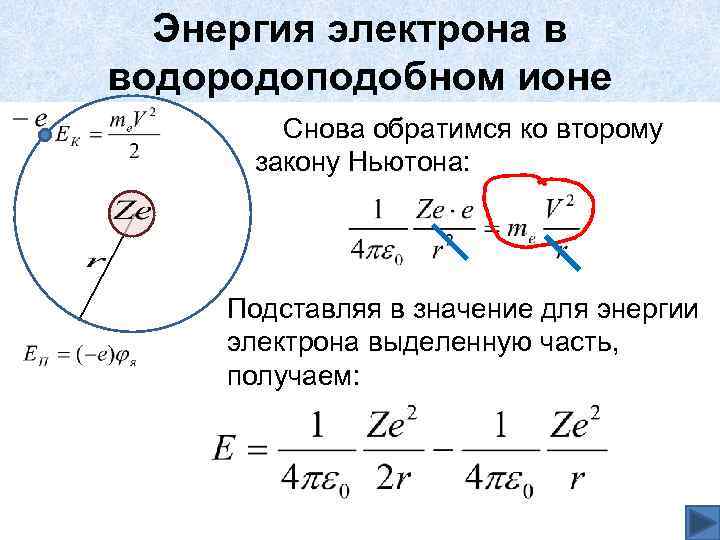
Энергия электрона в водородоподобном ионе Снова обратимся ко второму закону Ньютона: Подставляя в значение для энергии электрона выделенную часть, получаем:

Энергия электрона в водородоподобном ионе Упростим: и подставим полученное нами значение радиуса орбиты:

Энергия электрона в водородоподобном ионе Введем постоянную в законе Кулона Тогда выражение для энергии приобретает вид: В этих формулах n – главное квантовое число. Оно отвечает за размер электронного облака.

ВАЖНО Радиус орбиты пропорционален квадрату её номера (главного квантового числа) Энергия электрона на орбите обратно пропорциональна квадрату её номера (главного квантового числа)

Орбиты электрона и соответствующие им уровни энергии Серия Пашена, инфракрасная Серия Лаймана, ультрафиолет Серия Бальмера, видимая область Серия Пашена, инфракрасная Серия Бальмера, видимая область Серия Лаймана, ультрафиолет

Особенности, характерные для любой серии Стрелка вверх– фотон поглощается Головная линия серии Этой линии соответствует минимальная энергия перехода, и, соответственно, минимальная частота Этой линии соответствует максимальная энергия перехода, и, соответственно, максимальная частота, но минимальная длина волны излучения Стрелка вниз – фотон излучается
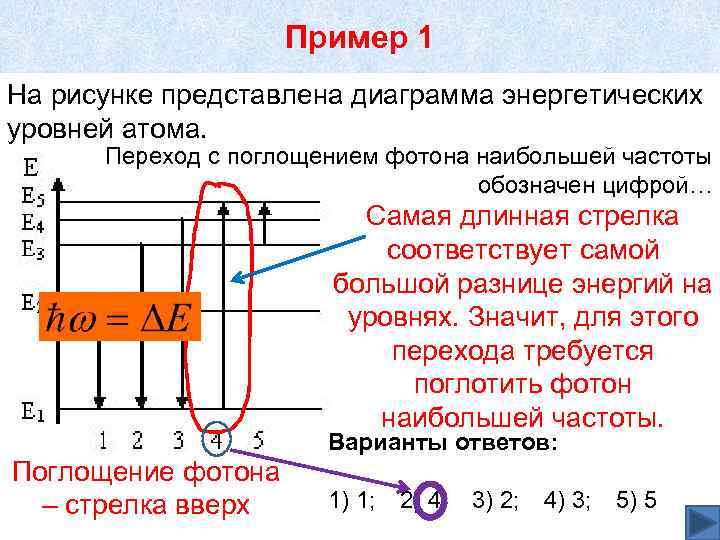
Пример 1 На рисунке представлена диаграмма энергетических уровней атома. Переход с поглощением фотона наибольшей частоты обозначен цифрой… Самая длинная стрелка соответствует самой большой разнице энергий на уровнях. Значит, для этого перехода требуется поглотить фотон наибольшей частоты. Варианты ответов: Поглощение фотона – стрелка вверх 1) 1; 2) 4; 3) 2; 4) 3; 5) 5

Пример 2 На рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а также условно изображены переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена. Наибольшей частоте кванта в серии Лаймана соответствует переход… Серия Лаймана – УФ, то есть самые высокоэнергетичные кванты из перечисленных, то есть самые длинные стрелки. Наибольшая частота – аналогично.

Квантовые числа При изучении спектральных линий в приборах высокого разрешения выяснилось, что каждому номеру n орбиты (каждому главному квантовому числу) соответствует n подуровней. Эти подуровни обозначают символом l. Это – побочное, или орбитальное квантовое число. Орбитальное квантовое число может меняться от 0 до n-1, но его принято обозначать буквами s, p, d, f, … Главное квантовое число n Значения орбитального квантового числа l 1 2 3 4 5 0 0; 1; 2; 3; 4 s s; p; d; f; g

Квантовые числа Орбитальное квантовое число отвечает за форму орбиты и, соответственно, за орбитальный момент импульса электрона
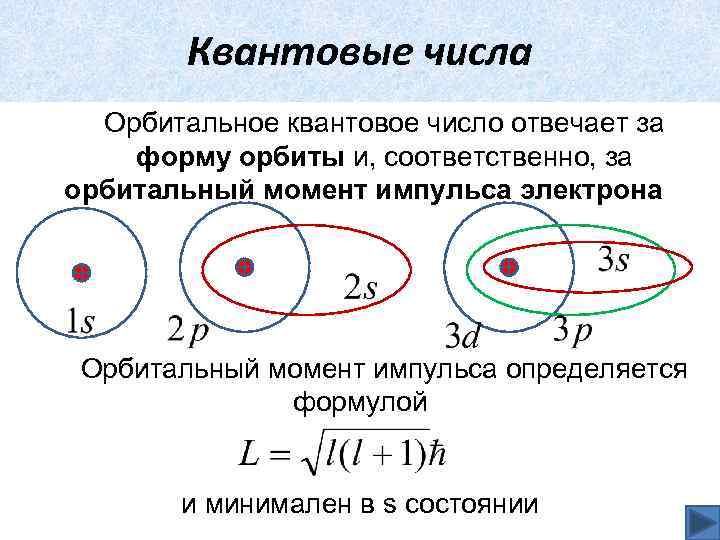
Квантовые числа Орбитальное квантовое число отвечает за форму орбиты и, соответственно, за орбитальный момент импульса электрона Орбитальный момент импульса определяется формулой и минимален в s состоянии

Квантовые числа Движение электрона по орбите представляет собой ток, а значит существует орбитальный магнитный момент. Этот магнитный момент может быть по разному ориентирован в пространстве. Каждой ориентации орбитального магнитного момента отвечает своё магнитное квантовое число m. Каждому значению орбитального квантового числа l соответствует свой набор значений магнитного квантового числа m в интервале (-l… 0…l)

Квантовые числа и соответствующие состояния n l Обозначение состояния 1 0 1 s 0 0 2 s 0 1 2 p -1; 0; 1 0 3 s 0 1 3 p -1; 0; 1 2 3 d -2; -1; 0; 1; 2 2 3 m

Квантовые числа и соответствующие состояния n l Обозначение состояния m 1 0 1 s 0 0 2 s 0 1 2 p -1; 0; 1 0 3 s 0 1 3 p -1; 0; 1 2 3 d -2; -1; 0; 1; 2 2 3 Каждому значению орбитального квантового числа n соответствует n 2 значений магнитного квантового числа m и, соответственно, n 2 значений энергии (без учёта спина). Говорят, что уровень энергии n вырожден n 2 раз
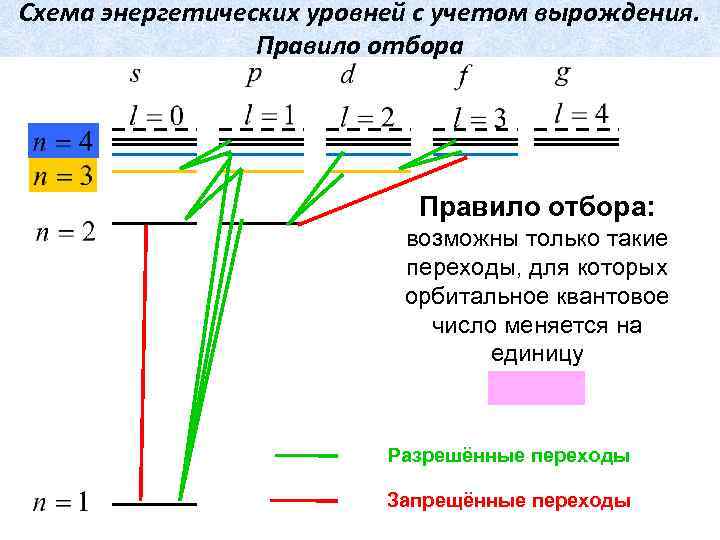
Схема энергетических уровней с учетом вырождения. Правило отбора: возможны только такие переходы, для которых орбитальное квантовое число меняется на единицу Разрешённые переходы Запрещённые переходы
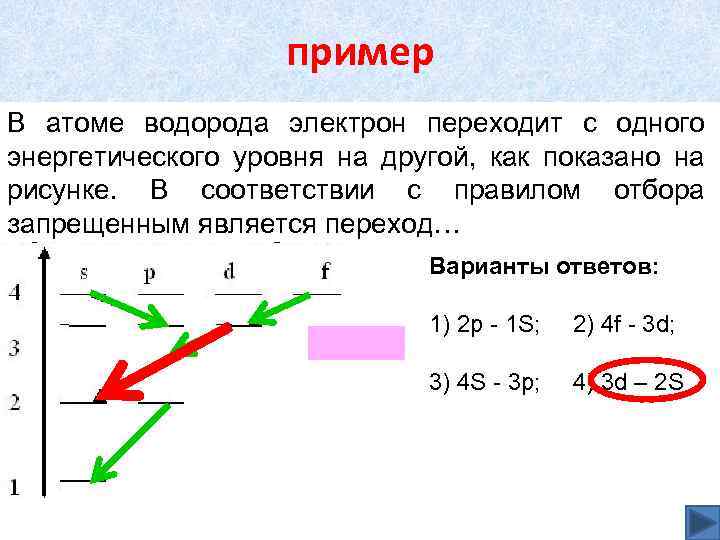
пример В атоме водорода электрон переходит с одного энергетического уровня на другой, как показано на рисунке. В соответствии с правилом отбора запрещенным является переход… Варианты ответов: 1) 2 р - 1 S; 2) 4 f - 3 d; 3) 4 S - 3 p; 4) 3 d – 2 S

ПРИМЕР Установить соответствие квантовых чисел, определяющих волновую функцию электрона в атоме водорода, их физическому смыслу. 1 Варианты ответов: 1) 1 -Г, 2 -Б, 3 -А; 2) 1 -В, 2 -А, 3 -Г; 3) 1 -А, 2 -Б, 3 -В; 4) 1 -В, 2 -Б, 3 -А

Распределение электронов по энергетическим уровням. Оболочки. Правило Паули: В одном и том же атоме не может быть двух электронов, обладающих одинаковой совокупностью всех четырёх квантовых чисел. Совокупность электронов, обладающих одинаковым значением главного квантового числа n, называется оболочкой (иногда - слоем). Значение n 1 2 3 4 5 6 7 Обозначение оболочки K L M N O P Q … …

Заполнение оболочек Оболочка n l m K 1 0 (s) 0 1 (p) -1 0 +1 2 (d) -2 -1 0 +1 +2 L M 2 3 s (ms)

ПРИМЕР Оболочка n l K 1 0 (s) В К оболочке р-электронов нет 0 (s) L 2 1 (p) m s (ms) 0 0 -1 0 +1 В атоме K и L оболочки заполнены полностью. Общее число p-электронов в атоме… Варианты ответов: 1)2; 2)4; 3)10; 4)8; 5)6

Ключевые понятия и выводы Атом Бора-Резерфорда • Из бесконечного множества электронных орбит осуществляются только некоторые, находясь на которых электрон не излучает энергии; • Излучение испускается и поглощается в виде светового кванта только при переходе электрона из одного стационарного состояния в другое • Момент импульса электрона на стационарных орбитах может приобретать только значения, кратные постоянной Планка: 32

Ключевые понятия и выводы Квантовые числа • Главное квантовое число n отвечает за размер орбиты (электронного облака) • Орбитальное квантовое число l отвечает за форму орбиты • Магнитное квантовое число m отвечает за ориентацию орбиты в пространстве 33

Ключевые понятия и выводы Квантовые переходы • Правило отбора: возможны только такие переходы, для которых орбитальное квантовое число меняется на единицу 34

Ключевые формулы Формула Название Боровское условие квантования момента импульса Энергия электрона в поле ядра складывается из кинетической и потенциальной энергий 35

36
Лекция_15_Атом Бора.ppt