biochem lecture1.ppt
- Количество слайдов: 38

БИОХИМИЯ Занятие 1







СO 2




Воспоминания о химии

Строение атома m(p+)=1, 67*10 -27 кг m(е-)=9, 1*10 -31 кг R=1 -2 ˚ A 1 ангстрем=10 -10 м

Поведение электронов в атоме… чрезвычайно странно 1) Принцип квантования энергии 2) Корпускулярно-волновой дуализм 3) Принцип неопределённости Гейзенберга

Орбитали – откуда они берутся Атомная орбиталь – одно из многих возможных состояний электрона в атоме. Молекулярная орбиталь – одно из многих возможных состояний электрона в молекуле. Главное квантовое число (n) может принимать любые целочисленные положительные значения: n = 1, 2, 3, …, Орбитальное квантовое число (l) может принимать любые целочисленные значения от нуля до n – 1: l = 0, 1, 2, … , (n – 1). Магнитное квантовое число (m) может принимать любые целочисленные значения от – l до + l, включая ноль: m = – l, … , – 1, 0, +1, … , + l.

Наборы значений квантовых чисел для различных АО n l m Число АО Обозначение АО 1 0 0 Одна 1 s 2 0 1 0 – 1, 0, 1 Одна Три 2 s 2 p 3 0 1 2 0 – 1, 0, 1 – 2, – 1, 0, 1, 2 Одна Три Пять 3 s 3 р 3 d 4 0 1 2 3 0 – 1, 0, 1 – 2, – 1, 0, 1, 2 – 3, – 2, – 1, 0, 1, 2, 3 Одна Три Пять Семь 4 s 4 p 4 d 4 f

«Форма» атомных орбиталей

«Форма» атомных орбиталей


Заполнение орбиталей электронами Законы заполнения АО электронами Принцип наименьшей энергии: суммарная энергия всех электронов атома, находящегося в основном состоянии, минимальна. Принцип Паули: в атоме не может быть даже двух электронов со всеми четырьмя одинаковыми квантовыми числами. Правило Хунда: в пределах подуровня электроны распределяются по орбиталям таким образом, чтобы модуль суммы их спиновых квантовых чисел был максимальным.

И приснится же такое!
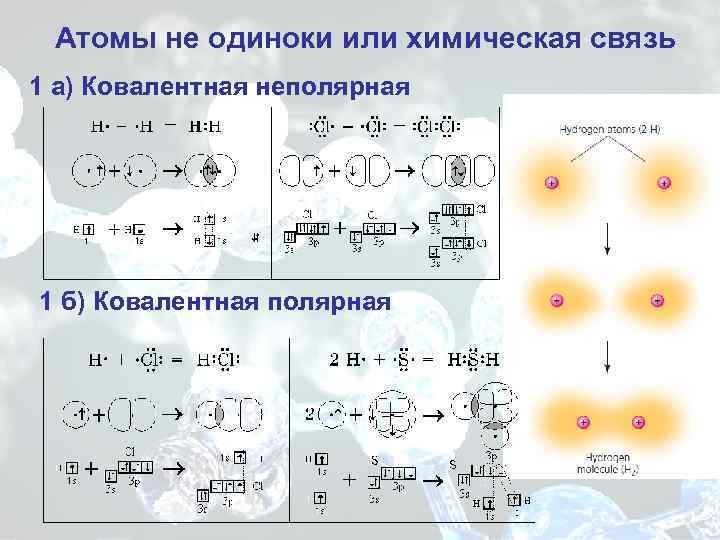
Атомы не одиноки или химическая связь 1 а) Ковалентная неполярная 1 б) Ковалентная полярная

Атомы не одиноки или химическая связь 2) Ионная Ионы – заряженные аналоги атомов и молекул Катионы – положительно заряженные ионы Анионы – отрицательно заряженные ионы.

Атомы не одиноки или химическая связь 2) Ионная

Атомы не одиноки или химическая связь 3) Водородная

Вода – основной растворитель в живых системах

Вода – основной растворитель в живых системах

Вода – основной растворитель в живых системах

Вода – основной растворитель в живых системах

Вода – основной растворитель в живых системах Когезия и адгезия

Вода – основной растворитель в живых системах Вода обладает высокой теплоёмкостью Вода образует водородные связи с другими молекулами

Вода – основной растворитель в живых системах Молекулы воды взаимодействуют электростатически с ионами, гидратация

Вода – основной растворитель в живых системах Молекулы воды взаимодействуют электростатически с ионами, гидратация

Вода – основной растворитель в живых системах Вещества по растворимости в воде Гидрофильные Гидрофобные Частный случай более общего правила! Все вещества Полярные Неполярные ПОДОБНОЕ РАСТВОРЯЕТСЯ В ПОДОБНОМ

Вода – основной растворитель в живых системах

Вода – основной растворитель в живых системах


Литература С. Т. Жуков «Экспериментальный учебник по химии» http: //www. chem. msu. ru/rus/school/zhukov 1/welcome. html http: //www. chem. msu. ru/rus/school/zhukov/welcome. html Марри, Греннер «Биохимия человека» 2 тома
biochem lecture1.ppt