Соединит. ткань.ppt
- Количество слайдов: 50

Биохимия соединительной ткани

Примеры заболеваний соединительной ткани (коллагенозы) 1. Ревматизм 2. Склеродермия 3. Полиартрит 4. Волчанка 5. Остеопороз

Биологическая роль соединительной ткани. 1. Опорная функция (сухожилия, связки, хрящи, костная ткань и т. д. ); 2. Барьерная функция; 3. Депонирующая функция; 4. Метаболическая функция; 5. Репаративная функция;

Схема строения соединительной ткани (I- тучная клетка; II-ретикулярные волокна; III-эластическое волокно; IV -коллагеновые волокна V- фибробласт) V

химические компоненты соединительной ткани

- коллагеновые волокна - ретикулиновые волокна - эластические волокна - аморфное вещество - клеточные элементы

Строение коллагена

Особенности химического состава и строения белка - коллагена 1. Наличие “необычных” аминокислот; 2. Избыток аминокислот: глицин (30%), глютаминовая к -та (10%), пролин (!0%), оксипролин (8%), оксилизин (2%); 3. Высокое содержание аминокислот с гидрофобными радикалами. Белок коллаген не растворим в воде; 4. Фибриллярное строение белка; 5. Соединение макромолекул тропоколлагена частично происходит за счет электростатических сил фибриллы приобретают свойства пьезоэлемента.
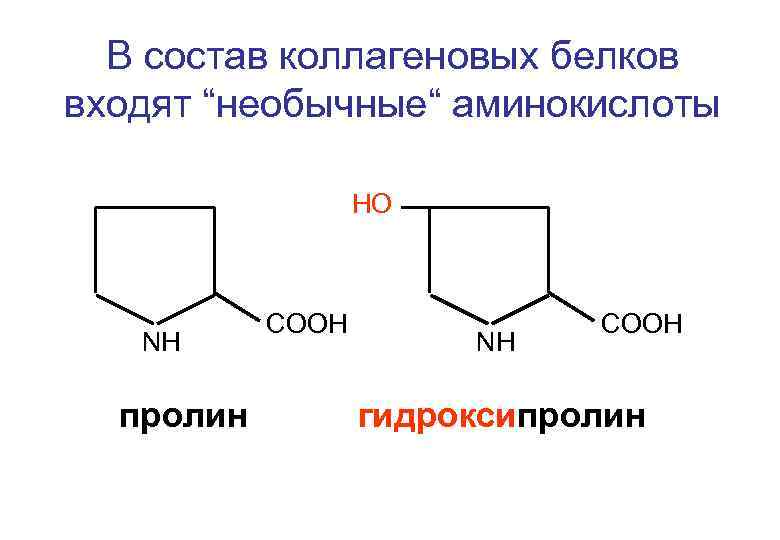
В состав коллагеновых белков входят “необычные“ аминокислоты НО NH пролин СООН NH СООН гидроксипролин
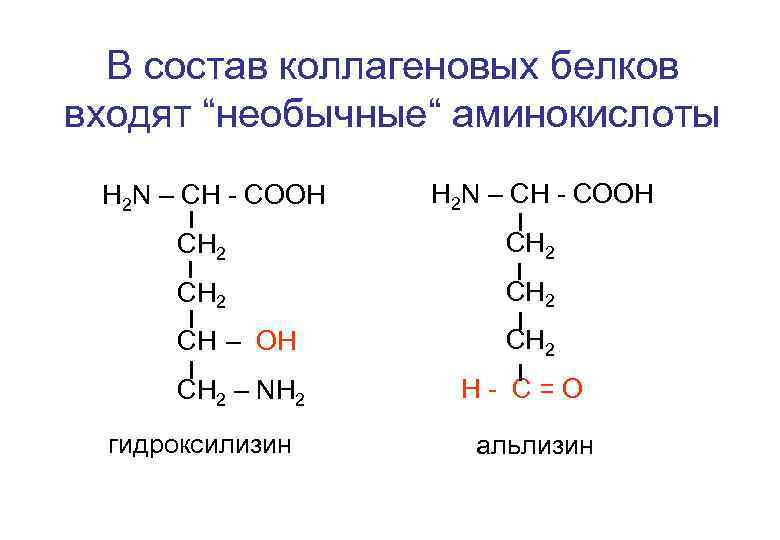
В состав коллагеновых белков входят “необычные“ аминокислоты Н 2 N – CH - COOH CH 2 CH – OH CH 2 – NH 2 гидроксилизин H- C=O альлизин

Синтез коллагена в клетке фибробласта
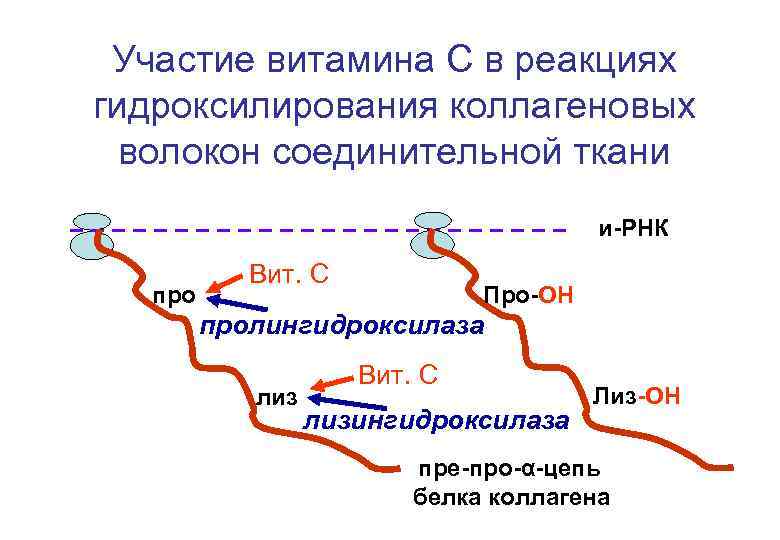
Участие витамина С в реакциях гидроксилирования коллагеновых волокон соединительной ткани и-РНК про Вит. С Про-ОН пролингидроксилаза лиз Вит. С лизингидроксилаза Лиз-ОН пре-про-α-цепь белка коллагена
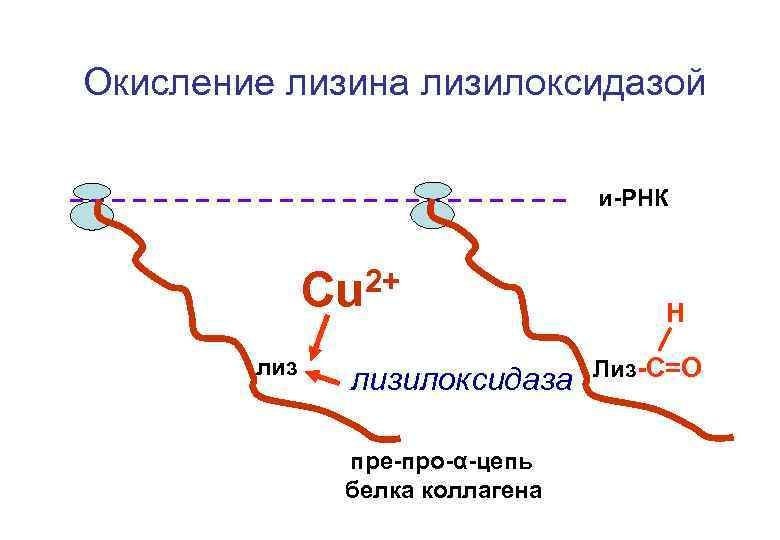
Окисление лизина лизилоксидазой и-РНК 2+ Cu лизилоксидаза пре-про-α-цепь белка коллагена Н Лиз-С=О
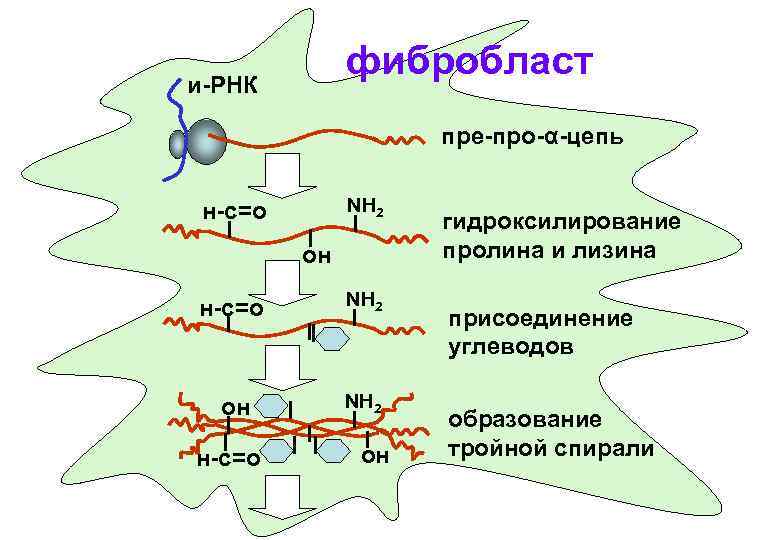
фибробласт и-РНК пре-про-α-цепь NH 2 н-с=о он н-с=о NH 2 он NH 2 н-с=о он гидроксилирование пролина и лизина присоединение углеводов образование тройной спирали
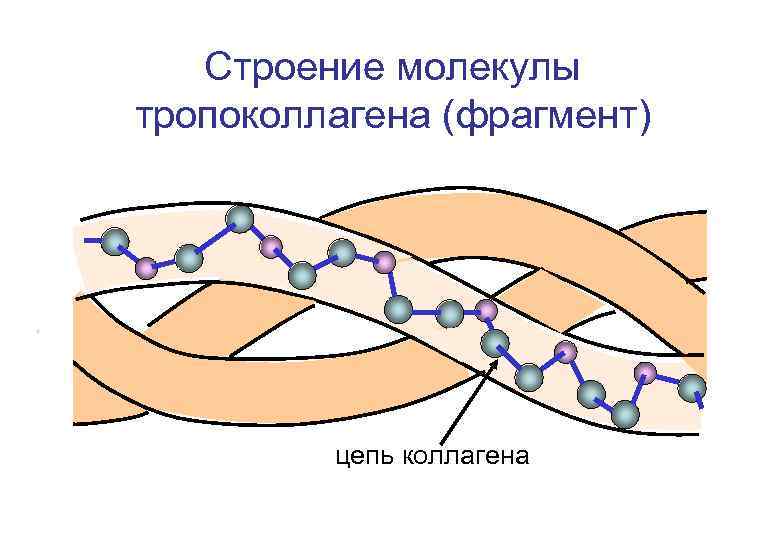
Строение молекулы тропоколлагена (фрагмент) цепь коллагена
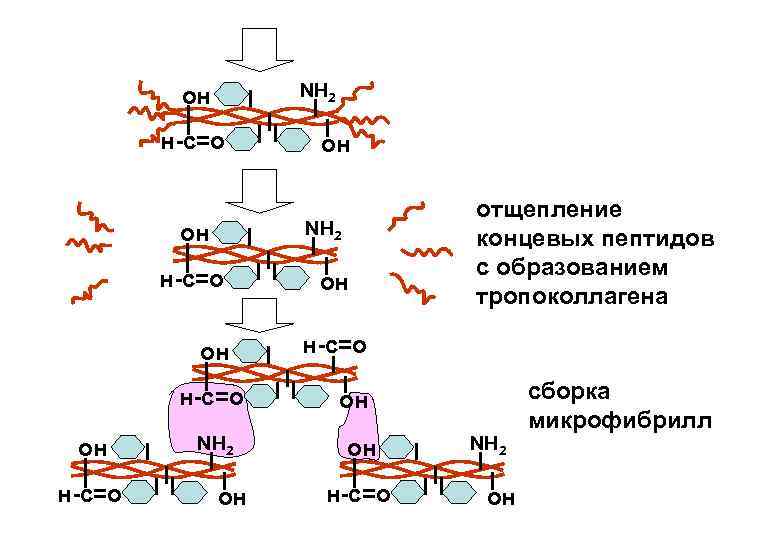
NH 2 он н-с=о он NH 2 он он отщепление концевых пептидов с образованием тропоколлагена н-с=о он он н-с=о NH 2 он сборка микрофибрилл
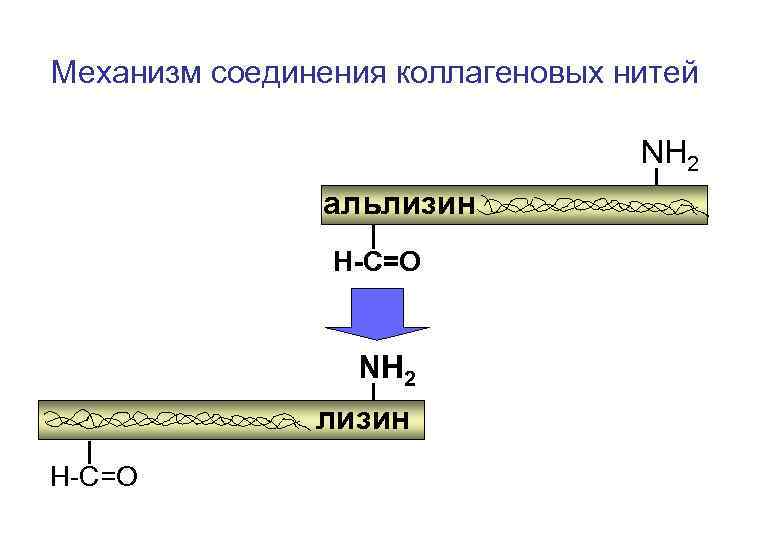
Механизм соединения коллагеновых нитей NH 2 альлизин H-C=O NH 2 лизин H-C=O
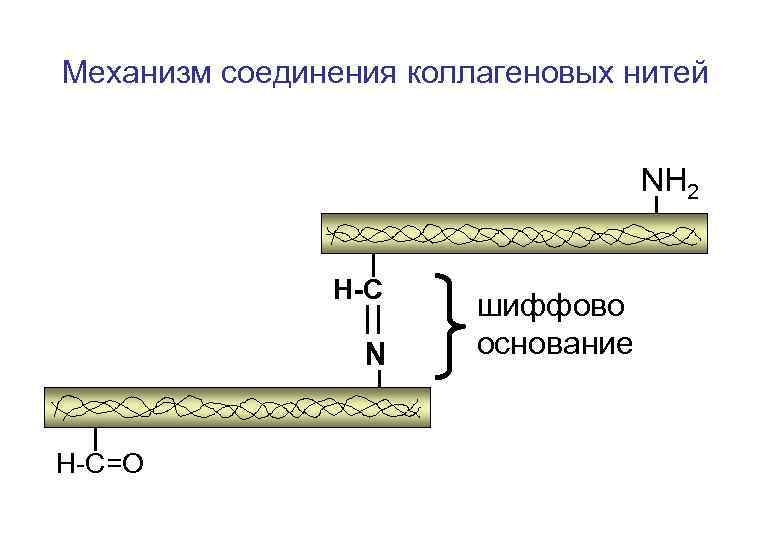
Механизм соединения коллагеновых нитей NH 2 H-C N H-C=O шиффово основание
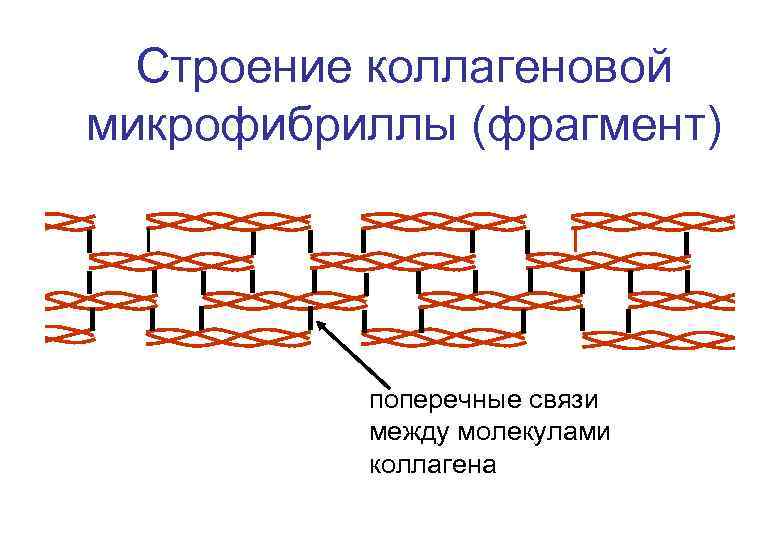
Строение коллагеновой микрофибриллы (фрагмент) поперечные связи между молекулами коллагена
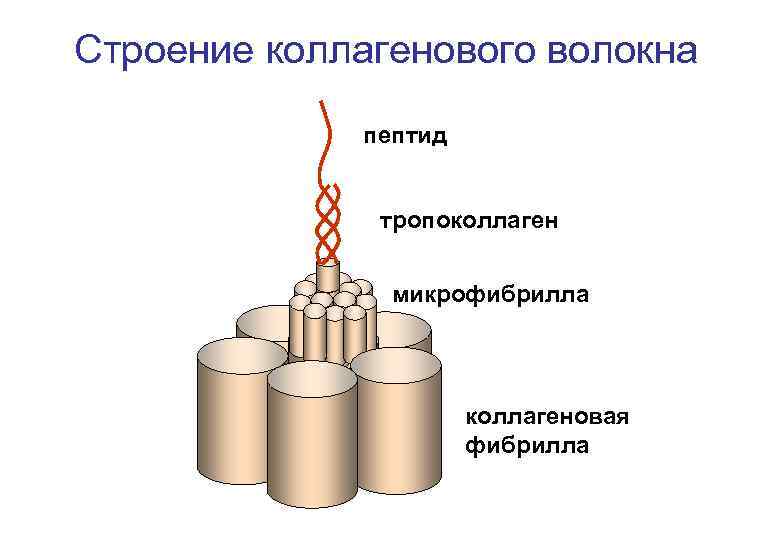
Строение коллагенового волокна пептид тропоколлаген микрофибрилла коллагеновая фибрилла
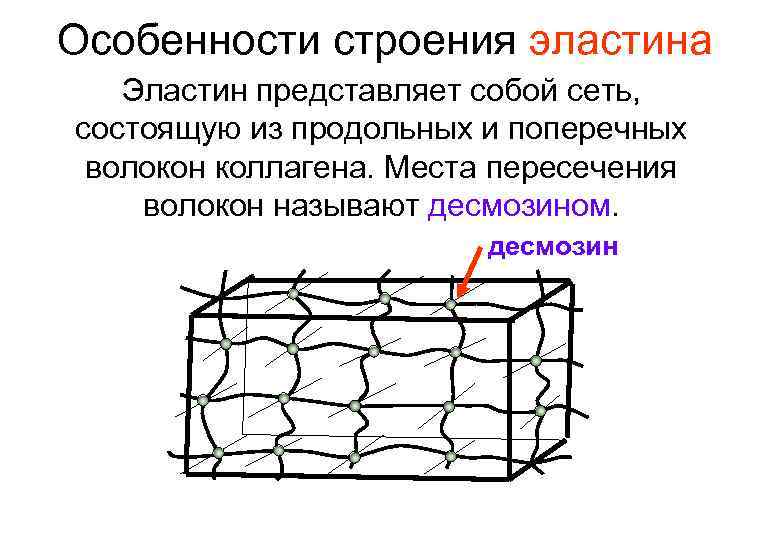
Особенности строения эластина Эластин представляет собой сеть, состоящую из продольных и поперечных волокон коллагена. Места пересечения волокон называют десмозином. десмозин
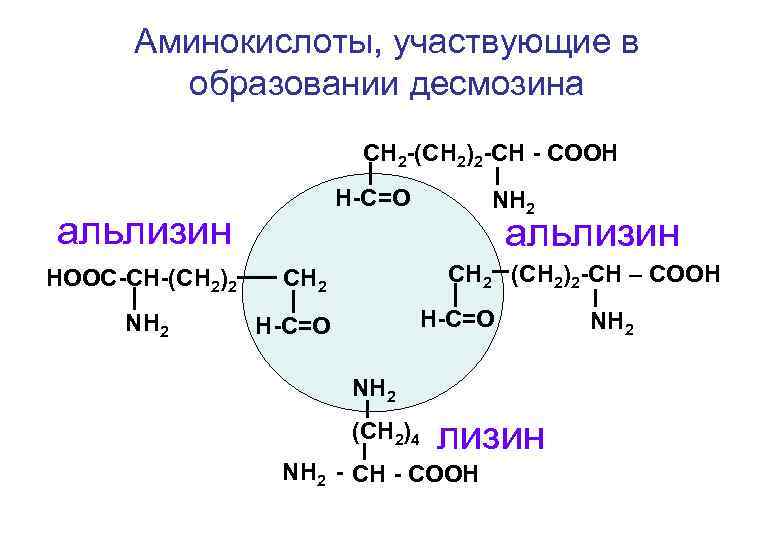
Аминокислоты, участвующие в образовании десмозина СН 2 -(СН 2)2 -СН - СООН Н-С=О альлизин НООС-СН-(СН 2)2 NН 2 альлизин СН 2 (СН 2)2 -СН – СООН СН 2 Н-С=О NН 2 (СН 2)4 лизин NН 2 - СН - СООН NН 2
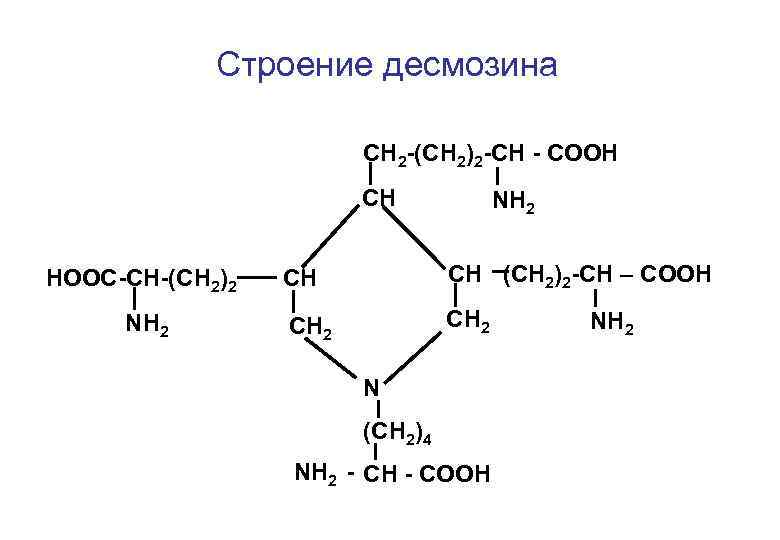
Строение десмозина СН 2 -(СН 2)2 -СН - СООН СН НООС-СН-(СН 2)2 NН 2 СН СН (СН 2)2 -СН – СООН СН 2 N (СН 2)4 NН 2 - СН - СООН NН 2

Неколлагеновые белки соединительной ткани 1. белковые компоненты гликопротеинов и протеогликанов; 2. белки клеток соединительной ткани; 3. белки сыворотки крови.

Бесструктурные компоненты соединительной ткани – гликопротеины и протеогликаны
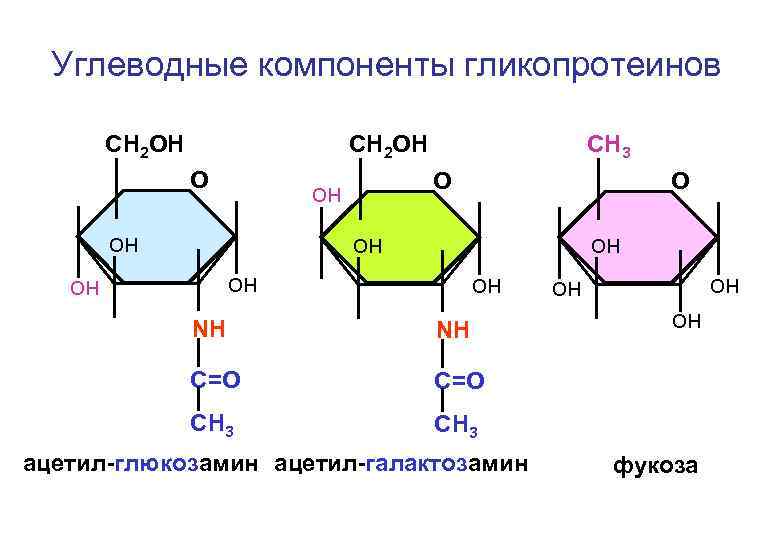
Углеводные компоненты гликопротеинов СH 2 ОН О О он он СH 3 О он он он NH NH C=O он C=O CH 3 он он CH 3 ацетил-глюкозамин ацетил-галактозамин фукоза
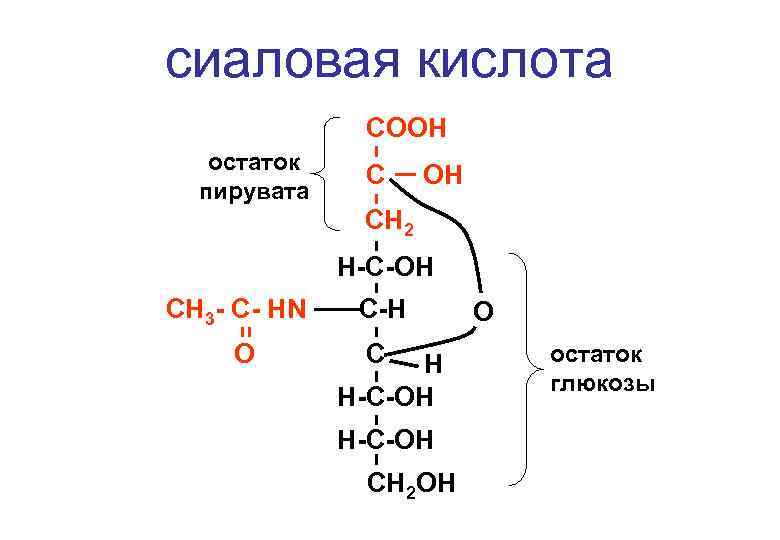
сиаловая кислота СООН остаток пирувата С ОН СН 2 Н-С-ОН СН 3 - С- НN О С-Н С Н Н-С-ОН СН 2 ОН О остаток глюкозы
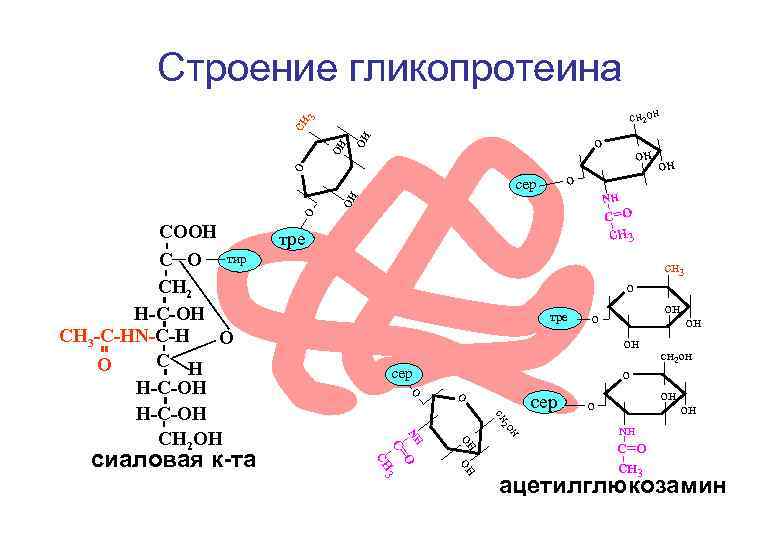
Строение гликопротеина сн 3 сн 2 он он о о о С=О о тре сер о о о сер сн 3 он он сн 2 О он он Nн сн 3 сиаловая к-та сн 3 тре С= СООН С О тир СН 2 Н-С-ОН СН 3 -С-НN-С-Н О С Н О Н-С-ОН СН 2 ОН он Nн он сер он сн 2 он он он Nн С=О сн 3 ацетилглюкозамин

Биологическая роль гликопротеинов 1. Защищают белки от протеолиза; 2. Выполняют роль рецепторов на поверхности клеток; 3. Повышают прочность плазматических мембран клеток; 4. Углеводный компонент служит “меткой”, обеспечивающей транспортировку белка из клетки; 5. Повышает прочность коллагеновых волокон, упорядочивает соединение коллагеновых фибрилл и их пучков.

Гетерополисахариды протеогликанов
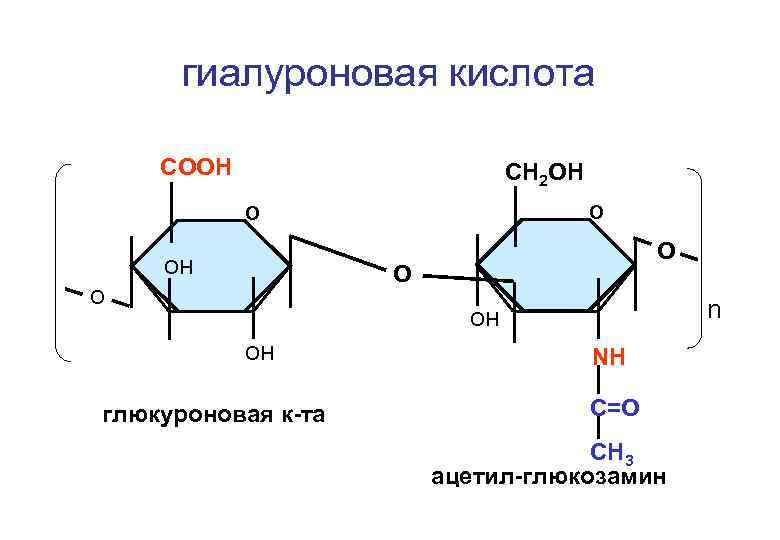
гиалуроновая кислота СООН СH 2 ОН О О он О О о n он он глюкуроновая к-та NH C=O CH 3 ацетил-глюкозамин
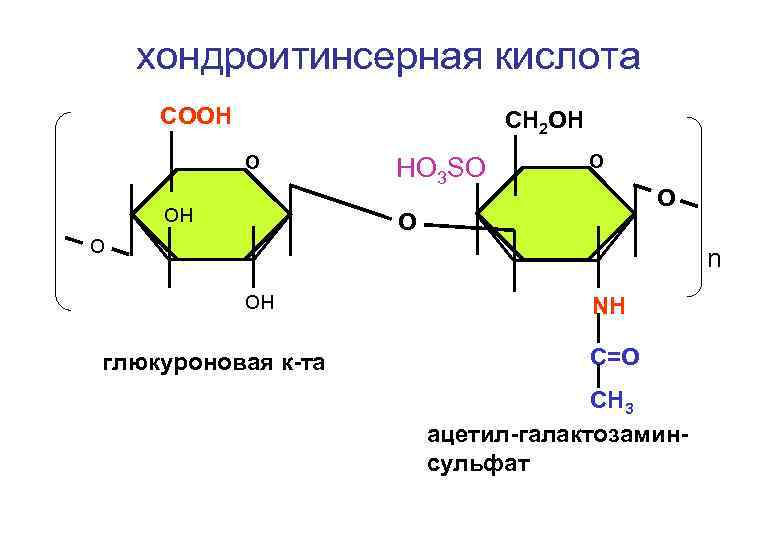
хондроитинсерная кислота СООН СH 2 ОН О он НО 3 SO О О О о n он глюкуроновая к-та NH C=O CH 3 ацетил-галактозаминсульфат
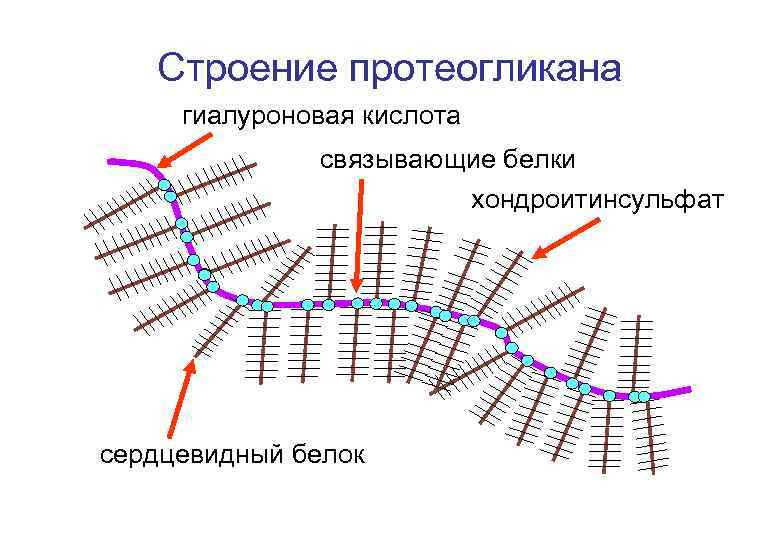
Строение протеогликана гиалуроновая кислота связывающие белки хондроитинсульфат сердцевидный белок

Свойства протеогликанов 1. Способны депонировать воду; 2. Обладают свойством клея; 3. Связывают ионы Са 2+; 4. В определенных условиях образуют прозрачные ткани (стекловидное тело, хрусталик); 5. Выполняют роль смазки в суставных полостях; 6. Защищают слизистые поверхности от разрушения протеолитическими ферментами;

Особенности обмена в соединительной ткани. ФИБРОБЛАСТЫ 1. основное место синтеза коллагена; 2. место синтеза гетерополисахаридов; 3. место синтеза эластина; 4. Происходит интенсивный процесс транскрипции, биосинтеза белка, преобладает гликолиз (недостаток кислорода), пентозофосфатный путь окисления (для синтеза РНК), уронатный путь окисления глюкозы (для образования глюкуроновой кислоты), осуществляется синтез ФАФС.

Особенности обмена в соединительной ткани. ТУЧНЫЕ КЛЕТКИ 1. основное место синтеза гепарина, гистамина и 5 гидрокситриптофана (серотонина); 2. принимает участие в воспалительной реакции; 3. осуществляют синтез большого количества протеолитических ферментов; 4. способны накапливать кальций и фосфор.

Особенности строения и свойства костной ткани

Проблемы патологии костной ткани в медицинской практике: 1. Заживление переломов костей; 2. Работы акад. Елизарова по реконструкции костной ткани; 3. Проблемы гипокинезии; 4. Проблемы космической медицины; 5. Остеопороз и остеомаляция.
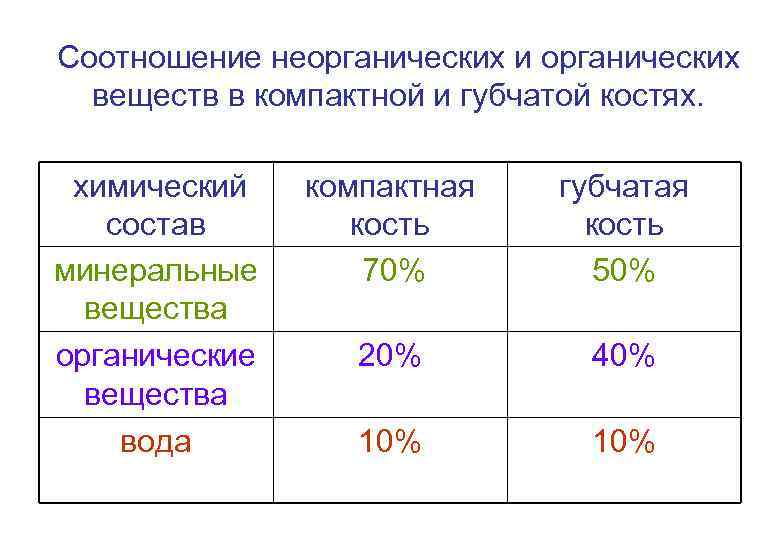
Соотношение неорганических и органических веществ в компактной и губчатой костях. химический состав минеральные вещества органические вещества вода компактная кость 70% губчатая кость 50% 20% 40% 10%
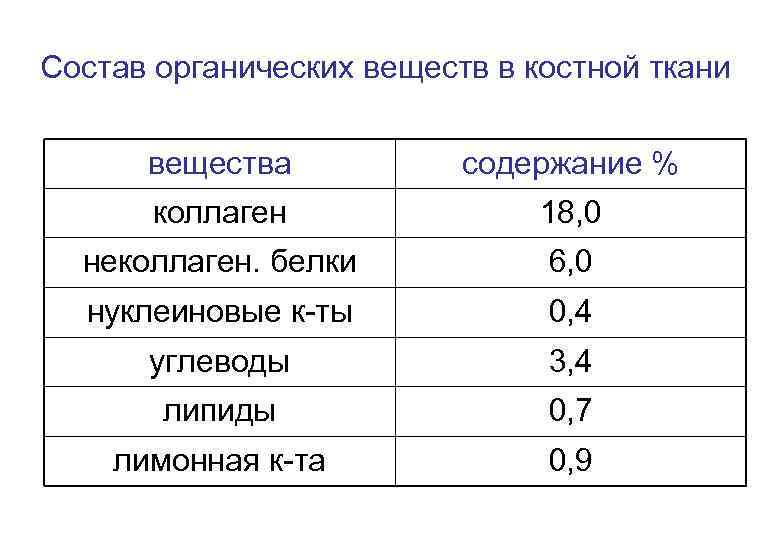
Состав органических веществ в костной ткани вещества содержание % коллаген 18, 0 неколлаген. белки 6, 0 нуклеиновые к-ты 0, 4 углеводы 3, 4 липиды 0, 7 лимонная к-та 0, 9
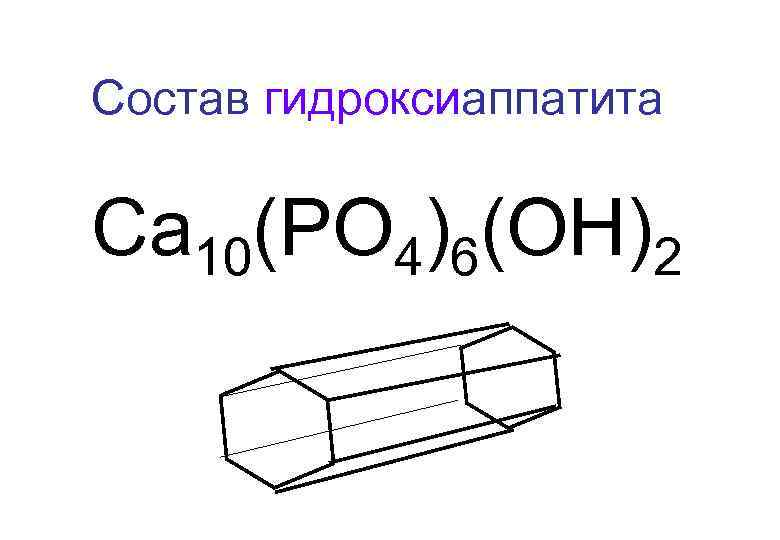
Состав гидроксиаппатита Са 10(РО 4)6(ОН)2

Состав фторгидроксиаппатита Са 10(РО 4)6(ОН)F

Строение органической матрицы костной ткани
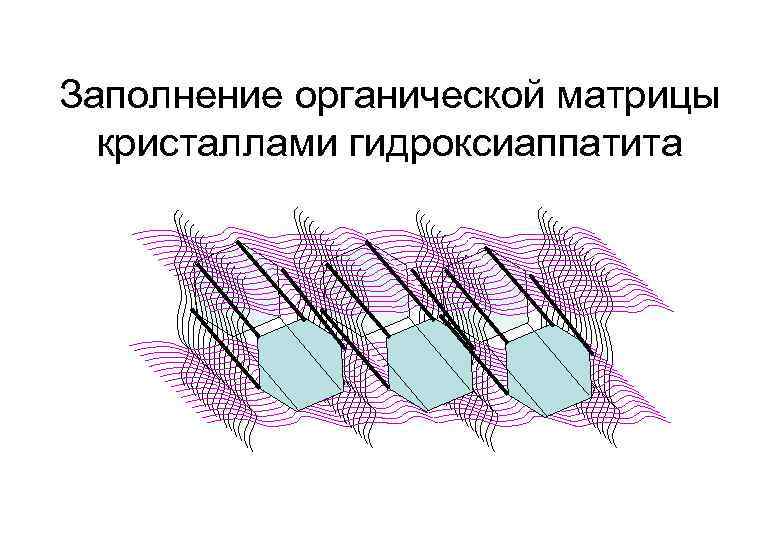
Заполнение органической матрицы кристаллами гидроксиаппатита

Места кристаллизации гидроксиаппатита Са-связывающие белки фосфолипиды 2+ Са РО 43+ лимонная кислота
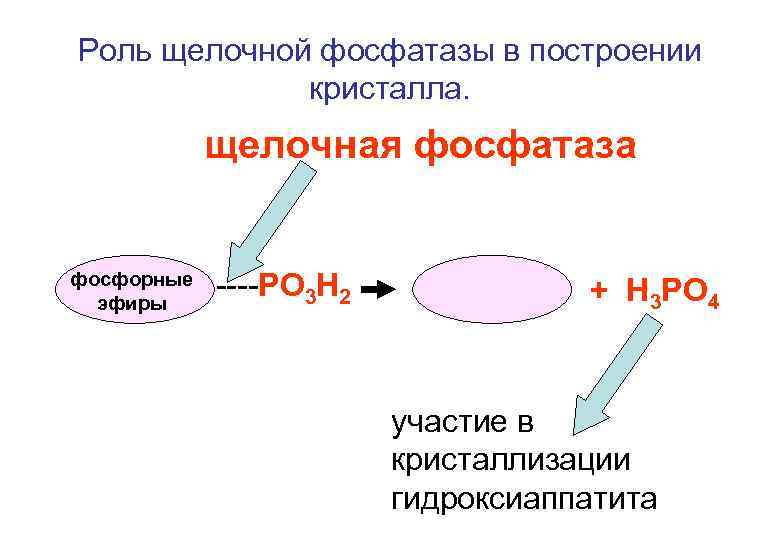
Роль щелочной фосфатазы в построении кристалла. щелочная фосфатаза фосфорные эфиры ----РО 3 Н 2 + Н 3 РО 4 участие в кристаллизации гидроксиаппатита
Особенности обмена в костной ткани

Особенности обмена в костной ткани 1. Высокая скорость аэробного и анаэробного путей окисления глюкозы; 2. Интенсивный процесс транскрипции и биосинтеза коллагеновых и Са-связывающих белков; 3. Активный процесс уронатного пути окисления глюкозы (синтез УДФ-глюкуронида).
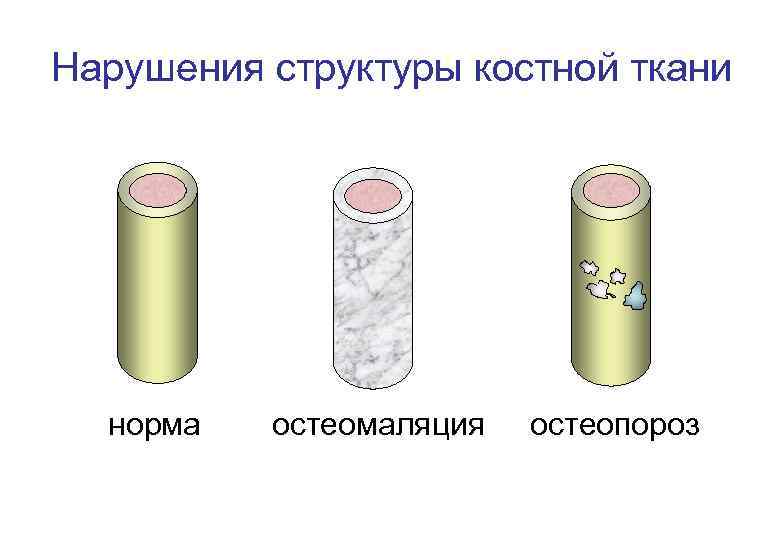
Нарушения структуры костной ткани норма остеомаляция остеопороз

Регуляция обмена веществ в соединительной ткани 1. Соматотропный гормон – стимулятор синтеза; 2. Минералокортикоиды – стимуляторы синтеза; 3. Глюкокортикоиды – ингибиторы синтеза; 4. Тироксин – ингибитор синтеза; 5. Аскорбиновая кислота –активатор синтеза; 6. Рентгеновское облучение – ингибитор синтеза.
Соединит. ткань.ppt